Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1542-1546
Возможности протонной флэш-терапии на ускорителе ИЯИ РАН
С. В. Акулиничев 1, 2, *, В. Н. Васильев 3, Ю. К. Гаврилов 1, Д. А. Коконцев 1, 2, Л. В. Кравчук 1, В. В. Мартынова 1, И. А. Яковлев 1
1 Федеральное государственное бюджетное учреждение науки
Институт ядерных исследований Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное учреждение здравоохранения
Больница Российской академии наук
Москва, Россия
3 Федеральное государственное бюджетное учреждение Российский научный центр рентгенорадиологии Министерства здравоохранения Российской Федерации
Москва, Россия
* E-mail: akulinic@inr.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Ускоритель протонов ИЯИ РАН обеспечивает режим облучения биологических образцов за один импульс, когда средняя мощность дозы совпадает с импульсной и приближается к 1 МГр ∙ с–1. В работе описаны протонная лучевая установка и метод локальной пленочной дозиметрии, использованные для облучения культур клеток в лабораторных планшетах. Определены характеристики облучения каждой лунки в планшетах и достигнуты рекордные для протонов значения мощности дозы.
ВВЕДЕНИЕ
Флэш-терапия – метод дистанционной лучевой терапии с высокой мощностью дозы, превышающей 40 Гр ∙ с–1 [1]. Возможность флэш-терапии – сохранять клетки здоровых тканей при проведении радикальной лучевой терапии [1] – является в настоящее время предметом интенсивных исследований [2]. Облучение протонами может усилить флэш-эффект за счет большей конформности по сравнению с облучением жесткими фотонами, электронами или излучением рентгеновского спектра. Используемые для исследований флэш-терапии клинические протонные ускорители обычно обеспечивают среднюю мощность дозы ${{\dot {D}}_{m}}$ в области 100 Гр ∙ с–1. При этом одномоментная или импульсная мощность дозы ${{\dot {D}}_{p}}$ в зависимости от типа ускорителя и режимов его работы может достигать значений 1 МГр ∙ с–1. Тем не менее, биологические эффекты под воздействием облучения, по-видимому, определяются в большей степени значением величины ${{\dot {D}}_{m}}.$ Именно эта величина, наравне с поглощенной дозой D, является интегральной характеристикой воздействия одной фракции облучения на клетки. Хотя влияние величины ${{\dot {D}}_{p}}$ на флэш-эффект является пока открытым вопросом и будет предметом дальнейших исследований. Линейный ускоритель протонов (ЛУ) ИЯИ в г. Троицке (Москва) является уникальным сильноточным ускорителем средних энергий, получившим в последнее время новое применение в связи с интересом к флэш-терапии. Рабочие характеристики ЛУ ИЯИ РАН описаны в работе [3], и позволяют подводить канцерицидную дозу 50 Гр ко всей мишени массой до 1 кг за один импульс длительностью порядка 100 мкс. Нам не известно других ускорителей протонов средних энергий с такими же возможностями для облучения биологических образцов. При таком сверхинтенсивном режиме облучения ${{\dot {D}}_{m}}$ становится равной ${{\dot {D}}_{p}}$ и достигает значений порядка 1 МГр ∙ с–1. Для ускорителей протонов это новый неизученный режим облучения биологических объектов, который можно назвать “экстремальным” флэш-режимом. Подобные режимы облучения ранее были реализованы с использованием ускорителей электронов [4‒6] и рентгеновского излучения [7, 8]. Однако электроны средних энергий, получаемые на обычных клинических ускорителях, и низкоэнергетическое рентгеновское излучение уступает протонам средних энергий по пробегу и не имеет известного преимущества протонов по дозовому распределению в тканях. Электроны высоких энергий менее доступны и формирование таких пучков является технически сложной задачей. Исследование влияния экстремального флэш-режима на свойства и выживаемость нормальных и опухолевых клеток является задачей предстоящих радиобиологических исследований. Для проведения таких исследований требуется иметь локальную абсолютную дозиметрию для исследуемых биологических образцов. Использование для этих целей обычных ионизационных камер (ИК) нежелательно поскольку в экстремальном флэш-режиме может нарушаться линейность результатов измерения дозы. Поэтому мы использовали не зависящие от мощности дозы измерения с помощью радиохромных пленок EBT2 фирмы GafChromic. Для привязки измеренных значений дозы к отдельным лункам стандартного культурального планшета Eppendorf на 96 или 24 лунки мы использовали методику, основанную на автоматизированном анализе и сопоставлении фотоизображений планшетов и результаты цифровой обработки облученных пленок. В данной работе мы представляем конструкцию протонной лучевой установки с рекордными параметрами мощности дозы и методику измерения дозиметрических характеристик при облучении образцов, а также некоторые физические результаты таких измерений.
МАТЕРИАЛЫ И МЕТОДЫ
ЛУ ИЯИ имеет в настоящее время следующие основные рабочие характеристики: энергия протонов может варьироваться в диапазоне E = 70–230 МэВ путем включения нужного количества ускоряющих модулей, импульсный ток Ip = 0–10 мА, длительность импульсов τ = 1–120 мкс, частота повторения импульсов f = 1–100 Гц. Несущая частота основной части ускорителя составляет 991 МГц. Ускоритель может генерировать пучок непрерывно или подавать на мишень фиксированное количество импульсов np от 1 до 1000. При максимальном токе, количество протонов в отдельном импульсе пучка длительностью τ = 100 мкс может достигать значений 1013 частиц. Именно эта особенность ускорителя, уникальная для ускорителей протонов средних энергий, дает возможность реализовывать экстремальный флэш-режим. ЛУ ИЯИ позволяет использовать любой из следующих режимов облучения биологических образцов:
a) экстремальный флэш-режим с ${{\dot {D}}_{m}}$ ~1 МГр ∙ с–1;
б) “обычный” флэш-режим с ${{\dot {D}}_{m}}$ ~ 100 Гр ∙ с–1;
в) конвенциональный режим с ${{\dot {D}}_{m}}$ < 1 Гр ∙ с–1.
В режиме (a) подается только один импульс с длительностью τ ~ 100 мкс и импульсным током протонов порядка 10 мА, причем в этом случае Ip = Im. В этом режиме ${{\dot {D}}_{m}}$ достигает рекордных значений в области 105–106 Гр ∙ с–1для мишеней массой около 1 кг, облучаемых целиком. Очевидно, что чем больше масса мишени, тем больше требуется протонов чтобы выделить ту же дозу. В режиме (б) на ускорителе ЛУ ИЯИ можно выбрать значения np, f, τ и Ip так, чтобы получить требуемые величины D и ${{\dot {D}}_{m}}.$ Например, если выбраны типичные значения f = 100 Гц и np = 50, то длительность облучения составит 0.5 с, что соответствует “обычному” флэш-режиму. Чтобы подвести в этом режиме ту же величину D, что и в режиме (a), требуется сделать произведение τIp в режиме (б) в np раз меньше, чем в режиме (a). Например, в вышеуказанном примере допустимы значения τ = 10 мкс, Ip = 2 мА. В этом случае подводится одинаковая доза в режимах (a) и (б), то есть Da = Db, однако ${{\dot {D}}_{{m,a}}}$ = 5 · 103${{\dot {D}}_{{m,b}}}.$ Это показывает, что режим (б) соответствует “обычному” флэш-режиму и ${{\dot {D}}_{m}}$ ~ 200 Гр ∙ с–1. В конвенциональном режиме требуется в сотни раз уменьшить значение Ip. Это достигается путем введения дополнительного коллиматора в начальной части ускорителя. К сожалению, использование этого коллиматора не позволяет точно контролировать величину импульсного тока. Поэтому при конвенциональном облучении характеристики интенсивности пучка и дозиметрические характеристики проведенного с ним облучения оцениваются ретроспективно. Тем не менее, при необходимости можно менять интенсивность и дозу облучения за счет изменения параметров τ, f и np.
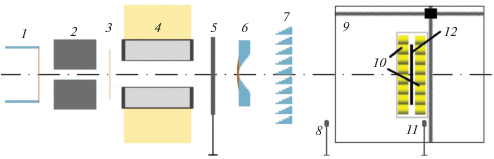
ЛУ ИЯИ имеет общую длину около 500 м и после выхода из ускорителя пучок протонов подается по вакуумным ионопроводам длиной более 200 м в экспериментальный корпус, где находится протонная лучевая установка. В этой установке проводится облучение мишеней фиксированным горизонтальным пучком с максимальной апертурой 10 см. Формирование дозового поля обеспечивается пассивным рассеянием протонов при помощи системы двойного рассеяния в комбинации с гребенчатым фильтром [9], если требуется формировать модифицированный пик Брэгга (МПБ). Схема лучевой установки для облучения образцов клеток в стандартных лабораторных планшетах приведена на рис. 1. Эта установка спроектирована для одновременного облучения широким пучком протонов в области пика Брэгга или на плато перед ним объектов, имеющих размер до 8 см в любом измерении. Оба рассеивателя, а также гребенчатый фильтр, рассчитываются для каждой энергии протонов и проверяются численными симуляциями в программе, использующей библиотеки GEANT4. Элементы формирования изготовлены с использованием фрезерного станка с ЧПУ. В качестве первичного рассеивателя использована тонкая медная пластина, а вторичный фигурный рассеиватель является комбинацией медных пластин различного диаметра и компенсатора поглощения энергии, изготовленного из водоэквивалентного пластика. Для точного позиционирования облучаемых биологических образцов в области МПБ мы использовали стандартный водный фантом фирмы PTW марки MP3-T, в котором на дистанционно перемещаемой каретке размещена рамка с закрепленным на ней планшетом. Перед облучением планшет без крышки герметизируется клеящейся пленкой для сохранности жидкого биологического материала. Крепление осуществляется таким образом, что все лунки планшета располагаются на одной глубине в воде фантома по пучку, то есть перпендикулярно оси пучка. Перед облучением планшет автоматически погружается в воду фантома в заданное положение по отношению к пучку, а после облучения поднимается на поверхность. Для определения подведенной дозы поверх центральных лунок планшета накладывается и фиксируется детектор из радиохромной пленки EBT2 размером 5 × 5 см2. В случае двух планшетов, облучаемых одновременно, пленка может фиксироваться между этими планшетами. Облучать биологические объекты именно в области МПБ с использованием фантома следует тогда, когда важны радиобиологические эффекты, связанные с величиной линейной передачи энергии (ЛПЭ) протонов. Если значение ЛПЭ не существенно, то можно облучать объекты протонами “на пролет” без использования водного фантома. Для определения фактического положения МПБ в воде фантома мы использовали штатный передвижной детектор фантома (ионизационная камера) и пленки EBT2, размещенные в водном фантоме вдоль пучка. В результате анализа полученного таким образом продольного профиля пучка выбирается оптимальное положение планшета при облучении. Каждая фракция облучения дает возможность проанализировать реакции клеток в каждой лунке в зависимости как от типа клеток, так и от дозы и мощности дозы. В связи с этим важно точно установить поглощенную дозу для каждой лунки планшетов. С этой целью разработана практичная методика определения локальной дозы и основных дозиметрических характеристик облучения для каждой лунки планшета с использованием пленок EBT2. Подробно данная методика будет описана в [10], а в данной работе мы приводим ее основное содержание. Реализация получения искомых значений включает следующие этапы: 1) первичная обработка дозового распределения на пленках из tif-файлов, полученных на сканере Epson марки Perfection V700; 2) обработка фотоизображений планшетов с целью установления соответствия распределений доз и облучаемого материала в каждой лунке; 3) нанесение изодозных кривых на первичное изображение пленок; 4) численная обработка данных для выделенных областей планшетов с целью определения стандартных дозиметрических характеристик. К этим характеристикам относится следующее: минимальное и максимальное значение дозы Dmin и Dmax для исследуемой области, гистограмма доза-объем, Di – значение дозы, получаемое частью в i процентов от объема мишени, и индекс гомогенности HI по уровню D50: HI = (D5 – D95)/D50.
Рис. 1.
Схема протонной лучевой установки для облучения планшетов с клетками: 1 – ионопровод; 2 – графитовый коллиматор; 3 – первичный рассеиватель; 4 – биологическая защита; 5 – проходная ИК; 6 – вторичный рассеиватель; 7 – гребенчатый фильтр; 8, 11 – референсная и полевая ИК; 9 – водный фантом; 10 – планшеты с образцами; 12 – радиохромная пленка.
Использование вышеизложенной методики обработки пленки позволяет ретроспективно получить полную количественную характеристику облучения каждой лунки планшетов. Однако эта методика применима только при облучении образцов клеток, размещенных в культуральных планшетах.
РЕЗУЛЬТАТЫ
В сеансе работы ЛУ ИЯИ в декабре 2019 г. впервые для этого ускорителя использованы сразу все вышеописанные режимы облучения биологических образцов. Причем для экстремального флэш-режима были получены рекордные значения мощности дозы для ускорителей протонов средних энергий. Энергия пучка протонов на выходе из вакуумного ионопровода составляла 209 МэВ и образцы облучались протонами в области МПБ. Это означает, что облучение образцов происходило на глубине более 15 г ∙ см–2. В табл. 1 представлены результаты измерения максимальных доз и рассчитанные значения соответствующей мощности дозы для отдельных планшетов. Для каждого планшета выбирались свои параметры облучения с целью получения максимального диапазона значений дозы и мощности дозы. Из таблиц следует, что в режиме (a) достигнуты значения средней мощности дозы до 0.3 МГр ∙ с–1 (планшеты 3 и 4), которые ранее не использовались при облучении биологических образцов протонами. Такая мощность дозы подводилась к планшетам, размещенным в области МПБ с шириной модуляции положения максимальной дозы порядка 40 мм. Поскольку поперечный размер пучка в фантоме был около 10 см, такие высокие значения мощности дозы были подведены к объектам массой порядка 0.5 кг. Кроме вышеуказанных дозиметрических характеристик, для каждой лунки мы определили значение усреднённой по пикселям поглощенной дозы Dmean с учетом среднеквадратичного отклонения σ. В качестве примера приведены результаты анализа дозовых характеристик для планшета № 3, в котором получены максимальные значения мощности дозы. В табл. 2 приведены дозиметрические характеристики для отдельных центральных лунок этого планшета в соответствии со стандартной нумерацией лунок. На рис. 2 представлено полученное распределение доз на фоне центральных лунок этого планшета.
Таблица 1.
Режимы облучения и максимальные измеренные дозы и мощности дозы для планшетов
| № | Ip, мА | τ, мкс | f, Гц | np | T, с | D, Гр | ${{\dot {D}}_{p}},$ Гр · с–1 | ${{\dot {D}}_{m}},$ Гр · с–1 | Режим |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 4 | 80 | 1 | 1 | 8 · 10–5 | 9.0 | 1.1 · 105 | 1.1 · 105 | ЭФ |
| 2 | 4 | 120 | 1 | 1 | 1.2 · 10–4 | 7.4 | 6.2 · 104 | 6.2 · 104 | ЭФ |
| 3 | 8 | 80 | 1 | 1 | 8 · 10–5 | 26 | 3.3 · 105 | 3.3 · 105 | ЭФ |
| 4 | 8 | 30 | 50 | 1 | 3 · 10–5 | 8.4 | 2.8 · 105 | 2.8 · 105 | ЭФ |
| 5 | 4 | 120 | 50 | 5 | 1 · 10–1 | 56 | 9.3 · 104 | 560 | Ф |
| 6 | 4 | 120 | 50 | 10 | 2 · 10–1 | >66 | >5.5 · 104 | >330 | Ф |
| 7 | 8 | 30 | 50 | 2 | 4 · 10–2 | 22 | 3.7 · 105 | 550 | Ф |
| 8 | 8 | 30 | 50 | 4 | 8 · 10–2 | 46 | 3.8 · 105 | 575 | Ф |
| 9 | – | 20 | 50 | 500 | 10 | 6.1 | 6.1 · 102 | 0.61 | К |
| 10 | – | 20 | 50 | 500 | 10 | 5.3 | 5.3 · 102 | 0.53 | К |
| 11 | – | 20 | 50 | 1000 | 20 | 10.2 | 5.0 · 102 | 0.50 | К |
| 12 | – | 20 | 50 | 1000 | 20 | 12.0 | 6.0 · 102 | 0.60 | К |
Таблица 2.
Дозиметрические характеристики облучения планшета № 3
| 5 | 6 | 7 | 8 | |
|---|---|---|---|---|
| C | Dmean = 17.6, σ = 1.1; Dmin = 15.5; Dmax = 19.7; D50 = 17.6, σ = 1.1; HI = 19.61% |
Dmean = 20.9, σ = 0.8; Dmin = 19.2; Dmax = 22.6; D50 = 20.9, σ = 0.8; HI = 12.67% |
Dmean = 23.0, σ = 0.7; Dmin = 21.5; Dmax = 24.8; D50 = 23.0, σ = 0.7; HI = 9.41% |
Dmean = 23.6, σ = 0.6; Dmin = 22.2; Dmax = 24.8; D50 = 23.6, σ = 0.6; HI = 8.16% |
| D | Dmean = 19.1, σ = 1.0; Dmin= 17.0; Dmax = 21.1; D50 = 19.0, σ = 1.0; HI = 17.17% |
Dmean = 22.4, σ= 0.8; Dmin = 20.8; Dmax = 24.2; D50 = 22.5, σ = 0.8; HI = 11.0% |
Dmean = 24.9, σ = 0.6; Dmin = 23.3; Dmax= 26.6; D50 = 24.9, σ = 0.6; HI = 7.75% |
Dmean = 25.3, σ = 0.4; Dmin = 24.2; Dmax = 26.4; D50 = 25.4, σ = 0.4; HI = 4.68% |
| E | Dmean = 19.7, σ = 1.0; Dmin = 17.4; Dmax = 21.7; D50 = 19.7, σ = 1.0; HI = 16.53% |
Dmean = 23.1, σ = 0.7; Dmin = 21.6; Dmax = 24.7; D50 = 23.0, σ = 0.7; HI = 9.92% |
Dmean = 25.6, σ = 0.5; Dmin = 24.2; Dmax = 26.8; D50 = 25.6, σ = 0.5; HI = 6.28% |
Dmean= 26.2, σ = 0.3; Dmin = 25.1; Dmax = 27.1; D50 = 26.3, σ = 0.3; HI = 3.88% |
| F | Dmean = 19.1, σ = 1.1; Dmin = 16.8; Dmax = 21.3; D50 = 19.2, σ = 1.1; HI = 17.45% |
Dmean = 22.6, σ = 0.7; Dmin = 21.0; Dmax= 24.2; D50 = 22.6, σ = 0.7; HI = 10.7% |
Dmean = 25.1, σ = 0.6; Dmin= 23.6; Dmax = 26.8; D50 = 25.1, σ = 0.6; HI = 8% |
Dmean = 26.0, σ = 0.4; Dmin = 25.0; Dmax = 26.9; D50 = 26.0, σ = 0.4; HI = 4.39% |
Рис. 2.
Поперечное распределение дозы пучка на поверхности центральных лунок планшета в виде изодозных кривых (в единицах Гр) (сетка соответствует границам лунок планшета, шаг сетки 8.2 мм).

Как видно из табл. 2 и рис. 2, распределение дозы по лункам не было полностью однородным из-за сложности формирования дозовых распределений для пучков большого поперечного размера. Однако эта неоднородность не препятствует биологическим экспериментам, поскольку нам удалось восстановить характеристики облучения для каждой отдельной лунки. Отметим, что в некоторых случаях доза, подведенная к планшету за фракцию, превысила 50 Гр и вышла за пределы калибровки пленок EBT2 (например, в планшетах 5 и 6).
ОБСУЖДЕНИЕ
Уникальные характеристики ЛУ ИЯИ позволили впервые реализовать экстремальный флэш-режим облучения протонами достаточно объемных образцов культур клеток. В этом режиме канцерицидная доза подводится за один импульс длительностью около 100 мкс, а средняя мощность дозы приблизилась к 0.5 МГр ∙ с–1. Пока нет установленных данных о клиническом преимуществе такого режима по сравнению с “обычным” флэш-режимом облучения, в котором средняя мощность дозы находится в области 100 Гр ∙ с–1. Однако логично предположить, что экстремальный флэш-режим по крайней мере сохраняет преимущества “обычного” флэш-режима по сравнению с конвенциональным облучением в плане меньшего повреждения нормальных тканей. Отметим, что облучение образцов производилось на глубине более 15 г ∙ см–2, что также является новым для протонной флэш-терапии. Очевидно также, что результат облучения опухолей в экстремальном флэш-режиме еще меньше зависит от физиологического движения облучаемого органа, чем “обычный” флэш-режим.
ЗАКЛЮЧЕНИЕ
Ускоритель ИЯИ РАН позволил реализовать разнообразные режимы облучения культур клеток от конвенционального режима до экстремального флэш-режима с рекордной для протонов мощностью дозы. Это открывает широкие возможности для исследования радиобиологических эффектов, направленных на разработку оптимальной технологии радиотерапии.
Список литературы
Bourhis J. Montay-Gruel P., Gonçalves Jorge P. et al. // Radiother. Oncol. 2019. V. 139. P. 11.
Al-Hallaq H., Cao M., Kruse J., Klein E. // Int. J. Radiat. Oncol. Biol. Phys. 2019. V. 104(2). P. 257.
Feschenko A.V., Kravchuk L.V., Serov V.L. // JACoW. RuPAC-2016. P. 48.
Durante M., Bräuer-Krisch E., Hill M. // Brit. J. Radiol. 2018. V. 91(1082). Art. № 20170628.
Lempart M., Blad B., Adrian G.M. et al. // Radiother. Oncol. 2019. V. 139. P. 40.
Jorge P.G. Jaccard M., Petersson K. et al. // Radiother. Oncol. 2019. V. 139. P. 34.
Montay-Gruel P., Bouchet A., Jaccard M. et al. // Radiother. Oncol. 2018. V. 129(3). P. 582.
Eling L., Bouchet A, Nemoz C. et al. // Radiother. Oncol. 2019. V. 139. P. 56.
Васильев В.Н., Илич Р.Д., Коконцев А.А., Акулиничев С.В. // Мед. физ. 2009. № 3(43). С. 21.
Яковлев И.А., Акулиничев С.В., Мартынова В.В. // Тезисы ТКМФ-7. Москва–Троицк, 2020.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


