Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1547-1552
Радиационные технологии в медицине: роль вторичных частиц в формировании дозы
П. П. Ганцовский 1, М. В. Желтоножская 2, А. Ю. Комаров 1, Е. Н. Лыкова 3, *, А. Г. Цовьянов 1, А. П. Черняев 2, 3, Ф. Ю. Смирнов 1, Ю. П. Зинченко 2, М. С. Ковязина 2, Р. С. Шилко 2
1 Федеральное государственное бюджетное учреждение
“Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр
имени А.И. Бурназяна” Федерального медико-биологического агентства России
Москва, Россия
2 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”, Биологический факультет
Москва, Россия
3 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”,
Научно-исследовательский институт ядерной физики имени Д.В. Скобельцына
Москва, Россия
* E-mail: iv-kate@yandex.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Для оценки величины дозы при облучении вторичными частицами использован метод сфер Боннера с активационной фольгой из природного тантала. Рассчитан спектр нейтронов в изоцентре медицинского линейного ускорителя Varian Trilogy. Определены средняя энергия и эффективное сечение нейтронов. По измеренному спектру рассчитан поток реакции (γ,n). Величины потоков, измеренных методом сфер Боннера с естественной танталовой активационной мишенью, соответствуют результатам аналогичных измерений, полученных другими методами.
ВВЕДЕНИЕ
Современная ядерная физика глубоко шагнула в медицинские технологии. Благодаря этому медицина имеет более 110 000 высокотехнологичных установок для диагностических и терапевтических целей, в которых используются источники ионизирующих излучений – рентгеновские трубки, естественные и искусственные изотопы, ускорители. В настоящее время в лучевой терапии действует около 13 000 ускорителей, в том числе ускорителей тяжелых заряженных частиц – 136, установок томотерапии более 400, интраоперационной лучевой терапии – 200, киберножей ~350 (табл. 1) [1].
Таблица 1.
Высокотехнологичная медицинская техника в России и в мире в 2020 г.
| Техника | В мире | В России |
|---|---|---|
| Ускорители | ~13 000 | ~220 |
| Источники гамма-излучения 60Со | ~2000 | ~236 |
| Гамма-камеры и ОФЭКТ | ~17 000 | ~281 |
| Компьютерные томографы | ~40 000 | ~1100 |
| МРТ | ~30 000 | ~ 500 |
| ПЭТ-сканеры | ~4000 | 54 |
| ПЭТ-центры | ~600 | 18 |
| Гамма-нож | ~300 | 5 |
| Кибер-нож | ~300 | 9 |
| Установки для брахитерапии | ~2200 | ~150 |
| Комплексы протонной и ионной терапии | 136 | 5 |
| Рентгеновские установки | ~4 млн | 55 000 |
В настоящей работе исследуются физические принципы совершенствования и развития ядерных технологий в медицине. Одно из важных направлений таких исследований – роль потоков вторичных нейтронов. Многие годы считалось, что эти потоки при работе медицинских ускорителей незначительны и их вкладом в интегральную дозу можно пренебречь.
В лучевой терапии чаще используют пучки тормозных фотонов, образующихся в тормозной мишени линейных ускорителей с энергиями электронов от 6 до 20 МэВ. При энергиях выше 8 МэВ (когда открывается большое число каналов фотоядерных реакций) тормозные фотоны при взаимодействии с элементами ускорителя и конструкционными материалами лечебного помещения создают потоки вторичных нейтронов [2, 3]. Поскольку головка медицинского ускорителя состоит из материалов с высоким атомным номером Z, в них образуется интенсивный поток вторичных нейтронов. Причем такие химические элементы имеют малое сечение поглощения нейтронов. Поэтому они достигают больного, формируя дозу, не учитываемую современными системами планирования. Ее величина может достигать нескольких Гр [4, 5]. Для того, чтобы оценить дозу от вторичных нейтронов необходимо знать спектр образующихся нейтронов.
Большинство опубликованных исследований приводят оценки потоков нейтронов для медицинского ускорителя одной из моделей. В нескольких работах приведены сравнительные данные о потоках фотонейтронов, образующихся при работе линейных медицинских ускорителей разных производителей. Например, в [14] измерения проводили на линейных ускорителях трех производителей: Varian 21EX, с энергиями 15, 18 и 20 МэВ, Siemens ONCOR, с энергиями от 15 до 18 МэВ, и Elekta Precise с энергиями на 15 и 18 МэВ. Поток нейтронов измеряли с помощью активации золотых фольг в сферах Боннера. На основе измерений авторы определили нейтронные спектры и вычислили среднюю энергию, общий флюенс нейтронов, амбиентный эквивалент дозы. Измерения показали, что для всех ускорителей 68% нейтронов были первичными, 26% были рассеяны, а 6% были тепловыми [14]. Поскольку первичные нейтроны являются не только самыми многочисленными, но и имеют самую высокую энергию, керму и высокое значение коэффициента качества, эти нейтроны являются доминирующей составляющей дозы от нейтронов для всех ускорителей. Тепловые нейтроны имеют небольшие факторы кермы и поэтому вносят малый вклад в эквивалент дозы.
В связи с тем, что, конфигурация медицинских линейных ускорителей отличается в зависимости от модели ускорителя и фирмы-изготовителя, оценку дозы от нейтронов необходимо проводить на каждом линейном ускорителе. Кроме этого, на дозу влияет форма, площадь и материал, используемый для строительства каньонов. Именно поэтому целью данной работы было разработать методику измерения спектра нейтронов на действующем медицинском ускорителе с использованием активационного метода на мишени из естественного тантала.
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе спектр вторичных нейтронов на линейном медицинском ускорителе определялся с помощью модифицированного нейтронного дозиметра-спектрометра ДСН-01. Принцип работы данного спектрометра основан на методе сфер Боннера. Метод заключается в использовании нескольких замедлителей сферической формы различных размеров и высокоэффективного детектора тепловых нейтронов, помещающегося в центре замедляющих сфер. При этом для сфер разного диаметра максимум чувствительности находится в разных областях энергий нейтронов. Восстановление спектра нейтронов по показаниям детекторов сводится к решению интегрального уравнения (1):
где i – номер сферического замедлителя, Mi – результаты измерений, Ri(E) – функция отклика сферического замедлителя, φ(E) – энергетическое распределение флюенса нейтронов.Линейный медицинский ускоритель работает в импульсном режиме с высокой плотностью потока частиц в поле излучения (по разным оценкам ~1012–1014 частиц · см–2 · с–1 [6]). Поэтому использование прямых спектрометрических методов для измерения потока тормозных гамма-квантов и нейтронов крайне затруднено. В связи с этим штатный детектор спектрометра – БДМН-96с, основанный на регистрации сцинтиллятором ZnS(Ag) альфа частиц, образующихся в реакции Li6(n,α)H3 [7], так же оказался непригоден для проведения измерений в условиях высокоинтенсивных импульсных полей. Для решения этой задачи мы использовали активационный метод регистрации излучения. Регистрация тормозных гамма-квантов и нейтронов проводилась с использованием (γ,n) и (n,γ)-реакций:
(3)
$n + {}_{{73}}^{{181}}{\text{Ta}} \to {}_{{73}}^{{182}}{\text{Ta}}\xrightarrow{{{{{\beta }}^{ - }}}}\gamma .$В качестве детектирующей мишени использовался естественный тантал 181Ta. При измерениях спектрометром ДСН-01 шаровые замедлители надеваются на детектор БДМН-96с.
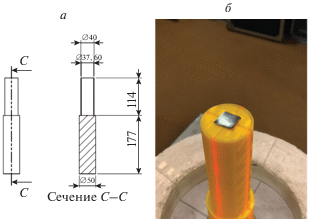
Для проведения измерений с помощью танталовых детекторов методом FDM печати из пластика была изготовлена конструкция, повторяющая форму детектора. Данная конструкция обеспечивала размещение детекторов по центру шаровых замедлителей и концентрическое расположение самих шаровых замедлителей в пространстве. Внутренний объем конструкции, находящийся в шаровом замедлителе, был заполнен парафином для исключения утечки тепловых нейтронов из центра шара. Общий вид изготовленной конструкции представлен на рис. 1.
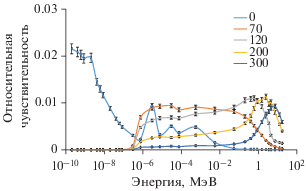
Поскольку в результате модификации механизм регистрации нейтронов в центре шаровых замедлителей был изменен, потребовали пересчета и функции отклика шаровых замедлителей. Расчет новых функций отклика был выполнен с помощью программного кода Geant4 с учетом всех деталей конструкции получившейся системы (рис. 2).
Рис. 2.
Функции отклика модифицированного спектрометра ДСН-01 с танталовым детектором для различных диаметров замедлителей в мм.
Поскольку штатное программное обеспечение восстановления нейтронных спектров спектрометра ДСН-01 является закрытым, была разработана специальная программа восстановления нейтронного спектра для данной модификации спектрометра основанная на методе параметризации [8]. Программа решает систему интегральных уравнений (1) в численном виде:
(4)
$\begin{gathered} {{M}_{i}} = \sum\limits_{j = 1}^n {{{R}_{i}}\left( {{{E}_{j}}} \right)\varphi \left( {{{E}_{j}}} \right){\Delta }{{E}_{j}}} + \\ + \,\,\Delta {{m}_{i}},\,\,\,\,~i = 1, \ldots ,5, \\ \end{gathered} $Нейтронный спектр $\varphi \left( E \right)~$ был представлен суперпозицией низкоэнергетического Максвелловского спектра тепловых нейтронов $~{{\varphi }_{{th}}}\left( E \right),$ хвоста эпитепловых нейтронов ${{\varphi }_{{epi}}}\left( E \right)$ и пика быстрых нейтронов ${{\varphi }_{f}}\left( E \right)$ [9].
(5)
$\varphi \left( E \right) = {{\alpha }_{1}}{{\varphi }_{{th}}}\left( E \right) + {{\alpha }_{2}}{{\varphi }_{{epi}}}\left( E \right) + {{\alpha }_{3}}{{\varphi }_{f}}\left( E \right),$(6)
${{{\varphi }}_{{{\text{th}}}}}\left( E \right) = 2 \cdot \sqrt {\frac{E}{{E_{{th}}^{3}{\pi }}}} {{{\text{e}}}^{{ - \frac{E}{{{{E}_{{th}}}}}}}},\,\,\,\,{{E}_{{th}}} = 0.025\,\,{\text{eV,}}$(7)
$\begin{gathered} {{{\varphi }}_{{epi}}}\left( E \right) = {{E}^{{ - b}}} \cdot {{\left[ {1 + {{{\left( {\frac{{{{E}_{{th}}}}}{E}} \right)}}^{7}}} \right]}^{{ - 1}}} \cdot {{\left[ {1 + {{{\left( {\frac{E}{{{{E}_{f}}}}} \right)}}^{2}}} \right]}^{{ - 1}}}, \\ {\text{\;}}0.5 < b < 1.5, \\ \end{gathered} $(8)
$\begin{gathered} {{{\varphi }}_{f}}\left( E \right) = 2 \cdot \sqrt {\frac{E}{{E_{f}^{3}{\pi }}}} {{{\text{e}}}^{{ - \frac{E}{{{{E}_{f}}}}}}}, \\ 0.01\,\,{\text{MeV}} < {{E}_{f}} < 20\,\,~{\text{MeV}}{\text{.}} \\ \end{gathered} $Подбор параметров производился методом координатного спуска с применением метода золотого сечения. Параметром оптимизации являлась минимизация значения выражения (9):
(9)
${{\chi }^{2}} = \sum\limits_{i = 1}^5 {{{{\left( {\frac{{{{A}_{i}} - {{M}_{i}}}}{{{\Delta }{{M}_{i}}}}} \right)}}^{2}}} ,$(10)
${{A}_{i}} = \sum\limits_{j = 1}^n {{{R}_{i}}\left( {{{E}_{j}}} \right)\varphi \left( {{{E}_{j}}} \right){\Delta }{{E}_{j}}} .$Медицинский ускоритель Varian Trilogy во время проведения эксперимента работал при максимальной энергии тормозного излучения 20 МэВ, был ориентирован вертикально вниз на пол с углом поворота гантри и коллиматора равным 0°. Использовалась максимальная установленная мощность дозы равная 6 Гр/мин. Размер поля для всех измерений был максимальным и составил 40 × 40 см2. На столе для пациента на расстоянии 100 см от источника был установлен спектрометр, который состоял из танталовых активационных детекторов, размещаемых внутри сферических полиэтиленовых замедлителей диаметрами 70, 120, 200 и 300 мм. Для измерения флюенса нейтронов использовалась также “голая” танталовая фольга. Танталовые мишени имели квадратную форму 10 × × 10 мм2, весом 1.2 г и толщиной 350 мкм. Время облучения каждой мишени из танталовой фольги составило 17.7 минуты. Принципиальная схема эксперимента представлена на рис. 3.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
После облучения активность танталовых фольг измерялась на полупроводниковом спектрометре Сanberra с анализатором Inspector 2000 с широкополосным детектором из сверхчистого германия BE3830 с энергетическим разрешением 1.94 кэВ по линии 1332.5 кэВ. Обработка γ-спектров проводилась с помощью программы Winspectrum [10].
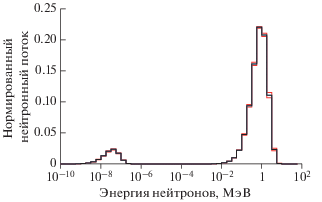
Результаты измерений активности мишеней и активности, рассчитанные по восстановленному спектру приведены в табл. 2. Восстановленный спектр нейтронов изображен на рис. 4. Восстановленный спектр имеет два пика: один пик от тепловых фотонейтронов низкой интенсивности, за которым следует хвост эпитепловых фотонейтронов до достижения пика быстрых фотонейтронов. Вид спектра согласуется с большинством литературных работ [11–13].
Таблица 2.
Активности облученных танталовых детекторов
| Размер замедлителя, мм | Измеренная активность, Бк/г | Активность по восстановленному спектру, Бк/г |
|---|---|---|
| 0 | 3.37 ± 0.17 | 3.376 |
| 70 | 17.9 ± 0.38 | 17.035 |
| 120 | 35.64 ± 0.49 | 36.069 |
| 200 | 32.34 ± 0.47 | 31.786 |
| 300 | 13.57 ± 0.24 | 13.744 |
Средняя энергия нейтронов была рассчитана по формуле
(11)
$\bar {E} = \frac{{\sum\limits_{i = 1}^n {{{E}_{i}}\Phi \left( {{{E}_{i}}} \right)} }}{{\sum\limits_{i = 1}^n {\Phi \left( {{{E}_{i}}} \right)} }},$По полученным спектрам были посчитаны интегральные потоки тормозных γ-квантов по формуле, n/(см2 · с):
(12)
$F = \frac{{S\lambda A}}{{\left( {1 - {{e}^{{ - {\lambda }{{t}_{{{\text{обл}}}}}}}}} \right){{e}^{{ - {\lambda }{{t}_{{{\text{охл}}}}}}}}\left( {1 - {{e}^{{ - {\lambda }{{t}_{{{\text{изм}}}}}}}}} \right)\xi k\alpha {{\sigma }^{{{\text{эф}}}}}{{N}_{{\text{A}}}}mp}},$Значения эффективных сечений $\left( {{{\sigma }^{{{\text{эф}}}}}} \right)$ реакций на мишенях 181Ta(γ,n)180Ta и 181Ta(n,γ)182Ta определялось по формуле:
(13)
${{\sigma }^{{{\text{эф}}}}}\left( Е \right) = \frac{{\int\limits_{{{E}_{{{\text{пор}}}}}}^{{{E}_{{max}}}} {\sigma \left( E \right){\text{Ф}}\left( Е \right)dE} }}{{\int\limits_{{{E}_{{{\text{пор}}}}}}^{{{E}_{{max}}}} {{\text{Ф}}\left( Е \right)dE} }},$В результате получено значение эффективного сечения для тормозных γ-квантов с граничной энергией 20 МэВ ${{\sigma }^{{{\text{эф}}}}}\left( {{{E}_{{\gamma }}}} \right) = 147~\,\,{\text{мбн}},$ и эффективное сечение$~{{\sigma }^{{{\text{эф}}}}}\left( {{{E}_{n}}} \right) = \left( {2.33{\text{\;}} \pm {\text{\;}}0.10{\text{\;}}\,\,{\text{барн}}} \right)$ для нейтронов. По формуле (12) вычислены величины потоков гамма-квантов и нейтронов.
Сравнивая полученные результаты с работами других авторов (табл. 4), можно отметить, что они выше. Это объясняется тем, что максимальная величина поля в наших экспериментах в 2–4 раза выше, и измерения проходили при максимальной энергии тормозных фотонов 20 МэВ.
Таблица 4.
Сравнительная таблица потоков нейтронов
| Модель линейного ускорителя | Метод измерения расчета |
Энергия, МэВ | Размер поля, см2 | Флюенс нейтронов на 1 Гр (н/см2/Гр) | Ссылка |
|---|---|---|---|---|---|
| Siemens Primus | Индиевая фольга | 15 | 10 × 10 | 4.7 · 105 | [18] |
| Varian Clinac 2300 | Индиевая фольга | 20 | 10 × 10 | 2.3 · 106 | [18] |
| Varian Clinac | Сферы Боннера с золотой фольгой | 15 | 15 × 15 | 1.23 · 107 | [19] |
| Varian Clinac DHX | Золотая фольга | 18 | 20 × 20 | (5.71 ± 0.33) · 107 | [20] |
| Varian Clinac 21 ЕХ |
Сферы Боннера с золотой фольгой | 18 | 10 × 10 | 7.47 · 106 | [21] |
| Varian Trilogy | Танталовая фольга | 20 | 20 × 20 | 7 · 106 | [22] |
| Varian Trilogy | Сфера Боннера с танталовой фольгой | 20 | 40 × 40 | (4.53 ± 0.36) · 107 | Данная работа |
ЗАКЛЮЧЕНИЕ
Предлагаемый подход, основанный на измерении спектра методом сфер Боннера, эффективен при измерениях в интенсивных импульсных пучках тормозных фотонов. По измеренным спектрам рассчитан поток (γ,n) реакции, который равен (4.53 ± 0.36) × 107 нсм–2 ∙ Гр–1. Измеренные потоки методом сфер Боннера с активационной мишенью из естественного тантала соответствуют результатам аналогичных измерений другими методами.
Исследование выполнено при финансовой поддержке РФФИ в рамках научных проектов № 18-00-00745 и 18-00-01263 (K) КОМФИ.
Список литературы
Черняев А.П., Варзарь С.М., Белоусов А.В. и др. // Яд. физ. 2019. Т. 82. № 5. С. 425.
Carrillo H.R., Almaraz B.H., Dávila V.M., Hernández A.O. // J. Radioanal. Nucl. Chem. 2010. V. 283. P. 261.
Nedaie H.A., Darestani H., Banaee N., Shagholi N. et al. // J. Med. Phys. 2014. V. 39. № 1. P. 10.
Белоусов А.В., Варзарь С.М., Желтоножская М.В. и др. // Вестн. МГУ. Сер. 3. Физ. астр. 2019. № 6. С. 3.
Желтоножская М.В., Лыкова Е.Н., Черняев А.П., Яценко В.Н. // Изв. РАН. Сер. физ. 2019. Т. 83. № 7. С. 1003; Zheltonozhskaya M.V., Lykova E.N., Chernyaev A.P., Iatsenko V.N. // Bull. Russ. Acad. Sci. Phys. 2019. V. 83. № 7. P. 915.
Naseria A., Mesbahia A. // Rep. Pract. Oncol. Radiother. 2010. № 15. P. 138.
Руководство по эксплуатации ДСН-01РЭ.
Юревич В.И. // ЭЧАЯ. 2012. Т. 43. № 3. С. 711.
Санников А.В. Развитие методов спектрометрии нейтронного излучения на больших протонных ускорителях. Автореферат дис. … канд. физ.-мат. наук. Протвино: ГНЦ РФ ИФВЭ, 2006.
Strilchuk N.V. The WinSpectrum manual, 2000.
Maglieri R., Licea A., Evans M. et al. // Med. Phys. 2015. V. 42. № 11. P. 6162.
Benites-Rengifo J.L., Vega-Carrillo H.R., Velazquez-Fernandez J. // Appl. Rad. Isot. 2014. V. 83. P. 256.
Domingo C., Garcia-Fuste M.J., Morales E. et al. // Radiat. Meas. 2010. V. 45. P. 1391.
Howell R.M., Kry S.F., Burgett E., Hertel N.E. et al. // Med. Phys. 2009. V. 36. P. 4027.
Kase K.R., Mao X.S., Nelson W.R. et al. // Health Phys. 1998. V. 74. P. 38.
Facure A., Falcao R.C., Silva A.X. et al. // Appl. Rad. Isotopes. 2005. V. 62. P. 69.
Varlamov V.V., Ishkhanov B.S., Orlin V.N. et al. // Phys. Atom. Nucl. 2013. V. 76. P. 1403.
Martínez-Ovalle S.A., Barquero R., Go’mez-Ros J.M., Lallena A.M. // Rad. Prot. Dosim. 2011. V. 147. № 4. P. 498.
Thomas D.J., Bardell A.G., Macaulay E.M. // Nucl. Instrum. Meth. A. 2002. V. 476. P. 31.
Yücel H., Çobanbas I.‚ Kolbaşi A. et al. // Nucl. Engin. Technol. 2016. V. 48. P. 525.
Kry S.F., Howell R.M., Titt U. et al. // Med. Phys. 2008. V. 35. P. 1906.
Лыкова Е.Н., Желтоножская А.П., Черняев А.П. и др. // Мед. радиол. и радиац. безоп. 2019. Т. 64. № 3. С. 78.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая