Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1648-1651
Результаты первых биологических экспериментов по флэш-терапии на ускорителе ИЯИ РАН
С. В. Акулиничев 1, 2, В. К. Боженко 3, Ю. К. Гаврилов 1, Д. А. Коконцев 1, 2, Т. М. Кулинич 3, В. В. Мартынова 1, *, Н. С. Поженько 2, А. М. Шишкин 3, И. А. Яковлев 1
1 Федеральное государственное бюджетное учреждение науки
Институт ядерных исследований Российской академии наук
Москва, Россия
2 Федеральное государственное бюджетное учреждение здравоохранения
Больница Российской академии наук
Москва, Россия
3 Федеральное государственное бюджетное учреждение Российский научный центр рентгенорадиологии Министерства здравоохранения Российской Федерации
Москва, Россия
* E-mail: donvaleriia@gmail.com
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Современные методы лучевой терапии ограничены токсическими эффектами и лучевой нагрузкой на здоровые ткани. Флэш-терапия протонами является инновационным методом, призванным свести к минимуму данные ограничения при сверхвысоких дозах. Представлены первые результаты облучения онкологических и нормальных клеток человека протонами во флэш-режиме и конвенциональной режиме.
ВВЕДЕНИЕ
Радиотерапия онкологических заболеваний направлена на разрушение опухолевых тканей, при минимальном повреждении здоровых тканей и органов. Одним из наиболее перспективных направлений в дистанционной радиотерапии является протонная терапия. За счет преимущества дозового распределения в тканях, использование протонов позволяет уменьшить влияние излучения на здоровые ткани, расположенные вблизи и в непосредственном контакте с опухолью. Наибольшая эффективность технологии протонной терапии проявляется при лечении глубокозалегающих злокачественных новообразований. Флэш-терапия – это метод лучевой терапии, предполагающий сверхбыстрое подведение дозы при ее мощности на несколько порядков выше используемой в настоящее время в клинической практике. В настоящее время протонная флэш-терапия находится в центре внимания ученых многих научных центров. Ожидается, что данная технология позволит существенно повысить качество лучевой терапии злокачественных новообразований за счет преобладания разрушений опухолевых клеток в сравнении с нормальными клетками [1]. Это предположение опирается на тот факт, что эффективность лучевой терапии зависит не только от величины поглощенной дозы, но и от мощности дозы [2]. Однако из-за ограниченной доступности и технической сложности требуемых ускорителей, протонная флэш-терапия пока недостаточно исследована. Следует отметить, что не каждый ускоритель протонов подходит для изучения данного метода. Линейный ускоритель ИЯИ РАН занимает особое положение среди ускорителей протонов средних энергий, поскольку позволяет облучать объекты с рекордно высокой мощностью дозы. На данный момент метод флэш-терапии находится в основном на стадии доклинических испытаний во всем мире. Основная часть экспериментов поставлена на клеточных культурах и лабораторных животных. Для оценки флэш-эффекта мы использовали МТТ-тест, широко применяемый в качестве скрининг метода измерения выживаемости клеток и включенный в большинство протоколов молекулярной биологии и медицины [3]. Анализ МТТ основан на формировании темноокрашенного формазанового красителя путем восстановления МТТ тетразолия метаболически активными клетками. После инкубации нерастворимый в воде формазан-краситель образует кристаллы, которые могут быть растворены в органическом растворителе, их количество можно определить полуавтоматически с помощью микропланшетного ридера. Показания абсорбции связаны с количеством клеток, что дает возможность использовать МТТ-тест в качестве анализа пролиферации для оценки роста клеток после облучения [4, 5].
МАТЕРИАЛЫ И МЕТОДЫ
Принцип работы стенда облучения клеток, использованного в данной работе, основан на методе пассивного формирования распределения дозы за счет рассеяния протонов. Установка содержит систему двойного рассеяния, состоящую из первичного рассеивателя в виде тонкой медной пластины, фигурного вторичного рассеивателя с компенсатором поглощения энергии и модулятор энергии в виде гребенчатого фильтра. Первая пара формирующих устройств создает широкий однородный пучок протонов. Модулятор энергии формирует модифицированный пик Брэгга, если требуется облучать образцы замедленными протонами в конце их пробега, где возрастает линейная передача энергии. Целиком эта система формирования создает в водном фантоме однородное дозовое распределение, которое охватывает несколько стандартных планшетов. Общая область однородности дозы с точностью ±5% в водном фантоме была подобрана не менее 10 см в поперечном измерении и по глубине (область модифицированного пика Брэгга) не менее 5 см. В данном эксперименте использовались пучки протонов с энергией 209 МэВ на выходе из ускорителя. Это соответствует глубине пика Брэгга около 15 г/см2.
Рис. 1.
Сравнение результатов МТТ-теста для опухолевый клеток Mel-x во флэши конвенциональном режимах.

В эксперименте участвовало две линии опухолевых клеток: аденокарцинома толстой кишки человека HT-29 и меланома человека Mel-x. В качестве здоровых клеток были выбраны лимфоциты периферической крови здоровых доноров, выделенные на фиколе за 2 сут. до облучения. Опухолевые клетки наращивали в культуральных флаконах в среде DMEM c добавлением гентамицина, глутамина и 10%-эмбриональной телячьей сыворотки, в качестве стимулятора роста. Культивация проводилась в инкубаторе (Binder, Германия) в стандартных условиях: атмосфера – 5% СО2, температура – 37°С, влажность – 5%. Лимфоциты культивировались в среде RPMI1640 при тех же условиях.
Для эксперимента клетки были рассеяны по 96‑луночным планшетам в концентрации 15 000 клеток на одну лунку в объеме 300 мкл полной среды DMEM. На процесс инкубации клеток отводилось 24 ч, затем планшет заклеивался водонепроницаемой пленкой. Для контроля подводимой дозы ионизирующего излучения на крышку планшета приклеивалась радиохромная пленка EBT2 размером 5 × 5 см, накрывающая 16 центральных лунок 96-луночного планшета. Предварительно, установив радиохромные пленки в область рабочего положения планшета производился контрольный снимок продольного и поперечного дозного профиля пучка. Далее, планшет погружался в водный фантом, где облучался пучком протонов в области модифицированного пика Брэгга.
После облучения планшет извлекали из воды и снимали радиохромную пленку. Далее он обрабатывался дистиллированной водой и 70% этиловым спиртом. После высыхания водонепроницаемую пленку удаляли, а сам планшет убирали в СО2-инкубатор на 24 ч. После облучения пленки EBT-2 выдерживались около 20 сут для точного соответствия условиям обработки калибровочных образцов пленок. После этого изображение на пленках оцифровывалось с помощью сканера Epson Perfection V-700. В программном комплексе DoseLabPro определялось дозное распределение в абсолютных величинах путем соотношения степени затемнения исследуемых участков пленки и калибровочных значений, полученных в референсных условиях. Облучение калибровочных пленок проводилось на медицинском линейном ускорителе электронов в пучке фотонов 6 МэВ в диапазоне доз 0.5–55.0 Гр. Указывая в программе область интереса, соответствующую исследуемой ячейке (область пленки совпадает по ходу пучка с проекцией ячейки) были получены данные для оценки дозы, подведенной к каждой ячейке.
Через сутки после облучения проводился МТТ-тест. Из ячеек удалялось по 100 мкл среды и добавлялось по 10 мкл раствора МТТ в концентрации 10 мг · мл–1. После этого планшет помещался в СО2-инкубатор еще на 3 ч, а затем аккуратно удаляли среду и добавляли 200 мкл диметилсульфоксида. Для оценки оптической плотности (ОП) использовали микропланшетный ридер MR-96A (Midray, Китай) при длине волны 570 нм против референсной 630 нм. Клеточную жизнеспособность определяли как соотношение ОП образца к ОП контроля, выраженное в процентах. В качестве пассивного контроля были использованы ОП лунок с чистым ДМСО в объеме 200 мкл каждая.
РЕЗУЛЬТАТЫ
Для обработки полученных результатов были использованы методы стандартного пакета Microsoft Exel 2010 и STATISTICA 10. Получены достоверные отличия количества живых клеток в не облученных образцах и образцах, подвергшихся воздействию протонного излучения. Однако, достоверных отличий в воздействии двух режимов в данном эксперименте не получено. Клетки были облучены дозой в диапазоне от 4 до 47 Гр во флэш-режиме и от 4 до 12 Гр в конвенциональном режиме. По результатам эксперимента во всех ячейках с лимфоцитами наблюдалось увеличение лимфоцитов и значительное превышение по сравнению с контрольными данными. Трудно оценить полученные результаты для лимфоцитов, отклоняющиеся от ожидаемых эффектов облучения. Возможно, что их увеличенное количество в опытных лунках является результатом неравномерного внесения клеток в лунки или частичных потерь при проведении теста. Большинство исследований и литературных данных отмечают, что при воздействии ионизирующего излучения происходит снижение количества жизнеспособных лимфоцитов. Для подтверждения данных результатов необходим повтор эксперимента с такими же начальными условиями.
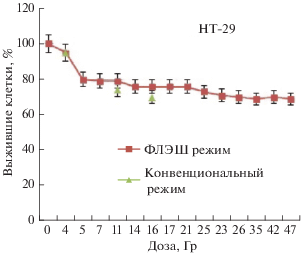
Определение радиочувствительности опухолевых клеток по результатам МТТ-теста представлены на рис. 1 и 2 , показано, что во флэш режиме наиболее устойчивыми к воздействия протонного излученияв режиме флэш и конвенциональномявляются клетки HT-29. Через 24 ч после проведенного облученияв диапазоне доз от 1 до 4 Гр наблюдается резкий спад выживаемости у обеих клеточный культур. Однако, дальнейшее увеличение доз не приводит к ожидаемому падению выживаемости клеток, характерному для гамма-излучения. У HT-29 после наблюдается плавное и медленное снижение выживаемости клеток и в диапазоне от 25 до 40 Гр количество клеток примерно одинаковое. У Mel-х же также виден резкий спад до 4 Гр, но в диапазоне от 5 до 25 Гр количество выживших клеток на 10 процентов меньше, чем у HT-29. Однако после 25 Гр у Mel-х виден опять резкий спад выживаемости. Это говорит о меньшем пределе толерантных доз у Mel-x по сравнению с HT-29. В приведенных данных присутствуют результаты облучения клеток во флэш режиме в широком диапазоне мощности дозы от 200 Гр · с–1 до 0.3 МГр · с–1. Зависимость выживаемости клеток от мощности дозы в данный момент анализируется и будет опубликована в дальнейшем.
ЗАКЛЮЧЕНИЕ
Восстановление МТТ и других тетразолиевых красителей зависит от клеточной метаболической активности. Клетки с низким уровнем метаболизма восстанавливают очень мало MTT. Напротив, быстро делящиеся клетки показывают высокую степень восстановления MTT. При проведении МТТ-теста необходимо уделить внимание выбору клеточных культур. Также при проведении МТТ-теста недостаточно оценивать только одну временную точку. Для более полного анализа жизнеспособности клеток после облучения необходимо отслеживать несколько временных промежутков. В зарубежных работах больше используют метод проточной цитометрии, который является более информативным [6, 7]. По результатам облучения протонами во флэш и конвенциональном режимах нами также готовится анализ радиобиологических эффектов с использованием проточной цитометрии. В нескольких работах встречаются упоминания о возможности стимуляции пролиферативной активности лимфоцитов физическими методами [8, 9]. Возможно, что в данном случае, получен эффект митогенной стимуляции лимфоцитов. В силу спорности результатов по воздействию протонного излучения на лимфоциты, для полной уверенности необходим повтор экспериментов.
Список литературы
Vozenin M.C., Hendry J.H., Limoli C.L. // Clin. Oncol. 2019. V. 31. № 7. P. 407.
Symonds P., Jones G.G.D. // Clin. Oncol. 2019. V. 31. № 7. P. 405.
Jain A.K, Singh D., Dubey K. et al. In vitro toxicology. Cambridge: Academic Press, 2018. P. 45.
Buch K., Peters T., Nawroth T. et al. // Radiat. Oncol. 2012. V. 7. P.1.
Hossam M., Alghamian Y., Ajapawe A., Madania A. // BMC Res. Notes. 2018. V. 11. P. 330.
Buonanno M., Grilj V., Brenner D.J. // Radiother. Oncol. 2019. V. 139. P. 51.
Komatsu S., Oike T., Komatsu Y. et al. // Radiother. Oncol. 2019. V. 139. P. 87.
Щебникова Н.Е., Соловьев А.С., Береснев А.С. Способ стимуляции пролиферативной активности лимфоцитов. Пат. РФ № 2167196, кл. C12N5/06. 2001.
Маркина Т.Н. Пролиферативная активность и задержка клеточного цикла лимфоцитов крови человека в отдаленные сроки хронического облучения, Дис. … канд. биол. наук. Москва: МГУ, 2011. 154 с.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая