Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1652-1656
3D-печать тетрафункционального полилактида с использованием производных ципрофлоксацина в качестве фотоинициаторов
Е. О. Епифанов 1, П. С. Тимашев 1, 2, Я. В. Фалетров 3, 4, Ю. А. Пискун 3, С. В. Костюк 2, 3, 4, Н. В. Минаев 1, К. Н. Бардакова 1, 2, *
1 Федеральное государственное учреждение “Федеральный научно-исследовательский центр
“Кристаллография и фотоника” Российской академии наук,
Институт фотонных технологий Российской академии наук
Москва, Россия
2 Федеральное государственное автономное образовательное учреждение высшего образования
Первый Московский государственный медицинский университет имени И.М. Сеченова
Министерства здравоохранения Российской Федерации (Сеченовский Университет),
Институт регенеративной медицины
Москва, Россия
3 Белорусский государственный университет, Научно-исследовательский институт физико-химических проблем
Минск, Беларусь
4 Белорусский государственный университет, химический факультет
Минск, Беларусь
* E-mail: arie5@yandex.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Синтезированы гидрофобные производные антибактериального препарата ципрофлоксацина, которые были использованы в качестве фотоинициаторов двухфотонной полимеризации. Для фоточувствительных композиций на основе тетрафункционального поли(D,L-лактида) и производных ципрофлоксацина продемонстрирована методика подбора параметров 3D-печати, влияние параметров 3D-печати на топографию матриксов.
ВВЕДЕНИЕ
Среди способов формирования трехмерных матриксов особо стоит выделить технологии 3D-печати, когда трехмерный матрикс формируется послойно, исходя из цифровой модели желаемого объекта. Одним из наиболее перспективных методов структурирования является метод двухфотонной микростереолитографии – уникальная технология 3D-печати микро- и нанообъектов с использованием фемтосекундного лазерного излучения и жидкого фотополимеризуемого композиционного материала [1–4]. Метод двухфотонной микростереолитографии позволяет формировать матриксы непосредственно в объеме фоточувствительного материала. Благодаря нелинейному характеру поглощения лазерного излучения, процесс структурирования происходит без нагрева материала, что дает возможность вводить различные биоактивные компоненты (факторы роста, цитокины) в материал матрикса непосредственно перед 3D-печатью. C помощью метода двухфотонной микростереолитографии уже получены трехмерные матриксы из фоточувствительных композиций на основе желатина [5], гиалуроновой кислоты [6, 7], фибрина [8], хитозана [9].
Данная работа является продолжением наших исследований по формированию трехмерных микроструктур из композиций на основе фоточувствительных разветвленных поли(D,L-лактидов). Ранее было показано, что такие матриксы обеспечивают остеогенную дифференцировку стволовых клеток жировой ткани, увеличивают скорость минерализации новообразованной костной ткани [10]. Были синтезированы гидрофобные производные антибактериального препарата ципрофлоксацина, которые дополнительно обладали абсорбцией в области двухфотонного поглощения. Это позволило использовать их в качестве фотоинициаторов 3D-печати, а также реализовать ковалентную фиксацию производных ципрофлоксацина в структуре трехмерных матриксов. В дальнейшем такой подход может обеспечить пролонгированное действие антибактериальных препаратов при хирургических операциях с использованием трехмерных матриксов из тетрафункционального поли(D,L-лактида), также избежать традиционную бактериальную терапию после имплантации.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез гидрофобных производных ципрофлоксацина
Для получения производных ципрофлоксацина в работе использовали фармацевтическую субстанцию ципрофлоксацина (CPF) гидрохлорида, аллил-хлорид, 4-винилбензилхлорид, триэтиламин, метанол, K2CO3. Для подтверждения получения целевых соединений использовали масс-спектрометрический (ESI-MS) анализ с системой LCMS-2020, оснащенной масс-спектрометром.
Синтез производного CPF с аллил хлоридом (CPF-Allyl) осуществляли согласно схеме на рис. 1: ципрофлоксацина гидрохлорид (200 мг, 545 мкмоль, 1 эквивалент) растворяли в 10 мл метанола, добавляли аллилхлорид (50 мкл, 695 мкмоль, избыток 1.3 раза) и карбонат калия (115 мг, 0.833 мкмоль, избыток 3.0 раза). Полученную смесь кипятили в течение 2 ч в круглодонной колбе с обратным холодильником. По окончании реакции полученный раствор охлаждали, отфильтровывали от соли на целлюлозном фильтре, упаривали на ротационном испарителе при пониженном давлении. Получили белое твердое вещество, растворы которого в метаноле обладают характерной синей флуоресценцией при облучении УФ излучением на длине волны 365 нм. ESI-MS: m/z 372.15 [M+H]+ для ${{{\text{C}}}_{{{\text{2}}0}}}{{{\text{H}}}_{{{\text{23}}}}}{\text{F}}{{{\text{N}}}_{{\text{3}}}}{\text{O}}_{{\text{3}}}^{ + }$ (теор. 372.17).
Синтез производного CPF с винилбензил хлоридом (CPF-VBC) осуществляли согласно схеме на рис. 2: ципрофлоксацина гидрохлорид (200 мг, 545 мкмоль, 1 эквивалент) растворяли в 10 мл метанола, добавляли винилбензил хлорид 90% (153 мкл, 1000 мкмоль, избыток 1.8) и карбонат калия (115 мг, 0.833 мкмоль, избыток 3.0 раза). Полученную смесь кипятили в течение 2 ч в круглодонной колбе с обратным холодильником. По окончании реакции полученный раствор охлаждали, отфильтровывали от соли на целлюлозном фильтре, хроматографировали на силикагеле с использованием этанола в качестве элюента, упаривали на ротационном испарителе при пониженном давлении. Получили белое твердое вещество, растворы которого в метаноле обладают характерной синей флуоресценцией при облучении УФ излучением на длине волны 365 нм. ESI-MS: m/z 448.2 [M+H]+ для ${{{\text{C}}}_{{26}}}{{{\text{H}}}_{{{\text{27}}}}}{\text{F}}{{{\text{N}}}_{{\text{3}}}}{\text{O}}_{{\text{3}}}^{ + }$ (теор. 448.20).
Для регистрации спектров поглощения растворов производных ципрофлоксацина использовали спектрофотометр Cary-50 (Varian Optical Spectroscopy Instruments).
Оценка липофильности производных ципрофлоксацина
Липофильность веществ оценивалась по значению LogP теоретически рассчитываемому проводилась с помощью программы HyperChem 7.01. Конформация молекул предварительно находилась в приближении полуэмпирического метода модели Аустина AM1 по алгоритму Полака–Райбера (значение градиента – не более 0.05).
Теоретические расчеты взаимодействия полученных производных ципрофлоксацина осуществляли с помощью программ MGL Tools 1.5.6 и Autodock Vina 1.1.2 (область докирования 4 × 4 × × 4 нм с центром по центру белка, параметры exhaustiveness и число моделей были 12 и 5, соответственно). Структуры ДНК гиразы E. coli были из базы Protein Data Bank. Эффективность взаимодействия оценивали по величине расчетной энергии связывания (Есв), которая табулировалась вместе с данными об аминокислотном окружении структур полученных соединений в рассчитанных комплексах.
Подготовка фотополимеризующихся композиций
Для приготовления фотополимеризующихся композиций (ФПК) на первом этапе к навеске производного ципрофлоксацина (4–5.5 мг) добавляли 1 мл трихлорметана. Растворы оставляли перемешиваться на 24 ч, после чего фильтровали через фильтрующую насадку с размером пор 0.45 мкм. На втором этапе в фильтрат вводили тетрафункциональный поли(D,L-лактид) (20 мас. %), модифицированный метакрилоил хлоридом согласно [10] (Мn(ГПХ) = 2340 г/моль; Mw/Mn =1.2, содержание концевых метакрилатных групп (Fn) 91%). ФПК оставляли перемешиваться на 24 ч, после использовали для трехмерной печати.
3D-печать
Подбор параметров 3D-печати производили на комплексе лазерного фемтосекундного микроструктурирования, созданном в ИФТ ФНИЦ “Кристаллография и фотоника” РАН. Использовали излучение второй гармоники фемтосекундного лазера “ТЕМА-100” длиной волны 525 нм (длительность импульса ~200 фс, частота следования импульсов 80 МГц, средняя мощность до 100 мВт) и 20× планарный микрообъектив с числовой апертурой NA = 0.4. Излучение перемещалось в рабочем поле микроскопического объектива с помощью гальваносканирующей системы со скоростями до 50 мм/с. Смещение по вертикальной оси осуществлялось с помощью прецизионных подвижек с субмикронной точностью позиционирования. Такой подход позволял проводить высокопроизводительное лазерное воздействие на фоточувствительную полимерную композицию и сформировать тестовые микроструктуры за время порядка 10 мин.
Для анализа возможности формирования трехмерных микроструктур использовался матричный подбор параметров воздействия лазерным излучением. Для этого формировались двухмерные матрицы с единичными элементами в виде цилиндров (внешний диаметр 250 мкм, внутренний диаметр 180 мкм, высота 80 мкм), расположенных на предварительно сформированной из ФПК подложке. В двухмерной матрице цилиндров по одной из осей варьировалась средняя мощность лазерного излучения (от 25 мВт, шаг 5 мВт – 4 точки) и плотность заливки отдельными треками лазерного излучения – расстояния между отдельными проходами лазерного луча (от 1 мкм, шаг 1 мкм, 6 точек). Скорость перемещения лазерного луча составляла 25 мм/с.
Для оценки геометрических размеров элементов матрицы после 3D-печати использовали флуоресцентный микроскоп KOZO XJF900. Далее сформированные матрицы отмывали от несшитых компонентов ФПК трихлорметаном в течение 2 ч. Топографию матриц оценивали с помощью метода сканирующей электронной микроскопии (СЭМ) на приборе Phenom ProX.
РЕЗУЛЬТАТЫ
В результате УФ-спектрометрии было подтверждено, что полученные производные ципрофлоксацина сохраняют характерную для исходного соединения оптические свойства, а именно способность к синей флуоресценции (максимум при 420–450 нм) при облучении светом светодиода с максимумом излучения при 365 нм. Следовательно, синтезированные производные ципрофлоксацина прозрачны в области работы фемтосекундного лазера, при этом имеют интенсивную полосу поглощения при 282 нм и более слабый максимум при 320 нм. Способность ципрофлоксацина претерпевать фотоиндуцированные радикальные превращения описана в литературе [11], однако новизна этой работы состоит в том, что это его свойство использовали для лазер-инициируемой контролируемой фотополимеризации функционализированного акрилатом полилактида. Введение аллиловой и винилбензиловой групп в структуру ципрофлоксацина дало производные с повышенной гидрофобностью. Это важно для лучшей растворимости соединения в полилактиде, а также сайты ковалентного присоединения к обсуждаемой полимерной матрице через механизмы радикальной полимеризации [12, 13]. Таким образом, введение двойной ‒С=С– связи в структуру ципрофлоксацина позволяет расширить возможности применения данного антибактериального препарата за счет использования его в качестве фотоинициатора и мономера материалов для двухфотонной полимеризации.
Результаты, представленные в табл. 1, количественно характеризуют увеличение липофильности аллильного и винилбензильного производных по сравнению с исходным ципрофлоксацином.
Таблица 1.
Теоретически-рассчитанные величины липофильности (log P) для ципрофлоксацина и его полученных производных
| Вещество | CPF | CPF-Allyl | CPF-VBC |
|---|---|---|---|
| log P | –1.85 | –0.74 | +1.19 |
Из полученных данных по докингу следует, что данные соединения способны связываться с ДНК гиразой бактерии E. coli с различной аффинностью, однако различия в нюансах их связывания (аминокислотного окружение фторхинолонового фрагмента) могут вносить существенный вклад в возможность ингибирования активности этого фермента полученными соединениями (табл. 2).
Таблица 2.
Теоретически-рассчитанные параметры взаимодействия полученных соединений с ДНК-гиразой бактерий E. coli
| ДНК гираза B E. coli (код структуры 3g7e) | |||
| Соединение | CPF | CPF-Allyl | CPF-VBC |
| Есв, ккал/моль | –8.5 | –6.8 | –9.4 |
| Аминокислотное окружение в радиусе 0.4 нм от фторхинолонового ядра | ALA47; GLY77; ILE78; ILE94; PHE104 | PHE104; ASN46; ILE78; ILE94 | ARG76; ALA53; PHE104; LYS103; GLU50 |
| ДНК гираза B E.coli (код структуры 5l3j) | |||
| Соединение | CPF | CPF-Allyl | CPF-VBC |
| Есв, ккал/моль | –6.7 | –7.5 | –8.8 |
| Аминокислотное окружение в радиусе 0.4 нм от фторхинолонового ядра | ARG190; LYS189; PRO274 | ARG276; CYS268; GLU193; HIS37; LYS189; PRO274 | ASP49; ASP73; GLU42; GLU50 |
Подбор параметров 3D-печати проводили в несколько этапов. Вначале, подбиралась минимальная мощность лазерного воздействия, при которой происходило формирование матрицы параметров с четкими контурами. Также оценивалась сохранность матрицы после процедуры отмывки. Затем, при фиксированной мощности лазера формировали матрицу параметров, меняя расстояние между отдельными слоями и расстояние между отдельными проходами луча. Результаты подбора параметров приведены на рис. 3 и 4.
Рис. 3.
Микрофотография (а) и СЭМ (б, в) матрицы подбора параметров для ФПК с CPF-Аllyl в качестве фотоинициатора. (в) – элемент матрицы параметров, структурированный при мощности 60 мВт, расстояние между отдельными слоями – 5 мкм, расстояние между проходами луча – 1 мкм.

Рис. 4.
Микрофотография (а) и СЭМ (б–г) матрицы подбора параметров для ФПК с CPF-VBC в качестве фотоинициатора. Элемент матрицы параметров, структурированный при мощности 35 мВт, расстояние между отдельными слоями – 5 мкм, расстояние между проходами луча – 1 мкм (в). Элемент матрицы параметров, структурированный при мощности 50 мВт, расстояние между отдельными слоями – 8 мкм, расстояние между проходами луча – 4 мкм (г).
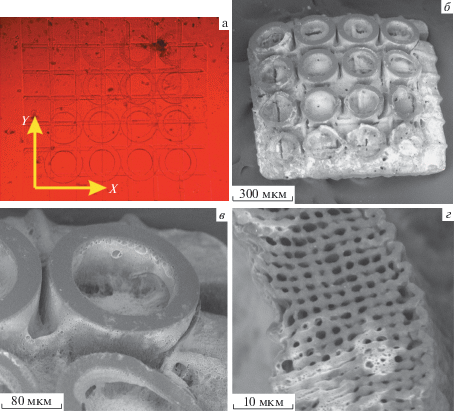
Для матрицы параметров из ФПК и CPF-Аllyl в качестве фотоинициатора (рис. 3) мощность структурирования составила 60 мВт, при этом единичные элементы матрицы сохранялись после отмывки только в случае “плотной” заливки линиями c шагом 1 мкм.
Минимальная мощность лазерного излучения при структурировании ФПК с CPF-VBC в качестве фотоинициатора составила 35 мВт. Для ФПК с CPF-VBC (рис. 4) наблюдалась большая стабильность матрицы после отмывки в сравнении с CPF-Аllyl: единичные элементы матрицы сохранялись при расстоянии между проходами луча с шагом 4 мкм, при этом поверхность элементов представляла собой решетчатую структуру (рис. 4г).
Таким образом, методом 3D-печати с использованием фемтосекундного лазерного излучения впервые были сформированы трехмерные матриксы на основе тетрафункционального поли(D,L-лактида) и производных ципрофлоксацина, модифицированных аллил хлоридом и винилбензил хлоридом. Синтезированные производные ципрофлоксацина характеризуются большей липофильностью по сравнению с исходным ципрофлоксацином. В рамках продолжения работы будут изучены биосовместимость и антимикробные свойства трехмерных матриксов на основе разработанных ФПК.
Исследование выполнено при финансовой поддержке РФФИ и БРФФИ (проекты № 19-52-04020 и № Х19РМ-034), Министерства науки и высшего образования в рамках выполнения работ по государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части развития лазерных аддитивных технологий.
Список литературы
Nguyen A.K., Narayan R.J. // Mater. Today. 2017. V. 20. № 6. P. 314.
Guo R., Xiao S., Zhai X. et al. // Opt. Expr. 2006. V. 14. № 2. P. 810.
Serbin J., Ovsianikov A., Chichkov B. // Opt. Expr. 2004. V. 12. № 21. P. 5221.
Ovsianikov A., Chichkov B., Mente P. et al. // Int. J. Appl. Ceram. Technol. 2007. V. 4. № 1. P. 22.
Koroleva A., Kufelt O., Schlie-Wolter S. et al. // Biomed. Tech. Eng. 2013. V. 58. № 5. P. 399.
Leach J.B., Bivens K.A., Patrick C.W. et al. // Biotechnol. Bioengin. 2003. V. 82. № 5. P. 578.
Leach J.B., Bivens K.A., Collins C.N. // J. Biomed. Mater. Res. Part A. 2004. V. 70. № 1. P. 74.
Koroleva A., Gittard S., Schlie S. et al. // Biofabrication. 2012. V. 4. № 1. Art. № 015001.
Timashev P.S., Bardakova K.N., Minaev N.V. et al. // Appl. Biochem. Microbiol. 2016. V. 52. № 5. P. 508.
Timashev P., Kuznetsova D., Koroleva A. et al. // Nanomed. 2016. V. 11. № 9. P. 1041.
Soldevila S., Cuquerella M.C., Lhiaubet-vallet V. et al. // Free Radic. Biol. Med. 2014. V. 67. P. 417.
Volodina V.I., Tarasov A.I. // Russ. Chem. Rev. 1970. V. 39. № 2. P. 140.
Atsumoto B.A.M., Umagai Ã.T.K., Ota H.A. et al. // Polymer J. 2009. V. 41. № 1. P. 26.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая




