Известия РАН. Серия физическая, 2020, T. 84, № 11, стр. 1628-1632
Индивидуальные блоки из металлической крошки для дистанционной лучевой терапии электронами
А. Н. Моисеев 1, 2, *, С. С. Русецкий 1, Ю. В. Лысак 1, М. А. Кузнецов 1, С. В. Голуб 1, 3
1 Общество с ограниченной ответственностью “Медскан”
Москва, Россия
2 Государственное бюджетное учреждение здравоохранения города Москвы
“Научно-практический клинический центр диагностики и телемедицинских технологий
Департамента здравоохранения города Москвы”
Москва, Россия
3 Федеральное государственное автономное образовательное учреждение высшего образования
“Российский университет дружбы народов”
Москва, Россия
* E-mail: moiseev@medscannet.ru
Поступила в редакцию 18.06.2020
После доработки 10.07.2020
Принята к публикации 27.07.2020
Аннотация
Описан новый метод создания индивидуальных блоков для дистанционной лучевой терапии пучками электронов. Блоки изготавливаются из стальной или свинцовой крошки, равномерно распределенной в эпоксидной смоле. Предложенная технология удобна, имеет низкую стоимость, а используемые материалы нетоксичны.
ВВЕДЕНИЕ
В современной практике лучевая терапия (ЛТ) пучками электронов занимает не более 10% от общей загрузки медицинского линейного ускорителя электронов (МЛУЭ). Основным показанием для применения такой методики можно считать поверхностное (подкожное) расположение опухолей. Такое расположение мишени, совмещенное с прилеганием критических органов непосредственно к опухоли, осложняет использование фотонных пучков, в том числе технологий с модуляцией интенсивности. Преимущество применения пучков электронов в таких ситуациях достигается благодаря их небольшим пробегам в тканях человека. При корректном подборе энергии пучка резкое падение процентной глубинной дозы дает ощутимый выигрыш в дозе на органы риска, расположенные глубже мишени. Применение пучка электронов особенно актуально в лечении опухолевых заболеваний кожи, в частности, если первичный очаг локализуется в области век, крыльев или кончика носа, в области ушной раковины, волосистой части головы. Электронный пучок может применяться для облучения достаточно больших объемов тканей, особенно при поражении кожи конечностей (меланома, лимфома), а в некоторых случаях объем облучения может включать весь кожный покров (грибовидный микоз). Лечение электронным пучком может быть использовано при проведении послеоперационной лучевой терапии на область передней грудной стенки у пациентов после мастэктомии, облучения регионарных лимфоузлов, в методиках комбинированного фотонно-электронного облучения. Пучок электронов также может быть использован в онкогинекологической практике для лечения заболеваний вульвы, облучения пораженных паховых лимфоузлов.
При лечении электронами на современных МЛУЭ встает вопрос о формировании полей. Существует несколько методик создания необходимой формы пучка электронов. Основной считается использование квадратных и прямоугольных аппликаторов для электронных полей и соответствующих вставок нескольких размеров, которые обычно входят в комплектацию МЛУЭ. Совместно с аппликаторами также могут применяться индивидуальные блоки, что позволяет сформировать поле в соответствии с контуром мишени в плоскости, перпендикулярной оси пучка. Такие блоки изготавливаются из различных материалов, но чаще всего применяются сплавы Вуда (олово, свинец, висмут и кадмий) и Розе (олово, свинец, висмут), имеющие низкую температуру плавления (60.0–68.5 и 94°С соответственно). Основными недостатками данных сплавов является наличие в их составе кадмия и свинца, что делает сплавы токсичными при плавлении и требует специального помещения с вытяжкой для изготовления блоков, приспособлений для литья металла, а также дополнительных средств защиты дыхания и кожи персонала.
Несколько групп исследователей предложили другие варианты создания индивидуальных блоков или модуляции электронного пучка, решающие данную проблему:
а) пластиковый компенсатор или фильтр, распечатанный на 3D-принтере [1, 2];
б) полая пластиковая подставка под блок (англ. tray), распечатанная на 3D-принтере и заполненная дробью из материала с высоким Z (например, вольфрамом) [3];
Кроме использования блоков, в качестве экспериментальных моделей, рассматриваются создание специализированных многолепестковых коллиматоров (МЛК) для электронов, которые монтируются на гантри МЛУЭ [4], а также варианты формирования пучков электронов с помощью лепестков основного (фотонного) МЛК с уменьшением расстояния источник–поверхность РИП [4, 5].
В данной статье рассматривается способ создания блока для формирования поля из стальной или свинцовой крошки (дроби) в эпоксидной смоле.
МАТЕРИАЛЫ И МЕТОДЫ
Процесс изготовления блока состоял из следующих этапов:
1. Изготовление внешней формы из жидкого силикона (использовался двухкомпонентный формовочный силикон на платине ToolDecor 40). Силиконовая форма необходима для того, чтобы блок из эпоксидной смолы не приклеился к металлической рамке блока, которая вставляется в электронный аппликатор в клиническом режиме. Формы подготавливаются для каждого размера аппликатора и используются многократно.
2. Изготовление внутренней апертуры блока в соответствии с рассчитанной в системе дозиметрического планирования (СДП) формой электронного поля (рис 1а). Авторами использовалась СДП Eclipse (Varian, США). Шаблон формы апертуры распечатывался для РИП = 95 см, которое равно расстоянию от источника до блока в МЛУЭ TrueBeam (Varian, США). Затем по этому шаблону изготавливалась вставка из полиуретановой пены или экструдированного пенополистирола с помощью терморежущего станка Thermocut (Proxxon, ФРГ). Вставку для исключения приклеивания к эпоксидной смоле оборачивали пищевой пленкой или скотчем (рис. 1б).
Рис. 1.
Ключевые этапы изготовления блоков: а – распечатанный шаблон формы блока из системы дозиметрического планирования, б – силиконовая форма под блок для аппликатора 6 × 6 см2 с размещенной внутри полиуретановой вставкой, вырезанной по шаблону (а), в – готовый блок из стальной крошки с соответствующей формой и позицией апертуры.

3. Создание индивидуального блока из смолы и металлической крошки. Для измерения необходимого объема металлической крошки последняя засыпалась в силиконовую форму с закрепленной в ней полиуретановой вставкой (рис. 1в) по уровню выемки. Далее в одноразовом стакане эпоксидный клей (ЭДП) и отвердитель (ЭТАЛ-45М) смешивались в пропорции 5 : 1, а затем добавлялись в подготовленную во втором стакане металлическую крошку до однородной консистенции при постоянном перемешивании. Полученная композиция равномерно распределялась деревянным шпателем в силиконовой форме с предварительно закрепленной в ней в соответствии с шаблоном из СДП полиуретановой вставкой. Время застывания полученного блока до твердого состояния составляло 24 ч. Готовый блок в рамке показан на рис. 1в.
Измеренная методом гидростатического взвешивания плотность изготовленного блока из стальной крошки составила 3.7 ± 0.6 г ⋅ см–3, из свинцовой крошки (дроби) – 10.6 ± 0.1 г ⋅ см–3.
Для того, чтобы оценить коэффициент пропускания пучков электронов различных энергий через предложенные материалы, были изготовлены сплошные блоки без апертуры. Измерение данной величины осложняется тем, что блок, выступая в качестве компенсатора, сдвигает глубинную дозовую кривую к поверхности, что потенциально может привести не только к ослаблению дозы на референсной глубине, но даже к ее возможному увеличению непосредственно на поверхности кожи пациента. Кроме того, в материале блока происходит генерация тормозного излучения, которое также вносит вклад в дозу. Оба эффекта будут продемонстрированы далее. Было принято решение об измерении дозы для закрытого поля на глубине 1 мм, а для открытого поля – в референсной точке (точка калибровки мониторных единиц в соответствии с протоколом МАГАТЭ TRS-398 [6]).
Измерения фактора пропускания блока и сканирование глубинных дозовых распределений выполнялось плоскопараллельной ионизационной камерой PPC05 (IBA Dosimetry GmbH, ФРГ). Для измерения факторов пропускания блока использовался водный фантом WP1D, глубинных дозовых распределений – трехмерный водный сканер дозовых полей BluePhantom2 (оба изготовлены IBA Dosimetry GmbH, ФРГ). Геометрия измерений показана на рис. 2. Над водным фантомом виден аппликатор с блоком в рамке в нижней его части. Для блоков с апертурой величина поглощенной дозы на оси пучка оценивалась аналогичным образом.
Рис 2.
Геометрия измерения фактора пропускания блока, абсолютной дозы на оси пучка и глубинных дозовых распределений в водном фантоме.

Кроме того, с помощью двумерного массива детекторов MatriXX Evolution (IBA Dosimetry GmbH, ФРГ) измерялась относительная эффективность блока с точки зрения формы дозового распределения, то есть эффективность экранирования излучения материалом блока.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 приведены измеренные факторы пропускания блоков из стальной и свинцовой крошки (дроби) для поля 6 × 6 см2 для различных энергий электронного пучка, определенные как отношение дозы на глубине 1 мм в воде за сплошным блоком к дозе в максимуме на центральной оси пучка для открытого поля.
Таблица 1.
Факторы пропускания блока для различных энергий электронного пучка
| Максимальная энергия пучка E, МэВ | 6 | 9 | 12 | 16 | 18 | |
|---|---|---|---|---|---|---|
| Фактор пропускания блока, % | Сталь | 0.6 | 1.2 | 2.4 | 9.0 | 17.4 |
| Свинец | 0.8 | 1.1 | 1.8 | 3.7 | 5.0 | |
| Экстраполированное значение тормозной компоненты, % | Сталь | 0.6 | – | 2.4 | – | 5.9 |
| Свинец | 0.8 | – | 1.9 | – | 4.3 | |
Исходя из полученных в результате измерений данных, был сделан вывод о том, что блок из стальной крошки подходит для использования в режимах 6, 9 и 12 МэВ и неприменим для режимов 16 и 18 МэВ. Блок из свинцовой дроби обладает более низким значением пропускания и, таким образом, может быть использован для всех имеющихся энергий электронов.
Вид кривой глубинного дозового распределения (рис. 3) обусловлен значительным вкладом тормозного излучения в величину поглощенной дозы. Оценка этого вклада по экстраполяции “хвоста” кривой глубинного дозового распределения до пересечения с осью ординат для выборочных энергий внесена в табл. 1, из которой видно, что вклад электронов для энергий до 12 МэВ включительно пренебрежимо мал по сравнению с тормозной компонентой для обоих материалов.
Рис. 3.
Глубинные дозовые (поскольку зависимость спектра электронов от глубины в фантоме для случая блокированных полей не определена, ионизация в дозу не конвертирована) распределения для открытого поля электронов 18 МэВ, сплошного блока из железной крошки и сплошного блока из свинцовой дроби. Показана экстраполяция экспоненциальной функцией “хвоста” дозы от тормозного излучения на поверхность фантома.

Полученные значения факторов пропускания блоков были введены в СДП Eclipse, после чего были рассчитаны планы лечения двух пациентов. Верификация этих планов лечения производилась со следующими параметрами: РИП = 100 см, плоскопараллельная ионизационная камера PPC05, измерения в пластинчатом фантоме из твердого пластика RW3 (IBA Dosimetry GmbH, ФРГ) на эффективной глубине zeff для конкретной энергии электронного пучка.
Измеренное значение поглощенной дозы превысило рассчитанное на 7.9 ± 0.8%. По всей видимости, это может быть обусловлено следующими неточностями использованного расчетного алгоритма (Varian eMC, Electron-Monte-Carlo) СДП Eclipse:
1. Игнорирование введенного значения фактора пропускания блока (данный фактор инкорпорирован в алгоритм);
2. Игнорирование вклада в рассчитанную величину дозы тормозного излучения, образованного в блоке;
3. Игнорирование рассеяния электронов и тормозных фотонов от стенок блока по направлению к камере (считается, что блок имеет бесконечно малую толщину и лежит на поверхности фантома).
Приведенные факторы могут существенно влиять на точность расчета дозы алгоритмом eMC, особенно для апертур блока малого размера, что было также экспериментально показано в ряде работ [7–9].
Вклад тормозного излучения также достаточно велик: по факту большая часть фактора пропускания индивидуального блока из свинцовой крошки обусловлена именно вторичным тормозным излучением, что показано выше.
Измерения в двумерном массиве детекторов MatriXX проводились при РИП = 100 см, глубина расположения детекторов в пластике RW3: 1.4 см. Результаты верификации лечебного плана после нормализации на фактор 1.04 представлены на рис. 4. Видно практически идеальное совпадение формы полей.
Рис. 4.
Результаты дозиметрической верификации двумерной матрицей детекторов (а), расчета в СДП дозового распределения от электронного поля с изготовленным блоком (б), сравнение профилей (в) и результат анализа гамма-индекса [10] с параметрами (3% глобально, 3 мм, порог = 20%) после нормировки измеренного распределения (г).
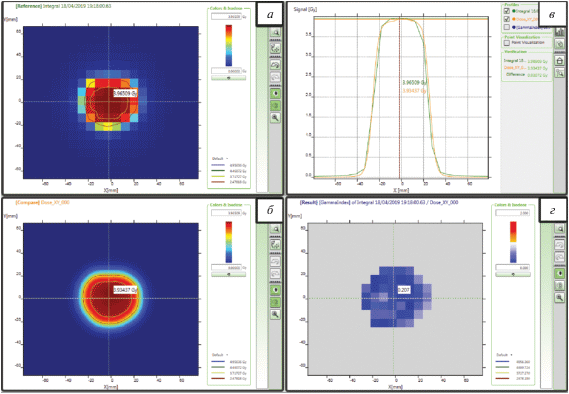
Из представленных данных можно сделать вывод, что блок более чем удовлетворительно выполняет свою основную задачу – создает требуемую форму поля электронного пучка и, в случае использования свинцовой дроби в качестве материала наполнителя, имеет приемлемый коэффициент пропускания для электронов с энергиями до 18 МэВ включительно.
ЗАКЛЮЧЕНИЕ
Разработанная оригинальная технология создания индивидуальных блоков для электронных пучков обладает определенными преимуществами по сравнению со стандартно применяемыми: компоненты относительно недороги, не используются токсичные материалы, блок через 24 ч готов к применению.
Результаты дозиметрических измерений показывают, что рассчитанные в системе дозиметрического планирования дозовые распределения отличаются от измеренных в меньшую сторону по абсолютной дозе в открытой части блока, при этом экранирование работает удовлетворительно для блока из железной крошки вплоть до 12 МэВ энергии электронного пучка и как минимум до 18 МэВ для блока из свинцовой крошки (дроби). Причиной выявленного расхождения абсолютной дозы, вероятно, являются ограничения алгоритма системы дозиметрического планирования при расчете дозовых распределений малых электронных полей, и не свидетельствует о качествах блока. Блоки используются в клинических условиях в ООО “Медскан”, где технология зарекомендовала себя с положительной стороны и может быть рекомендована к применению при соответствующей дозиметрической верификации.
Список литературы
Su S., Moran K., Robar J.L. // J. Appl. Clin. Med. Phys. 2014. V. 15. № 4. P. 194.
Miloichikova I., Krasnykh A., Danilova I. et al. // AIP Conf. Proc. 2016. V. 1772. № 1. Art. № 60018.
Skinner L., Fahimian B.P., Yu A.S. // PLoS One. 2019. V. 14. № 6. Art. № 0217757.
Lee M.C., Jiang S.B., Ma C.M. // Med. Phys. 2000. V. 27. № 12. P. 2708.
Klein E.E., Mamalui-Hunter M., Low D. // Phys. Med. Biol. 2008. V. 54. № 2. P. 327.
Серия технических докладов № 398 Определение поглощенной дозы при дистанционной лучевой терапии. МАГАТЭ, 2004.
Hu Y.A., Song H., Chen Z. et al. // J. Appl. Clin. Med. Phys. 2009. V. 10. № 2. P. 152.
Lawrence S., Lieshout N., Charland P. // J. Appl. Clin. Med. Phys. 2015. V. 16. № 3. P. 5036.
Chang J., Lin M.H., Lu W. at al. // J. Appl. Clin. Med. Phys. 2018. V. 19. № 2. P. 128.
Miften M., Olch A., Mihailidis D. et al. // Med. Phys. 2018. V. 45. № 4. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


