Известия РАН. Серия физическая, 2021, T. 85, № 8, стр. 1148-1153
Оценка коэффициентов диффузии низкомолекулярных ионов в микрофлюидном канале
А. Н. Безруков 1, *, Ю. Г. Галяметдинов 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Казанский национальный исследовательский технологический университет”
Казань, Россия
* E-mail: artem_bezrukov@kstu.ru
Поступила в редакцию 12.03.2021
После доработки 05.04.2021
Принята к публикации 28.04.2021
Аннотация
Рассмотрены реакционные процессы в параллельных ламинарных потоках микрофлюидного устройства для фокусировки потока. На примере гидроксид-анионов проанализированы возможности оценки коэффициентов диффузии реагирующих частиц в микроканале путем сравнения результатов эксперимента с данными математического моделирования. Полученные значения коэффициентов диффузии согласуются с литературными данными.
ВВЕДЕНИЕ
Процессы массопереноса занимают важное место в различных физических и биологических процессах [1, 2]. Данные о коэффициентах диффузии участников подобных процессов являются ключевыми для решения задач нанотехнологии, биотехнологии и медицины [1–4].
Определение коэффициентов диффузии молекул и молекулярных систем с помощью различных экспериментальных методик, таких как ядерный магнитный резонанс с импульсным градиентом магнитного поля, динамическое рассеяние света и т.д. не теряет актуальности в последние годы [5–7]. Одной из перспективных технологий, позволяющей непосредственно наблюдать эффекты диффузии молекул и оценивать их значения, является микрофлюидика [8, 9]. Микрофлюидика оперирует потоками жидкостей в каналах диаметром порядка 100 мкм и позволяет одновременно осуществлять ряд физических и химических процессов в устройствах размером несколько сантиметров [9]. Это особенно перспективно для развития новых решений для медицинских задач, что обуславливает преобладающий интерес к микрофлюидике как к технологии для медицинской диагностики и получения новых лекарственных средств [3, 10].
Комбинирование микрофлюидных чипов с различными экспериментальными методами позволяет осуществлять оценку коэффициентов диффузии широкого спектра различных частиц. Для решения данных задач были адаптированы такие методы как спектроскопия ядерного магнитного резонанса [11, 12], рамановская спектроскопия [13], флуоресцентная микроскопия [14], оптическая микроскопия [15], УФ-спектроскопия [16] и т.д.
Измерение коэффициентов диффузии различных частиц в микрофлюидных устройствах основано на анализе их распределения в микроканале и сравнении экспериментальных результатов с соответствующими решениями уравнений конвекции-диффузии [8, 9]. Результаты первых исследований с данной области в устройствах типа T-sensor [17–19] в настоящее время находятся на стадии практического применения [20].
В данной работе предлагается способ оценки коэффициентов диффузии в микрофлюидных устройствах, основанный на новой методике – анализе поведения ламинарных потоков растворов реагирующих частиц. На примере реакционной системы соляная кислота–гидроксид калия рассматривается возможность оценки коэффициентов диффузии протонов или гидроксид-анионов по известному значению коэффициента диффузии другого реагента.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Микрофлюидные устройства изготавливали по методике [21]. Фотошаблоны с негативным изображением структуры микроканалов были отпечатаны в компании CAD/Art Services, США с разрешением 20 000 пикселей на квадратный дюйм.
Для получения матриц негативный фоторезист SU-8 (компания MicroChem, США) наносили на пластину монокристаллического кремния с помощью спин-коутера и обрабатывали ультрафиолетовым излучением через фотошаблон в течение 1 мин. Толщина нанесенного слоя фоторезиста в матрицах составляла 100 мкм. Нанесение слоя фоторезиста заданной толщины осуществляли в соответствии со спецификациями изготовителя.
Для изготовления микрофлюидных устройств использовали полидиметилсилоксан (ПДМС) марки Sylgard-184 компании Dow Corning, поставляемый изготовителем в виде двухкомпонентного комплекта: полимер и отвердитель. Навеску ПДМС смешивали с поставляемым отвердителем в массовом соотношении 10 : 1, выдерживали под вакуумом в течение 30 мин для удаления пузырьков воздуха и заливали полимером матрицу, предварительно обеспыленную продувкой азотом, до образования слоя толщиной 3–4 мм. Оставшийся ПДМС помещали в чашку Петри для изготовления подложки толщиной составляла 2–3 мм. Отверждение полимера проводили в течение 4 ч при температуре 60°С. Отвержденный полимер и подложку после отверждения обрабатывали в кислородной плазме на приборе Harrick Plasma Cleaner PDC-32G в течение 1 мин и соединяли друг с другом непосредственно после обработки. Микрофлюидный чип выдерживали при температуре 180°С в течение 1 ч для усиления связывания активированных плазмой контактирующих поверхностей ПДМС.
Фотосъемку процессов, протекающих в микроканале, осуществляли на микроскопе Levenhuk D320 с видеокамерой Levenhuk M1400 Plus при стократном увеличении. Разрешение видеокамеры при данном увеличении составляло 0.27 мкм/пиксель.
Расчет коэффициентов диффузии производили путем сравнения экспериментальных данных с результатами математического моделирования. Для моделирования был разработан специальный скрипт в программном пакете Matlab 2020a с модулем Partial Differential Equations Toolbox.
В работе анализировали реакционную систему на основе соляной кислоты (х. ч., Лабхим) и гидроксида калия (х. ч., Лабхим). Концентрация реагентов составляла 0.01 моль/л. В качестве индикатора использовали фенолфталеин.
Для оценки коэффициентов диффузии низкомолекулярных ионов были использованы устройства с Ψ-образным расположением микроканалов (три сходящихся входных канала и основной канал для проведения реакции). Длина основного канала составляла 15 мм, ширина – 200 мкм. Для подачи растворов реагентов и растворителя в микрофлюидный чип использовали шприцевые насосы SHE-ISPLab01 и SHE SPLab02. Объемные расходы реагентов и растворителя составляли 10 мкл/мин.
МОДЕЛЬ РЕАКЦИОННЫХ ПРОЦЕССОВ В МИКРОКАНАЛЕ
Взаимодействие реагирующих частиц в параллельных ламинарных потоках микроканала можно описать системой уравнений конвекции-диффузии-кинетики (рис. 1). Ряд химических процессов как в системах с низкомолекулярными реагентами (таких как реакция протонов с ионами гидроксида с образованием молекулы воды), так и в супрамолекулярных системах (например, связывание иона ПАВ макромолекулой полиэлектролита, распределение ПАВ между раствором и мицеллярной фазой [22, 23]) можно описать следующим уравнением:
где СА, СB, CC – концентрации реагентов и продукта реакции, kf и kb – скорости прямой и обратной реакции, соответственно.Рис. 1.
Модель микрофлюидного устройства с боковыми ламинарными потоками реагентов и центральным потоком растворителя.
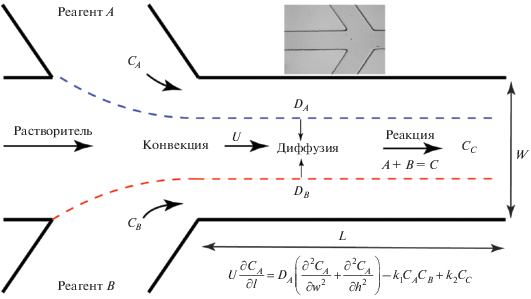
Концентрационное распределение исходных веществ или продуктов реакции в микрофлюидном канале с расположением ламинарных потоков, соответствующих рис. 1, описывается уравнением конвекции–диффузии [8]. На примере реагента А:
(2)
$U\frac{{\partial {{C}_{A}}}}{{\partial l}} = {{D}_{A}}\frac{{{{\partial }^{2}}{{C}_{A}}}}{{\partial {{w}^{2}}}},$Комбинируя данные уравнения (1) и (2) для исходных веществ и продуктов реакции, можно составить систему уравнений, которая позволяет охарактеризовать концентрационное распределение участников реакции в ламинарных потоках микроканала, соответствующих рис. 1:
(3)
$\left\{ {\begin{array}{*{20}{c}} {U\frac{{\partial {{C}_{A}}}}{{\partial l}} = {{D}_{A}}\frac{{{{\partial }^{2}}{{C}_{A}}}}{{\partial {{w}^{2}}}} - {{k}_{f}}{{C}_{A}}{{C}_{B}} + {{k}_{b}}{{C}_{C}}} \\ {U\frac{{\partial {{C}_{B}}}}{{\partial l}} = {{D}_{B}}\frac{{{{\partial }^{2}}{{C}_{B}}}}{{\partial {{w}^{2}}}} - {{k}_{f}}{{C}_{A}}{{C}_{B}} + {{k}_{b}}{{C}_{C}}} \\ {U\frac{{\partial {{C}_{C}}}}{{\partial l}} = {{D}_{C}}\frac{{{{\partial }^{2}}{{C}_{C}}}}{{\partial {{w}^{2}}}} + {{k}_{f}}{{C}_{A}}{{C}_{B}} - {{k}_{b}}{{C}_{C}}} \end{array}} \right..$Для перевода данной системы уравнений в безразмерную форму необходимо ввести следующие соотношения: l* = l/L, w* = w/W, $C_{A}^{*} = {{{{C}_{A}}} \mathord{\left/ {\vphantom {{{{C}_{A}}} {C_{A}^{0}}}} \right. \kern-0em} {C_{A}^{0}}},$ $C_{B}^{*} = {{{{C}_{B}}} \mathord{\left/ {\vphantom {{{{C}_{B}}} {C_{B}^{0}}}} \right. \kern-0em} {C_{B}^{0}}},$ $C_{C}^{*} = {{{{C}_{C}}} \mathord{\left/ {\vphantom {{{{C}_{C}}} {C_{C}^{0}}}} \right. \kern-0em} {C_{C}^{0}}},$ Z = = ${{C_{A}^{0}} \mathord{\left/ {\vphantom {{C_{A}^{0}} {C_{B}^{0}}}} \right. \kern-0em} {C_{B}^{0}}},$ $C_{A}^{*} = {{{{C}_{A}}} \mathord{\left/ {\vphantom {{{{C}_{A}}} {C_{A}^{0}}}} \right. \kern-0em} {C_{A}^{0}}},$ $D_{B}^{*} = {{{{D}_{B}}} \mathord{\left/ {\vphantom {{{{D}_{B}}} {{{D}_{A}}}}} \right. \kern-0em} {{{D}_{A}}}},$ $D_{C}^{*} = {{{{D}_{C}}} \mathord{\left/ {\vphantom {{{{D}_{C}}} {{{D}_{A}}}}} \right. \kern-0em} {{{D}_{A}}}}{\text{:}}$
(4)
$\left\{ \begin{gathered} \frac{{UW}}{{{{D}_{A}}}}\frac{W}{L}\frac{{\partial C_{A}^{*}}}{{\partial l{\kern 1pt} *}} = \frac{{{{\partial }^{2}}C_{A}^{*}}}{{\partial {{w}^{{*2}}}}} - \frac{{{{W}^{2}}}}{{{{D}_{A}}}}{{k}_{f}}C_{A}^{0}ZC_{A}^{*}C_{B}^{*} + \frac{{{{W}^{2}}}}{{{{D}_{A}}}}{{k}_{b}}C_{C}^{*} \hfill \\ \frac{{UW}}{{{{D}_{B}}}}\frac{W}{L}\frac{{\partial C_{B}^{*}}}{{\partial l{\kern 1pt} *}} = \frac{{{{\partial }^{2}}C_{B}^{*}}}{{\partial {{w}^{{*2}}}}} - \frac{{{{W}^{2}}}}{{{{D}_{B}}}}{{k}_{f}}C_{B}^{0}ZC_{A}^{*}C_{B}^{*} + \frac{{{{W}^{2}}}}{{{{D}_{B}}}}{{k}_{b}}C_{C}^{*} \hfill \\ \frac{{UW}}{{{{D}_{A}}}}\frac{W}{L}\frac{{\partial C_{C}^{*}}}{{\partial l{\kern 1pt} *}} = \frac{{{{\partial }^{2}}C_{C}^{*}}}{{\partial {{w}^{{*2}}}}} - \frac{{{{W}^{2}}}}{{{{D}_{C}}}}{{k}_{f}}C_{A}^{0}ZC_{A}^{*}C_{B}^{*} + \frac{{{{W}^{2}}}}{{{{D}_{C}}}}{{k}_{b}}C_{C}^{*} \hfill \\ \end{gathered} \right..$Граничным условием для данных уравнений будет условие непроницаемости стенок микроканала для участников реакции:
(5)
$\left\{ {\begin{array}{*{20}{c}} {{{{\left. {\frac{{\partial {\text{С}}}}{{\partial w}}} \right|}}_{{w = 0;1}}} = 0} \\ {{{{\left. {\frac{{\partial {\text{С}}}}{{\partial h}}} \right|}}_{{h = 0;1}}} = 0} \end{array}} \right..$Для входа потоков растворов компонентов в месте объединения входных микроканалов вводится граничное условие Дирихле. Согласно данному условию, концентрация реагента соответствует его начальной концентрации в потоке раствора данного реагента и равна нулю в остальной области микроканала. На примере реагента А:
(6)
$\left\{ {\begin{array}{*{20}{c}} {{{C}_{A}}\left( {w \in {{w}_{{\text{А}}}}} \right) = {\text{С}}_{{\text{А}}}^{0}} \\ {{{C}_{{\text{A}}}}\left( {w \notin {{w}_{{\text{А}}}}} \right) = 0} \end{array}} \right.,$РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 2 показаны результаты решения системы уравнений (4) для реакции HCl + KOH в условиях конвективной диффузии микрофлюидного канала, модель которого изображена на рис. 1.
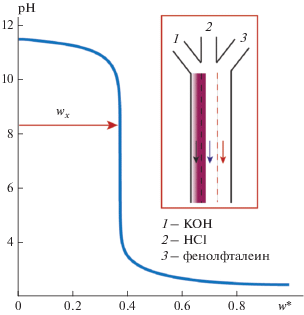
Для ламинарных потоков в неравновесных условиях микроканала можно подобрать условия, в которых реализуется дискретное изменение поведения реакционной среды, в частности – ее фазовых свойств. Ранее данный эффект был продемонстрирован на примере взаимодействия полимеров с ПАВ [24]. В данной работе аналогичный эффект был выявлен при математическом моделировании изменения pH раствора по ширине микроканала (рис. 2).
Согласно результатам математического моделирования, в области микроканала, размер которой не превышает 1–2% от его ширины, может наблюдаться значительное изменение pH раствора: pH > 10 при w* < 0.4 и pH < 3 при w* > 0.4. Данный эффект подтверждается изменением цвета раствора (появлением малиновой окраски при диффузии индикатора) в микроканале в области w* < 0.4 (рис. 2). При этом граница между областями с различными значениями pH (w* ≈ 0.4) четко фиксируется по цвету раствора на всем протяжении микроканала (рис. 3).
Рис. 3.
Изменение pH по радиусу микроканала в микрофлюидном чипе с параллельными боковыми потоками растворов HCl и KOH.
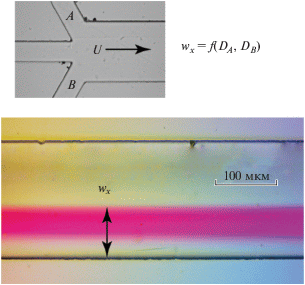
В соответствии с моделью процессов конвекции–диффузии–кинетики, описываемой уравнениями (1)–(6), концентрационное распределение реагирующих веществ и продуктов реакции по длине и ширине микроканала будут определяться значениями коэффициентов в системе уравнений (4). Для реакции HCl + KOH концентрации H+ и OH– будут, в свою очередь, определять изменение pH в микроканале.
Концентрации реагентов, размеры микрофлюидного чипа и скорость потока в микроканале являются параметрами, значения которых задаются в ходе подготовки к эксперименту. Согласно результатам моделирования, скорость реакции оказывает крайне незначительное влияние на концентрационное распределение реагирующих веществ в микроканале, что можно объяснить намного более быстрым протеканием реакционных процессов в микроканале по сравнению с диффузией реагирующих компонентов [8]. Решения системы уравнений (4) при различных значениях kf в диапазоне 102–109 л ∙ моль–1 ∙ с–1 показали, что положение зоны резкого падения pH по ширине микроканала изменяется не более чем на 1–1.5%.
Таким образом, главными параметрами, которые определяют концентрационное распределение реагирующих веществ в микроканале, являются коэффициенты диффузии реагирующих компонентов. Это позволяет определить коэффициент диффузии одного из данных компонентов по известному значению коэффициента диффузии другого компонента и положению реакционного фронта. Возможность детектирования положения реакционного фронта по изменению свойств системы внутри микроканала (выпадение осадка, изменение цвета раствора и т.д.) будет определять применимость данной методики к анализу диффузионных характеристик компонентов реакционных систем.
Для реакционной системы HCl–KOH в микроканале, положение реакционного фронта удобно регистрировать по изменению pH раствора. В свою очередь, pH раствора удобно определять по окраске раствора индикатора. В микрофлюидном устройстве, модель которого показана на рис. 1, раствор индикатора подается в центральный поток микроканала, растворы реагентов – в боковые потоки.
На рис. 3 показаны экспериментальные результаты, полученные при данном расположении потоков растворов HCl, KOH и индикатора (фенолфталеина). Во всех выполненных экспериментах наблюдается четкая граница между окрашенной и прозрачной областями. Положение данной границы соответствует положению зоны резкого падения pH на рис. 2.
Путем подстановки известного значения коэффициента диффузии протона [25] в уравнения (4), в программе Matlab был оценен коэффициент диффузии гидроксид-аниона по положению границы между зонами с различной окраской раствора индикатора (рис. 3). Значение коэффициента диффузии составило ~5.8 · 10–9 м2/с, что удовлетворительно согласуется со справочными и литературными данными по коэффициенту диффузии гидроксид-аниона (5.23 · 10–9 м2/с) [26].
ЗАКЛЮЧЕНИЕ
В настоящей работе предложен метод оценки коэффициентов диффузии низкомолекулярных ионов в микрофлюидных устройствах путем анализа изменения значения pH по ширине микроканала в системе реагирующих компонентов. Коэффициент диффузии одного из реагирующих веществ определяется по известному коэффициенту диффузии другого компонента.
В отличие от существующих микрофлюидных методик определения коэффициентов диффузии различных веществ по их концентрационному распределению в микроканале, данный метод основан на анализе дискретного сигнала микрофлюидного устройства – положения границы окрашенной области в микроканале при добавлении pH-индикатора. Подобная методика является более простой и не требует дополнительного оборудования.
Предложенная методика была протестирована на системе соляная кислота – гидроксид калия. Результаты оценки коэффициентов диффузии гидроксид-аниона согласуются с литературными данными. Анализ занимает 1–2 мин. Объем реагентов, требуемый для анализа, не превышает 20–30 мкл.
Данная методика может быть использована в качестве дополнительного или альтернативного метода оценки коэффициентов диффузии низкомолекулярных ионов по изменению pH среды в микрофлюидном канале.
Список литературы
Erbas-Cakmak S., Leigh D.A., McTernan C.T. et al. // Chem. Rev. 2015. V. 115. No. 18. Art. No. 10081.
Mircioiu C., Voicu V., Anuta V., Tudose A. et al. // Pharmaceutics. 2019. V. 11. No. 3. P. 140.
He Z., Ranganathan N., Li P. // Nanotechnology. 2018. V. 29. No. 49. Art. No. 492001.
Ribeiro A.C.F., Esteso M.A. // Biomolecules. 2018. V. 8. No. 4. P. 148.
Hassan P.A., Rana S., Verma G. // Langmuir. 2015. V. 31. No. 1. P. 3.
Stetefeld J., McKenna S.A., Patel T.R. // Biophys. Rev. 2016. V. 8. No. 4. P. 409.
Артёмов В.Г., Волков А.А., Сысоев Н.Н., Волков А.А. мл. // Изв. РАН. Сер. физ. 2015. Т. 79. № 12. P. 1642; Artemov V.G., Volkov A.A., Sisoev N.N., Volkov A.A. Jr. // Bull. Russ. Acad. Sci. Phys. 2015. V. 79. No. 12. P. 1435.
Berthier J., Silberzan P. Microfluidics for biotechnology. Second Edition. London: Artech House, 2009. 512 p.
Tabeling P. Introduction to Microfluidics. Oxford University Press, 2005. 312 p.
Li J., Mooney D.J. // Nature Rev. Mat. 2016. V. 1. No. 12. Art. No. 16071.
Evans R. // Prog. Nucl. Magn. Reson. Spectrosc. 2020. V. 117. P. 33.
Swyer I., Von der Ecken S., Wu B. et al. // Lab. Chip. 2019. V. 19. No. 4. P. 641.
Peters C., Thien J., Wolff L. et al. // J. Chem. Eng. Data. 2020. V. 65. No. 3. P. 1273.
Kopp M.R.G., Villois A., Capasso Palmiero U. et al. // Ind. Eng. Chem. Res. 2018. V. 57. No. 21. P. 7112.
Talebi S., Abedini A., Lele P. et al. // Fuel. 2017. V. 210. P. 23.
Yu M., Silva T.C., van Opstal A. et al. // Biophys. J. 2019. V. 116. No. 4. P. 595.
Kamholz A.E., Schilling E.A., Yager P. // Biophys. J. 2001. V. 80. No. 4. P. 1967.
Kamholz A.E., Weigl B.H., Finlayson B.A. et al // Analyt. Chem. 1999. V. 71. No. 23. P. 5340.
Kamholz A.E., Yager P. // Biophys. J. 2001. V. 80. No. 1. P. 155.
Azouz M., Gonin M., Fiedler S. et al. // BBA Biomembranes. 2020. V. 1862. No. 6. Art. No. 183215.
McDonald J.C., Duffy D.C., Anderson J.R. et al. // Electrophoresis. 2000. V. 21. No. 1. P. 27.
Zana R. Dynamics of surfactant self-assemblies. Surfactant science series. V. 125. CRC Press, 2019. 537 p.
Holmberg K., Jönsson B., Kronberg B., Lindman B. Surfactants and polymers in aqueous solution. Second Edition. John Wiley & Sons Ltd, 2003. 545 p.
Безруков А.Н., Галяметдинов Ю.Г. // Изв. РАН. Сер. хим. 2020. № 8. С. 1436; Bezrukov A.N., Galyametdinov Y.G. // Russ. Chem. Bull. 2020. V. 69. No. 8. P. 1436.
Fischer S.A., Dunlap B.I., Gunlycke D. // Chem. Sci. 2018. V. 9. No. 35. P. 7126.
Lee S.H., Rasaiah J.C. // J. Chem. Phys. 2011. V. 135. No. 12. Art. No. 124505.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая