Известия РАН. Серия физическая, 2021, T. 85, № 8, стр. 1128-1131
Вибрационно-акустическое воздействие на жидкофазную реакцию с кинетической неустойчивостью при ассоциации реагентов
Т. П. Кулагина 1, *, Л. П. Смирнов 1, З. С. Андрианова 1
1 Федеральное государственное бюджетное учреждение науки
Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: tan@icp.ac.ru
Поступила в редакцию 12.03.2021
После доработки 05.04.2021
Принята к публикации 28.04.2021
Аннотация
Проведено моделирование низкочастотного механического воздействия на реакцию с кинетической неустойчивостью при ассоциации реагента. Установлена связь собственной частоты осцилляций с параметрами реакции и показано, что выбор амплитуды и частоты воздействия позволяет управлять скоростью реакции, изменять форму, частоту и амплитуду осцилляций концентраций реагентов.
ВВЕДЕНИЕ
Успешное решение проблем управления кинетикой реакции посредством периодического воздействия требует перехода от феноменологии к моделированию на основе детальных представлений о кинетике и механизме реакций, учитывающих их зависимость от внешнего воздействия в широком диапазоне частот [1–4]. При анализе явлений, индуцированных низкочастотным механическим полем [5–7], показано, что формально простая реакция при ассоциации реагентов превращается в многостадийный процесс, при этом полагали, что связь константы равновесия ассоциации с внешним давлением описывается уравнением Вант-Гоффа, а вторичные химические связи ассоциатов легко разрушаются механически [8]. Хотя значительная часть работ посвящена изучению действия полей высокой частоты, обнаружены физико-химические и химические эффекты влияния на кинетику при частотах порядка 50–100 Гц [9, 10]. Целью настоящей работы является моделирование низкочастотного механического воздействия на химическую реакцию с кинетической неустойчивостью при учете влияния ассоциации на реакционную способность исходных реагентов.
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ЖИДКОФАЗНОЙ РЕАКЦИИ С ВРЕМЕННÓЙ НЕУСТОЙЧИВОСТЬЮ
Классическим примером реакций с кинетической неустойчивостью является модель Лотки-Вольтерра (Lotka A.J., Volterra V.) [11], предложенную ранее для описания изменчивости во времени состава биологической системы типа “хищник–жертва”. Динамика этой модели исследовалась неоднократно, но ассоциация реагентов при этом не принималась в расчет. В данной работе учитывали, что в жидкой среде из мономера А1 образуется димер А2: 2A1 ↔ A2 с константой равновесия K0. Рассматривается модель реакции молекул исходного реагента А1 с образованием двух конечных продуктов B и F;
Если в реакции димер непосредственно не участвует, то кинетические уравнения имеют вид:
(5)
$\begin{gathered} {{d\left[ X \right]} \mathord{\left/ {\vphantom {{d\left[ X \right]} {dt}}} \right. \kern-0em} {dt}} = {{k}_{1}}\left[ {{{A}_{1}}} \right]\left[ X \right]{\text{ }}--{{k}_{2}}\left[ X \right]\left[ Y \right]{\text{ }}--{{k}_{4}}\left[ X \right], \\ {{d\left[ Y \right]} \mathord{\left/ {\vphantom {{d\left[ Y \right]} {dt}}} \right. \kern-0em} {dt}} = {{k}_{2}}\left[ X \right]\left[ Y \right]--{{k}_{3}}\left[ Y \right], \\ {{d[B]} \mathord{\left/ {\vphantom {{d[B]} {dt}}} \right. \kern-0em} {dt}} = {{k}_{3}}[Y],~ \\ {{d[F]} \mathord{\left/ {\vphantom {{d[F]} {dt}}} \right. \kern-0em} {dt}} = {{k}_{4}}[X], \\ \end{gathered} $(6)
${{d\alpha } \mathord{\left/ {\vphantom {{d\alpha } {d\tau }}} \right. \kern-0em} {d\tau }} = \alpha \left( {\gamma --\beta } \right),~\,\,\,{{d\beta } \mathord{\left/ {\vphantom {{d\beta } {d\tau }}} \right. \kern-0em} {d\tau }} = \beta \left( {\alpha --1} \right),$Тривиальное стационарное решение системы уравнений (6): α(0) = β(0) = 0. Другое равновесие имеет место быть при α(1) = 1, β(1) = γ. Исследование устойчивости этого равновесия системы (6) показало, что концентрации интермедиатов осциллируют с частотой ω0 = γ0.5, при этом движение фазовой точки представляет собой незатухающее вращение вокруг центра.
Кинетические уравнения для продуктов реакции записываются как:
(7)
${{db} \mathord{\left/ {\vphantom {{db} {d\tau }}} \right. \kern-0em} {d\tau }} = \beta ,\,\,\,{{\,df} \mathord{\left/ {\vphantom {{\,df} {d\tau }}} \right. \kern-0em} {d\tau }} = \alpha ,$Определяя тип и параметры внешнего воздействия, учитываем, что реакция имеет собственную частоту ω0. Полагали, что частота воздействия ω связана с ω0 соотношением: ωτ = nω0τ + Δ, где n – кратность величины частоты воздействия относительно ω0, Δ – сдвиг по фазе ω относительно ω0. Зависимость константы равновесия K0 ассоциации от давления делает возможным регулирование динамики процесса за счет механического воздействия на реакционную систему. Создаваемые в реакционной среде волны растяжения и сжатия приводят к изменению константы равновесия K0 в соответствии с законом Вант-Гоффа:
где Р – давление, a – структурно чувствительный коэффициент. При расчетах полагали, что коэффициент a одинаков при растяжении и сжатии (предельный случай).Молекулы мономера, образованные при разрушении димера, имеют взаимную ориентацию центров межмолекулярного взаимодействия более выгодную для ассоциации на стадии сжатия по сравнению с остальными молекулами. При высокой частоте воздействия эти молекулы не успевают прийти в равновесное состояние, так что их ассоциация идет с большей вероятностью, чем ассоциация остальных молекул, и при этом с выделением тепла.
Динамика уравнений (6) и (7) исследована с помощью компьютерного моделирования для открытой системы, т.е. при условии:
(9)
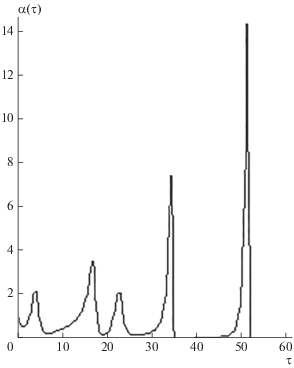
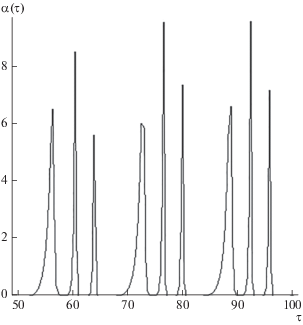
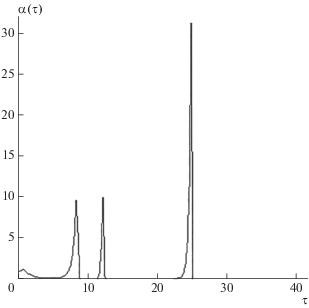
$\left[ A \right] = \left[ {{{A}_{{\text{1}}}}} \right] + 2K{{\left[ {{{A}_{{\text{1}}}}} \right]}^{2}} = const$при различных значениях параметров задачи. Некоторые кинетические зависимости показаны на рис. 1–3. Расчеты проводились при аР =2, K0 = 5; [А] = 5 моль ⋅ л–1, ω0 = 0.4 c–1, n = 1, Δ = 0, изменялись только параметры m1 = k1/k3 и m2 = k4/k3; концентрация [А1] определялась из уравнения (9). На рис. 1–3 приведены кривые для концентраций α(τ), поскольку качественно кривые β(τ) и скорости образования продуктов (7) имеют такой же вид, для β(τ) со сдвигом по времени вправо.
Без внешнего воздействия в системе устанавливается режим гармонических осцилляций. Ассоциация реагента отражается на характере кривых: максимумы амплитуд осцилляций изменяются во времени по гармоническому закону, причем наиболее резко это проявляется при больших значениях константы равновесия К0.
При сравнительно небольшой величине воздействия (аР = 2) происходит заметное изменение характера осцилляций: сначала они имеют хаотический, иррегулярный вид (рис. 1), а затем постепенно происходит изменение их формы. При увеличении параметра m1, связанного с константой скорости образования реагента X (1), на кинетических кривых концентраций ярко проявляются пульсации: после периода с практически нулевой амплитудой колебаний происходит их резкое возбуждение с последующим резким уменьшением амплитуды (рис. 2). Увеличение параметра m2, связанного с константой скорости образования продукта F (4), приводит от иррегулярного характера изменения концентрации [X] к прекращению реакции (рис. 3).
Увеличение концентрации реагента [А], параметров m1 и m2, частоты и амплитуды воздействия приводят к уменьшению частоты осцилляций и практическому прекращению реакции.
При изучении влияния сдвига Δ на осцилляции рассматривали случаи, когда Δ = π, ±0.5π, поскольку при этих значениях Δ меняется характер изменения функции sin или ее знак. При аР = 2 и сдвиге Δ ≠ 0 осцилляции концентраций первоначально имеют хаотический вид, затем после непродолжительного периода времени они приобретают более упорядоченную форму с несколькими (от 3 до 5) зубцами
Таким образом, внешнее воздействие позволяет управлять кинетикой данной реакции, изменяя частоту и амплитуду колебаний концентраций интермедиатов, вплоть до прекращения реакции. В случае, когда аР мало, начальное состояние временнóй структуры концентрации интермедиатов имеет форму хаоса. Такой режим не является самоподдерживающимся, и гладкая временная структура медленно релаксирует к более однородному распределению. Если величина аР превышает некоторое критическое значение аР ≥ аРкр, где аРкр зависит от ω, свойства временнóго изменения существенно меняются. В этом случае начальное состояние приводит к формированию иррегулярных, резко выраженных, изменяющихся со временем, структур, и, в конце концов, иррегулярные осцилляции становятся основными, так что динамика системы, как показали вычисления при большом времени, не претерпевает дальнейших изменений.
ЗАКЛЮЧЕНИЕ
Проблема выявления механизмов структурообразования в нелинейных системах занимает одно из центральных мест в естественных, технических и гуманитарных науках, так что полученные выводы справедливы для исследования механизма образования временных структур в подобных системах. В частности, важнейшей задачей является прогнозирование динамики систем при внешнем периодическом воздействии, которое появляется естественным образом в связи с суточными, сезонными и годовыми циклами температуры, доступности пищи и др. природными факторами [4].
Работа выполнена как часть государственного задания (номер государственной регистрации АААА-А19-119071190017-7).
Список литературы
Kononov L.O. // RSC Adv. 2015. V. 5. P. 46718.
Sedlák M. // J. Phys. Chem. B. 2006. V. 110. P. 4329.
Лен Ж.-М. Супрамолекулярная химия. Концепции и перспективы. Новосибирск: Наука, 1998.
Медвинский А.Б., Петровский С.В., Тихонова И.А. и др. // УФН. 2002. Т. 172. № 1. С. 31; Medvinskii A.B., Petrovskii S.V., Tikhonova I.A. et al. // Phys. Usp. 2002. V. 45. No. 1. P. 27.
Смирнов Л.П., Кулагина Т.П., Андрианова З.С. // Изв. РАН. Сер. хим. 2017. Т. 66. № 1. С. 30; Smirnov L.P., Kulagina T.P. Andrianova Z.S. // Russ. Chem. Bull. 2017. V. 66. No. 1. P. 2494.
Кулагина Т.П., Смирнов Л.П., Андрианова З.С. // Докл. РАН. 2017. Т. 475. № 3. С. 277; Kulagina T.P., Smirnov L.P., Andrianova Z.S. // Dokl. Phys. Chem. 2017. V. 475. No. 1. P. 126.
Смирнов Л.П., Кулагина Т.П. // Хим. физ. 2017. Т. 36. № 10. С. 55; Smirnov L.P., Kulagina T.P. // Russ. J. Phys. Chem. В. 2017. V. 11. P. 786.
Кауш Г. Разрушение полимеров. М.: Мир, 1981. 440 с.
Ганиев Р.Ф., Фомин В.Н., Малюкова Е.Б. и др. // Докл. РАН. 2005. Т. 403. С. 777; Ganiev R.F., Fomin V.N., Malyukova E.B. et al. // Dokl. Phys. Chem. 2005. V. 403. No. 6. P. 164.
Беляев А.А., Каганова З.И., Новожилов Б.В. // Хим. физ. 2005. Т. 24. С. 71; Belyaev A.A., Kaganova Z.I., Novozhilov B.V. // Russ. J. Phys. Chem. В. 2005. V. 24. No. 8. P. 71.
Эбелинг В. Образование структур при необратимых процессах. М.: Мир, 1979. 280 с.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая