Известия РАН. Серия физическая, 2021, T. 85, № 8, стр. 1122-1127
Управление агрегацией дифильных спиропиранов в монослоях Ленгмюра
О. А. Райтман 1, 2, *, Е. В. Райтман 1, Н. Л. Зайченко 3, Г. В. Любимова 3, А. А. Щербина 1, 2, А. В. Любимов 3
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Российский химико-технологический университет имени Д.И. Менделеева”
Москва, Россия
2 Федеральное государственное бюджетное учреждение науки
Институт физической химии и электрохимии имени А.Н. Фрумкина Российской академии наук
Москва, Россия
3 Федеральное государственное бюджетное учреждение науки
Федеральный исследовательский центр химической физики имени Н.Н. Семенова Российской академии наук
Москва, Россия
* E-mail: rightman@muctr.ru
Поступила в редакцию 12.03.2021
После доработки 05.04.2021
Принята к публикации 28.04.2021
Аннотация
Представлены результаты исследования фотохромных свойств монослоев 1'-гексадецил-3',3'-диметил-6-нитро-1',3'-дигидроспиро [хромен-2,2'-индола] в индивидуальном виде и в смеси с цетиловым спиртом. Выявлены переходы между различными фазовыми состояниями монослоев спиропирана. Изучено образование J-агрегатов этого соединения при различных соотношениях “спиропиран/цетиловый спирт” и при изменении поверхностного давления. Продемонстрировано, что изучаемое соединение проявляет фотохромные свойства в монослоях Ленгмюра. Полученные результаты открывают широкие перспективы использования спиросоединений в молекулярной электронике.
ВВЕДЕНИЕ
Фотоиндуцированная агрегация органических соединений вызывает повышенный интерес у исследователей вследствие того, что этот феномен позволяет получать материалы с нелинейно-оптическими свойствами, а также управлять фотофизическими свойствами объектов [1]. Фотохромные спиропираны являются одним из важнейших классов оптически активных соединений, используемых в устройствах записи и оптической обработки сигналов [2, 3], в голографии [4], в системах отображения информации на большом экране [5], в сенсорике [6] и др. К достоинствам систем на основе спиропиранов стоит, в первую очередь, отнести устойчивость к изменению температуры, высокий активационный барьер реакции изомеризации, значительную спектральную различимость изомеров и возможность стабилизации фотовозбужденной молекулы [7, 8]. Кроме того, ряд дифильных спиросоединений демонстрирует термо- и фотоиндуцированную H- и J-агрегацию в органических растворителях [9]. Ранее нами были изучены фотохромные и некоторые физико-химические свойства дифильного спиропирана в органических растворителях, а также исследована способность этого соединения растекаться по водной субфазе [10]. В данной работе изучена способность 1'-гексадецил-3',3'-диметил-6-нитро-1',3'-дигидроспиро [хромен-2,2'-индола] (SP1) в смеси с цетиловым спиртом формировать ленгмюровские монослои на жидких подложках, и продемонстрирована возможность управления агрегационным состоянием таких систем путем введения разбавителя и изменения поверхностного давления.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Дифильный спиропиран 1'-гексадецил-3',3'-диметил-6-нитро-1',3'-дигидроспиро [хромен-2,2'-индол] (SP1) синтезирован по известной методике [11].
Цетиловый спирт (CA) (“Компонент–Реактив”, С16Н33ОН, Mr = 242.4 г/моль, 99.9%) использовали без дальнейшей очистки.
Для изучения монослоев спиропирана и его смесей с цетиловым спиртом на водной субфазе готовили 1 · 10–4 моль/л раствор SP1 и SP1/CA в свежеперегнанном хлороформе. Изотермы сжатия (зависимость поверхностного давления π (мН/м) от площади, приходящейся на молекулу A (Å2/мол.)), измеряли с помощью установки KSV MINI-TROUGH 2 LB (KSV Instruments, Финляндия), оснащенной полностью автоматизированными весами Ленгмюра и платиновой пластинкой Вильгельми. Управление интерфейсным устройством, осуществляющим связь комплекса с компьютером, и обработка экспериментальных данных осуществлялись с помощью программного обеспечения KSV Software 2.0. Для формирования монослоя на поверхность водной субфазы наносили раствор исследуемого соединения объемом 100 мкл. Через 15 мин, необходимых для испарения растворителя, монослой сжимали со скоростью 10 мм/мин. В качестве субфазы использовали деионизированную воду (сопротивление воды – 18 МОм · см). Температуру субфазы поддерживали постоянной (25 ± 0.1°C) с помощью рециркуляционного термостата JULABO ED-5 (JULABO Labortechnik GmbH, Germany). Облучение ультрафиолетовым светом с длиной волны 365 нм осуществляли с помощью УФ-светодиода, обеспечивающего сфокусированный поток света (выходная мощность – 1.7 мВт), в непосредственной близости от исследуемого монослоя.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В общем виде молекула спиропирана состоит из двух частей – хроменовой и индолиновой, соединенных общим sp3-гибридизованным атомом углерода – спироатомом (схема 1 ). В закрытой форме эти части расположены во взаимно-перпендикулярных плоскостях, в то время как при раскрытии пиранового цикла происходит поворот гетареновой части молекулы вокруг связи С=С, в результате чего мероцианиновая форма фотохрома становится плоской. Такие свойства могут быть использованы для управления структурой монослоев и пленок Ленгмюра–Блоджетт, переключения между различными фазовыми состояниями двумерных систем на поверхности водных субфаз, управления комплексообразованием таких систем и т.д. [12].
Схема 1 . Строение и фотохромные преобразования дифильного 1'-гексадецил-3',3'-диметил-6-нитро-1',3'-дигидроспиро [хромен-2,2'-индола] (SP1).
До недавнего времени примеров синтеза и исследования в монослоях дифильных фотохромных соединений было немного. Только после того, как стало ясно, что изучение фоточувствительности и ионселективных свойств фотоактивных ПАВ в монослоях на границе раздела фаз является важным этапом для создания новых типов наноматериалов, это направление стало развиваться опережающими темпами. В связи с этим, первой частью настоящего этапа исследований стало изучение возможности спиропирана образовывать истинные монослои на поверхности водной субфазы.
Анализ изотерм сжатия спиропирана SP1 (зависимости поверхностного давления монослоя от площади, предоставляемой одной молекуле) показал, что в закрытой форме это соединение не способно формировать устойчивые монослои на поверхности воды (рис. 1а, изотерма 1). Это может быть связано с тем, что обе части данной молекулы (углеводородная и спиропирановая группа) являются гидрофобными. При облучении ультрафиолетовым светом спиропиран переходит в мероцианиновую форму, представляющую собой цвиттерион. В связи с этим “головная” часть молекулы становится гидрофильной, и SP1 хорошо растекается по водной поверхности, формируя истинный монослой, изотерма сжатия которого представлена на рис. 1а (изотерма 2).
Рис. 1.
Изотермы сжатия спиропирана SP1 в темноте (1) и при УФ-облучении (2) (а). Спектры поглощения монослоев SP1 при облучении УФ-светом при различных давлениях (значения показаны слева в мН/м) (б).
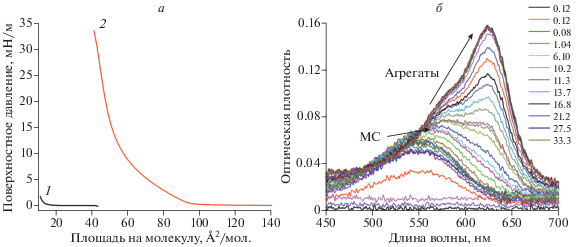
Анализ изотерм сжатия мероцианиновой формы SP1 позволяет выделить на графике 3 участка: до 5 мН/м происходит плавное повышение давления при уменьшении площади на молекулу, из чего можно заключить, что монослой находится в жидко-расширенном состоянии. От 5 до 15 мН/м давление растет не линейно с уменьшением площади, что может быть связано с фазовым переходом из жидко-расширенного в жидко-конденсированное, а также с образованием J-агрегатов мероцианина. Выше 15 мН/м зависимость поверхностного давления от площади, предоставляемой одной молекуле, имеет ярко выраженный линейный характер, свидетельствующий о том, что монослой спиропирана находится в двумерном жидко-конденсированном состоянии. При давлении выше 35 мН/м происходит коллапс, монослой спиропирана теряет устойчивость, начинается формирование полимолекулярных структур или трехмерных агрегатов SP1. Образование J-агрегатов в монослое подтверждается изменением спектра поглощения монослоя при увеличении давления. До 11 мН/м в электронных спектрах растет полоса поглощения в области 560 нм, характерная для мероцианиновой формы молекулы. При более высоких давлениях в спектре появляется и растет полоса поглощения в области 620 нм, что свидетельствует об образовании J-агрегатов (рис. 1б).
Из литературных источников известно, что спиропираны могут формировать устойчивые монослои на поверхности водной субфазы в смеси с длинноцепочечными углеводородными радикалами [13]. В связи с этим следующим этапом работы стало изучение возможности SP1 формировать монослои в смеси с цетиловым спиртом (CA) и исследование фотохромных свойств этих систем в двумерном состоянии. На рис. 2 представлены изотермы сжатия смесей SP1/nCA в различных соотношениях в темноте и при облучении ультрафиолетом.
Рис. 2.
Изотермы сжатия смешанных монослоев SP1/nCA в темноте (а) и под действием ультрафиолетового света (б). На вставках: расчетные площади спиропирана S (Å2/мол.) в зависимости от количества цетилового спирта n (%).
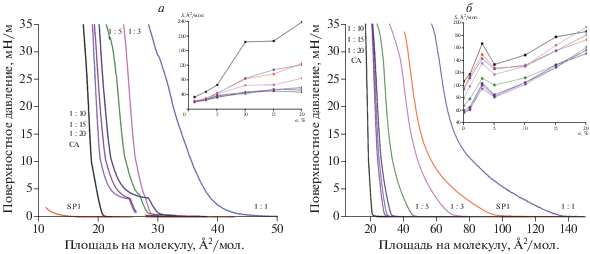
Очевидно, что уже при соотношении 1 : 1 смесь фотохрома и спирта свободно растекается по водной поверхности и формирует устойчивый монослой (рис. 2а). На изотерме сжатия можно выделить один фазовый переход. В отсутствие облучения вследствие того, что “головная” часть SP1 является гидрофобной, спиропиран вероятно формирует “островковые” структуры в смешанных пленках, которые уменьшаются в своих размерах по мере увеличения количества цетилового спирта в смеси. Это наглядно доказывается схожестью участков изотерм при низких давлениях до 3 мН/м. При повышении давления в монослое выше 3 мН/м происходит смешение фаз цетилового спирта и SP1, выражающейся в наличии плато и плавном подъеме изотермы до 10 мН/м. Выше этого значения смесь ведет себя как однородный слой и позволяет рассчитать площадь SP1, занимаемую молекулой в плотно упакованном монослое. При облучении светом (λ = 365 нм) молекулы фотохрома и углеводорода хорошо смешиваются и формируют устойчивые монослои на поверхности воды (рис. 2б). Анализ изотерм сжатия смесей цетилового спирта и спиропирана в открытом и закрытом состоянии показал, что при облучении площадь молекулы SP1, занимаемая на плоскости, увеличивается с 40 до 130 Å2 (рис. 2, вставки). Переход молекулы спиропирана в мероцианиновую форму под действием УФ-облучения подтверждается изменением спектров поглощения монослоя, записанных при различных давлениях (рис. 3).
Рис. 3.
Спектры поглощения монослоев смеси SP1 и СА в соотношении 1 : 3 в темноте (а) и под действием УФ-света (б). Микрофотография монослоя под углом Брюстера при давлении 25 мН/м (в).
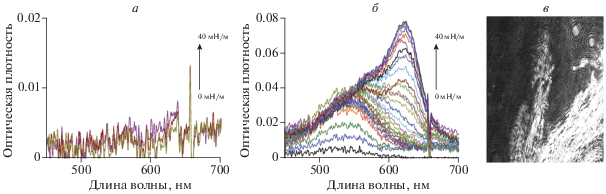
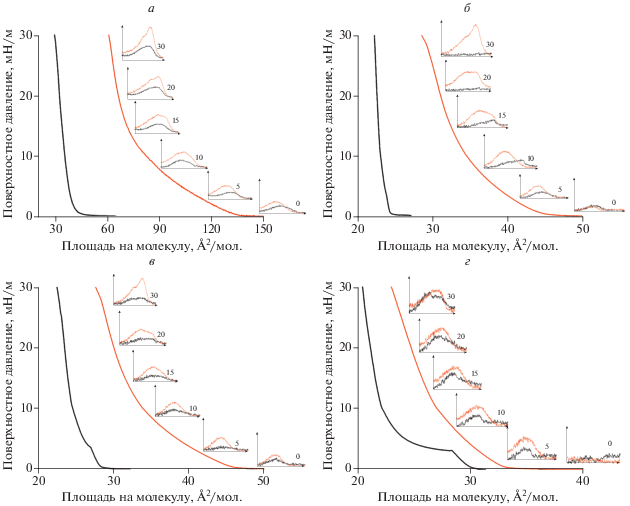
Очевидно, что при сжатии монослоя в темноте поглощение в области 560 нм отсутствует (рис. 3а), в то время как облучение ультрафиолетом приводит появлению полосы поглощения, характерной для мероцианина (560 нм), а при давлениях 10 мН/м (давление фазового перехода) растет полоса в области 620 нм, свидетельствующая об образовании J-агрегатов этого соединения (рис. 3б). Образование агрегатов при сжатии подтверждается исследованиями, проведенными с помощью метода микроскопии под углом Брюстера (рис. 3в). Увеличение содержания цетилового спирта в смешанном монослое приводит к тому, что удается предотвратить процесс агрегации фотохрома мероцианиновой формы (рис. 4). Очевидно, что в монослоях с соотношением SP1 : CA 1 : 1 и 1 : 3 агрегирование молекул фотохрома начинается при давлении 10 мН/м (рис. 4а и 4б, соответственно), однако при пятикратном разбавлении фотохрома цетиловым спиртом (соотношение 1 : 5) J-агрегаты образуются при давлениях выше 20 мН/м (рис. 4в), а при десятикратном и большем разбавлении (рис. 4г) – при давлениях 25 мН/м. На основе полученных данных можно сделать вывод, что варьирование содержания цетилового спирта в монослоях Ленгмюра на основе SP1 влияет на агрегационное состояние мономолекулярных пленок фотохрома при одинаковом поверхностном давлении, а механическое воздействие на смешанный монослой (изменение поверхностного давления) позволяет управлять образованием агрегатов на разных стадиях формирования системы.
Рис. 4.
Изотермы сжатия смешанных монослоев SP1 и СА в соотношении 1 : 1 (а), 1 : 3 (б), 1 : 5 (в) и 1 : 10 (г) в темноте и под действием УФ-света. На вставках – спектры поглощения при различных давлениях (значения показаны слева от спектров в мН/м) в темноте и под действием УФ-света, соответственно.
ЗАКЛЮЧЕНИЕ
Были исследованы фотохромные свойства дифильного 1'-гексадецил-3',3'-диметил-6-нитро-1',3'-дигидроспиро [хромен-2,2'-индола] на поверхности воды. Продемонстрировано, что фотохром в спироформе не образует устойчивых монослоев на водной субфазе, в то время как мероцианиновая форма этого соединения полностью растекается по поверхности и формирует истинный монослой. Показано, что в планарном состоянии у изучаемого вещества резко возрастает склонность к агрегированию, что подтверждается появлением и ростом полосы поглощения в области 620 нм. Формирование смешанных монослоев из молекул SP1 и цетилового спирта, а также внешнее механическое воздействие позволяет управлять степенью агрегации спиропирана в мономолекулярных пленках и добиваться полного растекания соединения по поверхности воды с одновременным сохранением фотохромных свойств вещества в двумерном состоянии. Полученные результаты открывают перспективы для использования соединений спиропиранового ряда в молекулярной электронике и создания наноразмерных оптически активных систем.
Работа выполнена при финансовой поддержке РФФИ (проект № 18-29-18039-мк) и частично в рамках государственного задания № 0082-2019-0003.
Список литературы
Uznanski P. // Synth. Met. 2000. V. 109. № 1. P. 281.
Berkovic G., Krongauz V., Weiss V. // Chem. Rev. 2000. V. 100. No. 5. P. 1741.
Guo X., Zhang D., Zhang G., Zhu D. // J. Phys. Chem. B. 2004. V. 108. No. 32. P. 11942.
Ghailane F. // Opt. Engin. 1995. V. 34. No. 2. P. 480.
Zhu M.-Q., Zhu L., Han J.J. et al. // J. Amer. Chem. Soc. 2006. V. 128. No. 13. P. 4303.
Avella-Oliver M., Morais S., Puchades R., Maquieira Á. // Trends. Analyt. Chem. 2016. V. 79. P. 37.
Минкин В.И. // Усп. хим. 2013. Т. 82. № 1. С. 1; Minkin V.I. // Russ. Chem. Rev. 2013. V. 82. No. 1. P. 1.
Koryako N.E., Ivakhnenko D.A., Ivakhnenko A.A. et al. // Prot. Met. Phys. Chem. Surf. 2019. V. 55. No. 6. P. 1118.
Metelitsa A.V., Coudret C., Micheau J.C., Voloshin N.A. // RSC Adv. 2014. V. 4. No. 40. P. 20974.
Ивахненко Д.А., Шокуров А.В., Любимова Г.В. и др. // Изв. АН. Сер. хим. 2018. № 12. С. 2266; Ivakhnenko D.A., Shokurov A.V., Lyubimova G.V. // Russ. Chem. Bull. 2018. V. 67. No. 12. P. 2266.
Gruda I., Leblanc R.M. // Can. J. Chem. 1976. P. 1.
Wang P.X., Bai F.Q., Zhang Z.X. et al. // Org. Electron. 2017. V. 45. P. 33.
Ando E., Miyazaki J., Morimoto K. et al. // Thin Sol. Films. 1985. V. 133. No. 14. P. 21.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая