Известия РАН. Серия физическая, 2021, T. 85, № 9, стр. 1257-1262
Наночастицы оксидов железа для выделения ДНК из клеток крови
А. В. Тюменцева 1, 2, *, А. С. Горбенко 1, 2, Р. Н. Ярославцев 1, 3, С. В. Столяр 1, 3, 4, Ю. В. Герасимова 3, 4, С. В. Комогорцев 3, О. А. Баюков 3, Ю. В. Князев 3, М. Н. Волочаев 3, И. А. Ольховский 1, 2, Р. С. Исхаков 3
1 Федеральное государственное бюджетное научное учреждение Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения Российской академии наук”
Красноярск, Россия
2 Красноярский филиал Федерального государственного бюджетного учреждения
“Гематологический научный центр” Министерства здравоохранения и социального развития
Российской Федерации
Красноярск, Россия
3 Институт физики имени. Л.В. Киренского Сибирского отделения Российской академии наук –
обособленное подразделение Федерального государственного бюджетного научного учреждения
Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения
Российской академии наук”
Красноярск, Россия
4 Федеральное государственное автономное образовательное учреждение высшего образования
“Сибирский федеральный университет”
Красноярск, Россия
* E-mail: komivlann@yandex.ru
Поступила в редакцию 19.04.2021
После доработки 12.05.2021
Принята к публикации 28.05.2021
Аннотация
Получены магнитные наночастицы с силикатным покрытием, изучены их физико-химические свойства. Экспериментально подтверждена возможность использования полученных нанокомпозитов для выделения ДНК из лейкоцитов для генетических исследований.
ВВЕДЕНИЕ
Магнитные наночастицы представляют большой интерес для биологии и медицины, как для фундаментальных исследований, так и для применения в различных областях [1–6]. Использование магнитных наночастиц для сепарации биологических молекул получило большое распространение благодаря простоте применения, относительной безопасности в сочетании с возможностью получить чистый продукт, возможности автоматизации процесса. Однако, несмотря на преимущества, данная технология создает ряд трудностей, среди которых высокая реакционная способность оксидов металлов, их воздействие на молекулы нуклеиновых кислот с возможным повреждением последних [7]. По этой причине биосовместимость магнитной наноконструкции является очень важной характеристикой, обусловливающей применимость разработанных частиц в биомедицине [8]. Степень воздействия частиц на мишеневую молекулу может зависеть от их химического состава, размера, концентрации и других показателей [9].
Наночастицы оксидов железа являются одними из наименее агрессивных соединений для биологических объектов [10]. Наиболее часто используемыми формами оксида железа в биомедицине являются магнетит (Fe3O4) и маггемит (γ‑Fe2O3). Согласно результатам работы [11] частицы со средним размером более 60 нм демонстрируют физические свойства и кристаллическую структуру массивного магнетита с параметром решетки a = 0.8383 нм. Наночастицы оксида железа достаточно малых размеров являются нестехиометрическим соединением магнетит-маггемитового ряда. Такое соединение может быть описано кристаллохимической формулой Fe3+[${\text{Fe}}_{{1 - 3n}}^{{2 + }}{\text{Fe}}_{{1 + 2n}}^{{3 + }}$ϕn]O4, где ϕ – обозначение вакансий, n – их формульный коэффициент [11]. При размерах менее 10 нм частицы по составу и структуре близки к маггемиту.
Модификация поверхности таких частиц веществами, обладающими более высокой сорбционной емкостью и химической стойкостью, позволяет получить конструкции с высокой функциональной активностью и минимальным побочным действием на целевые молекулы [12]. При этом наиболее простое покрытие для выделения нуклеиновых кислот – силикатное (SiO2). Выделение ДНК является одним из первых и очень важным этапом клинической лабораторной диагностики при молекулярно-генетических исследованиях и ряде тестов на наличие инфекционных заболеваний. Наиболее часто используемым материалом при этом является кровь. Поэтому разработка и оптимизация методов выделения ДНК из клеток крови не теряет актуальности.
Целью работы была разработка наномагнитных конструкций на основе наночастиц оксидов железа для сепарации молекул ДНК из клеток крови.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Магнитные частицы были получены методом соосаждения из раствора солей FeCl3 и FeCl2 в молярном соотношении 2.7 : 1 и 2 : 1 при комнатной температуре. Навески растворяли в дистиллированной воде и при перемешивании вводили в раствор NH4OH (25%) до достижения pH 10. Продолжали перемешивание в течение 4 ч (для 2.7 : 1) и 30 мин (для 2 : 1). По окончании реакции магнитные наночастицы в обоих случаях собирали при помощи магнита и отмывали несколько раз в дистиллированной воде до установления pH 7.0. Поверхность частиц модифицировали оксидом кремния с использованием тетраэтоксисилана (TEOS) и 3-аминопропилтриэтоксисилана (APTES). Полученные наночастицы были исследованы методами электронной просвечивающей микроскопии, ИК-спектроскопии, мессбауэровской спектроскопии, магнитометрии. Исследования выполнялись на оборудовании Красноярского регионального центра коллективного пользования ФИЦ КНЦ СО РАН.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Электронно-микроскопические изображения (рис. 1) показывают, что наночастицы, синтезированные из раствора с отношением солей 2 : 1, имеют сферическую форму (d ~ 10 нм), а частицы, синтезированные из раствора с отношением солей 2.7 : 1, имеют форму пластин со средним размером 11 нм и толщиной 2.5 нм. На вставках к рис. 1 приведены дифракционные картины, на которых регистрируются все характерные для наночастиц магнетит-маггемитового ряда отражения.
Рис. 1.
Изображения наночастиц, полученные с помощью просвечивающего электронного микроскопа высокого разрешения, и дифракционные картины. Частицы оксида железа, синтезированные из раствора с отношением солей 2 : 1 (а); частицы оксида железа, синтезированные из раствора с отношением солей 2.7 : 1 (б).

На рис. 2б приведен спектр мессбауэровской спектроскопии наночастиц, синтезированных из раствора с отношением солей 2.7 : 1. Компоненты спектров представлены цветными линиями. Состояния атомов в суперпарамагнитном состоянии характеризуются в данном спектре синглетом. Состояния атомов в заблокированном состоянии характеризуются секстетами. В табл. 1 приведены параметры обнаруженных неэквивалентных позиций катионов Fe3+ и их принадлежности. Используя заселенности позиций и соотношение (А5 + А4 + А3) = Vs/V, где V – общий объем наночастицы, Vs – объем ее поверхностной области, А3, А4 и А5 – заселенность поверхностных и приповерхностных позиций согласно табл. 1, оценили толщину поверхностного слоя, которая составила 5.6 Å [13].
Рис. 2.
Мессбауэровские спектры. Частицы оксида железа, синтезированные из раствора с отношением солей 2 : 1 (а); частицы оксида железа, синтезированные из раствора с отношением солей 2.7 : 1 (б).
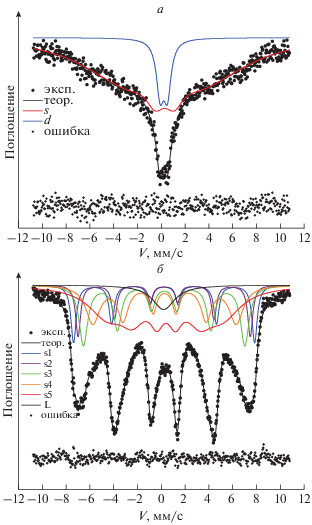
Таблица 1.
Мессбауэровские параметры
| IS | H | QS | W34–16 | A | Позиция | |
|---|---|---|---|---|---|---|
| (a) | 0.34 | 472 | 0.01 | 0.53–0.53 | 0.11 | Fe3+ – тетраэдрическое окружение |
| 0.35 | 449 | 0 | 0.50–0.50 | 0.09 | Fe3+ – октаэдрическое окружение | |
| 0.34 | 421 | 0 | 0.71–0.87 | 0.19 | Fe3+ – тетраэдрические приповерхностные | |
| 0.38 | 374 | 0 | 0.70–1.40 | 0.19 | Fe3+ – октаэдрические приповерхностные | |
| 0.45 | 303 | –0.23 | 1.40–3.74 | 0.37 | Fe3+ – поверхность | |
| 0.31 | – | – | 2.26 | 0.05 | Fe3+ – суперпарамагнитные частицы | |
| (б) | 0.39 | 311 | 0 | 2.0–8.3 | 0.90 | Fe3+ – ферромагнитные частицы |
| 0.31 | – | 0.61 | 0.75 | 0.10 | Fe3+ – суперпарамагнитные частицы |
Модельный спектр наночастиц, синтезированных из раствора с отношением солей 2 : 1 (спектр a) аппроксимирован суммой одного секстета и одного дублета. Результат подгонки сведен в табл. 1. Судя по величинам химических сдвигов, все железо в образцах находится в трехвалентном высокоспиновом состоянии. По сравнению с образцом (б) секстеты показывают очень широкие линии поглощения со значительным уширением внешних линий. Флуктуации сверхтонких полей по позициям образца могут составлять от 180 до 440 кЭ.
Основная часть железа (~90%), находится в магнитоупорядоченном состоянии при комнатной температуре (секстет). Парамагнитный дублет составляет ~10% от общей площади спектра. Уменьшение сверхтонкого поля на атомах железа магнитной фазы относительно образца (б) может означать уменьшение эффективности или числа межатомных взаимодействий (разупорядочение решетки) или же уменьшение размеров нанокристаллитов. Уширение резонансных линий, а также величины сверхтонкого поля в данном образце обусловлено релаксационными эффектами, т.е. данные частицы при комнатной температуре находятся вблизи перехода от суперпарамагнитного к ферромагнитному порядку. Температура перехода в суперпарамагнитное состояние (температура блокировки TB ~ KV/kB, где kB – константа Больцмана) определяется объемом частицы V и магнитной анизотропией K. Линейные размеры двух видов обсуждаемых частиц близки (см. рис. 1), однако за счет того, что частицы (б) имеют форму пластин, добавляется вклад анизотропии формы и температура блокировки увеличивается. Заблокированные частицы, вследствие диполь-дипольного взаимодействия, склонны к образованию агломератов, вследствие чего уменьшается удельная площадь поверхности. Суперпарамагнитные частицы сложнее собирать с помощью магнитного поля. Таким образом, для магнитной сепарации, по-видимому, наиболее пригодными являются частицы, находящиеся в ферромагнитном состоянии с TB вблизи комнатной.
На рис. 3 представлены ИК–Фурье спектры магнитных наночастиц (а – частицы оксида железа, синтезированные из раствора с отношением солей 2 : 1; б – частицы оксида железа, синтезированные из раствора с отношением солей 2.7 : 1).
Рис. 3.
ИК-Фурье спектры. Частицы оксида железа, синтезированные из раствора с отношением солей 2 : 1 (а); частицы оксида железа, синтезированные из раствора с отношением солей 2.7 : 1 (б).
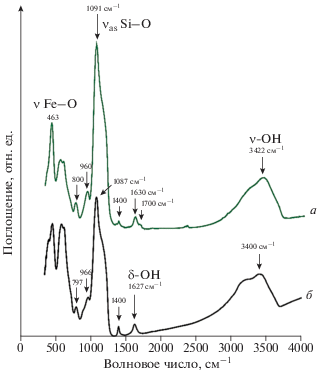
Анализ ИК-спектров показал наличие связей Fe–O (a – 580, б – 590 см–1) у всех образцов. В спектрах наночастиц пики сильных валентных колебаний силоксановых групп Si–O (а – 1091 и б – 1087 см–1) и силанольных групп Si–OН (~800 и ~960 см–1) доказывают образование оболочки оксида кремния на поверхности наночастицы. Валентное колебание ν-ОН образует интенсивную полосу в области 3200–3600 см–1 в исследуемых образцах.
В полученных спектрах происходит смещение пика Si–O от 1091 до 1087 см–1 и уменьшение его интенсивности. Изменения происходят и с деформационными колебаниями (~463 см–1) связи Si–O, наиболее интенсивными они являются в спектре (а) (см. рис. 3). Такие отличия спектра (a) со спектром (б), могут быть связаны с тем, что в образце (б) содержится высокая концентрация ОН-групп. Установлено, что силоксановые группы принимают участие в процессах связи между магнитными частицами и слоем кремнезема, а силанольные группы наиболее активны на поверхности и являются химически активными для образования ковалентной связи. Наличие ОН-групп на поверхности частиц кремнезема может тормозить процессы гибридизации молекул ДНК.
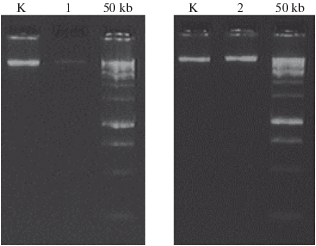
Произведено выделение ДНК из клеток крови при помощи разработанных магнитных частиц с использованием растворов коммерческого набора реагентов ДНК-сорб-В (AmpliSens, Москва, Россия). В качестве контроля выделения был использован полный набор ДНК-сорб-В, включающий силикатный сорбент для ДНК. Количество и качество ДНК, полученное в результате использования магнитных наночастиц, синтезированных из раствора солей железа в соотношении 2 : 1, было сопоставимо с количеством, выделенным при помощи силикатного сорбента. Электрофорез полученной ДНК в агарозном геле (рис. 4) продемонстрировал единую четкую полосу очищенных молекул, что указывает на их целостность, отсутствие фрагментации. Это делает пробы применимыми для последующих генетических исследований. Интенсивность свечения полос ДНК пропорциональна ее количеству и позволяет утверждать, что магнитные наночастицы способны выделять из смеси молекулы нуклеиновых кислот в количестве, сопоставимом с использованием стандартного силикатного сорбента.
Рис. 4.
Результат анализа ДНК, выделенной при помощи МНЧ: электрофорез ДНК в 1% агарозном геле. К – контроль выделения (силикатный сорбент), 1 – частицы, синтезированные из раствора с отношением солей 2.7 : 1; 2 – частицы, синтезированные из раствора с отношением солей 2 : 1; 50 kb – маркер молекулярного веса ДНК 50 kb.
ЗАКЛЮЧЕНИЕ
Синтезированы наночастицы оксида железа покрытые силикатной оболочкой при различных условиях получения. Изучение ИК-спектров показало, что наночастицы полученные из раствора солей железа в соотношении 2.7 : 1 имеют на своей поверхности повышенную концентрацию OH-групп. Данные образцы также имеют высокую температуру блокировки относительно образца, полученного из раствора солей железа в соотношении 2 : 1.
Выделение ДНК из клеток крови показало, что образец “2 : 1” по количеству и качеству выделенного ДНК не уступает силикатному сорбенту. В то время как образец “2.7 : 1” оказался недостаточно эффективен для выделения.
Таким образом, для магнитной сепарации ДНК более пригодными оказались частицы, синтезированные из раствора солей железа в соотношении 2 : 1. Это обусловлено тем, что данные частицы находятся в ферромагнитном состоянии с TB вблизи комнатной, а на поверхности отсутствуют OH-группы, ингибирующие связывание молекул ДНК.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований, Правительства Красноярского края, Красноярского краевого фонда поддержки научной и научно-технической деятельности (проект № 20-42-242902). Работа поддержана Советом по грантам Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук (проект № МК-1263.2020.3).
Список литературы
Mornet S., Vasseur S., Grasset F. et al. // Progr. Sol. St. Chem. 2006. V. 34. Nos. 2–4. P. 237.
Neuberger T., Schöpfa B., Hofmann H. et al. // J. Magn. Magn. Mater. 2005. V. 293. No. 1. P. 483.
Stolyar S. V., Balaev D. A., Ladygina V. P. et al. // J. Supercond. Nov. Magn. 2018. V. 31. No. 8. P. 2297.
Berry C.C., Curtis A.S.G. // J. Phys. D. 2003. V. 36. No. 13. Art. No. R198.
Chilom C.G., Sandua N., Bălăşoiu M. et al. // Int. J. Biol. Macromol. 2020. V. 164. P. 3559.
Chilom C.G., Zorilăb B., Bacalum M. et al. // Chem. Phys. Lipids. 2020. V. 226. Art. No. 104851.
Gaharwar U.S., Meena R., Rajamani P. // J. Appl. Toxicol. 2017. V. 37. No. 10. P. 1232.
Никифоров В.Н. // Наука. Технол. Пром. 2011. № 1. С. 90.
Комина А.В., Ярославцев Р.Н., Герасимова Ю.В. и др. // Изв. РАН. Сер. физ. 2020. Т. 84. № 11. С. 1597; Komina A.V., Yaroslavtsev R.N., Gerasimova Y.V. et al. // Bull. Russ. Acad. Sci. Phys. 2020. V. 84. No. 11. P. 1362.
Dadfar S.M., Roemhildab K., Drude N.I. et al. // Adv. Drug Deliv. Rev. 2019. V. 138. P. 302.
Салихов С.В., Савченко А.Г., Гребенников И.С., Юртов Е.В. // Изв. РАН. Сер. физ. 2015. Т. 79. № 9. С. 1251; Salikhov S.V., Savchenko A.G., Grebennikov I.S., Yurtov E.V. // Bull. Russ. Acad. Sci. Phys. 2015. V. 79. No. 9. P. 1106.
Tolmacheva V.V., Apyari V.V., Kochuk E.V. et al. // J. Analyt. Chem. 2016. V. 71. No. 4. P. 321.
Zakharova I.N., Shipilin M.A., Alekseev V.P. et al. // Tech. Phys. Lett. 2012. V. 38. No. 1. P. 55.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


