Известия РАН. Серия физическая, 2022, T. 86, № 8, стр. 1099-1103
Модельный анализ распределения дозы в костном имплантате в процессе радиационной стерилизации
В. В. Розанов 1, 2, *, А. О. Хуцистова 1, И. В. Матвейчук 2, А. П. Черняев 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”
Москва, Россия
2 Федеральное государственное бюджетное научное учреждение
“Всероссийский научно-исследовательский институт лекарственных и ароматических растений”
Москва, Россия
* E-mail: vrozanov@mail.ru
Поступила в редакцию 14.03.2022
После доработки 08.04.2022
Принята к публикации 22.04.2022
- EDN: VOFQCK
- DOI: 10.31857/S0367676522080154
Аннотация
С использованием программного комплекса GEANT4 проведено моделирование процесса радиационной обработки костного имплантата потоком гамма-квантов и пучком ускоренных электронов. Получены данные о пространственном распределении поглощенной дозы в образце с характеристиками костной ткани в зависимости от определяющих условий процесса радиационной обработки.
ВВЕДЕНИЕ
Стерилизация является важнейшим этапом технологии изготовления костных имплантатов, во многом определяющим эффективность и безопасность реконструктивно-восстановительных операций [1]. Около половины современного мирового рынка технологий стерилизации биообъектов занимает радиационная стерилизация [2], причем общая тенденция его развития ориентирована на расширение доли радиационных технологий. Такое положение обусловлено не только очевидными преимуществами радиационной обработки перед стерилизацией оксидом этилена [1], но и постоянным совершенствованием радиационных методик, включая и прогрессивное направление комбинированных методов [3, 4]. Их использование позволяет существенно снизить дозовую нагрузку на обрабатываемый костный материал и предотвратить проявление негативных дозозависимых воздействий радиации на биологические ткани [5]. При этом вопрос надежного контроля поглощаемой дозы в процессе стерилизации остается актуальным. Дополнительные сложности могут быть обусловлены спецификой архитектоники костной ткани ввиду наличия в ней развитой, пространственно-ориентированной системы внутрикостных пространств (СВП) [6]. СВП выполняет ряд важных функций, однако в ее объеме могут содержаться патогенные микроорганизмы. Прямые измерительные методики с использованием, например, калиброванных пленочных детекторов, а также расчетные методы могут дать информацию об интегральной дозе, полученной образцом в целом. Однако очевидно, что вопрос достижения равномерного пространственного распределения поглощенной дозы в объеме костного имплантата является существенным для обеспечения эффективного подавления патогенов и требует специального изучения и выработки соответствующих практических рекомендаций. Следует заметить, что вопрос обеспечения равномерности радиационного воздействия на обрабатываемые объекты остается актуальным и для случаев, например, обработки пищевой (в частности, мясной и рыбной) продукции [7]. Однако проблема равномерности дозового распределения в костных фрагментах в известной литературе практически не освещена. Это обусловило необходимость проведения настоящего исследования. Решение этого вопроса возможно с привлечением модельных подходов на базе адекватных программных средств.
Цель настоящего исследования – определение оптимальных условий радиационной стерилизации костных имплантатов на основе результатов моделирования процесса радиационного воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
За основу модельной задачи были взяты условия осуществленного ранее в НИИЯФ МГУ на базе линейного ускорителя электронов с энергией 1 МэВ эксперимента по радиационной обработке костного фрагмента, который предварительно подвергся воздействию озоно-кислородной смеси [8]. В этом исследовании использовали фрагменты кости – параллелепипеды с размерами 6 × 8 × 18 мм, полученные из компактного вещества нативных бедренных костей быка.
При анализе полученных данных сравнение проводили с результатами работ, где комбинированное воздействие на костные имплантаты осуществляли путем обработки водным раствором этанола, димексида и тимола (первый этап), а на втором этапе – потоком гамма-квантов [9].
В качестве основного инструмента при проведении моделирования в работе использовали программный комплекс GEANT4 – универсальный программный продукт, созданный в CERN для исследований в области физики высоких энергий [10, 11]. В настоящее время существует целый ряд пакетов специализированных программ, предназначенных для реализации модельных исследований по конкретным проблемам астрофизики, медицины, устройств радиационной защиты и др. [12]. В каждом конкретном случае в реализуемом программном пакете учитывается геометрия процесса радиационного воздействия, вид излучения, его энергетические параметры, физические процессы, происходящие при радиационном воздействии, геометрия, материал объекта воздействия и проч. В данном случае в качестве объекта были выбраны образцы прямоугольной формы с размерами 18 мм по оси Ох и 8 мм по оси Оу. Толщину образца по оси Оz варьировали. Облучение осуществляли по направлению оси Оz. Статистика составляла 106 частиц. Параметры кортикальной костной ткани выбирали из данных, имеющихся в библиотеке GEANT4.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Среди применяемых в современных условиях радиационных технологий стерилизации преобладает обработка гамма-квантами [2]. Такое положение обусловлено рядом преимуществ, к которым, в первую очередь, следует отнести большую глубину проникновения и относительную простоту технологической процедуры стерилизации. Значительная проникающая способность гамма-лучей определяет высокую равномерность распределения поглощенной дозы [1, 13]. Это положение в полной мере подтвердилось в модельных исследованиях.
Специально для этого случая был проведен модельный расчет при энергиях 0.5 и 1 МэВ для образца толщиной 6 мм при расстоянии между источниками гамма-излучения и костным фрагментом 15 см (рис. 1а и 1б).
Рис. 1.
Глубинное распределение величины поглощенной дозы в кости при облучении гамма-излучением с начальной энергией: 0.5 МэВ (K = 2.23) (а); 1 МэВ (K = 2.58) (б).

Для получения количественной оценки равномерности распределения дозы в костном образце при расчетах используется величина коэффициента неравномерности K, определяемого как отношение максимальной поглощенной дозы к минимальной. Приведенные графические зависимости подтверждают, что при облучении гамма-квантами достигается равномерное глубинное распределение дозы практически по всей толщине костного образца. Вместе с тем, накопление поглощенной дозы, достаточной для надежного подавления патогенов и достижения эффективной стерилизации костного образца, требует значительного времени радиационного воздействия. Эта закономерность отчетливо проявляется и при моделировании данного процесса. На практике метод стерилизации с использованием неподвижного источника гамма-излучения, в качестве которого обычно используется радиоактивный изотоп 60Co, считается наиболее простым и относительно недорогим. Однако обработка гамма-квантами может продолжаться в течение нескольких часов и даже суток. При этом обязателен контроль возможного изменения уровня активности изотопа. Кроме того, изотоп излучает непрерывно и это приводит к необходимости принятия специальных мер по постоянной защите персонала и окружающей среды. В результате между методиками радиационной стерилизации гамма-квантами и быстрыми электронами происходит постоянное соперничество. С появлением все более совершенной ускорительной техники использование пучков электронов для радиационной обработки стерилизуемых изделий становится вполне конкурентоспособным [14], особенно в связи с тем, что продолжительность такой процедуры может составлять всего несколько минут, а при выключении ускорителя между рабочими циклами нет необходимости в постоянной мощной радиационной защите. Вместе с тем, в условиях относительно малой проникающей способности ускоренных электронов, воздействующих на костный образец в процессе радиационной стерилизации, технологические условия этого процесса должны учитывать определенную специфику для обеспечения эффективности стерилизующего воздействия. Проведенные исследования показали, что в рамках модельного подхода возможно выделить ряд определяющих параметров для выработки рекомендаций по оптимизации процесса стерилизации костных имплантатов пучком быстрых электронов. В частности, к таким параметрам относятся, в первую очередь, расстояние от источника электронов до обрабатываемого объекта, энергия электронного пучка, а также толщина образца, подвергающегося радиационной обработке. Расчеты показали, что оптимальное расстояние между источником электронов и костным фрагментом составляет 7–10 см в зависимости от рассматриваемых энергетических параметров пучка. Именно эти значения задавались в дальнейших сериях расчетов, определивших оптимальные величины энергии пучка для обработки костных фрагментов различной толщины, варьируемой в диапазоне от 4 до 10 мм с шагом 2 мм. Указанный диапазон выбирали из соображения соответствия характерным размерам реальных заготовок для костных имплантатов.
Проведенное моделирование показало, что при малых значениях исходной энергии пучка электронов (0.5–1.0 МэВ) основная доза поглощается в поверхностной области. Поэтому для увеличения эффективности радиационной обработки образец следует либо вращать, или облучать последовательно с двух противоположных сторон. Типичная картина получаемого при этом глубинного распределения поглощенной дозы для образца толщиной 6 мм и при энергии пучка 1 МэВ (как в исходном фактическом эксперименте [8]) приведена на рис. 2а. Хорошо видно, что центральные области костного образца практически не получили дозы при такой обработке. В этом случае наличие в костной ткани объемной системы внутрикостных пространств [6, 15], которые могут содержать патогенные микроорганизмы, может способствовать сохранению в этих областях очага инфекции и как следствие – снижать эффективность процесса стерилизации.
Рис. 2.
Распределение поглощенной дозы по глубине образца костной ткани при облучении пучком ускоренных электронов с энергией 1 (а) и 3 МэВ (б).
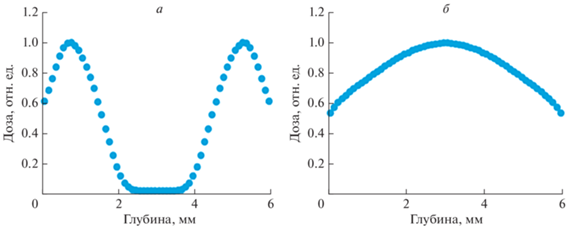
Увеличение энергии пучка электронов постепенно приводит к тому, что при величине энергии уже в 1.5 МэВ правый и левый пики начинают перекрываться и поглощенная доза в центре образца сравнивается по величине с дозой на поверхности. Дальнейшее увеличение дозы приводит к получению глубинного распределения величины поглощенной дозы, по своей конфигурации приближающегося к распределению дозы при обработке гамма-квантами. Пример такого распределения для энергии пучка 3 МэВ приведен на рис. 2б). Подобные зависимости получены и для других значений толщины костного образца. Однако следует обязательно иметь в виду, что увеличение энергии стерилизующего радиационного воздействия неизбежно сопряжено с дополнительной дозовой нагрузкой на биоткани, что будет сопровождаться негативными дозозависимыми эффектами [16]. Поэтому в каждом конкретном случае необходимо стремиться к установлению оптимального соотношения величины поглощенной дозы, энергии и продолжительности радиационного воздействия с учетом особенностей процесса, выбором вида радиационной обработки, объекта воздействия. При этом важно обеспечить соответствие национальным нормативам, регламентирующим применение радиационных технологий в различных приложениях [1, 17].
ЗАКЛЮЧЕНИЕ
Использование универсального программного комплекса GEANT4 позволило провести модельное исследование процессов, сопровождающих радиационное воздействие потоком гамма-квантов и пучков ускоренных электронов на образцы прямоугольной формы со структурно-функциональными характеристиками костной ткани. В результате получены пространственные распределения величины поглощенной дозы при различных условиях облучения и значениях определяющих параметров, что в свою очередь дает возможность выработать практические рекомендации по оптимизации процесса радиационной стерилизации костных имплантатов. В частности, показано, что воздействие потоком гамма-квантов позволяет получить равномерное распределение поглощенной дозы по всей толщине костного фрагмента, но для этого требуется значительное время. В свою очередь ускоренные электроны обеспечивают получение необходимой дозы в короткое время. Но при этом равномерность распределения величины поглощенной дозы по объему стерилизуемого образца требует его облучения с разных сторон или вращения в процессе радиационного воздействия. При этом для достижения относительной равномерности распределения дозы необходимо использовать пучки электронов с оптимальными (в зависимости от толщины стерилизуемого фрагмента) значениями энергии. В частности, для толщины 6 мм оптимальной является энергия пучка в 3 МэВ при двустороннем облучении костного образца.
При таких условиях пучки быстрых электронов становятся перспективной альтернативой традиционным гамма-квантам, и их доля на современном рынке радиационной стерилизации может существенно вырасти.
Исследование выполнено в рамках темы государственного задания АААА-А20-120061890024-5 при поддержке Междисциплинарной научно-образовательной школы Московского университета “Фотонные и квантовые технологии. Цифровая медицина”.
Список литературы
Розанов В.В., Матвейчук И.В. // Альм. клин. мед. 2019. Т. 47. № 7. С. 634.
Розанов В.В., Матвейчук И.В., Черняев А.П. и др. // Изв. РАН. Сер. физ. 2020. Т. 84. № 4. С. 521; Roza-nov V.V., Matveychuk I.V., Chernyaev A.P. et al. // Bull. Russ. Acad. Sci. Phys. 2020. V. 84. No. 4. P. 403.
Матвейчук И.В., Розанов В.В., Гордонова И.К. и др. Комбинированный способ стерилизации костных имплантатов. Пат. РФ № 2630464, кл. A61L23. 2017.
Розанов В.В., Матвейчук И.В., Черняев А.П. и др. // Изв. РАН. Сер. физ. 2021. Т. 85. № 5. С. 745; Roza-nov V.V., Matveychuk I.V., Chernyaev A.P. et al. // Bull. Russ. Acad. Sci. Phys. 2021. V. 85. No. 5. P. 581.
Шангина О.Р., Нигматуллин Р.Т. // Морфология. 2006. Т. 129. № 3. С. 44.
Денисов-Никольский Ю.И., Миронов С.П., Омельяненко Н.П. и др. Актуальные проблемы теоретической и клинической остеоартрологии. М.: ОАО “Типография “Новости”, 2005. 336 с.
Черняев А.П., Авдюхина В.М., Близнюк У.А. и др. // Учен. зап. физ. фак-та. МГУ. 2020. № 2. С. 1920303.
Алимов А.С., Близнюк У.А., Борщеговская П.Ю. и др. // Изв. РАН. Сер. физ. 2017. Т. 81. № 6. С. 819; Alimov A.S., Bliznyuk U.A., Borchegovskaya P.U. et al. // Bull. Russ. Acad. Sci. Phys. 2017. V. 81. No. 6. P. 743.
Савельев В.И., Булатов А.А., Рыков Ю.А. Комбинированный способ стерилизации костных трансплантатов. Пат. РФ № 2356224, кл. A01N1/02. 2009.
Lei F., Truscott P.R. // IEEE Trans. Nucl. Sci. 2002. V. 49. No. 6. P 2788.
Allison J. // IEEE Trans. Nucl. Sci. 2006. V. 53. No. 1. P. 270.
Allison J. Geant4 Developments and Applications // IEEE Trans. Nucl. Sci. 2006. V. 53. No. 1. P. 270.
Singh R., Singh D., Singh A. // World J. Radiol. 2016. V. 8. No. 4. P. 355.
Черняев А.П. Радиационные технологии. Наука. Народное хозяйство. Медицина. М.: Изд-во Московского университета, 2019. 231 с.
Розанов В.В., Матвейчук И.В., Литвинов Ю.Ю. и др. // Биорадикалы и антиоксиданты. 2016. Т. 3. № 3. С. 229.
Розанов В.В., Матвейчук И.В., Черняев А.П., Николаева Н.А. // Изв. РАН. Сер. физ. 2019. Т. 83. № 10. С. 1415; Rozanov V.V., Matveychuk I.V., Chernyaev A.P., Nikolaeva N.A. // Bull. Russ. Acad. Sci. Phys. 2019. V. 83. No. 10. P. 1311.
Черняев А.П., Розанов В.В., Беклемишев М.К. и др. // Изв. РАН. Сер. физ. 2020. Т. 84. № 11. С. 1619; Chernyaev A.P., Rozanov V.V., Beklemishev M.K. et al. // Bull. Russ. Acad. Sci. Phys. 2020. V. 84. No. 11. P. 1380.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


