Известия РАН. Серия физическая, 2022, T. 86, № 8, стр. 1123-1126
Разработка метода контроля распределения дозы в лучевой терапии на пучках фотонов
А. Г. Синельников 1, *, А. П. Черняев 1, А. А. Щербаков 1, С. А. Золотов 1, Е. Н. Лыкова 1
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Московский государственный университет имени М.В. Ломоносова”, физический факультет
Москва, Россия
* E-mail: sinelnikov1995@gmail.com
Поступила в редакцию 14.03.2022
После доработки 08.04.2022
Принята к публикации 22.04.2022
- EDN: BPDXVW
- DOI: 10.31857/S036767652208021X
Аннотация
Представлены новые результаты исследования, направленного на разработку метода модернизации действующих медицинских ускорителей электронов, который может стать способом оценки в режиме реального времени дозового распределения в теле пациента при облучении. Обоснована идея создания математической модели, позволяющей по распределению возникающих в процессе облучения аннигиляционных фотонов оценить распределение поглощенной дозы в исследуемом участке тканей.
ВВЕДЕНИЕ
Несмотря на распространение применения достижений ядерной физики в медицине, приведшее к созданию и активному использованию установок для лучевой терапии (гамма-нож, кибер-нож, томотерапия), а также установок для лучевой диагностики (компьютерная томография (КТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ), позитрон-эмиссионная томография (ПЭТ), магнитно-резонансная томография (МРТ), остается актуальной задача поиска новых методов, направленных на повышение качества оказываемого лечения.
Наравне с развитием радиационных технологий в лучевой терапии важно развитие дозиметрических технологий. В связи с необходимостью облучения пациентов ионизирующим излучением при проведении лучевой терапии, требуется особый подход к их радиационной защите. В медицине требуется управлять дозой у пациента так, чтобы она была соизмерима с лечебной целью, состоящей в использовании соответствующих доз для получения желаемого лечения [1].
Последнее десятилетие в зарубежных странах активно развиваются методы радиационной медицины, сочетающие в себе одновременно терапевтический и диагностический аспекты лечения. Разработан метод контроля дозы в процессе облучения электронами [2], для ионной лучевой терапии подобный метод разрабатывался в работах ученых в Германии и Республике Корея [3, 4].
Несмотря на то, что для дистанционной лучевой терапии используются пучки фотонов, электронов, протонов и ионов, более чем в 95% случаев лучевую терапию проводят именно на пучках тормозного излучения. Притом необходимые для этого медицинские ускорители электронов, которых в мире насчитывается более 14 000, составляют более 97% установок, используемых в дистанционной лучевой терапии [5].
Поэтому весьма актуальной для современной ядерной медицины задачей представляется разработка методов модернизации уже существующих медицинских ускорителей электронов, задействованных в лучевой терапии тормозными фотонами, методов, направленных на контроль распределения дозы в опухоли в динамике, непосредственно в процессе облучения.
Настоящая работа отражает результаты продолжения исследования, описанного авторами в работах [6, 7], в котором авторами было выдвинуто предположение, что число актов аннигиляции может быть инструментом определения величины дозы, поглощенной облучаемым телом. Поэтому целью данного исследования является поиск математической функции, осуществляющей получение глубинного распределения поглощенной дозы путем пересчета глубинного распределения актов аннигиляций позитронов, возникающих в процессе облучения. Акты аннигиляций регистрируются системой детекторов, подключенных по схеме совпадений.
МАТЕРИАЛЫ И МЕТОДЫ
В представленной работе был смоделирован компьютерный эксперимент, используя метод Монте-Карло, для реализации которого был использован пакет программ GEANT4 [8]. Выполнялось моделирование облучения водного фантома формы куба с ребром 200 мм пучком тормозного излучения, получаемого при прохождении монохроматического пучка электронов с энергией от 6 до 20 МэВ через тормозную мишень. Количество частиц в пучке электронов составляет 5 ⋅ 107. Тормозная мишень состоит из слоя вольфрама (74W) толщиной 0.6 мм и слоя меди (29Cu) толщиной 10 мм. Электроны, взаимодействуя с мишенью, образуют поток тормозных фотонов, который облучает водный фантом формы куба с ребром 200 мм. Расстояние “источник–поверхность фантома” (SSD) составляет 100 см. Фантом окружен системой кольцевых детекторов, регистрирующие тормозные и аннигиляционные фотоны, испускаемые из тела фантома.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для области энергий гамма-квантов от 2.5 до 25 МэВ зависимость сечения рождения пар может быть представлена в следующем виде [9]:
где ${{\sigma }_{п}}$ – сечение рождения пар, E – энергия γ-квантов, Z – зарядовое число атомного ядра вещества, из которого состоит мишень, ${{m}_{e}}{{c}^{2}}~$ – энергия покоя электрона, равная 0.511 МэВ.Поэтому в целях получения более информативных результатов, в работе представлены результаты компьютерного эксперимента, в котором энергия первичного пучка электронов составляла 20 МэВ. При этой энергии абсолютное количество аннигиляций будет наибольшим, а результаты будут наиболее удобными для анализа в условиях ограниченных вычислительных мощностей компьютерного моделирования (табл. 1).
Таблица 1.
Количество аннигиляционных фотонов энергией 511 кэВ, зарегистрированных системой детекторов, окружающих тело, полученное в результате моделирования облучения при различных энергиях электронов в первичном пучке
| Энергия, МэВ | Количество аннигиляционных фотонов, ед. | Доля в общем потоке гамма-квантов, % | Доля в потоке гамма-квантов с энергией 511 кэВ, % | Доля в потоке гамма-квантов с энергией, близкой к 511 кэВ, % |
|---|---|---|---|---|
| 6 | 6110 | 7.56 | 96.07 | 82.94 |
| 12 | 61 475 | 7.01 | 95.25 | 83.38 |
| 16 | 135 120 | 7.01 | 95.19 | 83.20 |
| 20 | 234 855 | 7.11 | 95.20 | 83.23 |
На рис. 1 представлены результаты компьютерного эксперимента: глубинное дозовое распределение и глубинное распределение числа аннигиляций, для удобства анализа нормированные на собственное максимальное значение.
Рис. 1.
Глубинное распределение поглощенной дозы и количества актов аннигиляций. Энергия первичного пучка электронов 20 МэВ.

В представленной работе ведется поиск математической функции пересчета, позволяющей получить глубинное дозовое распределение из распределения числа актов аннигиляции.
На рис. 2а представлено распределение отношения “доза–число аннигиляций”, используемое в качестве искомой функции. Данное распределение представляет собой отношение дозы к числу аннигиляций, приходящиеся на каждый миллиметр облучаемого тела.
Рис. 2.
Распределение отношения “доза–число аннигиляций” (а). Глубинные распределения поглощенной дозы, полученные при пересчете и методом Монте-Карло (20 МэВ) (б).
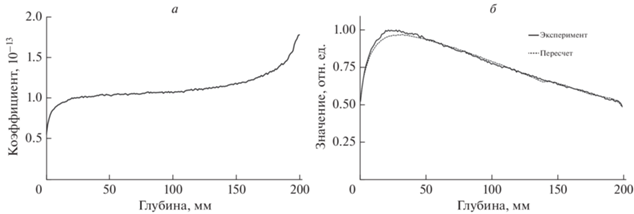
Представленное распределение качественно аппроксимируется следующей функцией:
(2)
$f\left( x \right) = \left\{ \begin{gathered} {{A}_{1}}\ln x + {{A}_{2}},\,\,\,\,x \in \left( {1,~140} \right) \hfill \\ {{B}_{1}} + {{B}_{2}}x + {{B}_{3}}{{x}^{2}} + {{B}_{4}}{{x}^{3}},\,\,\,\,x \in \left( {140,200} \right), \hfill \\ \end{gathered} \right.$Используя представленную выше функцию на распределении числа аннигиляций, было получено пересчитанное глубинное дозовое распределение. Результаты представлены на рис. 2б. Сравнение смоделированного и “пересчитанного” дозовых распределений привело к следующим выводам: координаты максимумов распределений совпадают (на глубине 28 мм), но отличаются величиной поглощенной дозы на 4%, составляя величину 0.96 отн. ед. для пересчитанных результатов и 1 отн. ед. для результатов компьютерного эксперимента. Градиент спада дозы для обоих графиков совпадает.
В процессе облучения из фантома, помимо аннигиляционных фотонов энергии 511 кэВ, вылетают значительное количество как тормозных фотонов различных энергий, так и аннигиляционных фотонов, потерявших часть своей энергии при взаимодействии с веществом, потому возникает интерес изучения количества и качества детектируемых фотонов, а также оценки загрузки используемых детекторов. В связи с этим был получен и исследован энергетический спектр фотонов, попадающих в окружающую фантом систему детекторов. Полученный спектр представлен на рис. 3.
Рис. 3.
Энергетический спектр фотонов, вылетающих из облучаемого тела, для энергии первичного пучка электронов 20 МэВ (за исключением фотонов с энергией, меньшей 10 кэВ).
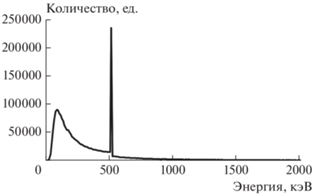
Анализ полученного спектра показал, что более 80% зарегистрированных фотонов обладают энергией, меньшей 511 кэВ. Количество аннигиляционных фотонов составляет 95% от общего числа фотонов с энергией 511 кэВ и более 80% от общего количества фотонов в диапазоне энергий 500–520 кэВ (табл. 1). Высокая разрешающая способность современных детекторов, составляющая от 4–5%, для сцинтилляционных счетчиков, до 0.1–0.2%, для полупроводниковых [10], позволяет создание на их основе будущей экспериментальной установки, основной задачей которой будет возможность идентификации пар аннигиляционных фотонов и качественное их отличие тормозного излучения.
Также в работе в целях оценки загрузки детекторов было рассчитано приближенное число актов аннигиляции позитронов, приходящееся на 1 Гр поглощенной дозы облучения. В случае использования электронов с энергией 20 МэВ данное число составляет ~7.37 ⋅ 109 по всему объему облучаемого тела. Это, учитывая временное разрешение современных сцинтилляционных детекторов (от 10–6 до 10–11 с) [11], а также размер рабочей зоны предполагаемого в будущей экспериментальной установке детектора и среднюю мощность дозы на медицинских ускорителях в 3–4 Гр/мин, позволяет судить о возможности их детектирования.
Учитывая вышесказанное, полученные результаты дают основание полагать предлагаемый метод реализуемым на практике.
ЗАКЛЮЧЕНИЕ
Подобрана приближенная математическая функция, позволяющая получение глубинного распределения дозы путем пересчета глубинного распределения аннигиляций (2). Полученное с помощью этой функции дозовое распределение качественно отражает результаты моделирования: градиент спада дозы и координаты максимума совпадают, отличаясь на 4% по величине.
Полученные результаты позволяют сделать вывод о теоретической обоснованности предлагаемого метода. Установка на уже существующие медицинские ускорители электронов предлагаемой системы детекторов позволит в динамике получать оценку глубинного распределения поглощенной дозы одновременно с сеансом облучения, тем самым осуществляя контроль за процессом лучевого лечения.
Исследование выполнено при поддержке Междисциплинарной научно-образовательной школы Московского университета “Фотонные и квантовые технологии. Цифровая медицина”.
Список литературы
Черняев А.П., Желтоножская М.В., Варзарь С.М. Радиационная безопасность: Уч. пособие. М.: ООП физ. фак-та МГУ, 2019. 98 с.
Jarvis L.A., Williams B.B., Gladstone D.J. et al. // Int. J. Radiat. Oncol. Biol. Phys. 2021. V. 109. № 5. P. 1627.
Su Jung An, Cheol-Ha Beak, Kisung Lee, Yong Hyun Chung // Nucl. Instrum. Meth. Phys. Res. A. 2013. V. 698. P. 37.
Ponisch F., Parodi K., Hasch B.G., Enghardt W. // Phys. Med. Biol. 2004. V. 49. P. 5217.
Черняев А.П. Радиационные технологии. Наука. Народное хозяйство. Медицина. М.: Издательство Московского университета, 2019. 231 с.
Синельников А.Г., Черняев А.П., Лыкова Е.Н. и др. // Мед. физика. 2020. № 1(85). С. 85.
Синельников А.Г., Черняев А.П. // Учен. зап. физ. фак-та МГУ. 2021. № 4. С. 2140501.
Allison J., Amako K., Apostolakis J. et al. // Nucl. Instrum. Meth. Phys. Res. A. 2016. V. 835. P. 186.
Мурзина Е.А. Взаимодействие излучения высокой энергии с веществом. Уч. пособие. Москва, 2007. 97 с.
Капитонов И.М. // БРЭ. 2006. Т. 6. С. 363.
Ишханов Б.С., Капитонов И.М., Кэбин Э.И. Частицы и ядра. Эксперимент. М.: МАКС Пресс, 2013.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая


