Известия РАН. Серия физическая, 2022, T. 86, № 9, стр. 1352-1357
Влияние высокоэнергетических протонов и гамма-излучения на структуру ДНК в растворе
О. М. Котб 1, 2, Д. С. Брожик 3, В. Н. Вербенко 3, Е. П. Гулевич 3, В. Ф. Ежов 1, 3, Д. Л. Карлин 3, Ф. А. Пак 3, С. В. Пастон 1, *, А. И. Халиков 3
1 Федеральное государственное бюджетное образовательное учреждение высшего образования
“Санкт-Петербургский государственный университет”
Санкт-Петербург, Россия
2 Кафедра физики, Факультет наук, Университет Загазиг
Загазиг, Египет
3 Федеральное государственное бюджетное учреждение
“Петербургский институт ядерной физики имени Б.П. Константинова Национального исследовательского центра
“Курчатовский институт”
Санкт-Петербург, Россия
* E-mail: s.v.paston@spbu.ru
Поступила в редакцию 18.04.2022
После доработки 13.05.2022
Принята к публикации 23.05.2022
- EDN: RMGCBF
- DOI: 10.31857/S0367676522090149
Аннотация
Выполнено сравнение повреждений в структуре ДНК под действием излучений с одинаковой ЛПЭ = $0.3\,\,{\text{КэВ}} \cdot {\text{мк}}{{{\text{м}}}^{{ - 1}}}{\text{:}}$ гамма-излучения и протонов с энергией 1 ГэВ при поглощенных дозах 0–100 Гр в растворах 5 и 150 мМ NaCl. Обнаружено, что протонное облучение вызывает меньшее падение температуры плавления ДНК, чем гамма-облучение. Дефекты вторичной структуры ДНК более значительны в гамма-облученных растворах. В ДНК, облученной протонами, наблюдаются признаки локальных множественных повреждений. Установлено, что протонное излучение имеет больший летальный эффект, чем гамма-излучение.
ВВЕДЕНИЕ
Облучение ионизирующей радиацией широко применяется при лечении онкологических заболеваний. Этот метод показан главным образом в тех случаях, когда опухоль не может быть удалена радикально хирургическим путем, или при наличии противопоказаний к оперативному вмешательству. До 70% онкологических больных подвергаются лучевой терапии как самостоятельному методу или в качестве компонента комбинированного лечения (в сочетании с хирургическим лечением, химиотерапией) [1]. Принцип действия радиационной терапии основан на фундаментальном законе, сформулированном еще в 1906 г. И. Бергонье и Л. Трибондо: клетки тем более радиочувствительны, чем менее они дифференцированы и чем интенсивнее они делятся [2]. Гибель таких клеток наступает в процессе деления, в результате повреждений в ДНК. Таким образом, для клеток злокачественной опухоли, быстро и неограниченно пролиферирующих и менее зрелых, чем клетки здоровой ткани, летальная доза будет ниже, чем для окружающих опухоль здоровых клеток [1, 3].
В настоящее время разработано множество методик радиационной терапии, направленных на усиление избирательности повреждения клеток опухоли и ослабления радиационной нагрузки на здоровые ткани [3–5]. Различные виды излучений характеризуются разной линейной передачей энергии (ЛПЭ) и зависимостью ЛПЭ от глубины проникновения в организм. Для фотонов эта зависимость имеет максимум в самом начале пробега частицы (для излучения 60Co с энергией фотонов 1.3 МэВ на глубине около 2 см в воде) [2], и затем медленно спадает. Такое распределение поглощенной энергии не благоприятно для лечения опухолей, локализованных глубоко внутри организма, так как доза радиации, полученная здоровыми тканями, оказывается выше, чем полученная опухолью. В случае же тяжелых заряженных частиц (протонов, α-частиц, ядер углерода) зависимость ЛПЭ от длины пробега в ткани имеет характерный максимум в конце трека (пик Брэгга), положение которого можно подобрать, варьируя начальную энергию частицы, так чтобы максимальная плотность ионизаций пришлась на опухоль [2]. Также в терапии используются пучки адронов высоких энергий, вдали от пика Брэгга – это так называемая технология “pencil beam”, особенно эффективная при лечении внутричерепных патологий [3–5]. Точная фокусировка, малое сечение пучка, практически не рассеивающегося в биологических тканях – неоспоримые преимущества этого метода. Подобный метод лечения успешно применялся в течение десятков лет в Комплексе лучевой терапии “на пролет” на базе ускорителя протонов СЦ-1000 в ФГБУ ПИЯФ им. Б.П. Константинова НИЦ “Курчатовский институт” (Гатчинский метод) [5–7]. На счету специалистов Комплекса более 1300 излеченных больных. Протоны высоких энергий имеют низкую ЛПЭ, сравнимую с ЛПЭ гамма-излучения [3]. Однако, взаимодействие этих ионизирующих частиц с веществом существенно различаются: гамма-кванты вызывают первичную ионизацию атомов в результате фотоэффекта и комптоновского эффекта, возникшие при этом быстрые электроны в свою очередь производят ионизацию и возбуждение окружающих атомов за счет электромагнитного взаимодействия с электронными оболочками. Треки этих электронов в веществе искривлены, длина пробега варьирует от 1 до 1000 мкм в зависимости от энергии фотона, переданной электрону. Протоны высоких энергий непосредственно вызывают множественные ионизации и возбуждение атомов в результате электромагнитного взаимодействия с электронными оболочками [2]. Целью данной работы является анализ повреждений в молекуле ДНК под действием γ-излучения 60Co (используется в терапевтическом устройстве гамма-нож) и протонов с энергией 1 ГэВ (на синхроциклотроне СЦ-1000 Санкт-Петербургского НИИ ядерной физики НИЦ “Курчатовский институт”). Эти два вида излучения имеют одинаковое значение ЛПЭ = $0.3\,\,{\text{кэВ}} \cdot {\text{мк}}{{{\text{м}}}^{{ - 1}}}.$
Радиационные нарушения в структуре ДНК подразделяют на одиночные и локальные множественные повреждения (ЛМП) [2, 8]. Одиночные повреждения являются, в основном, результатом косвенного действия радиации, т.е. взаимодействия макромолекулы с продуктами радиолиза воды. Эти повреждения быстро и эффективно репарируются в клетках. ЛМП – это два и более одиночных повреждений, расположенные на расстоянии менее 10 пар оснований. Такие повреждения труднорепарируемые либо нерепарируемые, особенно если нарушения возникли на обеих комплиментарных нитях ДНК. ЛМП играют основную роль в радиационной гибели клетки [8].
В данной работе нарушения в структуре ДНК изучали методом спектрофотометрического плавления [9, 10]. На параметры перехода спираль-клубок в облучаемой макромолекуле влияют различные типы радиационных повреждений. Одно- и двухцепочечные разрывы, разрушение, модификация и высвобождение азотистых оснований приводят к дестабилизации вторичной структуры и понижают температуру плавления ДНК (Tm) [9–12], в то время как межнитевые сшивки увеличивают Tm [9, 10].
МАТЕРИАЛЫ И МЕТОДЫ
Для исследования использовали натриевую соль ДНК из тимуса теленка (Sigma) молекулярной массы $M = \left( {6.3 \pm 0.5} \right) \cdot {{10}^{6}}\,\,{\text{Da,}}$ химически чистый NaCl, деионизованную воду. Растворы NaCl необходимой концентрации готовили из насыщенного раствора.
Облучение протонами с энергией 1 ГэВ проводили в аэробных условиях при комнатной температуре в ФГБУ ПИЯФ им. Б.П. Константинова НИЦ “Курчатовский институт” в комплексе Лучевой терапии “на пролет” на базе ускорителя СЦ-1000. Интенсивность пучка составляла 4 ${\text{Гр}} \cdot {\text{ми}}{{{\text{н}}}^{{ - 1}}}.$ Гамма-облучение проводили в аэробных условиях при комнатной температуре на установке Исследователь (60Co) в Отделении молекулярной и радиационной биофизики ПИЯФ им. Б.П. Константинова. Мощность дозы составляла 85 Гр мин–1. Концентрация ДНК в облучаемых растворах ${\text{С}} = \left( {1.4 \pm 0.1} \right) \cdot {{10}^{{ - 4}}}$ М нуклеотидов.
Измерения кривых плавления ДНК в исследуемых растворах проводили на приборе Specord 200 plus (Analytik Jena, Germany) с приставкой Пельтье, с шагом 1°, скорость нагрева 1° · мин–1. Использовали кварцевые кюветы с длиной оптического пути $l = 1\,\,{\text{см}}.$ В экспериментах измеряли оптическое поглощение раствора в максимуме поглощения ДНК D260 в зависимости от температуры T. Сбор данных и управление экспериментом осуществлялись с помощью программы WinASPECT (Analytik Jena, Germany). Обработку данных проводили в пакете OriginPro. Значение температуры плавления ДНК Тm определяли по положению максимума на дифференциальной кривой плавления $\frac{{d{{D}_{{260}}}}}{{dT}}$ [13]. Прежде, чем приступить к плавлению, регистрировали спектр УФ поглощения ДНК при температуре 25°С. После завершения плавления регистрировали спектр при максимальной температуре 95°С. Далее проводили охлаждение раствора до 25°С в течение 10 мин и регистрировали спектр ДНК. Используя полученные спектры поглощения, определяли величину гиперхромного эффекта [10]:
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выполнены измерения температуры плавления ДНК Тm в растворах 5 мМ NaCl и 150 мМ NaCl, облученной протонами 1 ГэВ и гамма-излучением 60Co в дозах 0–100 Гр. На рис. 1 показаны дифференциальные кривые плавления ДНК, использованные для определения Тm. С ростом ионной силы раствора увеличивается степень экранировки отрицательно заряженных фосфатных групп, что стабилизирует вторичную структуру ДНК. Это проявляется в увеличении температуры плавления Tm нативной ДНК и сужении температурного интервала перехода спираль-клубок в растворе 150 мМ NaCl по сравнению с этими параметрами для раствора 5 мМ NaCl. Облучение вызывает снижение температуры плавления ДНК и уширение перехода для обеих использованных ионных сил. Отметим, что в растворе 5 мМ NaCl при дозе гамма-облучения 100 Гр определить значение температуры плавления ДНК не представляется возможным, очевидно, вследствие весьма значительного нарушения структуры ДНК, тогда как при той же дозе протонного облучения Тm определить удается (рис. 1а, 1б). Уширение интервала перехода говорит о повышении гетерогенности структуры ДНК, т.е. о появлении в цепи ДНК участков, сильно различающихся по термостабильности.
Рис. 1.
Дифференциальные кривые плавления ДНК в растворах с ионной силой μ = 5 мМ NaCl (а, б) и μ = 150 мМ NaCl (в, г), облученной гамма-излучением (а, в) и протонным излучением (б, г). Поглощенные дозы в Гр указаны на графиках.
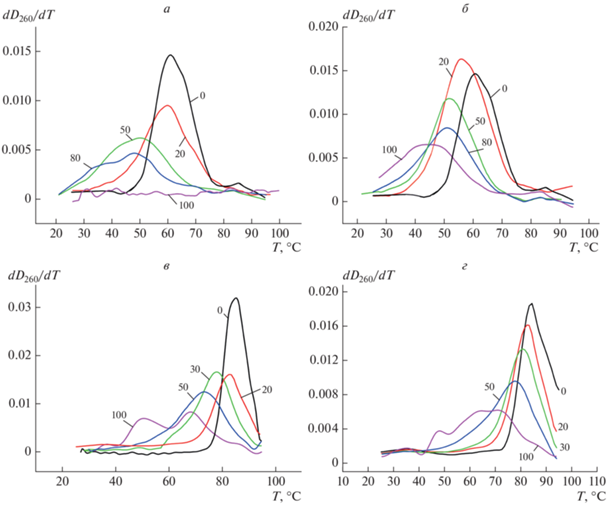
Несколько максимумов на кривой $\frac{{d{{D}_{{260}}}}}{{dT}} = f\left( T \right)$ наблюдается для ДНК, облученной в дозе 100 Гр при μ = 150 мМ NaCl (рис. 1в, 1г) – т.е. различие в термостабильности различных участков ДНК становится еще более резким. В этих условиях можно предположить образование сшивок (как между двумя комплиментарными нитями, так и между удаленными по цепи участками ДНК) в процессе облучения. Вследствие более эффективной экранировки фосфатных групп противоионами раствора, объем клубка ДНК при μ = 150 мМ NaCl примерно в 2 раза меньше, чем при μ = 5 мМ NaCl [14]. Размер мишени с ростом ${{\mu }}$ уменьшается, но плотность ДНК в клубке возрастает, что повышает вероятность образования и сшивок (т.е. сайтов с повышенной по сравнению с нативной ДНК Tm), и ЛМП (т.е. сайтов с пониженной Tm) [8, 15]. Так, например, если появились два близко расположенных однонитевых разрыва в одной из комплиментарных нитей ДНК, то этот участок макромолекулы денатурирует при более низкой температуре [10]. Известно, что ЛМП могут быть результатом как прямого, так и косвенного действия радиации; вероятность их появления возрастает с ростом дозы облучения [2, 8, 15, 16]. Таким образом, можно заключить, что наличие нескольких максимумов на дифференциальной кривой плавления свидетельствует о накоплении в ДНК значительного количества радиационных повреждений – сшивок и ЛМП.
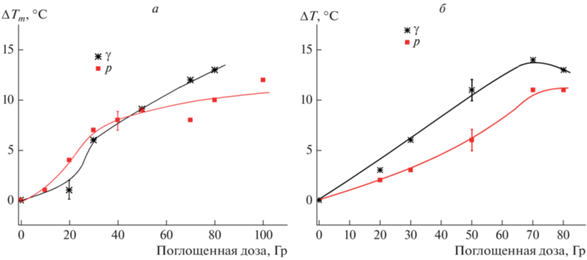
На рис. 2 показаны дозовые зависимости снижения температуры плавления ДНК, облученной протонным и гамма-излучением: ∆T = Tm0 – Tm (где Tm0 – температура плавления нативной ДНК, Tm – температура плавления облученной ДНК). Опыт показывает, что протонное облучение вызывает меньшее падение Tm ДНК, чем гамма-облучение в растворе 150 мМ NaCl при дозах 0–100 Гр и в растворе 5 мМ NaCl при дозах 70–100 Гр.
Рис. 2.
Снижение температуры плавления ДНК, облученной протонным и гамма-излучением в растворах с μ = 5 мМ NaCl (а) и μ = 150 мМ NaCl (б).
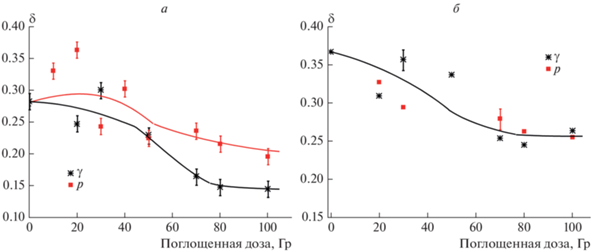
На рис. 3 показаны дозовые зависимости гиперхромного эффекта δ в изучаемых системах. В растворе 150 мM NaCl (рис. 3б) гиперхромный эффект монотонно снижается с ростом дозы облучения, причем данные, полученные при протонном и гамма-облучении ложатся на одну зависимость. Однако, в растворе 5 мM NaCl после протонного облучения в дозах 10 и 20 Гр гиперхромизм заметно возрос, и достиг значений, даже превышающих δ нативной ДНК (рис. 3а). Снижение гиперхромизма под действием ионизирующего излучения вполне ожидаемо (см. формулу (1)), и объясняется нарушениями во вторичной структуре ДНК (рост величины $D_{{260}}^{{25^\circ {\text{C}}}}$) и, одновременно, снижением количества хромофоров (уменьшение величины $D_{{260}}^{{95^\circ {\text{C}}}}$). Чем же можно объяснить рост гиперхромного эффекта при дозах 10 и 20 Гр протонного облучения в растворе 5 мМ NaCl (рис. 3а)? Можно предположить, что в этих системах при нагревании до 95°С происходит более полное нарушение стэкинг-взаимодействий между азотистыми основаниями ДНК, чем при тех же условиях в нативной макромолекуле. Это может осуществляться, если нагревание индуцирует не только расхождение комплементарных нитей, но и фрагментацию одиночных нитей [10]. Подобная фрагментация при нагревании может происходить, если в ДНК в результате облучения появились близко расположенные однонитевые разрывы в одной из комплиментарных нитей. Это предположение согласуется с литературными данными о том, что протоны высоких энергий производят как минимум в 2 раза больше однонитевых и примерно в 6 раз больше двунитевых разрывов в цепи ДНК, чем гамма-излучение [16–19]. При дозах протонного облучения больше 40 Гр гиперхромизм ДНК уже не превышает значения δ нативной ДНК (рис. 3а), вероятно, из-за того, что рост δ из-за фрагментации ДНК компенсируется падением δ вследствие нарастания других радиационных эффектов: снижения количества хромофоров и частичной денатурации ДНК. Интересно отметить, что такое аномальное поведение δ наблюдается только в растворе малой ионной силы. В 150 мМ NaCl дозовые зависимости δ монотонны и одинаковы для протонного и гамма-излучения. Это может объясняться разным объемом макромолекул-мишеней в этих системах.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что протонное излучение оказывает меньший разрушительный эффект на вторичную структуру ДНК, чем гамма-излучение с той же ЛПЭ и поглощенной дозой. Однако, при протонном облучении более четко наблюдаются признаки ЛМП – близко расположенные однонитевые разрывы в цепи макромолекулы. Распределение дефектов первичной и вторичной структуры в облученной ДНК определяет структура трека и распределение ионизаций и возбужденных молекул на пути ионизирующей частицы, и эти параметры различаются для гамма-излучения и высокоэнергетических протонов. Фотонное излучение характеризуется однородным распределением актов ионизации и возбуждения в облучаемом веществе, и в гамма-облученной ДНК возникают равномерно распределенные по цепи макромолекулы одиночные повреждения. В случае же протонного излучения ионизованные и возбужденные молекулы сосредоточены, в основном, в окрестности прямолинейного трека протона [20]. Этим объясняются ЛМП в цепи ДНК, подвергнутой облучению протонами. Таким образом, протоны с энергией 1 ГэВ индуцируют труднорепарируемые либо нерепарируемые повреждения в ДНК и, следовательно, проявляют более выраженное летальное действие. Можно заключить, что высокоэнергетичные протоны более эффективны в радиационной терапии опухолей, чем гамма-излучение.
Список литературы
Ганцев Ш.X. Онкология. Учебник для студентов медицинских вузов. М.: ООО “Медицинское информационное агентство”, 2006. 488 с.
Кудряшов Ю.Б. Радиационная биофизика (ионизирующие излучения). М.: Физматлит, 2004. 443 с.
Murshed H. Fundamentals of radiation oncology, physical, biological, and clinical aspects. London: Elsevier, 2019. 713 p.
Beyzadeoglu M., Ozyigit G., Ebruli C. Basic radiation oncology. Berlin, Heidelberg: Springer-Verlag, 2010. 575 p.
Труфанов Г.Е., Асатурян М.А., Жаринов Г.М. Лучевая терапия. Т. 2. М.: ГЭОТАР-Медиа, 2010. 200 с.
Абросимов Н.К., Воробьев А.А., Елисеев В.А. и др. // Мед. радиол. 1987. Т. 32. № 8. С. 10.
Abrosimov N.K., Gavrikov Yu.A., Ivanov E.M. et al. // J. Phys. Conf. Ser. 2006. V. 41. P. 424.
Газиев А.И. // Радиац. биол. Радиоэкол. 1999. Т. 39. № 6. С. 630.
Lazurkin Yu.S., Frank-Kamenetskii M.D., Trifonov E.N. // Biopolymers. 1970. V. 9. P. 1263.
Cantor C.R., Schimmel P.R. Biophysical chemistry. Part 3. San Francisco: W.H. Freeman and Company, 1980. 537 p.
Tankovskaia S.A., Kotb O.M., Dommes O.A., Paston S.V. // J. Phys. Conf. Ser. 2018. V. 1038. Art. No. 012027.
Tankovskaia S.A., Kotb O.M., Dommes O.A., Paston S.V. // Spectrochim. Acta. Part A. 2018. V. 200. P. 85.
Lando D.Y., Fridman A.S., Chang C.-L. et al. // Analyt. Biochem. 2015. V. 479. P. 28.
Kas’yanenko N.A. // J. Struct. Chem. 2006. V. 47. No. 1. P. 163.
Georgakilas A.G., O’Neill P., Stewart R.D. // Radiat. Res. 2013. V. 180. No. 1. P. 100.
von Sonntag C. Free-radical-induced DNA damage and its repair. Berlin, Heidelberg: Springer, 2006. 528 p.
Friedland W., Schmitt E., Kundrát P. // Sci. Rep. 2017. V. 7. P. 1.
Lee B.H.E., Wang C.-K.C. // Phys. Medica. 2019. V. 62. P. 140.
Pogozelski W.K., Xapsos M.A., Blakely W.F. // Radiat. Res. 1999. V. 151. No. 4. P. 442.
Nikjoo H., Emfietzoglou D., Watanabe R., Uehara S. // Radiat. Phys. Chem. 2008. V. 77. P. 12.
Дополнительные материалы отсутствуют.
Инструменты
Известия РАН. Серия физическая