Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 1, стр. 76-87
Ходьба децеребрированной кошки при одновременно различных скоростях на расщепленном тредбане
В. А. Ляховецкий 1, П. Ю. Шкорбатова 2, 4, О. В. Горский 3, 4, П. Е. Мусиенко 3, 4, Н. С. Меркульева 2, *
1 Институт физиологии им И.П. Павлова РАН, лаб. физиологии движения
Санкт-Петербург, Россия
2 Институт физиологии им И.П. Павлова РАН, лаб. нейроморфологии
Санкт-Петербург, Россия
3 Институт физиологии им И.П. Павлова РАН, лаб. нейромодуляции двигательных
и висцеральных функций
Санкт-Петербург, Россия
4 Институт трансляционной биомедицины СПбГУ, лаб. нейропротезов
Санкт-Петербург, Россия
* E-mail: mer-natalia@yandex.ru
Поступила в редакцию 20.02.2022
После доработки 11.04.2022
Принята к публикации 26.04.2022
- EDN: GJNJQX
- DOI: 10.31857/S0044467723010100
Аннотация
Определяющая роль сенсорного входа в инициации и модуляции локомоции показана неоднократно. Одним из способов изучения этого входа является парадигма “расщепленного” тредбана. В настоящем исследовании проведен сравнительный анализ ходьбы децеребрированной кошки по расщепленному тредбану, ленты которого двигались не только с разными скоростями (различались в 3 раза), но и в разных направлениях (вперед и назад). Показана реципрокная работа двух конечностей, а также мышц-сгибателей и разгибателей каждой конечности при таком локомоторном режиме. Выявлены две основные стратегии ходьбы: в ответ на один шаг конечности, идущей по медленной ленте тредбана, конечность, идущая по быстрой ленте, делала или один (стратегия 1 : 1), или два шага (стратегия 1 : 2); стратегии могли чередоваться. Результаты исследования позволяют предположить сохранение интеграции локомоторных сетей двух конечностей при значительном рассогласовании их сенсорных входов.
ВВЕДЕНИЕ
Большинство млекопитающих способны координировать движения конечностей посредством интеграции соответствующих центральных генераторов паттерна (ЦГП) за счет горизонтальных связей, образуемых нейронами спинного мозга (Frigon, 2017a). Одним из способов изучения координированных движений конечностей является предложенная Кулагиным и Шиком (1970) парадигма “расщепленного тредбана”, при которой каждая конечность располагается на отдельной ленте, имеющей возможность независимого движения в разных направлениях, с разной скоростью. Это обеспечивает рассогласование сенсорного входа от разных конечностей.
В большинстве работ исследована ходьба вперед, для обеспечения которой ленты тредбана движутся назад с разными скоростями. При относительно малом различии в скорости лент как животные (Кулагин, Шик, 1970), так и человек (Thelen et al., 1987; Reisman et al., 2005) сохраняют отношение циклов шага разных конечностей 1 : 1, то есть на один шаг одной из конечностей приходится один шаг другой. При увеличении различий между скоростями лент возможно изменение этого отношения (1 : 2, …, 1 : 5), при котором на один шаг конечности, движущейся по более медленной ленте, приходится несколько шагов конечности, движущейся по более быстрой ленте. К такой ходьбе способны не только интактные (Halbertsma, 1983; Kuczynski et al., 2017), но и острые децеребрированные (Кулагин, Шик, 1970), и хронические спинальные животные (Forssberg et al., 1980; Frigon et al., 2017b).
У животных, способных к квадрипедальной ходьбе, возможно использовать различные тредбаны для передних и задних конечностей. При этом у интактных животных возможно добиться ходьбы передними и задними конечностями в различном ритме (Akay et al., 2006). Между тем у хронических децеребрированных животных при спонтанной локомоции такой ходьбы у передних конечностей вызвать не удалось (Yanagihara et al., 1993).
При движении лент в различных направлениях с одинаковой скоростью как человек (Yang et al., 2005; Choi, Bastian, 2007), так и децеребрированные животные (Lyakhovetskii et al., 2021; Вещицкий и др., 2022) способны к двунаправленной ходьбе (ДХ), при которой одна конечность идет вперед (по ленте, движущейся назад), а другая – назад (по ленте, движущейся вперед). При этом влияние на ДХ еще более сильного рассогласования сенсорных входов, при котором каждая из лент тредбана будет обладать собственной скоростью, не исследовано. Цель настоящей работы – изучение ходьбы, обусловленной эпидуральной стимуляцией спинного мозга, в различных направлениях: вперед (ХВ), назад (ХН) и ДХ, при одновременно различной скорости лент тредбана, на модели острой децеребрированной кошки.
МЕТОДИКА
Объектом исследования являлись пять взрослых самцов кошек (весом 2.5–3.5 кг, нормальной пигментации). Экспериментальные процедуры были одобрены Комиссией по биоэтике Института физиологии им. Павлова. Эксперименты проводились в строгом соответствии с требованиями Директивы Совета Европы 2010/63EU Европейского парламента о защите животных, используемых в экспериментальных и других научных целях.
Хирургические процедуры и электростимуляция. Кошек глубоко анестезировали смесью изофлурана (2–4%) и газообразного кислорода. Трахея была канюлирована, а сонные артерии перевязаны. Животных децеребрировали на преколликулярно-постмаммилярном уровне (Gerasimenko et al., 2009). Голова децеребрированного животного, позвоночный столб и таз были зафиксированы в жесткой раме. Ламинэктомия была выполнена в области 4-го и 5-го поясничных позвонков, так, чтобы открыть доступ к дорсальной поверхности сегментов L5–L7 спинного мозга.
Регистрация ЭМГ проводилась с использованием биполярных электромиографических электродов (провода из нержавеющей стали диаметром 0.2 мм, тефлоновая изоляция), имплантированных билатерально в m. iliopsoas (IP, сгибатель бедра), m. tibialis anterior (ТА, сгибатель голеностопного сустава), m. astrocnemius lateralis (GL, разгибатель голеностопного сустава) обеих задних конечностей.
Анестезия была прекращена после хирургических процедур, и эксперименты были начаты через 2–3 ч после их окончания. В ходе эксперимента непрерывно контролировали температуру в прямой кишке, электрокардиограмму и частоту дыхания животного; они составляли 37 ± 0.5°С, 110–140 ударов/мин и 20–40 вдохов/мин соответственно.
Вызов всех трех рассматриваемых в работе режимов локомоции осуществляли с помощью электрической эпидуральной стимуляции (ЭС) монополярно серебряным шариковым электродом (d = 0.5 мм), расположенным в одной и той же точке твердой мозговой оболочки дорсальной поверхности спинного мозга над сегментами L5–L7. Индифферентный электрод располагался в мышцах спины. Выбор этой точки для каждого животного был сделан после предварительного картирования. Точное расположение точки стимуляции в сегменте спинного мозга было определено посмертно на основе бескорешково-корешкового варианта сегментарного деления спинного мозга (Shkorbatova et al., 2019). Была использована стимуляция со следующими параметрами: частота 5 Гц; длительность импульса 0.2–0.5 мс; ток 80–300 мкА (Merkulyeva et al., 2018).
Задние конечности были расположены на отдельных лентах тредбана, движущихся одновременно назад (для ХВ), одновременно вперед (для ХН) (Buford et al., 1990; Musienko et al., 2012) или в противоположных направлениях (для ДХ). “Базовая” скорость обеих лент была изначально равна 0.45 м/с для всех наблюдаемых типов локомоции. Далее скорость одной ленты тредбана уменьшали до 0.2 м/с, в то время как скорость другой ленты увеличивали до 0.7 м/с. Расстояние между лентой беговой дорожки и фиксированным тазом составляло 19–25 см.
Анализ и статистика. Чтобы охарактеризовать кинематику локомоторных движений, на гребне подвздошной кости, головке бедра, латеральном мыщелке бедра, латеральной стороне лодыжки и пятом плюсневом суставе были установлены светоотражающие маркеры, а вид сбоку шагающей кошки был записан на видео (частота 50 кадров/с). Для сравнения кинематики при различных режимах локомоции видеозаписи анализировались покадрово. Углы в тазобедренном, коленном и голеностопном суставах измеряли в тот момент, когда конечность была максимально согнута во время фазы переноса, и в момент, когда она была максимально вытянута в фазе опоры. Диапазоны изменения углов были рассчитаны как разность между этими значениями для каждого сустава. Кроме того, были записаны движения вперед-назад (A-P) конечностей (с помощью двух потенциометрических датчиков, прикрепленных к лодыжкам), и силы реакции опоры каждой конечности, которые были синхронизированы с видео. Сигналы от электродов ЭМГ, потенциометрических и силовых датчиков усиливались и оцифровывались с частотой дискретизации 20 кГц.
Чтобы выявить асимметрию локомоторных движений левой и правой задних конечностей, коэффициент асимметрии длины шага вычисляли как |Sleft – Sright|/(Sleft + Sright), где Sleft и Sright – длины шагов левой и правой конечности соответственно. Длина шага рассчитывалась как расстояние между положением лапы в начале и в конце фазы опоры. Коэффициент асимметрии периода шага рассчитывали аналогично: |Tleft – Tright|/(Tleft + + Tright), где Tleft и Tright – периоды шагов левой и правой конечности соответственно. Стабильность локомоторных движений отдельной конечности в рострокаудальной плоскости оценивалась с использованием коэффициента самоподобия (амплитуда второго пика автокорреляционной функции временного ряда движений отдельной конечности в A-P плоскости (Kim et al., 2007)). Для оценки каждого из параметров в анализ брали по 10 последовательных шагов.
Данные представлены как среднее значение ± стандартное отклонение. Статистическая значимость на уровне 0.05 оценивалась с помощью W-критерия Уилкоксона для отличий силы реакции опоры между шагами конечности, идущей по “быстрой” ленте при выборе стратегии ХВ 1 : 2, и с помощью критерия Краскела–Уоллиса в иных случаях.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Все пять животных были способны к ХВ, три из них были также способны к ХН и ДХ при базовой скорости лент и при их одновременно различной скорости.
Ходьба вперед. При ХВ были возможны две различных стратегии адаптации к одновременно различной скорости лент. Варьировалась либо длина шага, с сохранением соответствия между числом шагов двух конечностей (стратегия “1 : 1”; показана у 4 из 5 животных), либо длительность шага, тогда на 1 шаг конечности, идущей по “медленной” ленте, конечность, идущая по “быстрой” ленте тредбана, делала 2 шага (стратегия “1 : 2”; показана у 3 из 5 животных) (рис. 1 (а)). Обе эти стратегии, обладающие сходной рострокаудальной стабильностью (рис. 2 (г)) за счет согласованной работы мышц, могли использоваться в рамках одной пробы (рис. 1 (а)). У одного животного также наблюдались кратковременные (менее 5 шагов) эпизоды ХВ со стратегией 1 : 3, когда на 1 шаг конечности, идущей по “медленной” ленте, конечность, идущая по “быстрой” ленте тредбана, делала 3 шага.
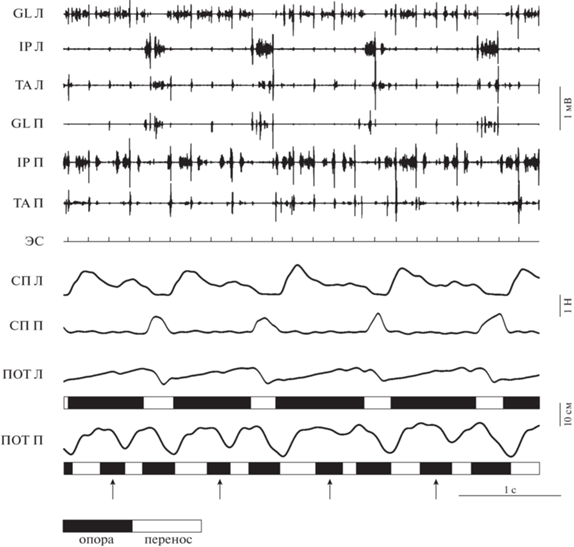
Рис. 1.
Ходьба вперед: (а) при одновременно различной скорости лент – показана смена двух стратегий 1 : 1 и 1 : 2, (б) при медленной скорости обеих лент. Л – левая конечность, П – правая, TA – tibialis anterior, GL – gastrocnemius lateralis, IP – iliopsoas, СП – силы реакции опоры, ЭС – канал эпидуральной стимуляции, ПОТ – траектории движения конечностей, белые прямоугольники – перенос, черные прямоугольники – опора. Серые стрелки – дополнительные максимумы нагрузки на левую конечность, идущую по более медленной ленте. Fig. 1. Forward stepping: (а) at simultaneously unequal belt speed; the change of strategy is shown (1 : 1 and 1 : 2), (б) at low speed of both belts. Л, П – left and right hindlimb, TA – tibialis anterior, GL – gastrocnemius lateralis, IP – iliopsoas, СП – ground reaction forces, ЭС – channel of epidural stimulation, ПОТ – trajectories of hindlimb movement, white and black rectangles – swing and stance phases. Gray arrows – additional maxima of load onto left hindlimb stepping at low-speed belt.
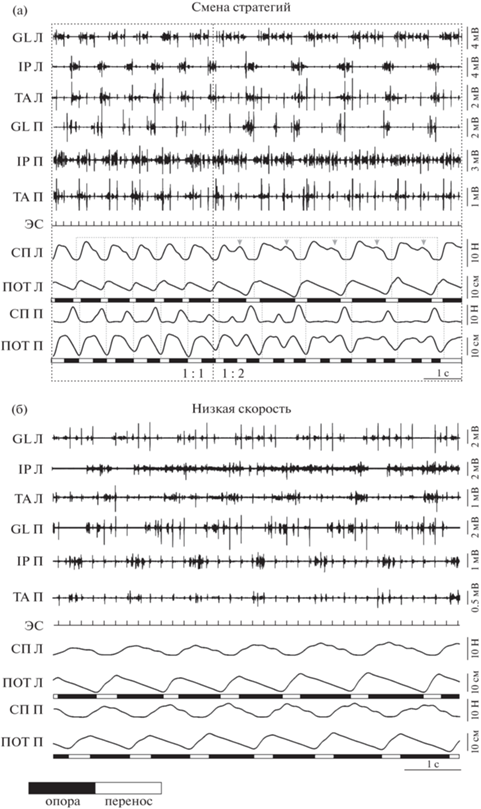
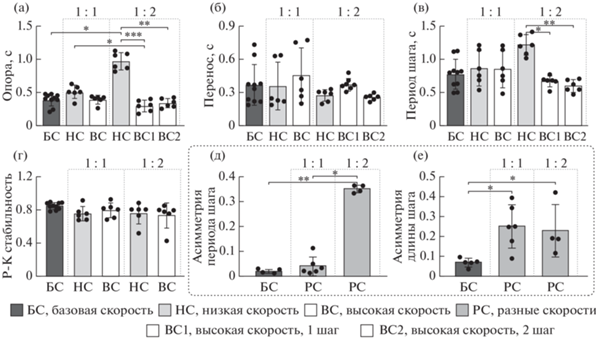
Рис. 2.
Зависимость характеристик ходьбы вперед (ХВ) (1 : 1 и 1 : 2) (длительность фазы опоры (а) и переноса (б), период (в) шага, рострокаудальная стабильность (г), асимметрия длительности (д) и длины (е) шага) от скорости лент. Ось абсцисс – группы. Среднее ± СОткл. Fig. 2. The dependence of forward stepping (ХВ) (1 : 1 и 1 : 2) parameters onto the belt speed: (а), (б) – swing and stance duration, (в) – stepping period, (г) – rostrocaudal stability, (д) – stepping period asymmetry, (е) – step length asymmetry. Abscissa: groups (БС – baseline speed, НС – low speed, ВС – high speed, РС – different speeds, ВС1, ВС2 – first and second steps at 1 : 2 strategy). Mean ± SD.
В случае стратегии 1 : 2, длины двух последовательных шагов по “быстрой” ленте тредбана, приходящихся на 1 шаг по “медленной” ленте, могли быть равны или значительно отличаться друг от друга; в последнем случае первый из шагов был коротким (рис. 1 (а)). Иногда лапа во время этого первого шага даже не касалась тредбана, а шагала в воздухе. Как следствие этого, в среднем сила реакции опоры для первого шага “быстрой” конечности была меньше, чем для второго (4.5 ± 4.3 Н против 8.7 ± 3.3 Н, W(6) = 21, p = 0.0313). Эти шаги анализировали отдельно (помечены соответствующим образом на рисунках).
Отметим также, что, несмотря на то, что при стратегии 1 : 2 на потенциометрической кривой “медленной” конечности присутствует только 1 пик (соответствует ее последовательному движению вперед и назад), на кривой силовой платформы можно видеть 2 пика (второй обозначен серой стрелкой), что свидетельствует о переменной нагрузке во время ее фазы опоры, не сопровождающейся активностью сгибателей (“медленная” конечность продолжает находиться в фазе опоры) (рис. 1 (а)). Оба этих пика реципрокны пикам на силовой платформе “быстрой” конечности. Мы сравнили эти данные с потенциометрическими и силовыми кривыми при ходьбе по тредбану с медленной скоростью движения обеих лент; как можно видеть (рис. 1(б)), появления второго толчка при этом не происходит.
Длительность фазы опоры (рис. 2 (а)), но не переноса (рис. 2 (б)), зависела от стратегии ходьбы (KW = 25.08, p = 0.0001). Длительность фазы опоры конечности, идущей по медленной ленте при ходьбе 1 : 1, была больше, чем для первого шага конечности, идущей с повышенной скоростью при ходьбе 1 : 2 (0.51 ± 0.10 с против 0.29 ± 0.09 с, p = 0.0495). Длительность фазы опоры конечности, идущей по медленной ленте при ходьбе 1 : 2, была больше, чем для базовой скорости и для обоих шагов конечности, идущей с повышенной скоростью при ходьбе 1 : 2 (0.98 ± 0.13 с против 0.39 ± 0.10 с, p = 0.0262, 0.29 ± 0.09 с, p = 0.0003 и 0.34 ± 0.07 с, p = 0.0026 соответственно). За счет отличий длительности фазы опоры достоверно разнились и периоды шагов (KW = 16.62, p = 0.0053): при ходьбе 1 : 2 период шагов конечности, идущей по медленной ленте, был больше, чем период обоих шагов конечности, идущей по быстрой ленте (1.22 ± 0.16 с против 0.67 ± ± 0.08 с, p = 0.0279 и 0.59 ± 0.09 с, p = 0.0032 соответственно) (рис. 2 (в)).
Наблюдались достоверные различия в асимметрии длительности шага (KW = 11.7, p = 0.0002) за счет отличий в асимметрии периодов для ходьбы 1 : 2 по сравнению с ХВ на базовой скорости и с ХВ 1 : 1 при различной скорости лент (0.34 ± 0.02 против 0.02 ± 0.01, p = 0.0036 и 0.04 ± 0.04, p = 0.0357 соответственно) (рис. 2д), а также достоверные отличия в длине шага (KW = 9.348, p = 0.0036) за счет отличий в асимметрии длины шага для ХВ на базовой скорости по сравнению с ходьбой 1 : 1 и 1 : 2 при различной скорости лент (0.07 ± 0.02 против 0.25 ± 0.11, p = 0.0199 и 0.23 ± 0.11, p = 0.0235 соответственно) (рис. 2 (е)).
Сравнение суставных углов конечностей показало, что длина шагов конечности, идущей по более медленной ленте при ходьбе 1 : 1, ниже за счет изменения объема движения в бедре (табл. 1) (KW = 16.19, p = 0.0063): объем движения в бедре конечности, идущей по более медленной ленте при ходьбе 1 : 1, ниже, чем для второго шага конечности, идущей по более быстрой ленте при ходьбе 1 : 2 (13.2 ± ± 4.1° против 30.0 ± 6.3°, p = 0.0040), а объем движений в колене и голеностопе не зависит от стратегии ХВ (табл. 1).
Таблица 1.
Значения суставных углов при разных типах локомоции (среднее ± станд.отклонение). БС – базовая скорость, НС – низкая скорость, ВС – высокая скорость (ВС1 и ВС2 – первый и второй шаг во время стратегии 1 : 2). *, ** – отличия при уровне значимости р < 0.05 и р < 0.01 соответственно. После знака “*” следует указание на условие, с которым отличие достоверно Table 1. Values of hindlimb joint angle ranges for different types of locomotion. БС – base speed, НС – low speed, ВС – high speed (BC1 and BC2 are the first and second steps during the 1 : 2 strategy). *, ** – differences at p < 0.05 and p < 0.01 levels, respectively. The star sign is followed by denotation of the condition with which the difference is significant. ХВ – forward stepping, ХН – backward stepping. Mean ± SD
| ХОДЬБА ВПЕРЕД | ||||||
|---|---|---|---|---|---|---|
| Сустав | БС | Стратегия 1 : 1 | Стратегия 1 : 2 | |||
| НС | ВС | НС | ВС1 | ВС2 | ||
| Бедро° | 24.5 ± 6.6 | 13.2 ± 4.1 **ВС2 |
21.2 ± 6.2 | 24.1 ± 4.7 | 17.3 ± 9.9 | 29.9 ± 6.3 |
| Колено° | 30.0 ± 14.6 | 16.3 ± 8.0 | 25.3 ± 8.1 | 19.6 ± 8.2 | 20.2 ± 10.2 | 11.7 ± 4.8 |
| Голень° | 51.7 ± 17.4 | 36.4 ± 10.0 | 52.2 ± 12.9 | 50.3 ± 11.8 | 37.2 ± 15.7 | 55.3 ± 12.8 |
| ХОДЬБА НАЗАД | ||||||
| Сустав | БС | Стратегия 1 : 1 | Стратегия 1 : 2 | |||
| НС | ВС | Нет | ||||
| Бедро° | 7.6 ± 4.3 | 6.5 ± 7.9 | 6.6 ± 5.9 | |||
| Колено° | 48.2 ± 13.6 | 41.4 ± 14.1 | 39.2 ± 13.0 | |||
| Голень° | 31.2 ± 15.5 | 34.0 ± 13.7 | 31.0 ± 7.1 | |||
| ДВУНАПРАВЛЕННАЯ ХОДЬБА; СТРАТЕГИЯ 1 : 1 | ||||||
| Сустав | ХОДЬБА НАЗАД (ХН) | ХОДЬБА ВПЕРЕД (ХВ) | ||||
| БС | НС | ВС | БС | НС | ВС | |
| Бедро° | 3.4 ± 2.4 *ХВ БС **ХВ ВС |
6.4 ± 4.3 | 4.2 ± 3.2 *ХВ БС |
17.7 ± 6.9 | 10.6 ± 6.2 | 20.7 ± 4.3 |
| Колено° | 39.1 ± 10.2 | 35.6 ± 14.7 | 44.0 ± 11.0 *ХВ НС |
27.3 ± 7.0 | 20.3 ± 10.1 | 31.6 ± 8.7 |
| Голень° | 23.8 ± 9.0 *ХВ ВС |
22.6 ± 11.5 *ХВ ВС |
25.1 ± 8.9 *ХВ ВС |
51.6 ± 15.2 | 44.1 ± 10.6 | 55.1 ± 10.5 |
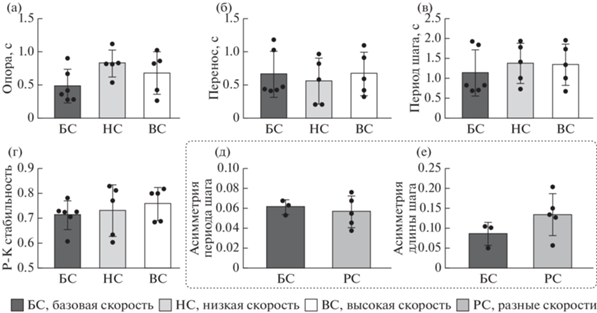
Ходьба назад. При ХН во всех опытах при различных скоростях лент у всех трех животных наблюдалась ходьба 1 : 1, причем характеристики ХН не менялись по сравнению с ХН на базовой скорости (рис. 3).
Рис. 3.
Зависимость характеристик ходьбы назад (ХН) 1 : 1 (длительность фазы опоры (а) и переноса (б), период (в) шага, рострокаудальная стабильность (г), асимметрия длительности (д) и длины (е) шага) от скорости лент. Ось абсцисс – группы. Среднее ± СОткл. Fig. 3. The dependence of backward stepping (ХН) parameters onto the belt speed: (а), (б) – swing and stance duration, (в) – stepping period, (г) – rostrocaudal stability, (д) – stepping period asymmetry, (е) – step length asymmetry. Abscissa: groups (БС – baseline speed, НС – low speed, ВС – high speed, РС – different speeds). Mean ± SD.
Двунаправленная ходьба. При ДХ при различных скоростях лент тредбана всегда, за исключением одного эпизода, речь о котором пойдет ниже, у всех трех животных наблюдалась ходьба 1 : 1, то есть одному шагу правой конечности соответствовал один шаг левой конечности. При этом сохранялось своеобразие, характерное для ДХ при равных скоростях лент: шаги конечности, идущей вперед, по кинематическим параметрам были подобны шагам при однонаправленной ХВ, а шаги конечности, идущей назад – шагам при однонаправленной ХН (рис. 4). Среди шести вариантов ходьбы (конечность двигалась вперед или назад, при базовой, высокой или низкой скорости соответственно) показано лишь одно достоверное различие по длительности фазы опоры (KW = 16.07, p = 0.0066): между конечностью, идущей назад при базовой скорости и конечностью, идущей вперед при низкой скорости (0.37 ± 0.10 с против 0.62 ± ± 0.10 с, p = 0.0129) (рис. 4 (а)). При этом при одновременно различной скорости лент тредбана периоды шагов обеих лап остаются одинаковыми (рис. 4 (в)), с низкой асимметрией длительности шагов и высокой рострокаудальной стабильностью, что свидетельствует о высокой координации движений (рис. 4 (г, д)). Любопытно, что, когда скорость лент становится различной, асимметрия длины шага уменьшается, то есть длина шагов конечностей, идущих одновременно вперед и назад, несколько выравнивается (KW = 6.34, p = 0.0348) (рис. 4 (е)).
Рис. 4.
Зависимость характеристик двунаправленной ходьбы (ДХ) 1 : 1 (длительность фазы опоры (а) и переноса (б), период (в) шага, рострокаудальная стабильность (г), асимметрия длительности (д) и длины (е) шага) от скорости лент. Ось абсцисс – группы. РС1 – режим различной скорости лент, при котором по медленной ленте конечность движется назад, РС2 – режим различной скорости лент, при котором по медленной ленте конечность движется вперед. Среднее ± СОткл. Fig. 4. The dependence of bidirectional stepping (ДХ) parameters onto the belt speed: (а), (б) – swing and stance duration, (в) – stepping period, (г) – rostrocaudal stability, (д) – stepping period asymmetry, (е) – step length asymmetry. Abscissa: groups (БС – baseline speed, НС – low speed, ВС – high speed, РС – different speeds). PC1 – mode of different belt speeds, in which the limb moves backward along the slow belt, PC2 – mode of different belt speeds, in which the limb moves forward along the slow belt. ХВ – forward stepping, ХН – backward stepping. Mean ± SD.
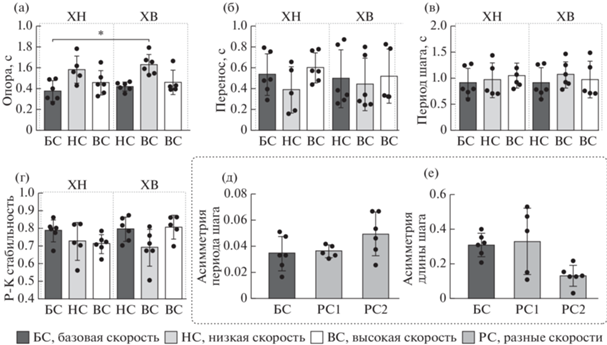
Объем движения в суставах во время двунаправленной ходьбы по тредбану с разными скоростями лент в целом зависит от направления ходьбы (KW = 22.28, p = 0.0005, KW = = 13.77, p = 0.0171 и KW = 22.41, p = 0.0004 для тазобедренного, коленного сустава и голеностопа соответственно) (табл. 1). Это выражается в снижении объема движения в бедре для конечности, идущей назад при базовой скорости ленты по сравнению с объемом движения в бедре для конечности, идущей вперед при базовой и повышенной скоростях ленты (3.43 ± 2.38° против 17.7 ± 6.93°, p = 0.0174 и 20.72 ± 4.31°, p = 0.0058 соответственно); а также – для конечности, идущей назад при повышенной скорости ленты по сравнению с объемом движения в бедре для конечности, идущей вперед при базовой и повышенной скоростях ленты (4.2 ± 3.23° против 17.7 ± ± 6.93°, p = 0.0487 и 20.72 ± 4.31°, p = 0.0167 соответственно). Объем движения в голеностопе для конечности, идущей вперед при повышенной скорости ленты, выше, чем для конечности, идущей назад при базовой, пониженной и повышенной скорости ленты (55.12 ± 10.47° против 23.77 ± 9.05°, p = 0.022, 22.64 ± 11.49°, p = 0.0327 и 25.07 ± 8.86°, p = = 0.0335 соответственно). Напротив, объем движения в коленном суставе выше для конечности, идущей назад при повышенной скорости ленты, по сравнению с конечностью, идущей вперед при пониженной скорости ленты (44.03 ± 11° против 20.33 ± 10.12°, p = 0.0175).
В одной пробе у одного из животных удалось вызвать ДХ в стратегии 1 : 2, длящуюся более 10 шагов “медленной” конечности (рис. 5). При этом ходьба назад осуществлялась по медленной (левой), а ходьба вперед – по быстрой (правой) ленте. Более быстрый шаг правой конечности (помечен стрелками) иногда осуществлялся в воздухе (сила реакции опоры правой конечности отсутствует). Такая ходьба характеризовалась высокой длительностью фазы опоры “медленной” конечности (0.86 ± 0.07 c) и высокой асимметрией длительности шагов (0.30). Между тем наблюдаемая ходьба была координированной, фазы переноса двух конечностей не пересекались, т.е. безопорная фаза ходьбы задних конечностей отсутствовала. Сгибатели левой конечности (IP Л, TA Л) работали в фазе с разгибателем правой конечности (GL П) и в противофазе с разгибателем левой конечности (GL Л) и со сгибателями правой конечности (IP П, TA П). Аналогично, сгибатели правой конечности (IP П, TA П) работали в фазе с разгибателем левой конечности (GL Л).
Рис. 5.
Двунаправленная ходьба 1 : 2 при одновременно различной скорости лент (левая конечность идет назад, а правая – вперед). Л – левая конечность, П – правая, TA – tibialis anterior, GL – gastrocnemius lateralis, IP – iliopsoas, СП – силы реакции опоры, ЭС – канал эпидуральной стимуляции, ПОТ – траектории движения конечностей, белые прямоугольники – перенос, черные прямоугольники – опора. Стрелками помечены более короткие шаги правой конечности. Fig. 5. Bidirectional 1 : 2 stepping at simultaneously unequal belts speed (left hindlimb moves backward, right hindlimb moves forward). Л, П – left and right hindlimb, TA – tibialis anterior, GL – gastrocnemius lateralis, IP – iliopsoas, СП – ground reaction forces, ЭС – channel of epidural stimulation, ПОТ – trajectories of hindlimb movement, white and black rectangles – swing and stance phases. Arrows mark shorter steps of the right hindlimb.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Неоднократно показана значительная роль афферентного входа в инициации и модуляции локомоции (см. (Rossignol et al., 2006)). Парадигма “расщепленного” тредбана позволяет изучать последствия модификации этого входа. Ходьба при одновременно различной скорости лент исследовалась у интактных кошек (Halbertsma, 1983), при стимуляции мезэнцефалической локомоторной области у децеребрированной кошки (Кулагин, Шик, 1970) и у хронических спинальных кошек при спонтанной ходьбе по тредбану (Forssberg et al., 1980) или при стимуляции промежности (Frigon et al., 2017b). По-видимому, в настоящей работе ходьба по расщепленному тредбану впервые рассмотрена при ЭС децеребрированной кошки.
Мы показали, что при ХВ при одновременно различных скоростях лент тредбана одному шагу конечности, идущей по медленной ленте, может соответствовать или 1 шаг конечности, идущей по быстрой ленте (стратегия 1 : 1), или 2 шага (стратегия 1 : 2). При этом длительность фазы опоры “медленной” конечности максимальна среди всех вариантов ХВ, что хорошо согласуется с литературными данными о ходьбе как спинальных (Forssberg et al., 1980), так и интактных (Halbertsma, 1983) животных. Большее влияние скорости на длительность фазы опоры, а не переноса, хорошо согласуется с предположением, высказанным еще в 1975 S. Grillner, о большем автоматизме фазы переноса по сравнению с фазой опоры (Pearson, Duysens, 1976), подтвержденном позже на примере интактной кошки (Halbertsma, 1983).
Обе эти стратегии (ходьба 1 : 1 и ходьба 1 : 2) могли использоваться в рамках одной пробы, в отличие от хронических спинальных кошек, сразу выбирающих стратегию ходьбы 1 : 2 (Frigon et al., 2017b). Иных кратностей длительности шагов конечностей (помимо кратковременных эпизодов ходьбы 1 : 3 у одного животного) не наблюдалось. Возможно, они могут возникать лишь у спинальных животных (Halbertsma, 1983; Frigon et al., 2017); при электрической стимуляции поясничного утолщения пациентов, страдающих параличом, также изредка вызывались локомоторные движения ног в стратегии 1 : 2 и 1 : 3 (Shapkova, 2004). Длина двух последовательных шагов “быстрой” конечности могла быть различна аналогично наблюдениям Forssberg et al. (1980) и Frigon et al. (2017b), но эти шаги могли и незначительно отличаться друг от друга. Напротив, при ХН стратегии локомоции 1 : 2 не наблюдалось.
Сопоставление данных потенциометрических кривых и силовых платформ при ходьбе 1 : 2 показало, что “медленная” конечность, несмотря на один шаг, совершает при этом не одно, но два толчковых движения; оба они находятся в реципрокных отношениях с двумя шагами “быстрой” конечности. Двойной толчок мы не связываем с медленной скоростью движения тредбана per se, поскольку при равной медленной скорости лент с обеих сторон появления второго толчка не происходит. Складывается впечатление, что на “медленной“ стороне происходит подавление второй фазы переноса, с сохранением второй фазы опоры. При этом сила реакции опоры "быстрой” конечности преимущественно выше в том шаге, который приходится на конец фазы опоры “медленной” конечности, предположительно за счет афферентного сигнала растяжения сгибателей, оказывающего дополнительное реципрокное тормозное воздействие на контралатеральный сгибательный полуцентр (Frigon et al., 2017a).
Мы полагали, что более сильная модификация приведет к более мощному воздействию на локомоторный паттерн, и одновременно модифицировали как скорости двух лент тредбана, так и направление их движения (Lyakhovetskii et al., 2021). Однако при ДХ по расщепленному тредбану преимущественно наблюдается стратегия локомоции 1 : 1, а при стратегии локомоции 1 : 2 два шага делает конечность, идущая вперед по более быстрой ленте. При этом межконечностная координация сохраняется, а безопорная фаза ходьбы отсутствует, что свидетельствует о тесной связи между ЦГП обеих конечностей и при таком рассогласовании сенсорных входов. Такая связь может быть объяснена в рамках двухуровневой модели ЦГП, включающей уровень генерации ритма, обеспечивающий стабильный и согласованный период шага конечностей, и уровень генерации паттерна, обеспечивающий мышечную активность, зависящую от направления ходьбы. Сгибательные полуцентры уровня генерации ритма двух ЦГП связаны между собой реципрокными тормозными связями (Вещицкий и др., 2022), вследствие чего при ходьбе 1 : 2 фаза одновременного сгибания обеих задних конечностей не возникает. Во время ДХ по расщепленному тредбану с различными скоростями лент главным образом используется стратегия 1 : 1, характерная для однонаправленной ХН. Предположительно, конечность, идущая назад, затрудняет использование стратегии 1 : 2, поэтому такая ДХ была вызвана лишь в единственном файле у одного животного.
Несмотря на кажущуюся необычность и координационную сложность, ДХ у децеребрированных животных сохраняется (хотя и ухудшается) и при обратимой спинализации путем охлаждения дорсальной поверхности спинного мозга в нижнегрудном отделе, и при остановке одной из лент (в этом случае конечность делает шагательные движения, период которых равен периоду ходьбы второй конечности, на месте) (Lyakhovetskii et al., 2021). Вместе взятые, работы (Forssberg et al., 1980; Frigon et al., 2017b; Lyakhovetskii et al., 2021) и настоящая работа свидетельствуют о высоком автоматизме нейронных сетей спинного мозга, достаточном для управления локомоцией, в условиях значительного рассогласования афферентных входов от рецепторов конечностей. Выявленные эффекты отражают значительную степень согласованности в работе локомоторных сетей правой и левой половин спинного мозга, реализуемых за счет работы комиссуральных связей. Комиссуральные взаимодействия имеют комплексную природу (Maxwell, Soteropoulos, 2019); данные, полученные в настоящем исследовании, подтверждают это предположение.
ЗАКЛЮЧЕНИЕ
На острой модели децеребрированной кошки с помощью ЭС вызывали ходьбу вперед, ходьбу назад и двунаправленную ходьбу. Показано, что локомоция во всех рассмотренных режимах сохранна при одновременно различной скорости лент тредбана. Сохранность двунаправленной ходьбы при одновременно различной скорости лент свидетельствует о высокой степени интеграции ЦГП двух конечностей. Конечность, идущая вперед (как при однонаправленной, так и при двунаправленной ходьбе) по более быстрой ленте, способна делать два шага, когда конечность, идущая по медленной ленте, делает один шаг. При однонаправленной ходьбе назад стратегии ходьбы 1 : 2 не наблюдалось. Результаты исследования позволяют предположить, что ходьба вперед обладает большим адаптивным набором паттернов координации конечностей по сравнению с ходьбой назад.
Список литературы
Вещицкий А.А., Ляховецкий В.А., Горский О.В., Мусиенко П.Е., Меркульева Н.С. Что может рассказать двунаправленная ходьба о центральных генераторах паттерна? Журнал высш нервн. деят. им. И.П. Павлова. 2022. 72 (2): 248–262.
Кулагин А.С., Шик М.Л. Взаимодействие симметричных конечностей при управляемой локомоции. Биофизика. 1970. 15 (1): 164–170.
Akay T., McVea D.A., Tachibana A., Pearson K.G. Coordination of fore and hind leg stepping in cats on a transversely-split treadmill. Exp Brain Res. 2006. 75 (2): 211–222.
Buford J.A., Zernicke R.F., Smith J.L. Adaptive control for backward quadrupedal walking. I. Posture and hindlimb kinematics. J. Neurophysiol. 1990. 64 (3): 745–755.
Choi J.T., Bastian A.J. Adaptation reveals independent control networks for human walking. Nat. Neurosci. 2007. 10 (8): 1055–1062.
Forssberg H., Grillner S., Halbertsma J., Rossignol S. The locomotion of the low spinal cat. II. Interlimb coordination. Acta Physiol. Scand. 1980. 108 (3): 283–295.
Frigon A. The neural control of interlimb coordination during mammalian locomotion. J. Neurophysiol. 2017. 117 (6): 2224–2241.
Frigon A., Desrochers E., Thibaudier Y., Hurteau M.F., Dambreville C. Left-right coordination from simple to extreme conditions during split-belt locomotion in the chronic spinal adult cat. J. Physiol. 2017. 595 (1): 341–361.
Gerasimenko Y., Musienko P., Bogacheva I., Moshonkina T., Savochin A., Lavrov I., Roy R.R., Edger-ton V.R. Propriospinal bypass of the serotonergic system that can facilitate stepping. J. Neurosci. 2009. 29 (17): 5681–5689.
Halbertsma J. The stride cycle of the cat: the modelling of locomotion by computerized analysis of automatic recordings. Acta Physiol. Scand. Suppl. 1983. 521, 1–76.
Kim S.A., Heinze K.G., Schwille P. Fluorescence correlation spectroscopy in living cells. Nat. Methods. 2007. 4 (11): 963–973.
Kuczynski V., Telonio A., Thibaudier Y., Hurteau M.F., Dambreville C., Desrochers E., Doelman A., Ross D., Frigon A. Lack of adaptation during prolonged split-belt locomotion in the intact and spinal cat. J. Physiol. 2017. 595 (17): 5987–6006.
Lyakhovetskii V., Merkulyeva N., Gorskii O., Musienko P. Simultaneous bidirectional hindlimb locomotion in decerebrate cats. Sci. Rep. 2021. 11 (1): 3252.
Maxwell D.J., Soteropoulos D.S. The mammalian spinal commissural system: properties and functions. J. Neurophysiol. 2020. 123 (1): 4–21.
Merkulyeva N., Veshchitskii A., Gorsky O., Pavlova N., Zelenin P.V., Gerasimenko Y., Deliagina T.G., Musienko P. Distribution of spinal neuronal networks controlling forward and backward locomotion. J. Neurosci. 2018. 38 (20): 4695–4707.
Musienko P., Courtine G., Tibbs J.E., Kilimnik V., Savochin A., Garfinkel A., Roy R.R., Edgerton V.R., Gerasimenko Y. Somatosensory control of balance during locomotion in decerebrated cat. J. Neurophysiol. 2012. 107 (8): 2072–2082.
Pearson K.G., Duysens J. Function of segmental reflexes in the control of stepping in cockroaches and cats. Neural control of locomotion. Advances in behavioral biology. Eds. Herman R.M., Grillner S., Stein P.S.G., Stuart D.G. Springer US, 1976. 519–537 pp.
Reisman D.S., Block H.J., Bastian A.J. Interlimb coordination during locomotion: What can be adapted and stored? J. Neurophysiol. 2005. 94 (4): 2403–2415.
Rossignol S., Dubuc R., Gossard J.-P. Dynamic sensorimotor interactions in locomotion. Physiol. Rev. 2006. 86 (1): 89–154.
Shkorbatova P.Y., Lyakhovetskii V.A., Merkulyeva N.S., Veshchitskii A.A., Bazhenova E.Y., Laurens J., Pavlova N.V., Musienko P.E. Prediction algorithm of the cat spinal segments lengths and positions in relation to the vertebrae. Anat. Rec. 2019. 302 (9): 1628–1637.
Shapkova E.Y. Spinal locomotor capability revealed by electrical stimulation of the lumbar enlargement in paraplegic patients. In: Latash M, Levin M, editors. Progress in Motor Control. Human Kinetics Publishers; 2004. 253–289.
Thelen E., Ulrich B.D., Niles D. Bilateral coordination in human infants: stepping on a split-belt treadmill. J. Exp. Psychol. Hum. Percept. Perform. 1987. 13 (3): 405–410.
Yanagihara D., Udo M., Kondo I., Yoshida T. A new learning paradigm: adaptive changes in interlimb coordination during perturbed locomotion in decerebrate cats. Neurosci Res. 1993. 18 (3): 241–244.
Yang J.F., Lamont E.V., Pang M.Y. Split-belt treadmill stepping in infants suggests autonomous pattern generators for the left and right leg in humans. J. Neurosci. 2005. 25 (29): 6869–6876.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


