Журнал высшей нервной деятельности им. И.П. Павлова, 2023, T. 73, № 1, стр. 62-75
Восприятие цвета и его кодирование в коре приматов
Н. А. Асеев *
Институт Высшей Нервной Деятельности и Нейрофизиологии РАН
Москва, Россия
* E-mail: aseyev@ihna.ru
Поступила в редакцию 11.06.2021
После доработки 17.12.2021
Принята к публикации 20.12.2021
- EDN: GIWPTC
- DOI: 10.31857/S0044467723010045
Аннотация
Восприятие цвета человеком и другими приматами – это комплексная задача, которую решают, помимо нейрофизиологии, и другие смежные науки, такие как психофизиология, психолингвистика и даже философия. В данном обзоре нейрофизиология зрения взята за отправную точку, рассматривается вклад всех смежных дисциплин в понимание того, как кодируется цветовое восприятие у приматов. Рассмотрены известные на данный момент нейрофизиологические механизмы восприятия цвета приматами и предлагается гипотетическая схема обработки цветовых стимулов в коре приматов, предполагающая на высшей стадии обработки стимула кодирование цвета концептуальными нейронами, отвечающими только за отражение параметра цветности зрительного стимула.
The sensation of colour cannot be accounted for by the physicist’s objective picture of light-waves.Could the physiologist account for it, if he had fuller knowledge than he has of the processes in the retina and the nervous processes set up y them in the optical nerve bundles and in the brain? I do not think so. Erwin Schrödinger
ВВЕДЕНИЕ
Существует два принципиально разных определения цвета: первое, физическое, что цвет – это спектральная характеристика электромагнитного излучения оптического диапазона, однозначно определяемая длиной волны испускаемых фотонов, и второе, психологическое, что цвет – это качественная субъективная характеристика этого излучения, зависящая не только от физических параметров, но также и от физиологических и психологических особенностей воспринимающего стимул индивида, от яркостных и цветовых контрастов с окружающим стимул пространством. В рамках данного обзора автор использует слово “цвет” или словосочетание “цвет стимула” для обозначения цвета по физическому определению, а также использует психологическое определение слова “цвет” (синоним – слово из философского словаря “квалиа”).
Восприятие цвета зрительных стимулов и соответственно квалиа цветности (субъективного переживания цвета) появляется вместе с физической возможностью воспринимать спектральные свойства света: соответствующими клеточными рецепторами в сетчатке глаза (колбочки) и генами, кодирующими белки-пигменты (опсины). Однако, раз возникнув, нейронные механизмы в высших отделах зрительной системы могут воспринимать как квалиа цветности и сигналы с других каналов, например, слепые люди научаются воспринимать как цвет определенные характеристики звука (Abboud et al., 2014), а в не таких уж редких случаях графем-цветной синестезии каждая буква алфавита или цифра ассоциируется с определенным цветом (Witthoft et al., 2015; Teichmann et al., 2021). Конечно, возможны и менее радикальные изменения восприятия цвета внутри зрительной системы, связанные, например, c пожелтением хрусталика, мутациями в опсинах (протанопия, дейтеронопия, тританопия, тетрахроматизм) или индивидуальными вариациями в соотношении S-, L- и M-колбочек в сетчатке (Viénot et al., 1995; Sharpe et al., 1998; Brainard et al., 2000; Jameson et al., 2001; Deeb, 2006; Isherwood et al., 2020; Emery et al., 2021; Tregillus et al., 2021). При рассмотрении восприятия цвета исследователь неизбежно сталкивается с психофизиологической проблемой (Koch et al., 2016; Ноздрачев, Щербатых, 2021), по одну сторону которой находятся стимулы и рецепторы (sensation, ощущение), а по другую – квалиа и субъективно воспринимаемый цвет (perception, восприятие). В приведенной в эпиграфе цитате (Schrödinger, 2001) Шрёдингер отказывается верить, что физиология может разрешить эту проблему, однако, по мнению автора данного обзора, в последние годы нейрофизиология вполне успешно разрешает частные случаи психофизиологической проблемы, и на протяжении этого обзора он рассмотрит ситуацию с мозговым субстратом для квалиа цветности.
РЕЦЕПТОРНАЯ ОСНОВА ЦВЕТНОГО ЗРЕНИЯ ПРИМАТОВ
Большинство млекопитающих дихроматы; они потеряли два гена опсинов (пресмыкающиеся – тетрахроматы) около 150 млн лет назад при переходе к сумеречному образу жизни в мезозое (в дневное время миром правили динозавры). Поэтому, например, у грызунов только два опсина: коротко- и длинноволновый (возбуждающиеся соответственно фиолетовым и желто-зеленым светом), лежащие в основе эволюционно древнего желто-синего оппонентного канала восприятия цвета в сетчатке (оцененный по мутациям возраст расхождения S- и M-опсинов в эволюции позвоночных – примерно 450–500 млн лет назад (Collin et al., 2003)). Некоторые ночные млекопитающие потеряли также и коротковолновый опсин и стали монохроматами. У вновь перешедших к дневному образу жизни приматов, наоборот, примерно 35 млн. лет назад ген длинноволнового опсина млекопитающих претерпевает дупликацию и появляется третий, еще более длинноволновый опсин (L, возбуждающийся желтым светом, разница между человеческими L- и M-опсинами в 15 аминокислот, что сдвигает пик возбуждения примерно на 30 нм), а сетчатка устроена так, что появляется новый L-M, красно-зеленый оппонентный канал (Rowe, 2002). У широконосых (приматы Нового Света) и узконосых (приматы Старого Света) обезьян трихроматизм возникает по разному механизму: у широконосых обезьян трихроматами являются только гетерозиготные по L-опсину самки (Mollon, 1999). Считается, что появление красно-зеленого оппонентного канала могло быть эволюционно выгодно для приматов, т.к. позволяло отличать спелые фрукты на фоне зелени листьев (Rowe, 2002).
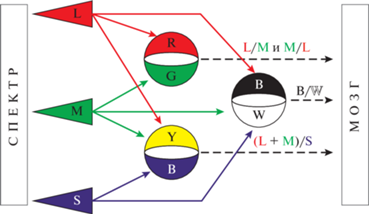
Древний желто-синий и более эволюционно молодой красно-зеленый каналы цветного зрения (рис. 1) проецируются от колбочек до первичной зрительной коры с переключениями в специфичных для каждого канала нейронах (Mollon, 1999; Baden, Osorio, 2019). У человека сигнал от желто-синего канала идет через коротковолновые биполяры, малые двуслойные ганглионары (small bistratified ganglion cells), далее в кониоклеточные нейроны латерального коленчатого тела и приходит в поле 17 новой коры на нейроны 2/3 слоя. Красно-зеленый канал переключается на карликовых (midget) биполярах и ганглионарах, далее на мелкоклеточных нейронах латерального коленчатого тела и приходит в то же поле 17 стриарной коры на нейроны слоя 4Cβ. Нейроны латерального коленчатого тела не имеют пространственно-оппонентных (центр-периферия) рецептивных полей на цвет и не могут обеспечивать такие наблюдаемые психофизиологические феномены, как цветовой контраст и константность цвета (color constancy); первым центром в зрительной системе, где такой анализ стимулов может происходить, является первичная зрительная (стриарная) кора V1 (Conway, Livingstone, 2006). От сетчатки и как минимум до латерального коленчатого тела одним из основных принципов, поддерживающих оппонентное кодирование цвета, является организация рецептивных полей по принципу латерального торможения.
Рис. 1.
Кодирование цвета оппонентными каналами на ранних этапах зрительного восприятия трихроматов. Fig. 1. Color coding by opponent channels in first levels of visual perception of trichromats.
КОДИРОВАНИЕ ЦВЕТОВЫХ СТИМУЛОВ В КОРКОВОЙ ЧАСТИ ЗРИТЕЛЬНОГО АНАЛИЗАТОРА ПРИМАТОВ
Первым местом корковой конвергенции двух оппонентных цветовых каналов являются нейроны цитохромоксидазных колонок (CO blobs) зрительной коры V1. Методами оптического картирования на мозге макаки с этих колонок были получены ответы на равнояркие (equiluminant) стимулы, при этом ответы были сгруппированы в пятна (patches), в которых нейроны отвечали на контраст в одном из двух оппонентных каналов (желто-синего и красно-зеленого) (Landisman, Ts’o, 2002). В одной из работ на V1, также при помощи оптической регистрации на макаке, были обнаружены хромотопические карты, при этом пятна, предпочтительно реагирующие на спектрально близкие оттенки, располагались рядом на поверхности коры (Xiao et al., 2007). В то же время в экспериментах с фМРТ на V1 человека не было обнаружено такого хромотопического соответствия между поверхностью коры и перцептивным цветовым пространством, и наблюдаемые ответы скорее отражали кодирование оппонентными каналами (Engel et al., 1997; Brouwer, Heeger, 2009; Parkes et al., 2009). По-видимому, разница в результатах связана не с различием в организации коры у макаки и человека, а с низким пространственным разрешением фМРТ, не позволяющим выявить отдельные хромотопически организованные колонки в V1 у человека.
В электрофизиологических экспериментах на макаках в области V1 также были показаны клетки, специфически реагирующие на “первичные цвета” оппонентных каналов (Vautin, Dow, 1985), и характерные оппонентные ON- и OFF-ответы корковых нейронов в области V1 на цветные стимулы; эти нейроны были способны кодировать пространственный и временной цветовой контраст, но параллельно кодируют также форму и направление движения стимула (Conway et al., 2002). Число таких нейронов с оппонентным хроматическим ответом в V1 невелико — около 10% (Conway, Livingstone, 2006). Более поздние эксперименты с V1 макак выявили также нейроны, кодирующие цвет не только линейно (как предполагает оппонентность цветовых каналов, таких клеток была примерно половина), но и с узким или широким диапазоном специфичности к определенным цветам (Horwitz, Hass, 2012). Следует подчеркнуть тот факт, что чувствительные к хроматической составляющей зрительных стимулов нейроны V1 приматов не являются концептуальными нейронами цвета, так как кодируют помимо цвета яркость, а также временные и пространственные параметры стимулов (Cottaris, De Valois, 1998; Johnson et al., 2001). Недавняя работа, сделанная на макаке при помощи двухфотонной визуализации, четко показывает на нейронном уровне, что кодирующие цвет нейроны V1 одновременно кодируют и ориентацию стимула (Garg et al., 2019). По оценке в этой статье, почти половина всех нейронов (46%) отвечала сильнее на цветной стимул, чем на серый цвет; хромотопическая организация также была показана.
Дальше по пути обработки зрительных стимулов, в области коры V2 макаки, электрофизиологические ответы на хроматические стимулы похожи на таковые в области V1, но число клеток с типичными ON- и OFF-ответами уменьшается; также имеется малая часть нейронов, настроенных на разные по широте диапазоны спектра. В зависимости от вида стимуляции и критериев отбора, до 50% нейронов области V2 отвечает на цветные стимулы, но надо опять же отметить, что эти нейроны не специфичны только лишь к цвету, а в основном отвечают на изменение яркости, кроме того, имеют настройку на положение в поле зрения, размер, форму и ориентацию стимула (Kiper et al., 1997). В комплексном исследовании методами оптического картирования и электрофизиологии у макак в области V2 были найдены хромотопические колонки (участки коры, в которых пространственное расположение совпадало со спектральным (и, возможно, перцептивным цветовым) пространством); пятна, активируемые схожими цветами, расположены рядом (Xiao et al., 2003; Lim et al., 2009). При последующей окраске мозговой ткани на цитохромоксидазу (ЦО) область коры, где были найдены колонки, соответствовала тонким полоскам паттерна окраски на ЦО (CO thin stripes). В областях зрительной коры человека V2 и V3 методом функциональной МРТ была обнаружена схожая с мозгом макаки организация цветовых колонок (Nasr et al., 2016; Dumoulin et al., 2017).
В недавнем исследовании на макаке (Liu et al., 2020) было произведено сравнение размеров цветовых колонок (оптическое картирование) в областях коры V1, V2 и V4 с размером пятен паттерна ЦО: размер колонок в V1 примерно соответствовал площади пятен ЦО, а колонки в V2 и V4 были в 2–3 раза крупнее. Согласно этой работе, при сравнении мощности ответов всех зарегистрированных колонок получается далеко не равномерное представление разных оттенков в первичной зрительной коре, но мощности ответов на разные оттенки становятся более равномерными в V2 и особенно в V4. Наибольшая мощность ответов была на красный и синий цвета, что, видимо, отражает частичное нейронное кодирование в V1 (и в меньшей степени в V2) по принципу оппонентных зрительных каналов. Авторы также разработали критерии оценки хромотопичности получаемых ими карт зрительной коры и получили по ним, что наименьший процент зарегистрированных карт является хромотопичным для V1, этот процент увеличивается в области V2 и достигает максимума в V4, что, видимо, отражает процесс обработки от сырого зрительного сигнала для цвета в сторону его равномерной категоризации на оттенки, как он представлен в перцептивном пространстве. В другой работе по оптическому картированию коры на макаке было показано, что колонки, кодирующие цвет, размер и ориентацию стимула, пространственно не пересекаются в V2, в отличие от таких колонок в V4 (Ghose, Ts’o, 2017).
Одним из вопросов, на протяжении лет вызывающим научные дискуссии и стимулирующим все новые эксперименты, является то, выделяется ли на нейронном уровне в коре кодирование “первичных оттенков” (cardinal colors): красного, зеленого, синего и желтого. Как уже было обсуждено, на ранних этапах обработки цвета в зрительной системе эти цвета выделяются как два оппонентных канала, что стимулировало многочисленные попытки найти какую-нибудь обособленность в кодировании этих четырех цветов в перцептивном пространстве приматов (perceptual salience). Однако до сего момента на каждую такую попытку находилось опровержение, связанное с различными методическими огрехами работ (Stoughton, Conway, 2008; Mollon, 2009; Bosten, Boehm, 2014; Wool et al., 2015; Bohon et al., 2016; Forder et al., 2017; Witzel et al., 2019).
Резюмируя изложенное выше, надо сказать, что, несмотря на значительные усилия в поисках нейронов, специфично настроенных только на хроматическую составляющую стимулов, в областях коры V1 и V2 найти их не удалось. Нейроны в этих областях реагируют комплексно на параметры зрительных стимулов, гораздо сильнее, чем на цветовые контрасты, отвечают на разницу в яркости и параллельно кодируют положение стимула в зрительном поле, его размер, ориентацию и другие пространственно-временные параметры.
Согласно классической функциональной схеме строения зрительной коры приматов, дальнейшая обработка сигнала от глаз идет по двум различным путям — дорзальному (от V2 через V3 (по другой классификации эта область называется DM/V6 (Hadjidimitrakis et al., 2019)) в область MT/V5) и вентральному (от V2 через V4 в нижневисочную область IT — разные исследователи дробят регионы V4 и IT на разные подзоны или, наоборот, объединяют их в единый комплекс (Arcaro, Kastner, 2015)), упрощенная схема представлена на рис. 2. Традиционно считается, что дорзальный путь ответственен за пространственно-временные параметры стимула и движение объекта, в то время как вентральный путь кодирует статичные параметры стимула, такие как форма и цвет.
Рис. 2.
Дорсальный и вентральный пути в новой коре макаки, упрощенная схема. Fig. 2. Dorsal and ventral pathways at macaque neocortex, simplified diagram.
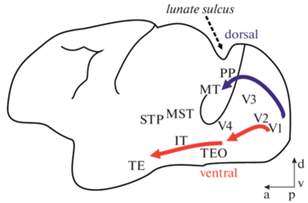
Тем не менее есть данные, не укладывающиеся в эту простую схему, так, в частности, в структурах дорзального пути регистрируют хроматическую чувствительность. Было показано, что нейроны в области зрительной коры V3 макаки реагируют на хроматические стимулы — как и в области V2, примерно половина от зарегистрированных нейронов проявляет чувствительность к цвету (Gegenfurtner et al., 1997). Этот регион традиционно считается кодирующим движение и не привлекал значительного внимания исследователей кодирования цвета в нем. Кроме того, имеющаяся разница в строении этой области у разных видов и, как следствие, постоянно пересматриваемое положение V3 в номенклатуре и иерархии зон зрительного анализатора затрудняют ее изучение (Jeffs et al., 2013; Arcaro, Kastner, 2015; Hadjidimitrakis et al., 2019). В своем обзоре Конвей приводит также данные, что возможное наличие в высшей области дорзального пути MT чувствительных к цвету нейронов недоисследовано по ряду причин (Conway, 2014).
КОДИРОВАНИЕ ЦВЕТОВЫХ СТИМУЛОВ В ОБЛАСТИ V4 И ВИСОЧНЫХ ОБЛАСТЯХ НОВОЙ КОРЫ
Наибольшее число работ с восприятием цвета приматами, изучающих корковую часть анализатора, посвящено области V4 и прилежащей к ней нижневисочной области IT (которую иногда разделяют на подобласти PIT, CIT, AIT, VO, TEO). Считается, что именно в этой области зрительной коры возникает сознательное перцептивное ощущение цвета, поэтому ее исследование, начатое Зеки (Zeki, 1980), активно продолжается до сих пор. В пионерской работе Зеки при помощи экстраклеточной регистрации на макаке обнаружил и охарактеризовал нейроны, специфически отвечавшие на цветовые стимулы. В области V4 зрительной коры им были обнаружены клетки, настроенные на стимулы в узких (10–45 нм) диапазонах спектра, при этом их чувствительность была равномерно распределена по всему диапазону видимого света. Нейроны V4 имели разные рецептивные поля, не связанные напрямую с топографией сетчатки. Также было обнаружено, что по мере углубления электрода в кору соседние зарегистрированные клетки имеют близкую спектральную чувствительность и скачком чередуются с группами нейронов, настроенных на оппонентные цвета. Также Зеки сумел продемонстрировать на клеточном уровне эффекты, получаемые в психофизиологических экспериментах с Мондриановым экраном, и показал нелинейность спектральной настройки нейронов V4 от яркости стимула. Дальнейшие работы с областью V4 макаки показали, что, несмотря на высокий процент нейронов в этой области, чувствительных к спектральным характеристикам света, назвать большую часть их цветоселективными нельзя (Schein, Desimone, 1990; Conway, Tsao, 2009). В более поздней работе Зеки с соавторами (Kusunoki et al., 2006) была изучена цветоселективность нейронов области V4 макаки при меняющемся цвете фона (вариант психофизиологической парадигмы с Мондриановым экраном, позволяющим исследовать такое свойство, как константность цвета). Оказалось, что настройка нейронов на цветовой стимул меняется соответственно с цветом фона, что говорит о том, что нейроны V4 обладают способностью кодировать константность цвета и, следовательно, отражают не просто сенсорный приток, но и перцептивные процессы.
В передней части нижневисочной области IT зрительной коры макаки методом экстраклеточной регистрации были зарегистрированы чувствительные к хроматической стимуляции нейроны (Koida, Komatsu, 2007). Авторы обучили двух обезьян выполнению задачи по категоризации или дискриминации 11 оттенков в диапазоне красный-зеленый. Нейронная активность большинства нейронов была цветоселективной, ответ зарегистрированных клеток также зависел от размера, формы и положения стимула в зрительном поле. Активность нейронов в этой области зависела от типа задачи (при категоризации были зарегистрированы более сильные ответы, чем при дискриминации), что предполагает нисходящую (top-down) модуляцию, видимо, со стороны префронтальной коры.
В задней части нижневисочной области IT зрительной коры макаки (называемой также PIT или complex V4 и включающей в себя регионы: V4, PITd и задняя TEO) последующие исследования также выявили кодирующие цвет нейроны (Conway et al., 2007; Conway, Tsao, 2009; Bohon et al., 2016). Они были организованы в миллиметрового размера цветовые гиперколонки (globs, по аналогии с blobs в V1, дословно “капельки”, названные за их форму при оптическом картировании), видимые на фМРТ при предъявлении стимулов с цветовым контрастом. Внутри гиперколонки находится несколько колонок (patches или columns), чувствительных к определенным оттенкам, размер их меньше 100 мкм. Внутри одной гиперколонки находятся нейроны, чувствительные к разным частям спектра, и соседствующие нейроны имеют схожую спектральную чувствительность. Помимо хроматической чувствительности эти нейроны кодируют также положение стимула в зрительном поле, грубо отражая ретинотопию данной области коры. Нейроны между гиперколонками этой области проявляют меньшую хроматическую чувствительность и в основном кодируют форму стимула и яркостный контраст. Основные выводы по нейронной организации области коры PIT были впоследствии воспроизведены в другой лаборатории (Yasuda et al., 2010). Недавние работы показывают, что в области IT макаки находятся также нейроны, чувствительные не только к цвету, форме и положению в зрительном поле, но и нейроны, настроенные на лица, и они также показывают модуляцию своей активности в зависимости от оттенка предъявляемых стимулов-лиц (Conway, 2018; Duyck et al., 2021). С другой стороны, на человеке показана (Lafer-Sousa et al., 2016) различная локализация нейронов лиц и цветовых нейронов в этой области коры, но, возможно, расхождение результатов связано с разностью применяемых методов (чувствительности фМРТ не хватает для выявления отдельных нейронов, при применении фМРТ к мозгу макаки результаты сходятся (Lafer-Sousa, Conway, 2013)).
В дорсальной части V4 (V4d) у макаки были найдены функциональные модули, активирующиеся на хроматические стимулы, по сути цветовые гиперколонки, которые были стабильны во времени (Li et al., 2014). При стимуляции определенным цветом, внутри гиперколонки (glob) активируется несколько (1–4) колонок (или пятен, patches), положение пика активности в которых варьирует в зависимости от цвета стимула, и они значительно пересекаются для спектрально близких цветов. Так как участки коры, активируемые близкими по спектру цветами, расположены рядом, цветовая колонка является картой оттенков, ее строение имеет хромотопическую организацию. При систематическом варьировании положения цветового стимула в зрительном поле макаки было выяснено, что каждый участок колонки, настроенный на разный цвет, имеет одинаковое зрительное поле, а между разными участками одной колонки очень близкое. Авторы предполагают, что ретинотопия может быть закодирована в разных гиперколонках, настроенных каждая на свое локальное зрительное поле. При тестировании цветовых стимулов, систематически отличающихся по яркости, было обнаружено, что цветовые колонки V4 кодируют яркость параллельно цвету: меняя яркость стимула от максимальной к минимальной, авторы наблюдали сдвиг активирующегося участка от характерного для данного насыщенного оттенка в сторону участка, активирующегося на черный цвет, и наоборот, при увеличении яркости стимула активирующиеся участки сдвигались по поверхности коры в сторону пятен, активирующихся на белый цвет. При этом расстояние по поверхности коры зависело от яркости стимула в цветовом пространстве HSL по логарифмическому закону, подтверждая нелинейность в описанных выше результатах Зеки. Аналогичная логарифмическая зависимость была обнаружена между амплитудой активности в участке колонки и насыщенностью цвета в HSL. Все эти данные свидетельствуют о том, что в V4 кодируются не категоризованные цвета (как они есть в перцептивном пространстве), а определенным образом упорядоченные физические параметры цветовых стимулов. Например, розовый и красный цвета отличаются только по насыщенности, а желтый и коричневый только по яркости (Buck, 2015) – и при наблюдаемой организации области коры V4 не следует ожидать в ней нахождения концептуальных нейронов цвета, кодирующих субъективное категориальное восприятие цвета. Ли и соавторы (Li et al., 2014) обсуждают также, как возможный вариант, распределенное кодирование цвета и, следовательно, подвергают сомнению существование концептуальных нейронов цвета. Автор этого обзора не согласен с ними – раз методом интроспекции мы сталкиваемся с явлением категоризации цвета на сознательном перцептивном уровне, значит, этому должны быть нейрофизиологические корреляты, реальный нейронный субстрат, который еще предстоит найти.
В недавней работе с областью V4 на макаке методом многоканальной электрофизиологической регистрации была показана более сложная организация цветовых рецептивных полей у нейронов этого региона, чем считалось ранее (Nigam et al., 2021). Авторы разбивали стимулирующий зрительное поле экран на 25 квадратов и тестировали цветовую чувствительность нейронов на изменение цвета в каждом из них. Оказалось, что рецептивные поля далеко не всех нейронов настроены гомогенно на один и тот же цвет, была заметная фракция нейронов с гетерогенным рецептивным полем – когда на предъявление цвета в разные квадраты рецептивного поля была обнаружена разная спектральная чувствительность нейрона, вплоть до оппонентных цветов внутри одного рецептивного поля. Если эти данные подтвердятся и не окажутся, например, методической ошибкой, связанной с адаптацией нейронов к длительному предъявлению стимулов, то текущие представления о кодировании цвета нейронами в области V4 придется кардинально пересмотреть.
В одной из работ на человеке методом фМРТ было показано, что нижневисочные области зрительной коры V4v и VO1 активируются сильнее в задаче по категоризации цветов, чем в задаче с тем же предъявлением цветовых стимулов, но с отвлечением внимания на посторонние арифметические вычисления (Brouwer, Heeger, 2013). Схожие результаты были получены с зависимостью активности в нижневисочной области коры IT макаки от предъявляемого типа задачи, отличающегося вниманием к категоризации цвета (Koida, Komatsu, 2007). Эти данные говорят о том, что наблюдаемая активность в этих зонах коры зависит от поставленной испытуемым задачи, то есть модулируется концентрацией внимания именно на дискриминацию цветов, а не просто отражает сенсорный приток.
В недавней работе на человеке методом фМРТ было показано: классификатор, обученный на активности мозга в области зрительной коры V4 при предъявлении абстрактных цветовых стимулов, был впоследствии способен угадывать цвет воображаемого человеком объекта по активности мозга (Bannert, Bartels, 2018). Эта работа примечательна тем, что по сути мы наблюдаем, как в последние годы нейрофизиология все решительнее атакует психофизиологическую проблему (Koch et al., 2016; Ноздрачев, Щербатых, 2021): методы нейронауки позволяют узнать, о какого цвета объекте думает человек в отсутствие зрительной стимуляции. Появляются работы, в которых исследователи сознательно строят дизайн эксперимента так, чтобы регистрировать активность мозга именно во время субъективного переживания цвета, а не во время сенсорной хроматической стимуляции (Morita et al., 2004; Dijkstra et al., 2019; Kim et al., 2020). В работе Кима и др. 2020 г., используя иллюзию константности цвета в парадигме чередующейся бинокулярной конкуренции, удалось в сигнале фМРТ разделить субъективно воспринимаемый цвет (регистрировалось нажатием кнопки испытуемым) и цвет от подаваемой хроматической стимуляции. Оказалось, что сигнал, регистрируемый в областях V1 и V2, отражает хроматическую стимуляцию, а сигнал в областях зрительной коры V3, V4v и VO1 – перцептивное ощущение цвета. В целом это хорошее эмпирическое подтверждение логики, которой придерживаются исследователи: в низших центрах зрительной системы обрабатываются физические параметры наблюдаемых стимулов, а в высших зонах зрительной коры активность сильнее коррелирует с осознанным перцептивным образом объекта, кодируя в том числе концептуализированное представление о параметрах наблюдаемого объекта, таких как его цветность и форма.
ГИПОТЕЗА О СУЩЕСТВОВАНИИ КОНЦЕПТУАЛЬНЫХ НЕЙРОНОВ ЦВЕТА
В единственной известной автору обзора работе, исследующей именно сознательное восприятие стимулов в других сенсорных системах, в парадигме тактильной иллюзии данные фМРТ указывали на локализацию нейрофизиологического субстрата перцепции в первичной соматосенсорной коре S1 (Rajaei et al., 2018), а не в высших корковых зонах. Значит ли это, что соматосенсорный анализатор устроен иначе, чем зрительный, пока не понятно, но можно надеяться, что с увеличением интереса к подобного рода работам ситуация в скором времени прояснится. Другим примером работ, успешно решающих частные случаи психофизиологической проблемы, хотя и не имеющим прямого отношения к теме обзора, является исследование, в котором по данным ЭЭГ можно было сказать, какие слоги произносит внутренней речью испытуемый (Whitford et al., 2017; Jack et al., 2019), и работа с мысленным напеванием мелодии, которую можно было угадать по данным МЭГ (Li et al., 2020).
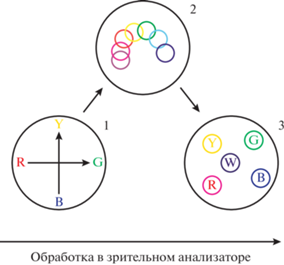
С другой стороны, психофизиологическая проблема частично уже давно преодолевается в нейрофизиологической области исследований (Ноздрачев, Щербатых, 2021), связанной с концептуальными нейронами (они же гностические, они же “нейроны бабушки” (Martin, 2000; Gross, 2002)), ансамбли которых, по-видимому, являются мозговым субстратом для таких гештальтных понятий, как положение организма во времени (Umbach et al., 2020) и пространстве (Miller et al., 2013; Hazama, Tamura, 2019), формирующих карту этого пространства (Killian et al., 2012; Jacobs et al., 2013), представление об абстрактном числе (Nieder, 2020), о лице конкретного конспецифика (Chang, Tsao, 2017), об ассоциации (Josselyn, Tonegawa, 2020). Вполне вероятным кажется наличие в мозге подобных же концептуальных нейронов цвета для кодирования квалиа цветности. Прямым подтверждением существования таких концептуальных нейронов цвета является работа, выполненная с применением имплантированных электродов на человеке (Murphey et al., 2008). При электрической стимуляции отдельных нейронов в зоне V4, настроенных на пурпурный цвет, у испытуемого возникало ощущение пурпурного цвета в центре поля зрения. С точки зрения автора этого обзора, нахождение нейронов с такими свойствами в коре является по сути нахождением мозгового субстрата для квалиа цвета и частным решением психофизиологической проблемы, связывающим ментальное с физическим, сознательное восприятие цвета с биологической тканью. Конечно, до разрешения психофизиологической проблемы, понимания того, как физиологическая активность мозга переходит в психический опыт индивида, еще очень далеко, однако эти примеры указывают на принципиальную возможность такого понимания (отрицаемую некоторыми философами). Схематическое изображение изменения принципов обработки цвета в коре приматов от низших зон к высшим, как представляется автору этого обзора, представлено на рис. 3.
Рис. 3.
Схема принципов кодирования на разных этапах цветового восприятия. 1 – оппонентное кодирование от сетчатки до V2, 2 – колонки и гиперколонки, от V2 до V4/IT, 3 – концептуальные нейроны цвета (гипотетические, от V4 и выше). Fig. 3. Plot of coding principles at different levels of color perception. 1 – opponent coding at retina to V2, 2 – columns and hypercolumns, 3 – conceptual color neurons (hypothetical, V4 and above).
Поскольку в исследованиях на человеке весьма редка возможность работать на клеточном уровне (в вышеупомянутой работе электроды имплантировались человеку по медицинским показаниям), хорошо бы было перейти к работе на низших приматах. Одной из очевидных трудностей в этом направлении является неспособность обезьян дать сознательный отчет о том, что она видит, тем не менее есть способы преодолеть эту проблему. Однозначная интерпретация поведения обезьяны при дискриминации или категоризации цвета непростая, но, по-видимому, решаемая методическая задача (Koida, Komatsu, 2007; Hesse, Tsao, 2020).
В каких областях коры обезьян искать концептуальные нейроны цвета? Помимо высших областей зрительной коры, V4 и нижневисочных зон (IT), данные по которым говорят то за, то против возможного категориального и перцептивного кодирования цвета в них, возможно, стоит искать вне зрительного анализатора, в ассоциативных областях коры. Например, работа Бёрда с соавторами (Bird et al., 2014) предполагает наличие концептуальных нейронов цвета в районе средней фронтальной извилины (MFG, поля по Бродману 9/46) и мозжечка. Авторы регистрировали фМРТ на человеке при стимуляции цветом близких оттенков (зеленый) и равных по расстоянию в цветовом пространстве, но принадлежащих к другой цветовой категории (синий) в парадигме адаптации BOLD-сигнала на одинаковые стимулы. Однако последующая попытка другой лаборатории повторить эксперимент в схожей парадигме не сумела выявить эти зоны мозга на фМРТ (Persichetti et al., 2015), хотя и подтвердила вывод, что зоны зрительной коры активируются только при хроматической, но не при категориальной стимуляции. Авторы попробовали заменить пассивное наблюдение цветовых стимулов испытуемыми на задачу активной категоризации цветов, но и в этом эксперименте также не выявили зоны, найденные Бёрдом с соавторами (хотя в этой задаче и активировалось несколько новых, фронтально расположенных зон). Несмотря на неоднозначность интерпретации этих исследований, для поиска концептуальных нейронов цвета было бы полезно адаптировать использованную авторами парадигму цветовой стимуляции для исследования на низших приматах методами электрофизиологии и оптического картирования.
Одной из перспективных моделей, на которой можно выявлять концептуальные нейроны цвета, является категоризация желтого и коричневого – эти цвета отличаются только яркостью, а спектрально одинаковы (возбуждают одни и те же рецепторы, имеют один и тот же оттенок, hue) (Buck, 2015; Witzel, Gegenfurtner, 2016). Другим возможным вариантом является применение ахроматичных стимулов, дающих перцептивное ощущение цвета: белого, серого и черного (Rajendran et al., 2021). Если удастся найти нейроны, избирательно отвечающие только на желтый и не отвечающие на коричневый (или наоборот), и при этом селективные к данному оттенку (нейрон не должен отвечать на яркость других цветов), то это будет веским доводом, что мы видим именно нейронный субстрат квалиа данного цвета, концептуальный нейрон, отвечающий за категоризацию цвета, а не за какой-то один из физических параметров зрительного стимула, таких как яркость или оттенок.
ИССЛЕДОВАНИЯ ЦВЕТА ВНЕ НЕЙРОФИЗИОЛОГИИ
К вопросу о квалиа цветности у человека, помимо нейрофизиологов, также пытались подобраться с другой стороны психолингвисты; начиная с классической работы Берлина и Кэя (Berlin, Kay, 1969; Kay et al., 2009) и до последнего времени (Skelton et al., 2017; Zaslavsky et al., 2018; Conway et al., 2020) они пытаются определить, в какие цветовые термины в разных языках категоризуется пространство цветовых стимулов. Судя по литературе за последние два десятилетия, психолингвисты сходятся в том, что категоризация цветов универсальна для сотни разных письменных и дописьменных языков (Regier et al., 2005; Lindsey, Brown, 2006), и есть работы, показывающие, что причиной тому – как раз анатомия и физиология зрения человека (Skelton et al., 2017).
Отечественная школа под руководством Е.Н. Соколова исследовала категоризацию цвета человеком. С использованием психофизиологических методов было установлено, что субъективно оцениваемое расстояние между двумя цветами и разница в длине волны стимула могут быть хорошо описаны поверхностью сферы в трехмерном евклидовом пространстве (Izmailov, Sokolov, 1991). Измайловым также были проведены эксперименты с пятью цветовыми словами вместо субъективного расстояния, которые также распределились по поверхности сферы (Измайлов и др., 1989). Эти результаты предполагают возможность точного математического описания перцептивного пространства человека и других животных.
Недавняя работа в области психофизиологии цвета показала, что индивидуальный словарный запас цветовых терминов не влияет непосредственно на восприятие цвета в простой задаче на сопоставление цвета, но от него зависит точность в задаче с отставленным во времени подбором цвета, то есть цветовая память (Hasantash, Afraz, 2020; Afraz, Hasantash, 2021; Lev-Ari, 2021). Методом функциональной томографии (фМРТ) ранее также было показано, что память о цвете может использоваться в категоризации известных объектов этого цвета: классификатор, натренированный на активность зрительной коры во время предъявления цветовых стимулов, впоследствии успешно предсказывал по активности в зонах V1, V3, hV4 и VO1, какого обычно цвета предъявляемый в виде черно-белой фотографии объект (Bannert, Bartels, 2013; Vandenbroucke et al., 2016). Тем не менее есть и доказательства в пользу так называемой уорфианской точки зрения (гипотеза Сапира-Уорфа и придерживающиеся ее лингвистические релятивисты): что на перцепцию и категоризацию цветов влияет то, как цветовые термины категоризуются в родном языке испытуемого или как испытуемый сам категоризует их словами (Winawer et al., 2007; Thierry et al., 2009; Mo et al., 2011; Forder et al., 2017; He et al., 2019). При тестировании шимпанзе на категоризацию цветов оказалось, что без специального обучения эти обезьяны не склонны категоризовывать цвета (Matsuno et al., 2004). В недавнем исследовании методом cпектроскопии в ближнем инфракрасном диапазоне (NIRS) младенцев довербального возраста удалось показать, что категоризация цветов возникает в мозге задолго до обучения языку (Yang et al., 2016) и, следовательно, является следствием развития зрительной системы, а не обучения за счет коммуникации и восприятия культуры. Эти данные также подтверждаются психофизиологическими экспериментами на довербальных младенцах (Skelton et al., 2017). В МЭГ-сигнале человеческого мозга содержится достаточно информации для декодирования из него цвета предъявляемого стимула (Rosenthal et al., 2021). Более того, сигнал содержал информацию о цвете при предъявлении названий цветов текстом (белым по серому), предварительно обученный на цветовых стимулах классификатор декодировал цвет из его названия с уровнем значительно выше случайного при анализе латентностей больше 450 мс, что говорит о конвергенции сигнала о цвете и его категоризации в виде цветового термина в высших зонах коры. Классификатор, наученный на МЭГ-сигнале при предъявлении цветовых терминов, не способен был предсказать цвет на данных стимуляции цветовыми стимулами, что говорит о том, что перцепция цвета может вызывать его семантическое представление, но не наоборот.
Суммируя процитированные выше работы, можно сказать, что гипотеза Сапира-Уорфа о лингвистической относительности вряд ли получит однозначный ответ “да” или “нет” – в разных парадигмах эксперимента ответы получаются разные, и все они, видимо, верны, так как категоризация может иметь разный мозговой субстрат, как зависящий, так и не зависящий от языка (Regier, Kay, 2009; Brouwer, Heeger, 2013; Witzel, Gegenfurtner, 2016; Regier, Xu, 2017).
ЗАКЛЮЧЕНИЕ
Как видно из анализа литературы, на сегодняшний момент сложилось представление о том, что в корковой части зрительного анализатора (области V1–V3 и отчасти V4) кодируются различные физические параметры цветового стимула (яркость, форма, скорость движения, положение в зрительном поле). В то же время в высшей области зрительного анализатора V4 и нижневисочных областях новой коры есть нейроны, активность которых кодирует более абстрактные свойства стимула, не связанные напрямую с физическими параметрами, зависящими от временных и пространственных контрастов (например, динамики цвета фона, на котором предъявляется цветовой стимул). Это позволяет говорить о том, что в этих областях мозга приматов кодируется именно перцептивное ощущение цвета, что было показано, в частности, в прямом эксперименте с применением имплантированных электродов на человеке (Murphey et al., 2008). На основе этих литературных данных автором выдвигается гипотеза, что в высших областях новой коры приматов могут быть найдены концептуальные нейроны, по аналогии с клетками места гиппокампа, кодирующие субъективное восприятие цвета. Кроме нейрофизиологических данных, подробно рассмотренных в обзоре, известные на данный момент данные психофизиологии и психолингвистики также не противоречат выдвигаемой гипотезе.
Список литературы
Измайлов Ч.А., Соколов Е.Н., Черноризов А.М. Психофизиология цветового зрения. 1989, М.: Изд-во МГУ. 205 pp.
Ноздрачев А.Д., Щербатых Ю.В. Физиология и психология – диалектика взаимодействия при решении психофизиологической проблемы. Рос. физиол. журн. им. И. М. Сеченова. 2021. 107 (2): 154–176.
Abboud S., Hanassy S., Levy-Tzedek S., Maidenbaum S., Amedi A. EyeMusic: Introducing a “visual” colorful experience for the blind using auditory sensory substitution. Restorative Neurology and Neuroscience. 2014. 32 (2): 247–257.
Afraz A., Hasantash M. Reply to Lev-Ari: Operational definition of “color perception”; which task represents the concept better? Proc Natl Acad Sci U S A. 2021. 118 (10).
Arcaro M.J., Kastner S. Topographic organization of areas V3 and V4 and its relation to supra-areal organization of the primate visual system. Vis Neurosci. 2015. 32: E014.
Baden T., Osorio D. The Retinal Basis of Vertebrate Color Vision. Annu Rev Vis Sci. 2019. 5: 177–200.
Bannert M.M., Bartels A. Decoding the yellow of a gray banana. Curr Biol. 2013. 23 (22): 2268–2272.
Bannert M.M., Bartels A. Human V4 Activity Patterns Predict Behavioral Performance in Imagery of Object Color. J Neurosci. 2018. 38 (15): 3657–3668.
Berlin B., Kay P. Basic Color Terms: Their Universality and Evolution. 1969, Berkeley and Los Angeles.: University of California Press.
Bird C.M., Berens S.C., Horner A.J., Franklin A. Categorical encoding of color in the brain. Proc Natl Acad Sci U S A. 2014. 111 (12): 4590–4595.
Bohon K.S., Hermann K.L., Hansen T., Conway B.R. Representation of Perceptual Color Space in Macaque Posterior Inferior Temporal Cortex (the V4 Complex). eNeuro. 2016. 3 (4).
Bosten J.M., Boehm A.E. Empirical evidence for unique hues? J Opt Soc Am A Opt Image Sci Vis. 2014. 31 (4): A385–393.
Brainard D.H., Roorda A., Yamauchi Y., Calderone J.B., Metha A., Neitz M., Neitz J., Williams D.R., Jacobs G.H. Functional consequences of the relative numbers of L and M cones. J Opt Soc Am A Opt Image Sci Vis. 2000. 17 (3): 607–614.
Brouwer G.J., Heeger D.J. Decoding and reconstructing color from responses in human visual cortex. J Neurosci. 2009. 29 (44): 13992–4003.
Brouwer G.J., Heeger D.J. Categorical clustering of the neural representation of color. J Neurosci. 2013. 33 (39): 15454–15465.
Buck S. L. Brown. Curr Biol. 2015. 25 (13): R536-7.
Chang L., Tsao D.Y. The Code for Facial Identity in the Primate Brain. Cell. 2017. 169 (6): 1013–1028 e14.
Collin S.P., Knight M.A., Davies W.L., Potter I.C., Hunt D.M., Trezise A.E. Ancient colour vision: multiple opsin genes in the ancestral vertebrates. Curr Biol. 2003. 13 (22): R864–865.
Conway B.R. Color signals through dorsal and ventral visual pathways. Vis Neurosci. 2014. 31 (2): 197–209.
Conway B.R. The Organization and Operation of Inferior Temporal Cortex. Annu Rev Vis Sci. 2018. 4: 381–402.
Conway B.R., Hubel D.H., Livingstone M.S. Color contrast in macaque V1. Cereb Cortex. 2002. 12 (9): 915–925.
Conway B.R., Livingstone M.S. Spatial and temporal properties of cone signals in alert macaque primary visual cortex. J Neurosci. 2006. 26 (42): 10 826–10 846.
Conway B.R., Moeller S., Tsao D.Y. Specialized color modules in macaque extrastriate cortex. Neuron. 2007. 56 (3): 560–573.
Conway B.R., Ratnasingam S., Jara-Ettinger J., Futrell R., Gibson E. Communication efficiency of color naming across languages provides a new framework for the evolution of color terms. Cognition. 2020. 195: 104086.
Conway B.R., Tsao D.Y. Color-tuned neurons are spatially clustered according to color preference within alert macaque posterior inferior temporal cortex. Proc Natl Acad Sci U S A. 2009. 106 (42): 18034–18039.
Cottaris N.P., De Valois R.L. Temporal dynamics of chromatic tuning in macaque primary visual cortex. Nature. 1998. 395 (6705): 896–900.
Deeb S.S. Genetics of variation in human color vision and the retinal cone mosaic. Curr Opin Genet Dev. 2006. 16 (3): 301–307.
Dijkstra N., Bosch S.E., van Gerven M.A.J. Shared Neural Mechanisms of Visual Perception and Imagery. Trends Cogn Sci. 2019. 23 (5): 423–434.
Dumoulin S.O., Harvey B.M., Fracasso A., Zuiderbaan W., Luijten P.R., Wandell B.A., Petridou N. In vivo evidence of functional and anatomical stripe-based subdivisions in human V2 and V3. Sci Rep. 2017. 7(1): 733.
Duyck M., Chang A.L.Y., Gruen T.J., Tello L.Y., Eastman S., Fuller-Deets J., Conway B.R. Color Tuning of Face-Selective Neurons in Macaque Inferior Temporal Cortex. eNeuro. 2021. 8 (2).
Emery K.J., Kuppuswamy Parthasarathy M., Joyce D.S., Webster M.A. Color perception and compensation in color deficiencies assessed with hue scaling. Vision Res. 2021. 183: 1–15.
Engel S., Zhang X., Wandell B. Colour tuning in human visual cortex measured with functional magnetic resonance imaging. Nature. 1997. 388 (6637): 68–71.
Forder L., Bosten J., He X., Franklin A. A neural signature of the unique hues. Sci Rep. 2017. 7: 42364.
Forder L., He X., Franklin A. Colour categories are reflected in sensory stages of colour perception when stimulus issues are resolved. PLoS One. 2017. 12 (5): e0178097–e0178097.
Garg A.K., Li P., Rashid M.S., Callaway E.M. Color and orientation are jointly coded and spatially organized in primate primary visual cortex. Science. 2019. 364 (6447): 1275–1279.
Gegenfurtner K.R., Kiper D.C., Levitt J.B. Functional properties of neurons in macaque area V3. J Neurophysiol. 1997. 77 (4): 1906–1923.
Ghose G.M., Ts’o D.Y. Integration of color, orientation, and size functional domains in the ventral pathway. Neurophotonics. 2017. 4(3): 031216.
Gross C.G. Genealogy of the “grandmother cell”. Neuroscientist. 2002. 8 (5): 512–518.
Hadjidimitrakis K., Bakola S., Chaplin T.A., Yu H.H., Alanazi O., Chan J.M., Worthy K.H., Rosa M.G.P. Topographic Organization of the 'Third-Tier’ Dorsomedial Visual Cortex in the Macaque. J Neurosci. 2019. 39 (27): 5311–5325.
Hasantash M., Afraz A. Richer color vocabulary is associated with better color memory but not color perception. Proceedings of the National Academy of Sciences. 2020. 117 (49): 31046.
Hazama Y., Tamura R. Effects of self-locomotion on the activity of place cells in the hippocampus of a freely behaving monkey. Neurosci Lett. 2019. 701: 32–37.
He H., Li J., Xiao Q., Jiang S., Yang Y., Zhi S. Language and Color Perception: Evidence From Mongolian and Chinese Speakers. Front Psychol. 2019. 10: 551.
Hesse J.K., Tsao D.Y. A new no-report paradigm reveals that face cells encode both consciously perceived and suppressed stimuli. Elife. 2020. 9: e58360.
Horwitz G.D., Hass C.A. Nonlinear analysis of macaque V1 color tuning reveals cardinal directions for cortical color processing. Nat Neurosci. 2012. 15 (6): 913–919.
Isherwood Z.J., Joyce D.S., Parthasarathy M.K., Webster M.A. Plasticity in perception: insights from color vision deficiencies. Fac Rev. 2020. 9: 8.
Izmailov C.A., Sokolov E.N. Spherical Model of Color and Brightness Discrimination. Psychological Science. 1991. 2 (4): 249–260.
Jack B.N., Le Pelley M.E., Han N., Harris A.W.F., Spencer K.M., Whitford T.J. Inner speech is accompanied by a temporally-precise and content-specific corollary discharge. Neuroimage. 2019. 198: 170–180.
Jacobs J., Weidemann C.T., Miller J.F., Solway A., Burke J.F., Wei X.X., Suthana N., Sperling M.R., Sharan A.D., Fried I., Kahana M.J. Direct recordings of grid-like neuronal activity in human spatial navigation. Nat Neurosci. 2013. 16 (9): 1188–1190.
Jameson K.A., Highnote S.M., Wasserman L.M. Richer color experience in observers with multiple photopigment opsin genes. Psychon Bull Rev. 2001. 8 (2): 244–261.
Jeffs J., Federer F., Ichida J.M., Angelucci A. High-resolution mapping of anatomical connections in marmoset extrastriate cortex reveals a complete representation of the visual field bordering dorsal V2. Cereb Cortex. 2013. 23 (5): 1126–47.
Johnson E.N., Hawken M.J., Shapley R. The spatial transformation of color in the primary visual cortex of the macaque monkey. Nat Neurosci. 2001. 4 (4): 409–16.
Josselyn S.A., Tonegawa S. Memory engrams: Recalling the past and imagining the future. Science. 2020. 367 (6473).
Kay P., Berlin B., Maffi L., Merrifield WR., Cook R. The World Color Survey. 2009, Stanford: CSLI.
Killian N.J., Jutras M.J., Buffalo E.A. A map of visual space in the primate entorhinal cortex. Nature. 2012. 491 (7426): 761–764.
Kim I., Hong S. W., Shevell S.K., Shim W.M. Neural representations of perceptual color experience in the human ventral visual pathway. Proc Natl Acad Sci U S A. 2020. 117 (23): 13145–13150.
Kiper D.C., Fenstemaker S.B., Gegenfurtner K.R. Chromatic properties of neurons in macaque area V2. Vis Neurosci. 1997. 14 (6): 1061–1072.
Koch C., Massimini M., Boly M., Tononi G. Neural correlates of consciousness: progress and problems. Nat Rev Neurosci. 2016. 17 (5): 307–321.
Koida K., Komatsu H. Effects of task demands on the responses of color-selective neurons in the inferior temporal cortex. Nat Neurosci. 2007. 10 (1): 108–116.
Kusunoki M., Moutoussis K., Zeki S. Effect of background colors on the tuning of color-selective cells in monkey area V4. J Neurophysiol. 2006. 95 (5): 3047–3059.
Lafer-Sousa R., Conway B.R. Parallel, multi-stage processing of colors, faces and shapes in macaque inferior temporal cortex. Nat Neurosci. 2013. 16 (12): 1870–1878.
Lafer-Sousa R., Conway B.R., Kanwisher N.G. Color-Biased Regions of the Ventral Visual Pathway Lie between Face- and Place-Selective Regions in Humans, as in Macaques. J Neurosci. 2016. 36 (5): 1682–1697.
Landisman C.E., Ts’o D.Y. Color processing in macaque striate cortex: electrophysiological properties. J Neurophysiol. 2002. 87 (6): 3138–3151.
Lev-Ari S. Richer color vocabulary is correlated with color memory, but its relation to perception is unknown. Proceedings of the National Academy of Sciences. 2021. 118 (10): e2024682118.
Li M., Liu F., Juusola M., Tang S. Perceptual color map in macaque visual area V4. J Neurosci. 2014. 34 (1): 202–217.
Li Y., Luo H., Tian X. Mental operations in rhythm: Motor-to-sensory transformation mediates imagined singing. PLoS Biol. 2020. 18 (10): e3000504.
Lim H., Wang Y., Xiao Y., Hu M., Felleman D.J. Organization of hue selectivity in macaque V2 thin stripes. J Neurophysiol. 2009. 102 (5): 2603–2615.
Lindsey D.T., Brown A.M. Universality of color names. Proc Natl Acad Sci U S A. 2006. 103 (44): 16608–16613.
Liu Y., Li M., Zhang X., Lu Y., Gong H., Yin J., Chen Z., Qian L., Yang Y., Andolina I.M., Shipp S., McLoughlin N., Tang S., Wang W. Hierarchical Representation for Chromatic Processing across Macaque V1, V2, and V4. Neuron. 2020. 108 (3): 538–550 e5.
Martin K.A. The Pope and grandmother–a frog’s-eye view of theory. Nat Neurosci. 2000. 3 Suppl: 1169.
Matsuno T., Kawai N., Matsuzawa T. Color classification by chimpanzees (Pan troglodytes) in a matching-to-sample task. Behav Brain Res. 2004. 148 (1–2): 157–165.
Miller J.F., Neufang M., Solway A., Brandt A., Trippel M., Mader I., Hefft S., Merkow M., Polyn S.M., Jacobs J., Kahana M.J., Schulze-Bonhage A. Neural activity in human hippocampal formation reveals the spatial context of retrieved memories. Science. 2013. 342 (6162): 1111–1114.
Mo L., Xu G., Kay P., Tan L.H. Electrophysiological evidence for the left-lateralized effect of language on preattentive categorical perception of color. Proc Natl Acad Sci USA. 2011. 108 (34): 14026–14030.
Mollon J.D. Color vision: opsins and options. Proc Natl Acad Sci USA. 1999. 96 (9): 4743–4745.
Mollon J.D. A neural basis for unique hues? Curr Biol. 2009. 19(11): R441-2; author reply R442-3.
Morita T., Kochiyama T., Okada T., Yonekura Y., Matsumura M., Sadato N. The neural substrates of conscious color perception demonstrated using fMRI. Neuroimage. 2004. 21 (4): 1665–1673.
Murphey D.K., Yoshor D., Beauchamp M.S. Perception matches selectivity in the human anterior color center. Curr Biol. 2008. 18 (3): 216–20.
Nasr S., Polimeni J.R., Tootell R.B. Interdigitated Color- and Disparity-Selective Columns within Human Visual Cortical Areas V2 and V3. J Neurosci. 2016. 36 (6): 1841–1857.
Nieder A. Neural constraints on human number concepts. Curr Opin Neurobiol. 2020. 60: 28–36.
Nigam S., Pojoga S., Dragoi V. A distinct population of heterogeneously color-tuned neurons in macaque visual cortex. Sci Adv. 2021. 7 (8).
Parkes L.M., Marsman J.B., Oxley D.C., Goulermas J.Y., Wuerger S.M. Multivoxel fMRI analysis of color tuning in human primary visual cortex. J Vis. 2009. 9 (1): 1 1–13.
Persichetti A.S., Thompson-Schill S.L., Butt O.H., Brainard D.H., Aguirre G. K. Functional magnetic resonance imaging adaptation reveals a noncategorical representation of hue in early visual cortex. J Vis. 2015. 15 (6): 18.
Rajaei N., Aoki N., Takahashi H.K., Miyaoka T., Kochiyama T., Ohka M., Sadato N., Kitada R. Brain networks underlying conscious tactile perception of textures as revealed using the velvet hand illusion. Hum Brain Mapp. 2018. 39 (12): 4787–4801.
Rajendran S., Maule J., Franklin A., Webster M.A. Ensemble coding of color and luminance contrast. Atten Percept Psychophys. 2021. 83(3): 911–924.
Regier T., Kay P. Language, thought, and color: Whorf was half right. Trends Cogn Sci. 2009. 13 (10): 439–446.
Regier T., Kay P., Cook R.S. Focal colors are universal after all. Proc Natl Acad Sci USA. 2005. 102 (23): 8386–8391.
Regier T., Xu Y. The Sapir-Whorf hypothesis and inference under uncertainty. Wiley Interdiscip Rev Cogn Sci. 2017. 8 (6).
Rosenthal I.A., Singh S.R., Hermann K.L., Pantazis D., Conway B.R. Color Space Geometry Uncovered with Magnetoencephalography. Curr Biol. 2021. 31 (5): 1127–1128.
Rowe M.H. Trichromatic color vision in primates. News Physiol Sci. 2002. 17: 93–98.
Schein S.J., Desimone R. Spectral properties of V4 neurons in the macaque. J Neurosci. 1990. 10 (10): 3369–3389.
Schrödinger E. What is life?: the physical aspects of the living cell (Repr. ed.). 2001: Cambridge Univ. Press.
Sharpe L.T., Stockman A., Jagle H., Knau H., Klausen G., Reitner A., Nathans J. Red, green, and red-green hybrid pigments in the human retina: correlations between deduced protein sequences and psychophysically measured spectral sensitivities. J Neurosci. 1998. 18 (23): 10053–10069.
Skelton A.E., Catchpole G., Abbott J.T., Bosten J.M., Franklin A. Biological origins of color categorization. Proc Natl Acad Sci U S A. 2017. 114 (21): 5545–5550.
Stoughton C.M., Conway B.R. Neural basis for unique hues. Curr Biol. 2008. 18 (16): R698–699.
Teichmann L., Grootswagers T., Moerel D., Carlson T.A., Rich A.N. Temporal dissociation of neural activity underlying synesthetic and perceptual colors. Proc Natl Acad Sci USA. 2021. 118(6).
Thierry G., Athanasopoulos P., Wiggett A., Dering B., Kuipers J.R. Unconscious effects of language-specific terminology on preattentive color perception. Proc Natl Acad Sci U S A. 2009. 106 (11): 4567–4570.
Tregillus K.E.M., Isherwood Z.J., Vanston J.E., Engel S.A., MacLeod D.I.A., Kuriki I., Webster M.A. Color Compensation in Anomalous Trichromats Assessed with fMRI. Curr Biol. 2021. 31 (5): 936–942 e4.
Umbach G., Kantak P., Jacobs J., Kahana M., Pfeiffer B.E., Sperling M., Lega B. Time cells in the human hippocampus and entorhinal cortex support episodic memory. Proc Natl Acad Sci USA. 2020. 117 (45): 28463–28474.
Vandenbroucke A.R.E., Fahrenfort J.J., Meuwese J.D.I., Scholte H.S., Lamme V.A.F. Prior Knowledge about Objects Determines Neural Color Representation in Human Visual Cortex. Cereb Cortex. 2016. 26 (4): 1401–1408.
Vautin R.G., Dow B.M. Color cell groups in foveal striate cortex of the behaving macaque. J Neurophysiol. 1985. 54 (2): 273–292.
Viénot F., Brettel H., Ott L., M’Barek A.B., Mollon J.D. What do colour-blind people see? Nature. 1995. 376 (6536): 127–128.
Whitford T.J., Jack B.N., Pearson D., Griffiths O., Luque D., Harris A.W., Spencer K.M., Le Pelley M.E. Neurophysiological evidence of efference copies to inner speech. Elife. 2017. 6.
Winawer J., Witthoft N., Frank M.C., Wu L., Wade A.R., Boroditsky L. Russian blues reveal effects of language on color discrimination. Proc Natl Acad Sci U S A. 2007. 104 (19): 7780–7785.
Witthoft N., Winawer J., Eagleman D.M. Prevalence of learned grapheme-color pairings in a large online sample of synesthetes. PLoS One. 2015. 10(3): e0118996.
Witzel C., Gegenfurtner K.R. Categorical perception for red and brown. J Exp Psychol Hum Percept Perform. 2016. 42 (4): 540–570.
Witzel C., Maule J., Franklin A. Red, yellow, green, and blue are not particularly colorful. J Vis. 2019. 19 (14): 27.
Wool L.E., Komban S.J., Kremkow J., Jansen M., Li X., Alonso J. M., Zaidi Q. Salience of unique hues and implications for color theory. J Vis. 2015. 15(2).
Xiao Y., Casti A., Xiao J., Kaplan E. Hue maps in primate striate cortex. Neuroimage. 2007. 35 (2): 771–786.
Xiao Y., Wang Y., Felleman D.J. A spatially organized representation of colour in macaque cortical area V2. Nature. 2003. 421 (6922): 535–9.
Yang J., Kanazawa S., Yamaguchi M.K., Kuriki I. Cortical response to categorical color perception in infants investigated by near-infrared spectroscopy. Proc Natl Acad Sci USA. 2016. 113 (9): 2370–2375.
Yasuda M., Banno T., Komatsu H. Color selectivity of neurons in the posterior inferior temporal cortex of the macaque monkey. Cereb Cortex. 2010. 20 (7): 1630–1646.
Zaslavsky N., Kemp C., Regier T., Tishby N. Efficient compression in color naming and its evolution. Proc Natl Acad Sci USA. 2018. 115 (31): 7937–7942.
Zeki S. The representation of colours in the cerebral cortex. Nature. 1980. 284 (5755): 412–418.
Дополнительные материалы отсутствуют.
Инструменты
Журнал высшей нервной деятельности им. И.П. Павлова


