Химическая физика, 2019, T. 38, № 12, стр. 59-63
Исследование молекулярного состава конденсата выдыхаемого воздуха с использованием масс-спектрометрии высокого разрешения
А. С. Кононихин 1, 2, 3, *, Н. В. Захарова 1, А. Э. Юсупов 1, 4, А. М. Рябоконь 1, 5, К. Ю. Федорченко 1, 5, М. И. Индейкина 1, А. Е. Бугрова 1, А. И. Спасский 2, И. А. Попов 4, С. Д. Варфоломеев 1, 4, Е. Н. Николаев 1, 2, 3
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н Семёнова РАН, Институт энергетических проблем химической физики им. В.Л. Тальрозе Российской академии наук
Москва, Россия
3 Сколковский институт науки и технологий
Сколково, Россия
4 Московский физико-технический институт
Москва, Россия
5 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: alex.kononikhin@gmail.com
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
Конденсат выдыхаемого воздуха (КВВ) содержит в себе широкий набор низко- и высокомолекулярных соединений и представляет большой исследовательский интерес для поиска маркеров социально-значимых патологий. Благодаря неинвазивному, быстрому и безопасному способу сбора проба КВВ может служить диагностическим образцом, используемым в персонализированных приборах мониторинга состояния организма. Применение современных высокочувствительных методов масс-спектрометрии при анализе проб составляет основу достоверной и наиболее полной идентификации молекулярного профиля КВВ. В ходе исследования проведен сравнительный анализ некоторых из них и предложен наиболее оптимальный подход к молекулярному профилированию конденсата выдыхаемого воздуха с помощью масс-спектрометрии высокого разрешения. Показано, что результаты анализа молекулярного профиля КВВ могут существенно зависеть как от типа использованного для сбора КВВ устройства, так и от температуры охлаждения конденсора. Примечательно, что большее количество соединений было идентифицировано в сорбированных на стенках собирающих устройств остатках КВВ, дополнительно собранных при помощи органического растворителя.
ВВЕДЕНИЕ
Дыхательная система выполняет важнейшую функцию жизнеобеспечения, на ее состоянии отражается образ жизни и здоровье человека. Конденсат выдыхаемого воздуха (КВВ) содержит в себе широкий набор низко- и высокомолекулярных соединений и представляет большой исследовательский интерес для поиска маркеров социально-значимых патологий [1–3]. Благодаря неинвазивному, быстрому и безопасному сбору, проба КВВ может служить диагностическим образцом, используемым в персонализированных приборах мониторинга состояния организма. Сбор таких проб может проводиться даже у очень тяжелых пациентов, в том числе и с повторами через короткие интервалы времени [4–6]. Таким образом, исследование дыхания представляется крайне перспективным подходом к созданию скрининговых программ для широкомасштабного клинического применения [7–9].
По своему молекулярному составу КВВ является сложной матрицей, химический состав которой сходен с составом альвеолярной жидкости легких. В состав КВВ входят разные классы соединений, включая белки, липиды, антитела, углеводы, аминокислоты и другие нелетучие биомакромолекулы. Суммарно КВВ человека содержит более 2000 различных соединений [10]. Соединения, присутствующие в КВВ, не ограничены происхождением в дыхательной системе и могут быть индикаторами самых разнообразных системных процессов [11]. При развитии патологических процессов в дыхательных путях характерно изменение белкового состава их тканей, которое может иметь диагностическое значение, а белки и пептиды выдыхаемого воздуха могут являться специфическими маркерами [4–6, 12–14].
Несмотря на недостаточную стандартизацию методов сбора и анализа образцов [15], интерес к исследованию КВВ продолжает расти [16, 17]. Применение современных высокочувствительных методов, например, масс-спектрометрии (МС) при анализе проб составляет основу достоверной и наиболее полной идентификации молекулярного профиля сложных смесей [18–20]. МС высокого разрешения является высокочувствительным методом и позволяет одновременно идентифицировать молекулы различных типов в диапазоне концентраций, различающихся на пять и более порядков, в том числе в КВВ [4]. В настоящее время проводятся исследования других высокоточных методов, таких как метаболомика и протеомика, обладающих огромным потенциалом в области профилирования биомаркеров выдыхаемого воздуха. Ввиду того, что концентрации веществ в КВВ на несколько порядков ниже, чем в других физиологических образцах, МС высокого разрешения является наиболее оптимальной для его молекулярного анализа [21–23]. В настоящей работе проведен сравнительный анализ проб КВВ, собранных в различных условиях, и предложен наиболее оптимальный подход к молекулярному профилированию конденсата выдыхаемого воздуха с использованием масс-спектрометрии высокого разрешения.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор и приготовление пробы конденсата выдыхаемого воздуха
Сбор КВВ осуществляли с помощью портативного устройства R-Tube в соответствии с ранее опубликованными протоколами [5, 6]. В качестве доноров в исследовании приняли участие здоровые, некурящие добровольцы. Протокол сбора КВВ был утвержден комитетами по этике ИБХФ РАН и ИМБП РАН, все доноры подписали информированное согласие на участие в исследовании. Пробоподготовка для масс-спектрометрии включала лиофилизацию пробы и селективный триптический гидролиз, расщепляющий белок по пептидным связям, содержащим лизин и аргинин [5, 6].
Хромато-масс-спектрометрический анализ (ВЭЖХ-МС/МС)
Хромато-масс-спектрометрический анализ (ВЭЖХ-МС/МС) образцов проводили на комбинированной системе, состоящей из жидкостного хроматографа Agilent 1100 (Agilent Technologies Inc., США) и масс-спектрометра LTQ FT Ultra (Thermo, Германия) в соответствии с ранее опубликованными протоколами [5, 6]. Масс-спектры собранных проб находились в диапазоне от 300 до 1600 m/z. Каждый образец КВВ был проанализирован трижды и для последующего анализа отобраны лишь те белки, которые были обнаружены в двух или трех повторах.
Список точных масс пептидов и масс их фрагментов использовали для поиска и идентификации белков по базе данных при помощи программы Mascot (Matrix Science, Лондон, Великобритания; версия 2.2.2). Для идентификации белков использовали базу данных Swiss-Prot Human из открытой базы данных последовательностей белков UniProt (Швейцария). Для идентификации белков применили следующие параметры поиска: фермент – трипсин; точность масс для родительского иона – 5 ppm; точность масс для MS/MS фрагментов – 0.50 Да; модификации – окисление метионина. Считалось, что белок достоверно идентифицирован, если для него нашлось более двух пептидов (Score > 24). Также считалось, что пептид идентифицирован верно, если вероятность его определения была более 95.0% согласно алгоритму по Peptide Prophet. Предполагается, что для надежной идентификации белков вероятность их определения должна быть более 99.0% согласно алгоритму по Peptide Prophet.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В начале исследования нами было проведено сравнение состава проб КВВ, собранных у одного и того же донора при использовании двух различных устройств: 1) коммерческого продукта R-Tube (Respiratory Research, США) с пластиковой трубкой и 2) изготовленного вручную устройства со стеклянной трубкой. Две пробы КВВ собирали в течение 10 мин (с интервалом в 1 ч) при охлаждении трубок до температуры –20 °С. В результате ВЭЖХ-МС-анализа при использовании устройства R-Tube определили 77 молекулярных ионов, лежащих в диапазоне масс 788–5576 Да. При использовании стеклянной трубки – 103 иона, диапазон масс – 1031–5576 Да (табл. 1). Примечательно, что для обоих устройств еще большее количество ионов было идентифицировано в остатках КВВ, дополнительно собранных со стенок устройств с использованием метанола (табл. 1). Это может указывать на существенную сорбцию ряда компонентов КВВ на стенках обоих собирающих устройств.
Таблица 1.
Количество молекулярных ионов, идентифицированных при использовании двух разных устройств для сбора КВВ в зависимости от условий сбора пробы КВВ при T = –20 °C в стеклянную и пластиковую трубки
| Заряд молекулярного иона, z | Разные устройства для сбора КВВ | |||
|---|---|---|---|---|
| КВВ | остаточный смыв метанолом | |||
| пластик | стекло | пластик | стекло | |
| 2 | 32 | 82 | 96 | 146 |
| 3 | 29 | 10 | 59 | 100 |
| 4 | 5 | 3 | 6 | 22 |
| 5 | 8 | 8 | 3 | 14 |
| 6 | 3 | 0 | 4 | 5 |
| 7 | 0 | 0 | 0 | 9 |
| 8 | 0 | 0 | 0 | 7 |
| 9 | 0 | 0 | 0 | 1 |
| Всего | 77 | 103 | 168 | 304 |
| Диапазон масс, Да | 788–5576 | 1031–5576 | 788–5576 | 905–11559 |
Для дальнейших экспериментов мы использовали устройство R-Tube, поскольку оно является стандартизованным, тогда как изготовленное вручную устройство со стеклянной трубкой представляется менее эффективным для отделения КВВ от примесей содержимого слюны, что, вероятнее всего, способствовало выявлению большего количества ионов.
Для анализа белково-пептидного состава КВВ пробы собирали при трех разных температурных режимах для охлаждении трубки устройства R-Tube: –80 °C, –20 °C и –10 °C). Три соответствующие пробы были собраны у одного и того же донора с интервалом не более 1 ч. В лиофилизированных пробах был проведен трипсинолиз. Из результатов анализа полученных с использованием программы Mascot (рис. 1 и табл. 2) масс-спектров можно сделать вывод, что наибольший выход по белкам получается при сборе образца с охлаждением трубки при температуре T = –20 °C. Тем не менее в каждом из образцов были идентифицированы уникальные белки, а количество общих белков оказалось равным восьми. Как и при анализе молекулярных ионов, общее количество идентифицированных белков в метанольном смыве оказалось выше во всех трех пробах, чем в соответствующих образцах КВВ. Так, при температуре T = –80 °C количество белков в смыве увеличилось с 11 до 32. Несмотря на то, что в метанольных смывах количество белков от температуры практически не зависело, наблюдалось некоторое отличие по белковому составу. В пробе, собранной при T = –20 °C оказалось больше всего уникальных белков, а именно восемь. Таким образом, сбор КВВ при T = –20 °С представляется наиболее оптимальным. Немаловажным является также то, что данную температуру можно получить с использованием стандартной бытовой техники, что не требует затрат на приобретение специализированного оборудования для применения данного метода в клинике.
Рис. 1.
Количество идентифицированных белков при анализе КВВ и метанольного смыва, собранных при разных температурах охлаждения собирающего устройства R-Tube.
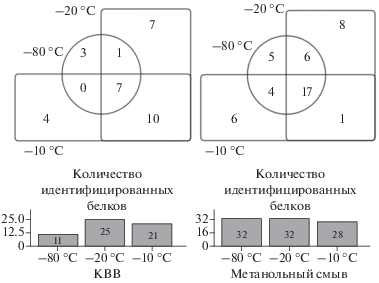
Таблица 2.
Идентифицированные белки при анализе КВВ
| ID белка | Название белка | Количество пептидов | Количество уникальных пептидов | Мол. масса, кДа |
|---|---|---|---|---|
| P02533 | Keratin, type I cytoskeletal 14 | 21 | 6 | 51.561 |
| P48668 | Keratin, type II cytoskeletal 6C | 20 | 1 | 60.024 |
| P02768 | Serum albumin | 3 | 3 | 69.366 |
| P08779 | Keratin, type I cytoskeletal 16 | 17 | 7 | 51.267 |
| P13645 | Keratin, type I cytoskeletal 10 | 32 | 20 | 59.51 |
| P13646-1 | Keratin, type I cytoskeletal 13 (Isoform 1) | 17 | 2 | 49.586 |
| P13647 | Keratin, type II cytoskeletal 5 | 23 | 5 | 62.378 |
| P19013 | Keratin, type II cytoskeletal 4 | 15 | 9 | 57.285 |
| P35908 | Keratin, type II cytoskeletal 2 epidermal | 32 | 22 | 65.432 |
| Q7Z794 | Keratin, type II cytoskeletal 1b | 6 | 1 | 61.358 |
| Q8N1N4 | Keratin, type II cytoskeletal 78 | 3 | 2 | 56.865 |
| Q86YZ3 | Hornerin | 3 | 3 | 282.39 |
| P02810 | Salivary acidic proline-rich phosphoprotein 1/2 | 2 | 2 | 17.016 |
| P04083 | Annexin A1 | 3 | 3 | 38.714 |
| P04264 | Keratin, type II cytoskeletal 1 | 42 | 26 | 66.038 |
| P04280 | Basic salivary proline-rich protein 1 | 6 | 6 | 38.545 |
| P12273 | Prolactin-inducible protein | 3 | 3 | 16.572 |
| P14923 | Junction plakoglobin | 3 | 3 | 81.744 |
| P15924 | Desmoplakin | 8 | 8 | 331.77 |
| P35527 | Keratin, type I cytoskeletal 9 | 25 | 24 | 62.064 |
| P47929 | Galectin-7 | 3 | 3 | 15.075 |
| P81605 | Dermcidin | 4 | 4 | 11.284 |
| Q02413 | Desmoglein-1 | 4 | 4 | 113.75 |
| Q6KC79 | Nipped-B-like protein | 2 | 2 | 316.05 |
| Q8TAX7 | Mucin-7 | 2 | 2 | 39.158 |
| Q96DA0 | Zymogen granule protein 16 homolog B | 2 | 2 | 22.739 |
| Q96DR5 | BPI fold-containing family A member 2 | 6 | 6 | 27.011 |
Таким образом, проведенные исследования позволяют заключить, что результаты анализа КВВ могут существенно зависеть как от материала использованного для сбора КВВ устройства стекло/пластик, так и от используемой температуры охлаждения. Важно также принимать во внимание существенную сорбцию выдыхаемых веществ на стенках собирающего устройства. Представляется крайне целесообразным использование органических растворителей для дополнительного смыва сорбированных веществ. Изменение режимов проведения ВЭЖХ-МС для анализа разных классов веществ также представляется рациональным.
Работа выполнения при финансовой поддержке грантом РФФИ 18-29-09158 МК. В работе использовали оборудование и ресурсы ЦКП ИБХФ РАН “Новые материалы и технологии”.
Список литературы
Phillips M. // Scientific Amer. 1992. V. 267. № 1. P. 74.
Davis M.D., Montpetit A., Hunt J. // Immunol. Allergy Clin. North Amer. 2012. V. 32. № 3. P. 363.
Sidorenko G.I., Zborovsky E.I., Levina D.I. // Ter. Arkh. 1980. V. 52. № 3. P. 65.
Kononikhin A.S., Starodubtseva N.L., Chagovets V.V., Bugrova A.E., Nikolaev E.N., Sukhikh G.T. // J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2017. V. 1047. P. 97.
Курова В.С., Анаев Э.Х., Кононихин А.С., Попов И.А., Федорченко К.Ю. и др. // Изв. РАН. Сер. хим. 2010. Т. 1. С. 284.
Kononikhin A.S., Fedorchenko K.Yu., Ryabokon A.M., Starodubtseva N.L., Popov I.A. et al. // Biochem. (Mosc) Suppl. Ser. B: Biomed. Chem. 2016. V. 10. № 3. P. 230.
Effros R.M. et al. // Amer. J. Respir. Crit. Care Med. 2012. V. 185. № 8. P. 803.
Lourenco C., Turner C. // Metabolites. 2014. V. 4. № 2. P. 465.
Hunt J. // J. Allergy Clin. Immunol. 2002. V. 110. № 1. P. 28.
Phillips M. et al. // PLOS ONE. 2013. V. 8. № 9.
Ladva C.N. et al. // J. Breath Res. 2017. V. 12. № 1.
López-Sánchez L.M. et al. // Amer. J. Physiol. Lung Cell. Mol. Physiol. 2017. V. 313 № 4. P. 664.
Рябоконь А.М., Анаев Э.Х., Кононихин А.С., Стародубцева Н.Л., Киреева Г.Х. // Пульмонология. 2014. Т. 1. С. 5.
Федорченко К.Ю., Рябоконь А.М., Кононихин А.С., Митрофанов С.И., Бармин В.В. и др. // Вестн. МГУ. 2016. № 2. С. 112.
Horváth I. et al. // Eur. Respir. J. 2005. V. 26. № 3. P. 523.
Zamuruyev K.O., Borras E., Pettit D.R., Aksenov A.A., Simmons J.D. et al. // Anal. Chim. Acta. 2018. V. 1006. P. 49.
Zamuruyev K.O., Schmidt A.J., Borras E., McCartney M.M., Schivo M. et al. // J. Breath Res. 2018. V. 12. № 3.
Костюкевич Ю.И., Кононихин А.С., Попов И.А., Николаев Е.Н. // Хим. физика. 2018. Т. 37. № 8. С. 7.
Горшков М.В., Харыбин О.Н., Вилков А.Н., Дривен В.В., Попов И.А. // Хим. физика. 2002. Т. 21 № 4. С. 32.
Тарасова И.А., Горшков М.В. // Хим. физика. 2004. Т. 23. № 7. С. 62.
Aksenov A.A., Zamuruyev K.O., Pasamontes A., Brown J.F., Schivo M. et al. // J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 2017. V. 1061–1062. P. 17.
Fernandez-Peralbo M.A. et al. // Talanta. 2015. V. 144. P. 1360.
Николаев Е.Н., Попов И.А., Кононихин А.С., Индейкина М.И., Кукаев Е.Н. // Успехи химии. 2012. Т. 81. № 11. С. 1051.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


