Химическая физика, 2019, T. 38, № 12, стр. 38-43
Комплексы биополимеров с эссенциальными липидами: взаимосвязь структуры и функциональных свойств
М. Г. Семёнова 1, *, А. С. Антипова 1, Н. П. Пальмина 1, Т. А. Мишарина 1, Е. И. Мартиросова 1, Д. В. Зеликина 1, Н. И. Крикунова 1, В. В. Каспаров 1, В. И. Бинюков 1, Н. Г. Богданова 1, С. А. Чеботарёв 1, М. Д. Гуреева 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: mariagersem@mail.ru
Поступила в редакцию 05.06.2019
После доработки 05.06.2019
Принята к публикации 20.06.2019
Аннотация
Получены наноразмерные и водорастворимые комплексы биополимеров (ковалентного конъюгата казеината натрия и мальтодекстрина) с эссенциальными липидами (липосомами фосфатидилхолина сои (ФХ: 59% омега-6 линолевой кислоты (ЛК) и 7% омега-3 альфа-линоленовой кислоты (АЛК)), обогащенными омега-3 АЛК в составе триглицеридов льняного масла (ЛМ: 55% АЛК и 18% ЛК) в отсутствии и в присутствии растительного антиоксиданта (эфирного масла гвоздики (ЭМГ)). Комбинацией методов статического, динамического и электрофоретического лазерного светорассеяния, а также электронной парамагнитной резонансной спектроскопии и атомно-силовой микроскопии были установлены основные взаимосвязи между структурными (размер, молярная масса, архитектура, заряд, плотность, структурная организация липидных слоев липосом фосфолипидов), а также термодинамическими (термодинамическое сродство к растворителю) параметрами комплексов и их функциональными свойствами. Среди функциональных свойств были изучены растворимость комплексов в водной среде и их защитные способности по отношению к автоокислению включенных в них эссенциальных липидов кислородом воздуха.
ВВЕДЕНИЕ
Современные данные доказательной медицины и нутрициологии свидетельствуют о недостаточном поступлении с пищей целого ряда биологически активных веществ, необходимых для снижения риска развития алиментарно-зависимых неинфекционных заболеваний (сердечно-сосудистых, нервно-дегенеративных, онкологических и диабета) [1–4]. В частности, в поддержании множества важных физиологических функций организма человека большое значение имеют эссенциальные (незаменимые) биологически активные липиды, такие как полиненасыщенные жирные кислоты ПНЖК (омега-3 и омега-6). Они не синтезируются в организме человека и должны поступать с пищей в достаточном количестве и в оптимальном соотношении (омега-6 : омега-3 ПНЖК = 1 : 1–4 : 1) [1–5]. В то же время чрезмерное употребление насыщенных жиров и критическое превышение омега-6 над омега-3 ПНЖК, достигающее 15 : 1–25 : 1 в высокоиндустриальных странах, являются одними из главных причин лишнего веса и сопутствующих алиментарно-зависимых заболеваний [5]. Таким образом, включение дополнительного количества омега-3 ПНЖК в рацион питания в профилактических целях, наряду с общим снижением насыщенных жиров, является актуальным для большинства населения и может быть осуществлено с помощью функциональных продуктов питания [6]. Однако серьезным сдерживающим фактором в разработке и производстве обогащенных омега-3 ПНЖК функциональных и специализированных продуктов питания является высокое содержание ненасыщенных углерод-углеродных связей в их молекулах. Это способствует высокой склонности ПНЖК к окислению и деградации под действием повышенных температур и света, что может приводить к образованию пероксидов и гидропероксидов, а также продуктов их разложения, многие из которых обладают токсичностью. Кроме того, это окисление может сопровождаться накоплением летучих карбонильных соединений, которые придают продуктам нежелательный запах и снижают их потребительские характеристики. В дополнение к этому липофильная природа ПНЖК и, следовательно, их низкая растворимость в водной среде, затрудняет введение ПНЖК в продукты питания и напитки в отсутствии или при низком общем содержании жира.
Таким образом, актуальной является разработка эффективных систем доставки эссенциальных ПНЖК (омега-3 и омега-6 в их достаточном количестве и в оптимальном соотношении) в организм человека через пищевые системы, которые, с одной стороны, должны обеспечить сохранность физиологических функций этих биологически активных веществ в условиях их хранения и переработки, а с другой стороны, придать им водорастворимую форму, а значит, как легкость введения в пищевые продукты с низким содержанием жира, так и высокий уровень их биодоступности в организме человека [7–9]. Такие системы доставки могут быть отнесены к физиологически-функциональным пищевым ингредиентам нового поколения, т.е. непосредственно оказывающим биологически значимое позитивное воздействие на метаболические процессы в организме человека. При этом они должны отвечать следующим основным требованиям: быть адекватными для питания и здоровья; безопасными с точки зрения сбалансированного питания; не должны снижать питательной ценности пищевых продуктов; должны употребляться перорально; должны обеспечивать содержание незаменимых биологически активных веществ в функциональном продукте в пределах 15–50% от средней суточной нормы их потребления; и должны удовлетворять растущим требованиям потребителей к “натуральности” пищевых продуктов и напитков [6, 10, 11].
Ранее было установлено, что ковалентные конъюгаты, содержащие казеинат натрия (основной белок молока) и мальтодекстрин (продукт ферментативного гидролиза крахмала), объединенные ковалентной связью на начальной стадии реакции Майара (Maillard), проявляют высокие инкапсулирующие способности по отношению к липосомам соевого фосфатидилхолина (ФХ), образуя с ними стабильные к окислению и хорошо растворимые в воде комплексы [12]. Учитывая эти свойства конъюгата, а также способность фосфатидилхолина к формированию липосом, именно комбинация такого ковалентного конъюгата и соевого фосфатидилхолина была выбрана нами за основу для разработки систем доставки незаменимых омега-3 и омега-6 ПНЖК. При этом для достижения наиболее оптимального оздоровительного эффекта (а именно, близкого к эквимассовому [5] соотношения омега-3 к омега-6 ПНЖК в разрабатываемой системе доставки) мы поставили перед собой задачу обогащения липосом ФХ (содержащих 59% омега-6 линолевой кислоты (ЛК) и 7% омега-3 альфа-линоленовой кислоты (АЛК)) триглицеридами льняного масла (ЛМ) (содержащими, по данным газожидкостной хроматографии, 55% омега-3 АЛК и 19% омега-6 ЛК). Для дополнительной стабилизации ПНЖК по отношению к окислению кислородом воздуха мы добавляли к формируемым липосомам (ФХ−ЛМ) один из наиболее эффективных растительных антиоксидантов, а именно эфирное масло гвоздики (ЭМГ) [13].
Используя комбинацию высокоточных физико-химических методов, таких как: статического, динамического и электрофоретического лазерного светорассеяния, а также электронной парамагнитной резонансной спектроскопии и атомно-силовой микроскопии, мы в данной работе ставили задачу выяснения основных взаимосвязей между структурными (размер, молярная масса, архитектура, заряд, плотность, структурная организация липидных слоев липосом фосфолипидов), а также термодинамическими (термодинамическое сродство к растворителю) параметрами формируемых супрамолекулярных комплексов и их функциональными свойствами. Среди функциональных свойств рассматривалась растворимость комплексов в водной среде и их защитные способности по отношению к автоокислению кислородом воздуха включенных в них эссенциальных липидов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Льняное масло (ЛМ) (“Соцсервис Агро”, Россия), было приобретено в аптеке. Перед использованием его дополнительно очищали от низкомолекулярных ПАВ с помощью пятикратного пропускания через адсорбент флорисил (“Sigma-Aldrich”, F5754) с использованием делительной воронки (4 г флорисила на 50 г масла). Соевый фосфатидилхолин (ФХ) 98%-ной химической чистоты (марка Lipoid S100, фирма “Lipoid GmbH”, Германия) был использован без дополнительной очистки. Точный жирнокислотный состав ЛМ (55% АЛК, 19% ЛК) и ФХ (7% АЛК, 59% ЛК) были определены газожидкостной хроматографией. Казеинат натрия (“Sigma-Aldrich”, С8654, Новая Зеландия) и мальтодекстрин SA2 (“AVEBE Group”, Нидерланды; декстрозный эквивалент равен двум) использовали для получения ковалентных конъюгатов (К). Для этого лиофильно высушенный раствор белка с мальтодекстрином (соотношение белок : мальтодекстрин = 1 : 2) прогревали в условиях повышенной температуры (60 °С) и постоянной влажности (79%) в течение 72 ч, инициируя первую стадию реакции Майара. Эфирное масло гвоздики (ЭМГ) (Eugenia caryophyllata Thumb., “Plant Lipids (Р)” Ltd., Индия) использовали в качестве растительного антиоксиданта для дополнительной стабилизации липидов от окисления (4% к общему весу липидов). Все другие используемые материалы характеризовались высокой степенью химической чистоты (>99.9%): радикал 16-доксилстеариновой кислоты (16-ДСК) (810604P, “Avanti Polar Lipids”); HCl, NaOH, диэтиловый эфир, азид натрия, трихлоруксусная кислота, 2-тиобарбитуровая кислота, Na2HPO4 и NaH2PO4 (АО “Лаверна”, Россия). Все растворы были приготовлены на бидистиллированной воде. Азид натрия (2 ∙ 10–4 г/мл) добавляли во все растворы как антимикробный агент.
Методы
Методы получения липосом ФХ (3.12 ∙ 10–3 г/мл) как чистых, так и обогащенных АЛК из льняного масла (3.33 ∙ 10–3 г/мл) до близкого к эквимассовому соотношения АЛК к ЛК (АЛК : ЛК = 1 : 1.2), включали последовательно механическую (фирма “Heidolph”, Германия, 22 000 об/мин, 2 мин) и ультразвуковую (3 раза по 5 мин во льду; 30 с – озвучивание, 30 с – перерыв; VCX130, фирма “Sonics & Materials”, США) гомогенизации с последующей экструзией (Avanti Polar Lipid Mini-Extruder, США) через мембранный фильтр с размером пор 100 нм (19 раз). Супрамолекулярные комплексы конъюгат‒липиды формировались самопроизвольно (40 °С, 1 ч) при смешении растворов конъюгата и липосом в термостатируемом шейкере (GFL 3032, Германия). Весовое соотношение липиды : конъюгат = 1 : 10. Ранее было показано, что данное соотношение обеспечивало высокую растворимость и защитные способности конъюгата по отношению к автоокислению липосом ФХ [14].
Методы характеристики структуры и функциональных свойств супрамолекулярных комплексов и их отдельных компонентов включали:
– многоугловое лазерное (633 нм, Не-Neлазер) светорассеяние в статическом и динамическом режимах (ЛС-01, ЗАО “Научные приборы” Санкт-Петербург, Россия): определение структурных (гидродинамического радиуса, Rh; радиуса инерции, RG; структурно-чувствительного параметра, характеризующего форму [15], ρ = RG/Rh; средневесовой молярной массы, Mw; плотности, d = Mw/(NAV) [14]) и термодинамического (осмотического второго вириального коэффициента, $A_{2}^{*},$ характеризующего термодинамическое сродство к растворителю) параметров;
– дифференциальную рефрактометрию (633 нм, “Shimadzu”, Япония): определение значений инкрементов показателя преломления и концентраций казеината натрия, мальтодекстрина, ковалентных конъюгатов, а также их комплексов с липидами (dn/dc = 0.17 ∙ 10–3 м3/кг);
– электрофоретическое светорассеяние (анализатор размера частиц Zeta sizer Nano ZS, “Malvern”, Великобритания): измерение дзета-потенциала;
– электронный парамагнитный резонанс (ЭПР-спектрометр Bruker ЕМХ, Германия): характеристика микровязкости липидных слоев исходных и инкапсулированных конъюгатом липосом (ФХ и ФХ−ЛМ в отсутствии и в присутствии ЭМГ) по измеренному времени вращательной корреляции спинового зонда (16-доксилстеариновой кислоты (16-ДСК));
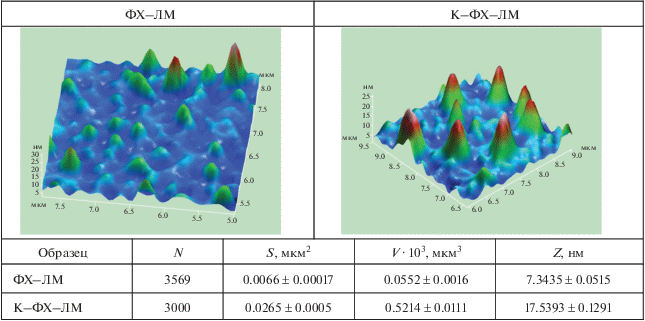
– атомно-силовую микроскопию (cканирующий зондовый микроскоп Solver P-47, “NT-MDT”, Россия): исследование рельефа поверхности липосом ФХ−ЛМ и их комплексов с конъюгатом;
– газожидкостную хроматографию (газовый хроматограф Кристалл 2000 М, “Хроматэк”, Россия) с пламенно-ионизационным детектором и кварцевой капиллярной колонкой DB-1 (длина 60 м, внутренний диаметр 0.32 мм, слой фазы 0.25 мкм, фирма “Supelco”, США): количественное определение содержания незаменимых ПНЖК в ФХ и ЛМ;
– спектрофотометрию (Beckman DU-70, США и СФ-2000 “ОКБ Спектр”, Россия): оценка продуктов перекисного окисления липидов (ПОЛ) (первичных (гидроперекисей) – после их экстракции диэтиловым эфиром и вторичных – малонового диальдегида (МДА) – по реакции с тиобарбитуровой кислотой в присутствии трихлоруксусной кислоты.
Все представленные в работе численные данные являются средними значениями, полученными, как минимум, из двух повторов экспериментов, стандартное отклонение полученных величин от среднего не превышало ±2%. Экспериментально полученные зависимости измеренных величин были проанализированы при помощи метода дисперсионного статистического анализа (ANOVA), и программного обеспечения OriginPro 8.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Молярная масса, размер, архитектура
Прежде всего, согласно данным лазерного многоуглового светорассеяния в статическом и динамическом режимах (табл. 1), было установлено, что комплексы конъюгата с липосомами ФХ, обогащенными триглицеридами ЛМ в отсутствии (К−(ФХ−ЛМ)) и в присутствии эфирного масла гвоздики (К−(ФХ−ЛМ−ЭМГ)), обладают более высокой средневесовой молярной массой (Мw) по сравнению с комплексом конъюгата с чистыми липосомами ФХ (К−ФХ), что отражалось на величине коэффициента ${{k}_{{{{M}_{w}}}}},$ характеризующего рост Мw комплексов К–(ФХ–ЛМ) и К–(ФХ–ЛМ–ЭМГ) относительно Мw = 6.8 ∙ 106 (Да) комплекса К−ФХ. Данный результат свидетельствовал, во-первых, что липосомы ФХ, обогащенные триглицеридами ЛМ (ФХ−ЛМ), являются более эффективными сшивающими агентами по отношению к молекулам конъюгата (${{k}_{{{{M}_{w}}}}}$ = 4.5), чем липосомы ФХ, и, во-вторых, что в присутствии ЭМГ сшивающие способности липосом становились еще более ярко выраженными (${{k}_{{{{M}_{w}}}}}$ = 6.9). По-видимому, добавление таких липофильных соединений, как триглицериды ЛМ и полифенолы ЭМГ, к липосомам ФХ приводило к возрастанию вклада гидрофобного притяжения в межмолекулярной ассоциации молекул конъюгата и обогащенных липосом (ФХ−ЛМ и ФХ−ЛМ−ЭМГ) при формировании их комплексов. При этом данные спектрофотометрических измерений концентрации свободных липидов (при λ = 215 нм) в их экстрактах диэтиловым эфиром (5 мл раствора липидов/комплексов + 3 мл диэтилового эфира), свидетельствовали о практически 95%-ном связывании в комплекс с конъюгатом как липосом ФХ, так и обогащенных липосом (ФХ−ЛМ и ФХ−ЛМ−ЭМГ).
Таблица 1.
Структурные и термодинамические параметры супрамолекулярных комплексов ковалентного конъюгата (К) с липосомами фосфатидилхолина (ФХ) в отсутствии и присутствии триглицеридов льняного масла (ЛМ) и эфирного масла гвоздики (ЭМГ) (рН 7.0, ионная сила = 0.001М, 25 °С)
| Комплексы | ${{k}_{{{{M}_{w}}}}}$ | RG, нм | kd | ρ = RG/Rh | ζ-потенциал, мВ | $А_{2}^{*},$ м3/моль |
|---|---|---|---|---|---|---|
| К−ФХ | 1.0 | 112 | 1.0 | 2.0 | −22.8 | 2.4 |
| К−(ФХ−ЛМ) | 4.5 | 129 | 3.3 | 1.7 | −42.0 | 37.7 |
| К−(ФХ−ЛМ−ЭМГ) | 6.9 | 150 | 3.2 | 1.7 | −42.0 | 75.2 |
О преобладающем вкладе гидрофобных взаимодействий в комплексообразование конъюгата и обогащенных липосом (ФХ−ЛМ и ФХ−ЛМ−ЭМГ) говорят также измерения методом электрофоретического лазерного светорассеяния величины ζ‑потенциала комплексов (−42.0 мВ) (табл. 1), которая в пределах ошибки опыта оказалась равной сумме ζ-потенциалов конъюгата (−22.0 мВ) и обогащенных липосом (−19.1 мВ). Этот результат кардинально отличался от результата, полученного для комплексообразования конъюгата с липосомами ФХ (ζ-потенциал = −21.7 мВ), при котором электростатическое взаимодействие между противоположными зарядами ФХ и казеината натрия, входящего в состав конъюгата, приводило к практически двукратному уменьшению ζ‑потенциала их комплекса (−22.8 мВ) (табл. 1) по сравнению с суммарной величиной ζ-потенциалов компонентов (−43.7 мВ).
Все сформированные комплексы имели наноразмеры и сферическую форму (ρ = RG/Rh ≤ 2.0 [15]) (табл. 1). Их радиусы инерции RG были равны: 112 нм для К–ФХ; 129 нм для К–(ФХ–ЛМ) и RG = 150 нм для К–(ФХ–ЛМ−ЭМГ). При этом обнаруженная значительно более низкая степень возрастания RG комплексов К−(ФХ−ЛМ) (в 1.15 раз) и К−(ФХ−ЛМ−ЭМГ) (в 1.34 раза) относительно RG комплекса К−ФХ по сравнению с ростом их молярной массы $({{k}_{{{{M}_{w}}}}})$ приводила к практически трехкратному росту плотности (kd) частиц этих комплексов (табл. 1). Этот результат хорошо соответствовал обнаруженному некоторому уменьшению структурно-чувствительного параметра ρ (табл. 1) для этих комплексных частиц, что указывало на их менее открытую архитектуру [15].
В дополнение к представленным в табл. 1 данным в качестве примера в табл. 2 показаны 3D-модели обогащенных липосом (ФХ‒ЛМ) и их комплексов с ковалентным конъюгатом (К‒(ФХ‒ЛМ)), а также приведены их размеры, полученные с помощью АСМ. Степень увеличения размеров комплексных частиц по сравнению с чистыми липосомами, рассчитанная из усредненных значений площади поперечного сечения частиц S, аппроксимируемой кругом (S = πR2): $R_{S}^{{{\text{К}} - ({\text{ФХ}} - {\text{ЛМ}})}}$ : $R_{S}^{{{\text{ФХ}} - {\text{ЛМ}}}}$ = = 160 нм : 80 нм = 2.0), находится в соответствии с размерами, полученными с помощью статического и динамического лазерного светорассеяния (табл. 1: $R_{G}^{{{\text{К}} - ({\text{ФХ}} - {\text{ЛМ}})}}$ : $R_{h}^{{{\text{ФХ}} - {\text{ЛМ}}}}$ = 129 нм : 65 нм = 1.98).
Микровязкость липидных бислоев липосом фосфатидилхолина
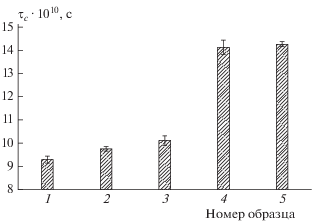
Для более глубокого понимания влияния триглицеридов ЛМ и полифенолов ЭМГ на локальную структуру свободных и связанных в комплекс с конъюгатом липосом ФХ была проведена оценка микровязкости липидных бислоев фосфолипидов с помощью метода ЭПР. Согласно полученным данным (рис. 1) обогащение липосом ФХ триглицеридами ЛМ приводило к уменьшению микровязкости их липидных бислоев, о чем свидетельствовало снижение времени вращательной корреляции, τc, зонда 16-ДСК. Этот результат может быть обусловлен увеличением доли ненасыщенных углеводородных цепочек [16] АЛК в составе бислоев липосом ФХ, что может также являться одним из доказательств встраивания в них молекул триглицеридов ЛМ. Присутствие эфирного масла гвоздики приводило лишь к небольшому повышению τc, а значит и микровязкости бислоев обогащенных липосом ФХ. Формирование комплексов обогащенных липосом ФХ с конъюгатом, напротив, сопровождалось значительным увеличением величины τС, а значит и микровязкости их бислоев, что, по всей вероятности, было связано с эффективным встраиванием гидрофобных участков конъюгата в липидные бислои, вызывающим упорядочивание в них гидрофобных цепочек липидов.
Термодинамические параметры супрамолекулярных комплексов и их растворимость в водной среде
Все изученные комплексные частицы обладали высокой растворимостью в водной среде, что было обусловлено положительными значениями второго вириального коэффициента $A_{2}^{*}$ (молярная шкала) (табл. 1), отражающими их термодинамическое сродство к водной среде [10]. При этом значительно более высокие положительные значения $A_{2}^{*}$ для комплексов (К−(ФХ−ЛМ)) и К−(ФХ−ЛМ−ЭМГ)) по сравнению с комплексом (К−ФХ) хорошо согласовывались с более высокими (практически двукратными) отрицательными значениями их ζ-потенциалов (табл. 1).
Исследование процессов ПОЛ в супрамолекулярных комплексах
Результаты исследования процессов перекисного окисления свободных и связанных в комплекс, обогащенных триглицеридами ЛМ, липосом ФХ представлены в табл. 3. Полученные данные свидетельствуют о высокой склонности липосом ФХ−ЛМ к окислительной деградации. Однако в супрамолекулярных комплексах этих липосом с конъюгатом их стабильность к окислению значительно возрастала, что проявлялось в существенно более низких значениях как индекса окисленности (D232/D215), отражающего присутствие первичных продуктов ПОЛ (гидроперекисей), так и в более длительном накапливании более низких, максимальных концентраций вторичного продукта ПОЛ, а именно, малонового диальдегида (МДА). Эфирное масло гвоздики усиливало эффект защиты липосом от окисления, что могло быть связано как с проявлением антиоксидантных свойств составляющих ЭМГ полифенолов [13], так и со значительной степенью ассоциации конъюгата в комплексе К−(ФХ−ЛМ−ЭМГ) (табл. 1), препятствующей диффузии кислорода к ненасыщенным углерод-углеродным связям инкапсулированных углеводородных цепочек липидов. Наряду с этим, как повышение микровязкости бислоев липосом (ФХ−ЛМ) в комплексе с конъюгатом, так и достаточно высокая плотность комплексов в целом также могли замедлять диффузию кислорода (табл. 1).
Таблица 3.
Период времени (в сут) достижения максимальной концентрации первичных (D232/D215) и вторичных (МДА) продуктов ПОЛ в водных растворах липосом ФХ−ЛМ и в их супрамолекулярных комплексах с конъюгатом в процессе хранения образцов в течение 21 сут при комнатной температуре на свету (pH = 7.0, ионная сила = 0.001 M, 25 °С)
| Образец | сут | D232/D215 | сут | СМДА, нмоль/мл |
|---|---|---|---|---|
| ФХ−ЛМ | 3 | 1.2 | 3 | 34.3 |
| К−(ФХ−ЛМ) | 3 | 0.2 | 17 | 20.9 |
| К−(ФХ−ЛМ−ЭМГ) | 3−21 | 0.7−0.8 | 21 | 3.7 |
ЗАКЛЮЧЕНИЕ
Проведенное исследование позволило выделить ключевые структурные (степень ассоциации, плотность, наноразмеры, заряд, микровязкость бислоев липосом) и термодинамические (термодинамическое сродство к растворителю) параметры, определяющие функциональность (водорастворимость и защитные способности по отношению к окислению и деградации инкапсулированных липидов) комплексов ковалентного конъюгата казеината натрия и мальтодекстрина с липосомами ФХ, обогащенными триглицеридами ЛМ и полифенолами ЭМГ. Знание этих параметров может способствовать целенаправленному и эффективному молекулярному дизайну биополимерных наноразмерных контейнеров для обогащения широкого ассортимента функциональных и специализированных низкожирных продуктов питания и напитков незаменимыми омега-3 ПНЖК в адекватном для оздоровительного эффекта количестве.
В этом исследовании были использованы приборы ЦКП ИБХФ РАН (центра магнитной спектроскопии и сектора лазерного светорассеяния).
Авторы выражают благодарность фирмам Lipoid GmbH (Германия) и AVEBE Group (Нидерланды) за бесплатное предоставление образцов фосфатидилхолина и мальтодекстрина для этого исследования соответственно.
Работа авторов Семёновой, Антиповой, Пальминой, Мишариной, Мартиросовой, Зеликиной, Богдановой, Чеботарёва и Гуреевой была поддержана грантом № 14-16-00102 Российского научного фонда.
Список литературы
Методические рекомендации МР 2.3.1.1915-04. Рекомендуемые уровни потребления пищевых и биологически активных веществ. М.: Издат. отдел ФЦ госсанэпиднадзора Минздрава России, 2004. С. 36.
Методические рекомендации МР 2.3.1.2432-08. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации. М.: Издат. отдел ФЦ госсанэпиднадзора Минздрава России, 2008. С. 50.
Ипатова Л.Г., Кочеткова А.А., Нечаев А.П. и др. Жировые продукты для здорового питания. Современный взгляд. М.: ДеЛи принт, 2009.
Максимов В.И. Пища и дегенеративные болезни. М.: Миклош, 2004.
Candela G.C., Bermejo L.L. M., Loria K.V. // Nutr. Hosp. 2011. V. 26. № 2. P. 323.
ГОСТ P 52349-2005 Продукты пищевые. Продукты пищевые функциональные. Термины и определения.
Терешкина К.Б., Степанов А.С., Синицын Д.О. и др. // Хим. физика. 2014. Т. 33. № 7. С. 64.
Шуршина А.С., Галина А.Р., Кулиш Е.И. // Хим. физика. 2016. Т. 35. № 11. С. 68.
Кулиш Е.И., Шуршина А.С., Колесов С.В. // Хим. физика. 2014. Т. 33. № 8. С. 76.
Semenova M.G., Dickinson E. Biopolymers in Food Colloids: Thermodynamics and Molecular Interactions. Leiden, Boston: Brill, 2010. P. 356.
McClements D.J. Nanoparticle- and Microparticle-based delivery systems. Encapsulation, Protection and Release of Active Compounds. London, New York: Taylor & Francis Group, 2015. P. 548.
Grigorovich N.V., Moiseenko D.V., Antipova A.S. et al. // Food Funct. 2012. № 3. P. 283.
Misharina T.A., Alinkina E.S., Terenina M.B. et al. // Appl. Biochem. Micro. 2015. V. 51. № 4. P. 455.
Semenova M.G., Zelikina D.V., Antipova A.S. et al. // Food Hydrocoll. 2016. V. 52. P. 144.
Burchard W. Light scattering technigue // Physical techniques for the study of food biopolymers / Ross-Murphy S.B. Glasgow: Blackie, 1994. P. 151.
Wassall S.R., Caffrey M., Cherezov V. et al. // Chem. Phys. Lipids. 2004. V. 132. P. 79.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика