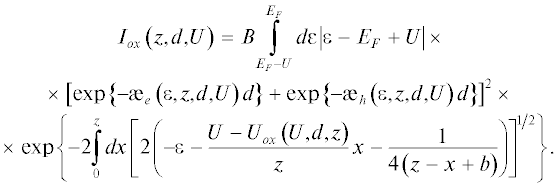Химическая физика, 2019, T. 38, № 6, стр. 27-34
Изменение электронной структуры оксидной пленки на поверхности титанового покрытия в процессе взаимодействия с кислородом
С. Ю. Сарвадий 1, *, В. А. Харитонов 1, Н. В. Дохликова 1, М. В. Гришин 1, Б. Р. Шуб 1
1 Институт химической физики им. Н.Н. Семёнова Российской академии наук
Москва, Россия
* E-mail: sarvadiy15@mail.ru
Поступила в редакцию 28.12.2018
После доработки 28.12.2018
Принята к публикации 21.01.2019
Аннотация
В работе определены с высоким пространственным разрешением особенности морфологии и электронной структуры оксидного слоя титанового покрытия, синтезированного на поверхности высокоупорядоченного пиролитического графита. Установлено, что взаимодействие с кислородом приводит к образованию оксида TiOx, где 1.75 < x < 2. Показана возможность синтеза оксидного слоя с заданным значением ширины запрещенной зоны на поверхности титанового покрытия путем подбора продолжительности и температуры его прокаливания в кислороде.
ВВЕДЕНИЕ
Физико-химические свойства каталитической системы, состоящей из наночастиц, нанесенных на покрытую слоем оксида проводящую подложку, можно контролировать путем изменения структуры оксидного слоя [1, 2]. При таком подходе особое значение приобретает достоверная информация о химическом составе, морфологии и электронной структуре поверхностной оксидной пленки. Толщина оксидного слоя, его диэлектрическая проницаемость и работа выхода электрона для материала подложки определяют эффективность переноса заряда между подложкой и наночастицами и, соответственно, влияют на механизмы протекающих химических реакций. Сравнительно небольшая работа выхода электрона для чистого титана (3.95 эВ) [3] и малая ширина запрещенной зоны (<0.1 эВ) для ряда его оксидов [3–5] в совокупности могут обеспечить условия для эффективного взаимодействия наночастиц с металлом подложки даже при достаточно большой толщине разделяющего их оксидного слоя. Это делает титан перспективным материалом с позиции создания модельных каталитических систем. Данная работа посвящена определению методами атомно-силовой и сканирующей туннельной микроскопии (АСМ и СТМ) особенностей образования и пространственного распределения оксидного слоя, образующегося на поверхности титанового покрытия в результате его взаимодействия с кислородом при различных температурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Титановые покрытия синтезировались методом терморезистивного напыления в вакууме: навеску титана помещали в танталовый испаритель, после чего камеру установки откачивали до давления остаточных газов Р = 10–6 Торр, а испаритель разогревали до температуры, близкой к температуре плавления навески титана, пропуская через него переменный ток. Пластинку с размерами 7 мм × 7 мм × 1 мм высокоупорядоченного пиролитического графита (ВОПГ) на 15–20 с помещали в поток испаряющегося вещества. Таким способом было синтезировано два образца. Первый из них был подвергнут прокаливанию в кислороде. Второй образец был извлечен из установки и оставался на воздухе при комнатной температуре в течение 30 сут.
Для прокаливания образца в кислороде в установку напускали О2 до давления ${{P}_{{{{{\text{O}}}_{2}}}}}$ ~ 100 Торр и в его атмосфере выдерживали разогретый до температуры Т = 500 °С образец. Нагрев образца осуществлялся за счет резистивного нагревателя, а температура определялась с помощью хромель-алюмелевой термопары. Прокаливание образца в кислороде происходило в два этапа. Продолжительность первого и второго этапа составила 4 и 9 ч соответственно. Дополнительные данные об элементном составе синтезированных образцов были получены методом оже-спектроскопии.
Предварительное исследование морфологии синтезированного покрытия проводилось методом АСМ, а более детально структура титанового покрытия была изучена с применением методов СТМ и сканирующей туннельной спектроскопии (СТС), которые позволили определить морфологию и локальную электронную структуру полученной титановой пленки. В работе использовались атомно-силовой микроскоп Solver (NT-MDT, Россия) и установка, которая состояла из сверхвысоковакуумного сканирующего туннельного микроскопа (СТМ “Оmicron”, Германия) и оже-спектрометра СМА-100 (“Omicron”, Германия). Давление остаточных газов в камере СТМ не превышало 2 ⋅ 10–10 Торр.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
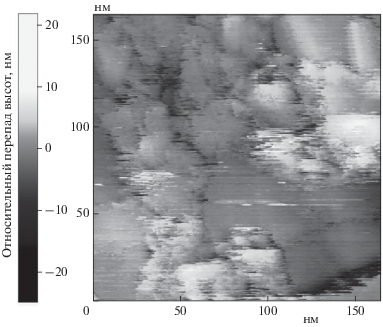
Первичные данные о морфологии поверхности синтезированных образцов получены с помощью атомно-силовой микроскопии. Обнаружено, что покрытие на обоих образцах представляет собой сплошную пленку из плотно соприкасающихся друг с другом зерен титана с характерными размерами 30–50 нм (см. рис. 1). Проведенные эксперименты показали, что увеличение в 3–4 раза времени экспозиции образца в потоке испаряющегося вещества не приводит к увеличению размеров зерен.
Рис. 1.
а – топография поверхности титанового покрытия, полученная методом АСМ; б – профиль поверхности вдоль линии разреза, указанной на рис. 1а.
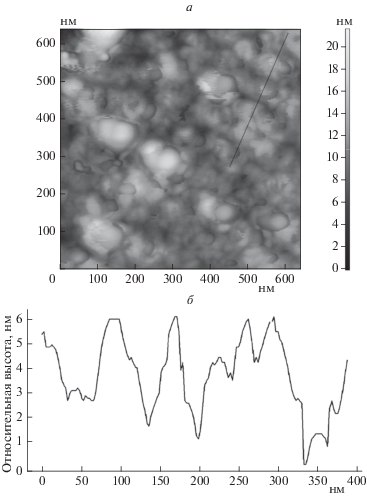
Определение элементного состава поверхности свежеприготовленных образцов методом оже-спектроскопии показало наличие углерода, титана и кислорода. Для сравнения были получены спектры для пленки оксида TiO2 стехиометрического состава, синтезированного на поверхности массивной титановой пластины. Как видно из рис. 2, положения пиков титана в обоих случаях совпадают.
Рис. 2.
Оже-спектры образцов: 1 – массивная пластина Ti с пленкой стехиометрического TiO2; 2 – навеска Ti, помещаемая в испаритель; 3 – образец Ti/ВОПГ сразу после синтеза.
Прокаленный образец
После 4 ч прокаливания в кислороде при Т = = 500 °С образец титанового покрытия был перенесен в камеру сканирующего туннельного микроскопа, где с помощью топографических и спектроскопических измерений были определены особенности морфологии и электронного строения его поверхности. Известно [6], что наноконтакту, образованному металлическим образцом и проводящей иглой, соответствует S-образная зависимость туннельного тока СТМ от напряжения (вольт-амперная характеристика, (ВАХ)). Окисление поверхности образца может приводить к существенному уменьшению плотности состояний металла в окрестности уровня Ферми, что ведет к появлению на S-образной кривой участка с нулевым током, протяженность которого с точностью до размерного множителя соответствует ширине запрещенной зоны материала под иглой СТМ [7–10]. Таким образом, форма ВАХ может служить индикатором, сигнализирующим о вариациях локального химического состава поверхности.
В результате СТМ-измерений подтвердились выводы о зернистой структуре титанового слоя, сделанные на основе данных АСМ: покрытие представляет собой пленку из плотно соприкасающихся друг с другом зерен титана с характерным латеральным размером порядка 30 нм и высотой 3–6 нм (см. рис. 3). При этом было выявлено наличие как более мелких (до 5 нм), так и более крупных наночастиц титана. Большинство кривых ВАХ туннельного наноконтакта, измеренных в разных точках поверхности образца, имеют участок нулевого тока (запрещенную зону) протяженностью 0.6–0.8 В. Значение ширины запрещенной зоны, Eg, для массивных образцов некоторых оксидов титана приведены в табл. 1.
Очевидно, что не представляется возможным диагностировать наличие оксидов TiO и Ti2O3 на поверхности образца из-за их слишком узкой запрещенной зоны. При этом можно утверждать, что на поверхности зерен титана не происходит формирования оксидного слоя TiO2, за исключением некоторых отдельных точек. Примечательно, что ширина запрещенной зоны TiC составляет 0.4 эВ [12], и это также не соответствует измеренным значениям. Таким образом, измеренное значение ширины запрещенной зоны на поверхности титанового покрытия не соответствует ни одному оксиду титана стехиометрического состава.
Наблюдаемое несоответствие может иметь два возможных объяснения. Первое состоит в том, что на поверхности титанового покрытия образуется соединение, отличное по своей стехиометрии от соединений, представленных в табл. 1. Действительно, литературные данные [13] говорят о том, что между Ti2O3 и TiO2 существует гомологичная группа фаз TinO2n – 1, где n = 4–9 (фазы Магнелли), физические свойства которых могут сильно различаться. Например, в статьях [14, 15] было показано появление запрещенной зоны шириной 0.25–0.29 эВ при низких температурах для фазы Ti4O7, которая при комнатной температуре является проводящей. Однако возможно и другое объяснение: на поверхности металлического титана образуется тонкий слой стехиометрического TiO2, электронная структура которого искажается за счет взаимодействия с металлическим титаном, в результате чего наблюдаемая ширина запрещенной зоны может оказаться меньше реальной.
Для определения толщины стехиометрического TiO2, необходимой для искажения ширины запрещенной зоны, был проведен ее расчет. Согласно работе [16], зависимость тока Iox электронов, туннелирующих через слой оксида толщиной d и вакуумный зазор шириной z, от напряжения смещения U можно записать следующим образом:
Здесь EF – уровень Ферми электрода (вольфрамового острия), Uox – падение напряжения в оксидном слое толщиной d и диэлектрической проницаемостью χ, а ${{\unicode{230} }_{e}}$ и ${{\unicode{230} }_{h}}$ – туннельные квазиимпульсы электрона и дырки. Константа b получена из результатов теоретической обработки туннельного тока в вакууме, b ≈ 5. Расчетная процедура состоит в минимизации квадратичного отклонения теоретической кривой от экспериментальной по величинам z и d. Поскольку коэффициент B слабо (неэкспоненциально) зависит от искомых параметров и не может быть точно рассчитан, то для минимизации брались относительные величины тока Iox(z, d, U)/Iox(z, d, Umax), где Umax = 1.6 В. Расчет проводился в предположении, что образующийся на поверхности титана оксид является стехиометрическим TiO2 с шириной запрещенной зоны Eg = 3.2 эВ и χ = 100 [17, 18]. Для расчетов использовался программный пакет Wolfram Mathematica 11. Результаты минимизации показали, что максимальное соответствие расчетной и экспериментальной кривых достигается при z = 3.9 Å, d = = 4.5 Å. Известно, что параметры элементарной ячейки TiO2–рутил a = 4.60 Å, c = 2.96 Å [19], а для ячейки TiO2–анатаз a = 3.78 Å, c = 9.50 Å [20], что сравнимо с полученным значением толщины оксидного слоя. То есть рассчитанная толщина TiO2 такова, что при меньших ее значениях мы не можем говорить о какой-то определенной кристаллической структуре – в ней просто будет отсутствовать ближний порядок, а при больших значениях будет увеличиваться наблюдаемая ширина запрещенной зоны. Из литературы [21] известно, что кислород активно растворяется в титане и хорошо проникает через образующийся оксидный слой. Таким образом, существование столь тонкого оксидного слоя с идеальной стехиометрией и четкой границей раздела фаз “металл–оксид” весьма сомнительно. Полученные данные и результаты расчетов позволяют сделать вывод о том, что поверхность зерен титана после 4 ч прокаливания в кислороде действительно покрыта слоем нестехиометрического оксида с шириной запрещенной зоны 0.6–0.8 эВ. Поскольку фаза Ti4O7 является проводником при комнатных температурах [14], можно сказать, что состав образующегося оксида с большой вероятностью соответствует формуле TiOx, где 1.75 < x < 2.Исследованный образец был снова подвергнут прокаливанию в кислороде при Т = 500 °С. На втором этапе прокаливание длилось 9 ч, после чего снова методами СТМ/СТС были определены характеристики его поверхности. Согласно результатам СТМ/СТС-измерений прокаливание заметным образом не повлияло на размер структурных элементов титанового покрытия – их средний латеральный размер остался порядка 30 нм. Плотность заполнения поверхности также не изменилась. В то же время ширина запрещенной зоны увеличилась – в большинстве точек измеренное значение ширины запрещенной зоны теперь составило 1.5–1.7 эВ (см. рис. 4в). По всей видимости, ширина запрещенной зоны образующейся оксидной пленки напрямую зависит от количества кислорода, растворяющегося в титане. Во многих местах можно было наблюдать запрещенную зону, ширина которой соответствует литературным данным для диоксида титана: 3.0–3.2 эВ. Таким образом, после 13 ч (суммарно) прокаливания в кислороде можно говорить об образовании диоксида титана на поверхности синтезированного покрытия. Наличие участков, в которых ширина запрещенной зоны превышает это значение и доходит до 4 эВ, может быть связано с различными процессами заряжения в объеме оксида, по своей сути близкими к кулоновской блокаде. Примечательно, что такие участки с шириной запрещенной зоны ~4 эВ наблюдались и в экспериментах с покрытием из диоксида титана, полученным на поверхности титановой пластины по методу, описанному в работе [22].
Рис. 4.
Топография поверхности (а), карта распределения оксидной фазы (б) и гистограмма частотного распределия ширины запрещенной зоны (в), полученные для образца, прокаленного в течение 13 ч в О2.
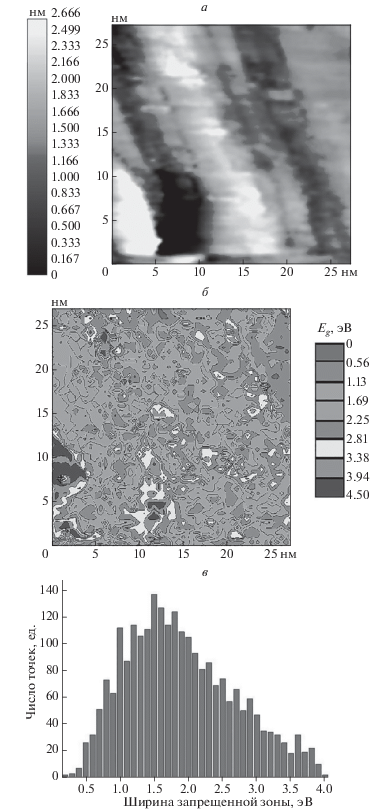
Измерение ширины запрещенной зоны в различных точках образца позволило составить карту распределения оксидной фазы по поверхности. Из рис. 4б видно, что различные значения ширины запрещенной зоны не разбросаны хаотично, а образуют области, расположение которых коррелирует с топографией образца.
Образец, окислявшийся на воздухе
Как уже упоминалось, второй образец титанового покрытия оставался на воздухе при комнатной температуре в течение 30 сут, после чего к нему был применен тот же комплекс методов исследования, что и к первому образцу. Топография синтезированного образца ничем не отличалась от топографии образца, подвергнутого прокаливанию в кислороде.
Измерения протяженности участка нулевой проводимости кривых ВАХ показали, что большая часть поверхности синтезированного покрытия демонстрирует запрещенную зону шириной ~0.8 эВ (см. рис. 5в). То есть окисление образца при комнатной температуре на открытом воздухе в течение 30 сут дало примерно такой же результат, как и прокаливание в кислороде при Т = 500 °С в течение 4 ч. Известно [23], что при окислении титана кислородом атмосферы в течение месяца на его поверхности образуется оксидная пленка толщиной порядка 35 Å. Эти данные также косвенно свидетельствуют о том, что на поверхности образуется не тонкая пленка стехиометрического оксида TiO2, а более толстый слой нестехиометрического оксида с меньшей шириной запрещенной зоны.
Рис. 5.
Топография поверхности (а), карта распределения оксидной фазы (б) и гистограмма частотного распределия ширины запрещенной зоны (в), полученные для образца, окислявшегося 30 сут на воздухе.
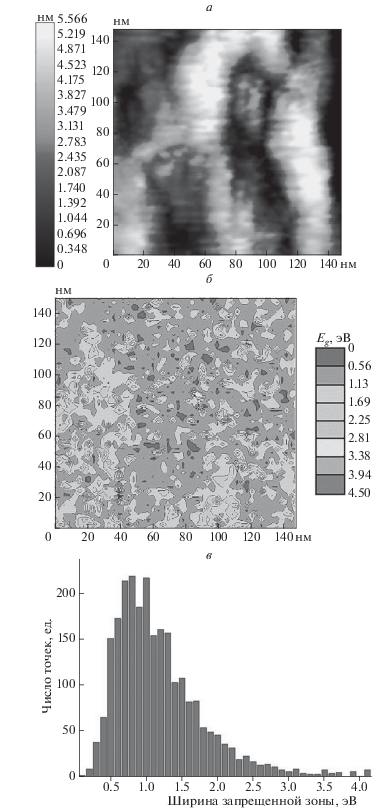
Измерения ширины запрещенной зоны в различных точках поверхности образца позволили составить карту пространственного распределения оксидной фазы по поверхности титанового покрытия (см. рис. 5б). Как и в случае прокаленного образца, расположение областей, образованных точками с близкими значениями ширины запрещенной зоны, коррелирует с особенностями топографии данного участка поверхности. При этом стоит отметить, что в целом распределение оксидной фазы на поверхности в данном случае является более однородным, чем в случае прокаленного образца. Сравнивая гистограммы частотного распределения различных значений ширины запрещенной зоны – рис. 4в и 5в – можно отметить, что оба распределения являются унимодальными. При окислении на воздухе максимум распределения получается достаточно узким, а при прокаливании он заметно уширяется и сдвигается в сторону больших значений ширины запрещенной зоны. Поскольку в ходе эксперимента изменялись только температура и продолжительность прокаливания образцов в кислороде, можно утверждать, что варьирование этих двух параметров позволяет создавать титанооксидные пленочные покрытия с заданным значением ширины запрещенной зоны.
ЗАКЛЮЧЕНИЕ
В результате проведенных исследований было установлено, что титановое покрытие, нанесенное на поверхность высокоупорядоченного пиролитического графита методом терморезистивного напыления, представляет собой пленку из плотно соприкасающихся друг с другом зерен титана с характерными латеральными размерами ~30 нм и высотой 3–6 нм. Размеры зерна не зависят от длительности выдержки образца в потоке испаряющегося титана. Прокаливание образцов титанового покрытия в кислороде (${{P}_{{{{{\text{O}}}_{2}}}}}$ ~ 100 Торр) при Т = 500 °С также не приводит к изменению размера зерен. Было показано, что при взаимодействии с кислородом на поверхности титана происходит образование нестехиометрического оксида TiOx, где 1.75 < x < 2. С увеличением продолжительности прокаливания образца в кислороде наблюдается постепенное увеличение ширины запрещенной зоны оксида, образующегося на его поверхности. Изменение температуры и продолжительности прокаливания в кислороде позволяет создавать титанооксидные покрытия с заданным значением ширины запрещенной зоны.
Работа выполнена в рамках государственного задания № 0082-2014-0011 “Нанохимия” (АААА-А17-117111600093-8) и при финансовой поддержке грантом Российского фонда фундаментальных исследований № 18-33-00020.
Список литературы
Freund H.-J. // Top. Catal. 2008. V. 48. P. 137.
Freund H.-J. // J. Amer. Chem. Soc. 2016. V. 138. P. 8985.
Ern V., Switendick A.C. // Phys. Rev. 1965. V. 137. P. 1927.
Henrich V.E., Cox P.A. The Surface Science of Metal Oxides. Cambridge University Press, 1996.
Reyers-Coronado D., Gattorno G.R., Pesqueira M.E.E. et al. // Nanotecnology. 2008. V. 19. P. 145605.
Guntherodt H.-J., Wiesendanger R. Scanning Tunnelling Microscopy I. General Principles and Applications to Clean and Absorbate-Covered Surfaces. Berlin: Springer-Verlag, 1994.
Binnig G., Rohrer H., Gerber C., Weibel E. // Appl. Phys. Lett. 1982. V. 40. P. 178.
Meyer E., Hug H.J., Bennewitz R. Scanning Probe Microscopy. Berlin: Springer, 2004.
Hamers R.J., Wang Y. // J. Chem. Rev. 1996. V. 96. P. 1261.
Hamers R.J., Tromp R.M., Demuth J.E. // Phys. Rev. Lett. 1986. V. 56. P. 1972.
Choudhary B., Dey M., Choudhary A. // Intern. Nano Lett. 2013. V. 3 P. 25.
Naitabdi A., Ono L.K., Cuenya B.R. // Appl. Phys. Lett. 2006. V. 89. P. 043101.
Bartholomew R.F., Frankl D.R. // Phys. Rev. 1969. V. 187. P. 828.
Abbate M., Potze R., Sawatzky G.A. et al. // Solid State Commun. 1995. V. 94. P. 465.
Leonov I., Yaresko A.N., Antonov V.N. et al. // J. Phys.: Condens. Matter. 2006. V. 18. P. 10955.
Гатин А.К., Гришин М.В., Кирсанкин А.А. и др. // Рос. нанотехнол. 2013. Т. 8. № 9–10. С. 51.
Morikawa T., Asahi R., Ohwaki T. et al. // Jpn. J. Appl. Phys. 2001. V. 40. P. L561.
Birks J.B. Modern Dielectric Materials. London: Heywood & Company, 1960.
Mashimo T., Bagum R., Ogata Y. et al. // Cryst. Growth Des. 2017. V. 17. P. 1460.
Treacy J.P.W., Hussain H., Torrelles X. et al. // Phys. Rev. B. 2017. V. 95. P. 075416.
Kubaschewski O., Hopkins B.E. Oxidation of Metals and Alloys. 2nd ed. London: Butterworths, 1962.
Chae S.Y., Park M.K., Lee S.K. et al. // Chem. Mater. 2003. V. 15. P. 3326.
Hass G., Bradford A.P. // J. Opt. Soc. Amer. 1957. V. 47. P. 125.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика