Химическая физика, 2020, T. 39, № 6, стр. 18-23
Реконструкция спектров флуоресценции бисретиноидов и продуктов их фотоокисления и фотодеградации из клеток ретинального пигментного эпителия глаза человека
М. А. Яковлева 1, *, А. Ш. Радченко 1, А. А. Костюков 1, П. М. Арбуханова 2, С. А. Борзенок 2, В. А. Кузьмин 1, Т. Б. Фельдман 1, 3, М. А. Островский 1, 3
1 Институт биохимической физики им. Н.М. Эмануэля Российской Академии наук
Москва, Россия
2 Межотраслевой научно-технический комплекс “Микрохирургия глаза” им. акад. С.Н. Фёдорова
Министерства здравоохранения Российской Федерации
Москва, Россия
3 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: lina.invers@gmail.com
Поступила в редакцию 03.06.2019
После доработки 03.06.2019
Принята к публикации 20.06.2019
Аннотация
Проведен глобальный анализ кинетики затухания флуоресценции хлороформного экстракта липофусциновых гранул из клеток ретинального пигментного эпителия кадаверных глаз человека. Кинетический анализ позволил восстановить индивидуальные флуоресцентные свойства четырех групп флуорофоров, относящихся к бисретиноидам и продуктам их фотоокисления и фотодеградации. Установлена корреляция между характерными временами жизни флуоресценции и спектральными характеристиками обозначенных групп флуорофоров при помощи усредненных спектральных и кинетических характеристик хлороформного экстракта.
ВВЕДЕНИЕ
Липофусциновые гранулы (ЛГ или “пигмент старости”) образуются в клетках ретинального пигментного эпителия (РПЭ) глаза в результате неполной лизосомальной деградации фагоцитированных обломков наружных сегментов фоторецепторных клеток [1]. Долгое время ЛГ считались инертным побочным продуктом жизнедеятельности клетки РПЭ: они накапливаются в клетках РПЭ в процессе старения [2, 3]. Однако позже была показана способность ЛГ генерировать при действии видимого света активные формы кислорода [4–6]. Также была выявлена явная корреляция между накоплением ЛГ в клетках РПЭ и дегенеративными заболеваниями сетчатки [7–10].
Липофусциновые гранулы поглощают свет в видимой, в основном коротковолновой (фиолетово-синей), области спектра и обладают ярко выраженной флуоресценцией. Флуоресцентные свойства ЛГ обусловлены преимущественно наличием в них бисретиноидов и продуктов их фотоокисления и фотодеградации. Бисретиноиды являются конъюгатами полностью-транс-ретиналя (all-trans-retinal (ATR)) различной природы. Хорошо изученным является только один флуорофор А2Е (N-ретинил-N-ретинилиденэтаноламин) – продукт взаимодействия двух молекул полностью-транс-ретиналя с аминогруппой одного из липидов фоторецепторной мембраны – фосфатидилэтаноламина [11, 12]. Помимо А2Е, в ЛГ содержится еще около двадцати флуорофоров, являющихся производными ретиналя [13].
На основе флуоресцентных свойств ЛГ разработан и широко внедрен в офтальмологическую практику неинвазивный диагностический метод аутофлуоресценции (АФ) глазного дна. Он позволяет оценить состояние клеток РПЭ у пациентов, избрать тактику лечения и сделать прогноз в отношении развития нейродегенеративного заболевания [9, 14].
В настоящее время предпринимаются попытки усовершенствования метода АФ глазного дна для извлечения дополнительной информации. Крайне перспективным является метод детектирования времени жизни флуоресценции при возбуждении ее на определенных длинах волн (Fluorescence Lifetime Imaging Microscopy (FLIM) [15, 16]). В экспериментах in vivo было показано, что результаты микроскопии методом FLIM для нормы и в случае возрастной макулярной дегенерации (ВМД) различаются [17]. Следует отметить, что до сих пор неизвестно, в результате чего возникает разница в характерных временах жизни флуоресценции для нормы и патологии.
Недавно нами было показано, что при ВМД содержание окисленных форм бисретиноидов в ЛГ выше по сравнению с нормой [18, 19]. Возможно, что именно этот феномен и является причиной возникновения разницы в значениях характерных времен жизни флуоресценции между нормой и патологией при использовании метода FLIM. Таким образом, изучение состава и спектральных характеристик флуорофоров, их неокисленных и окисленных форм, содержащихся в ЛГ клеток РПЭ, является важным как для понимания природы, так и для интерпретации картины АФ глазного дна, меняющейся в ходе старения и на различных стадиях патологического процесса.
В настоящей работе проведен глобальный анализ массива данных кинетик затухания флуоресценции хлороформного экстракта ЛГ из клеток РПЭ кадаверных глаз человека без визуализированных признаков патологии. При помощи усредненных спектральных и кинетических характеристик отдельных компонент, вносящих вклад в общую флуоресценцию хлороформного экстракта, выявлена связь между временами жизни флуоресценции и спектральными характеристиками отдельных групп флуорофоров, бисретиноидов и продуктов их фотоокисления и фотодеградации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использованы реактивы компаний Sigma-Aldrich, Fluka, Компонент-реактив. Для высокоэффективной жидкостной хроматографии (ВЭЖХ) использовали растворители компаний Sigma-Aldrich и Fluka хроматографической чистоты.
Материал. Кадаверные глаза человека были получены Глазным тканевым банком МНТК “Микрохирургия глаза” им. акад. С.Н. Фёдорова от доноров из танатологических отделений московского бюро судебно-медицинской экспертизы на основании действующего договора между московским бюро судебно-медицинской экспертизы и МНТК “Микрохирургия глаза” им. акад. С.Н. Фёдорова, а также договора о научном сотрудничестве между ИБХФ РАН и МНТК “Микрохирургия глаза” им. акад. С.Н. Фёдорова [18]. Анализ и скрининговый отбор донорского материала проводили по клиническим, половым и возрастным признакам. Исследование образцов проводили при приглушенном освещении.
Выделение липофусциновых гранул и получение хлороформных экстрактов бисретиноидов и их производных. ЛГ выделены из РПЭ 50 кадаверных глаз доноров возраста 17–78 лет без признаков патологии согласно методике, описанной в работе [20], и суспендированы в растворе 0.1 М калий-фосфатного буфера, рН 7.3. Бисретиноиды и их производные экстрагировали из ЛГ по методу Фолча смесью хлороформ–метанол (2 : 1) [21].
ВЭЖХ-анализ. Хроматографическое разделение бисретиноидов и продуктов их фотоокисления и фотодеградации в хлороформных экстрактах ЛГ из РПЭ проводили на хроматографе фирмы “Knauer” (Германия) с колонкой Диасфер 120 С18 (4 × 250 мм, размер сорбента 5 мкм). Разделение осуществляли путем линейного градиентного элюирования в системе: от 80% ацетонитрила + 20% воды (+ 0.05% трифторуксусной кислоты) до 100% ацетонитрила за 20 мин; скорость потока 1.5 мл/мин. Продукты хроматографического разделения измеряли при помощи фотометрического детектора К-2501 фирмы “Knauer” (Германия), а также флуориметрического детектора RF-10Axl фирмы “Shimadzu” (Япония).
Измерение спектров флуоресценции. Спектры флуоресценции регистрировали на спектрофлуориметре RF-5301PC (“Shimadzu”, Япония).
Синтез А2Е. В качестве стандарта использовали синтезированный флуорофор А2Е. Бисретиноид был синтезирован и очищен согласно методу, описанному в работе [11]. Чистоту А2Е контролировали методом ВЭЖХ на хроматографе фирмы “Knauer” (Германия).
Регистрация кинетики затухания флуоресценции. Измерения времени жизни флуоресценции хлороформного экстракта ЛГ выполняли методом подсчета коррелированных по времени фотонов с использованием спектрометра FluoTime 300 (“PicoQuant, GmbH”, Германия) в Центре ИБХФ РАН “Новые материалы и технологии”. Возбуждение флуоресценции проводили диодными лазерами LDH-P-C-450 (длина волны – 450 нм, длительность импульса – 30 пс), LDH-PC-485 (длина волны – 488 нм, длительность импульса – 107 пс), LDH-P-C-375 (длина волны – 375 нм, длительность импульса – 54 пс), и Solea supercontinuum (длины волн: 488, 570 и 600 нм, длительность импульса – 15 пс). Сигнал флуоресценции регистрировали в диапазоне длин волн 420–700 нм. Кинетические кривые затухания флуоресценции обрабатывали в рамках трех- и четырехэкспоненциальной моделей. Время жизни флуоресценции (ВЖФ) и вклад отдельных групп флуорофоров в детектируемые кривые затухания флуоресценции рассчитывали по следующей формуле с учетом функции внутреннего ответа лазера (IRF):
где i – номер компоненты, A – амплитуда. Значения Ai и τi использовали для определения вклада (Qi) группы флуорофоров в общую интенсивность флуоресценции хлороформного экстракта ЛГ по формуле: Qi = Aiτi/ΣjAjτj,
где j – общее число исследованных компонент.
Для проведения эксперимента образцы предварительно упаривали с помощью вакуумной системы (Vacuubrand MZ 2C NT + AK + M + D, Германия), а потом растворяли в 1 мл хлороформа. Анализ данных проведен с использованием программного обеспечения FluoFit (“PicoQuant”, Германия).
Глобальный анализ кинетики затухания флуоресценции. Для выявления флуоресцентных характеристик отдельных групп флуорофоров с различными временами жизни флуоресценции (неокисленные и окисленные бисретиноиды) был проведен глобальный анализ массива данных при помощи программного обеспечения FluoFit (FluoFit Manual, PicoQuant GmbH, 2017). Кинетические кривые гибели флуоресценции регистрировали последовательно с шагом 10 нм в выбранном диапазоне длин волн с использованием одной длины волны возбуждения флуоресценции. Для каждого набора данных построены спектры флуоресценции. Каждая точка в спектре соответствовала интегральной интенсивности одной из трех (четырех) составляющих (τ1, τ2, τ3 (τ4)), полученных из одной кинетической кривой на взятой длине волны.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены спектральные характеристики хлороформного экстракта ЛГ из РПЭ кадаверных глаз доноров возраста 17–78 лет. Прежде всего следует отметить, что флуоресцентные характеристики отдельных бисретиноидов и продуктов их фотоокисления и фотодеградации не отражают прямой зависимости между их относительным содержанием, определяемым по поглощению на длине волны 430 нм (рис. 1а), и флуоресцентными свойствами (рис. 1б). Так, относительное содержание основного бисретиноида А2Е при ВЭЖХ-анализе по поглощению (рис. 1а) является наиболее существенным по сравнению с остальными продуктами на хроматограмме. Однако интенсивность флуоресценции этого бисретиноида (рис. 1б) наоборот, практически не регистрируется на длинах волн, используемых для регистрации АФ (500–700 нм). Результаты ВЭЖХ-анализа хорошо коррелируют с ранее полученными нами данными [18, 19]. Таким образом, можно предположить, что вклад А2Е в общую флуоресценцию (рис. 1в) также является несущественным.
Рис. 1.
Спектральный анализ хлороформного экстракта липофусциновых гранул из РПЭ кадаверных глаз человека: а – ВЭЖХ-анализ по поглощению на длине волны 430 нм; б – ВЭЖХ-анализ по флуоресценции. Возбуждение флуоресценции светом с длиной волны 488 нм, детектирование эмиссии при длинах волн 560 (б) и 600 нм (г); в – спектр флуоресценции хлороформного экстракта. Возбуждение флуоресценции светом с длиной волны 488 нм.
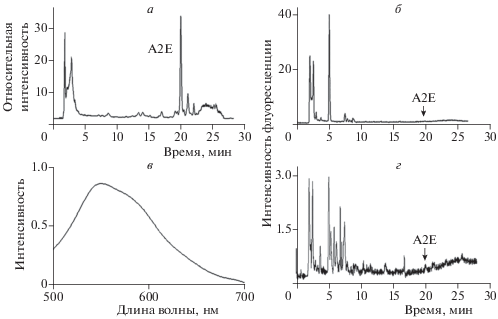
Ранее нами с помощью метода счета коррелированных по времени фотонов были получены кинетические зависимости затухания флуоресценции как самого хлороформного экстракта ЛГ, так и его отдельных фракций, полученных при ВЭЖХ-анализе экстракта [22]. Сделано предположение, что продукты фотоокисления и фотодеградации бисретиноидов характеризуются наибольшими временами жизни флуоресценции (7.2 ± 0.3 нс). Для более точного определения вклада отдельных групп флуорофоров в суммарный спектр флуоресценции и их спектральные характеристики мы провели глобальный анализ кинетики затухания флуоресценции хлороформного экстракта. Для проведения такого анализа кинетические кривые затухания флуоресценции, полученные методом подсчета коррелированных по времени фотонов, были аппроксимированы тремя экспонентами модельных кривых (табл. 1).
Таблица 1.
Глобальный анализ кинетических кривых затухания флуоресценции хлороформного экстракта ЛГ из РПЭ кадаверных глаз человека при разных длинах волн возбуждения флуоресценции
| Длина волны возбуждения, нм |
Спектральная область детектирования, нм | τ1, нс | Q1, % | max нм* | τ2, нс | Q2, % | max нм* | τ3, нс | Q3, % | max нм* | χ2 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 375 | 420–700 | 0.2 | 15 | 560 | 1.6 | 53 | 560 | 6.6 | 32 | 530 | 0.903 |
| 405 | 420–700 | 0.1 | 14 | 570 | 1.4 | 49 | 570 | 5.3 | 37 | 540 | 0.927 |
| 488 | 490–700 | 0.2 | 19 | 595 | 1.5 | 49 | 595 | 5.0 | 32 | 575 | 0.862 |
| 570 | 580–700 | 0.3 | 19 | 620 | 1.7 | 47 | 620 | 5.1 | 34 | 610 | 0.917 |
| 600 | 610–700 | 0.2 | 17 | 640 | 1.5 | 44 | 640 | 4.6 | 39 | 630 | 0.978 |
Несмотря на то, что кинетические кривые хорошо аппроксимируются тремя экспонентами (табл. 1), можно видеть, что третья составляющая τ3, которая, как мы предполагаем, является характерным временем затухания флуоресценции продуктов фотоокисления и фотодеградации А2Е [22], уменьшается с увеличением длины волны возбуждения флуоресценции. Можно предположить, что τ3 является усредненным характерным временем затухания флуоресценции двух групп флуорофоров, близких по своим химико-физическим свойствам.
Для проверки данного предположения кинетические кривые затухания флуоресценции были аппроксимированы четырьмя экспонентами модельных кривых (табл. 2). Из таблицы видно, что компоненты τ1 и τ2 практически не изменились, а компонента τ3 распалась на две составляющие: в среднем 3 и 8.1 нс. Таким образом, можно предположить, что фотоокисленные продукты характеризуются двумя группами флуорофоров. На рис. 2 представлены реконструированные спектры флуоресценции для трех- и четырехэкспоненциального приближения (а и б соответственно).
Таблица 2.
Глобальный анализ кинетических кривых затухания флуоресценции хлороформного экстракта ЛГ из РПЭ кадаверных глаз человека при разных длинах волн возбуждения флуоресценции
| Длина волны возбуждения, нм |
Спектральная область детектирования, нм |
τ1, нс | Q1, % | max нм* | τ2, нс | Q2, % | max нм* | τ3, нс | Q3, % | max нм* | τ4, нс | Q4, % | max, нм* | χ2 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 375 | 420–700 | 0.18 | 9.6 | 560 | 1.0 | 30.6 | 560 | 3.0 | 43.2 | 560 | 9.2 | 16.5 | 530 | 0.903 |
| 488 | 490–700 | 0.2 | 17.6 | 595 | 1.2 | 31.7 | 595 | 3.0 | 37.6 | 595 | 7.0 | 12.9 | 575 | 0.862 |
Рис. 2.
Спектры флуоресценции отдельных групп флуорофоров хлороформного экстракта ЛГ, полученные в результате глобального анализа массива данных кинетических кривых затухания флуоресценции при ее возбуждении на длинах волн 375 и 488 нм в трех- и четырехэкспоненциальном приближении (а и б соответственно). Группа 1 (спектр 1) характеризуется временем τ1, группа 2 (спектр 2) – τ2, группа 3 (спектр 3) – τ3, группа 4 (спектр 4) – τ4 (см. табл. 1 и 2). Возбуждение флуоресценции светом с длиной волны 375 (а, в) и 488 нм (б, г). По оси ординат отложена интенсивность флуоресценции, обозначенная как количество фотонов, зарегистрированных для данного компонента в кинетике распада флуоресценции.
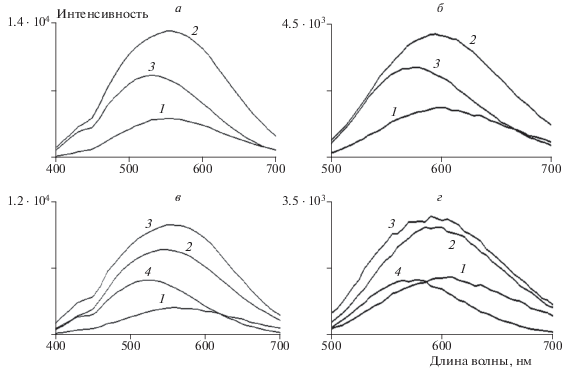
Глобальный анализ кинетических кривых затухания флуоресценции хлороформного экстракта ЛГ подтвердил полученные ранее данные о двухкомпонентной системе продуктов фотоокисления и фотодеградации бисретиноидов [22]. Кинетическая кривая затухания флуоресценции этих продуктов, полученная при возбуждении светом с длиной волны 485 нм и детектировании на длине волны 556 нм, при трехэкспоненциальном приближении состояла только из двух компонент со значениями τ2 = (3.4 ± 0.2) нс и τ3 = (7.2 ± 0.3) нс [22]. Эти значения достаточно хорошо согласуются с результатами данного исследования. При возбуждении флуоресценции светом с длиной волны 488 нм и детектировании в области 480–700 нм при четырехэкспоненциальном приближении глобальный анализ определил четыре компоненты, две из которых имеют наибольшие времена затухания флуоресценции: τ3 = 3.0 нс и τ4 = 7.0 нс. Этим компонентам τ3 и τ4, соответствуют спектры флуоресценции с максимумами в области 595 и 575 нм.
Известно, что при облучении А2Е происходит его окисление по двойным связям, приводящее к уменьшению длины сопряженных двойных связей и образованию новых фотоокисленных продуктов, таких как эпокси- и фураноидные формы этого бисретиноида [23, 24]. При длительном облучении происходит деградация окисленных форм с образованием низкомолекулярных высокореактивных продуктов [25–27]. При этом в спектре флуоресценции окисленных продуктов с увеличением времени облучения сначала сохраняется положение максимума, но при этом увеличивается интенсивность сигнала флуоресценции, а затем он (спектр) постепенно смещается в коротковолновую область. Таким образом, мы можем предположить, что группа флуорофоров с τ3 = 3.0 нс может принадлежать к продуктам с невысокой степенью окисления А2Е и с флуоресцентными характеристиками (максимум флуоресценции в области 595 нм при возбуждении флуоресценции светом с длиной волны 488 нм), близкими к таковым самого А2Е (максимум флуоресценции в области 600 нм при возбуждении флуоресценции светом с длиной волны 430 или 500 нм) [13]. А группа флуорофоров с τ4 = 7.0 нс, соответственно, может принадлежать к уже более окисленным формам А2Е или продуктам фотодеградации А2Е или других бисретиноидов (максимум флуоресценции в области 575 нм).
ЗАКЛЮЧЕНИЕ
Одним из методологических подходов к изучению сложных флуоресцентных систем, таких как ЛГ, содержащих более 20 флуорофоров, является глобальный анализ массива данных кривых затухания флуоресценции смеси, определяющий компоненты с различным временем жизни [28, 29]. Данный анализ позволяет выявить ряд центров свечения в сложных системах и вклад каждого центра в общую флуоресценцию всей системы.
Таким образом, данные глобального анализа в этой работе можно использовать для обработки результатов метода детектирования FLIM в in vivo условиях для понимания природы и механизмов изменения флуоресцентных характеристик флуорофоров ЛГ при старении организма или патологии.
Кроме того, результаты наших исследований хорошо коррелируют с полученными ранее данными [18, 19]. В предыдущих работах нами показано, что при ВМД наблюдается повышенное содержание окисленных форм бисретиноидов по сравнению с нормой, что выражается в увеличении интенсивности флуоресценции в области 530–580 нм при возбуждении флуоресценции длиной волны 488 нм [18, 19]. Кроме того, с помощью метода подсчета коррелированных по времени фотонов показано, что вклад окисленных форм бисретиноидов при патологии больше по сравнению с нормой.
Таким образом, полученные результаты по определению кинетических и спектральных характеристик продуктов фотоокисления и фотодеградации А2Е и других бисретиноидов в хлороформном экстракте ЛГ могут стать полезными в офтальмологической практике.
Работа выполнена при поддержке Программой фундаментальных исследований Президиума РАН № 42 “Фундаментальные исследования для биомедицинских технологий”.
Список литературы
Geng L., Wihlmark U., Algvere P.V. // Exp. Eye Res. 1999. V. 69. P. 539.
Feeney-Burns L., Hilderbrand E.S., Eldridge S. // Investig. Ophthalmol. Vis. Sci. 1984. V. 25. P. 195.
Boulton M., Docchio F., Dayhaw-Barker P. et al. // Vis. Res. 1990. V. 30. № 9. P. 1291.
Островский М.А., Федорович И.Б. // Хим. физика. 1996. Т. 15. С. 73.
Островский М.А. // Успехи биологической химии. 2005. Т. 45. С. 173.
Boulton M., Dontsov A., Jarvis-Evans J. et al. // J. Photochem. Photobiol. B:
Allikmets R., Singh N., Sun H. et al. // Nat. Genet. 1997. V. 15. P. 236.
Delori F.C., Staurenghi G., Arend O. et al. // Investig. Ophthalmol. Vis. Sci. 1995. V. 36. № 11. P. 2327.
Holz F.G., Bellman C., Staudt S. et al. // Ibid. 2001. V. 42. № 5. P. 1051.
Robson A.G., Michaelides M., Saihan Z. et al. // Doc. Ophthalmol. 2008. V. 116. P. 79.
Parish C.A., Hashimoto M., Nakanishi K. et al. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 14609.
Ben-Shabat S., Parish C.A., Vollmer H.R. et al. // J. Biol. Chem. 2002. V. 277. № 9. P. 7183.
Sparrow J.R., Wu Y., Kim C.Y. et al. // J. Lipid Res. 2009. V. 51. P. 247.
Holz F.G., Schmitz-Valckenberg S., Spaide R.F. et al. Autofluorescence Imaging. Berlin-Heidelberg: Springer–Verlag, 2007. P. 342.
Schweitzer D., Schenke S., Hammer M. et al. // Microsc. Res. Tech. 2007. V. 70. №. 5. P. 410.
Schweitzer D., Gaillard E.R., Dillon J. et al. // Investig. Ophthalmol. Vis. Sci. 2012. V. 53. №. 7. P. 3376.
Schweitzer D., Quick S., Schenke S. et al. // Ophthalmology. 2009. V. 106. P. 714.
Feldman T.B., Yakovleva M.A., Arbukhanova P.M. et al. // Anal. Bioanal. Chem. 2015. V. 407. P. 1075.
Feldman T.B., Yakovleva M.A., Larichev A.V. et al. // Eye. 2018. V. 32. P. 1440.
Boulton M., Dontsov A.E., Ostrovsky M.A. et al. // Investig. Ophthalmol. Vis. Sci. 1992. V. 33(4). P. 919.
Folch J., Lees M., Stanley GH.S. // J. Biol. Chem. 1957. V. 226. P. 497.
Яковлева М.А., Фельдман Т.Б., Арбуханова П.М. и др. // ДАН. 2017. Т. 472. № 2. С. 226.
Sparrow J.R., Zhou J., Ben-Shabat S. et al. // Investig. Ophthalmol. Visual Sci. 2002. V. 43. P. 1222.
Яковлева М.А., Сакина Н.Л., Кононихин А.С. и др. // ДАН. 2006. Т. 409(3). С. 411.
Yoon K.D., Yamamoto K., Ueda K. et al. // PLOS One. 2012. V. 7(7).
Wu Y., Yanase E., Feng X. et al. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 7275.
Wang Z., Keller L.M.M., Dillon J. et al. // Photochem. Photobiol. 2006. V. 82. P. 1251.
Beechem J.M. // Methods Enzymol. 1992. V. 210. P. 37.
Lakowicz J.R. Principles of fluorescence spectroscopy. 3rd Ed. New York: Springer, 2006. P. 97.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


