Химическая физика, 2021, T. 40, № 10, стр. 22-29
Столкновительная диссоциация интермедиатов криге CH3CHOO и метана в верхней атмосфере земли
Ю. А. Дьяков 1, 2, *, С. О. Адамсон 1, П. К. Ванг 2, 3, А. С. Ветчинкин 1, Г. В. Голубков 1, 4, И. И. Морозов 1, С. Я. Уманский 1, Ю. А. Чайкина 1, М. Г. Голубков 1
1 Федеральный исследовательский центр химической физики
им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Исследовательский центр экологических изменений, Академия Синика
Тайбэй, Тайвань
3 Факультет аэронавтики и астронавтики Национального университета Ченг Кунг
Тайнань, Тайвань
4 Национальный исследовательский центр “Курчатовский институт”
Москва, Россия
* E-mail: yuri_dyakov@mail.ru
Поступила в редакцию 18.03.2021
После доработки 13.04.2021
Принята к публикации 20.04.2021
Аннотация
Рост концентрации метана в атмосфере в результате антропогенной деятельности, таяния вечной мерзлоты и разложения газовых гидратов на морском дне привлекает в последние десятилетия пристальное внимание научного сообщества из-за потенциально опасного влияния метана на озоновый слой и климат Земли. По разным оценкам парниковый эффект от метана в десятки раз превышает аналогичный эффект от углекислого газа, поэтому процессы переноса метана в верхние слои атмосферы Земли, время его жизни и взаимодействие с другими веществами, присутствующими в стратосфере, мезосфере и ионосфере, представляют большой научный интерес. В настоящей работе рассмотрены химические реакции, протекающие при столкновениях молекул метана с метилкарбонилоксидом CH3CHOO в верхних слоях атмосферы. Показано, что данный процесс инициирует образование радикала OH и запускает каскад химических реакций, продуктами которых являются радикалы CH3, атомарный водород, ацетон, ацетальдегид, пропальдегид, метиловый спирт и вода. Данные соединения способны активно влиять на состав атмосферы и ее физико-химические свойства.
1. ВВЕДЕНИЕ
Метан наряду с многими другими компонентами атмосферы Земли (водяным паром, углекислым газом, оксидом азота, озоном и др.) является парниковым газом, отражающим часть инфракрасного излучения, идущего от поверхности, тем самым нарушая сложившееся термодинамическое равновесие и способствуя общему росту температуры атмосферы. “Парниковый потенциал” метана чрезвычайно высок. Так, по оценкам Межправительственной группы экспертов по изменению климата ООН (IPCC), парниковая активность метана в зависимости от используемых моделей превышает парниковую активность углекислого газа от 20 до 84 раз [1]. Поэтому наблюдаемый в последнее время быстрый рост концентрации метана в атмосфере вызывает тревогу мирового сообщества. Антропогенные источники выбросов метана в атмосферу связаны с деятельностью человека: сельское хозяйство, добыча угля, выделение биогаза на полигонах захоронения отходов. Кроме того, ими могут быть и природные источники. Такими источниками с огромными законсервированными массами метана, в частности, являются вечная мерзлота и газовые гидраты на морском дне, которые быстро разрушаются вследствие общего потепления климата, выделяя метан. В свою очередь, это запускает своеобразную цепную реакцию, в результате которой выбросы метана стремительно растут, что ведет к еще большему нагреву атмосферы. Наибольшее влияние на климат Земли оказывают парниковые газы, попавшие в стратосферу и мезосферу, поэтому процессы их вертикального переноса вверх, фотохимическая стабильность и химическое взаимодействие с другими веществами, присутствующими на данных высотах, представляют большой научный интерес.
В приэкваториальных областях антропогенный метан как более легкий газ попадает в стратосферу в результате естественной диффузии и периодического движения больших масс воздуха из тропосферы в стратосферу во время тропических ураганов и грозовых штормов [2]. В приполярных широтах, обладающих наиболее значимым запасом метана, его перенос в верхние слои атмосферы Земли происходит через полярный вихрь [3], что способствует заметному росту концентрации метана в стратосфере в последние десятилетия.
Попадая в верхнюю атмосферу, молекулы метана подвергаются интенсивному ультрафиолетовому облучению, что приводит к их электронному возбуждению, ионизации и последующему распаду [4]. На больших высотах растет концентрация атомарного кислорода, радикалов OH, электронно-возбужденных химически активных молекул и ионов, реакции с которыми также приводят к окислению и распаду метана с образованием воды и других веществ, что влияет на химический состав мезосферы и нижней ионосферы. Это должно приводить к появлению избыточного количества воды и образованию серебристых облаков в верхнем слое мезосферы, наблюдаемому в течение последних полутора веков и до сих пор до конца не объясненному.
Карбонилоксиды, известные также как интермедиаты Криге (Criegee Intermediates (CI))
[5], образующиеся при взаимодействии озона с ненасыщенными углеводородами, играют важную
роль в формировании химически активных компонентов верхней атмосферы Земли и во взаимной
трансформации данных соединений. Роль интермедиатов Криге в химии атмосферы активно
обсуждается с начала 50-х годов прошлого столетия. Карбонилоксиды являются химически
чрезвычайно активными соединениями благодаря наличию группы 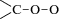 , обладающей бирадикальными свойствами. Например, они активно реагируют с молекулами
SO2 и NO2, способствуя образованию соответственно серной и азотной кислот [6, 7], с радикалами OH и водой [8–11], а также с большим числом других химических соединений [12–17].
, обладающей бирадикальными свойствами. Например, они активно реагируют с молекулами
SO2 и NO2, способствуя образованию соответственно серной и азотной кислот [6, 7], с радикалами OH и водой [8–11], а также с большим числом других химических соединений [12–17].
Образование интермедиатов Криге сопровождается выделением значительного количества энергии (обычно 40–50 ккал/моль) [18], большая часть которой переходит во внутреннюю колебательную энергию CI, способствуя их распаду с образованием метана, атомарного кислорода, OH- и CH3-радикалов, углекислого газа и CO [19, 20]. В плотных слоях атмосферы эта энергия за счет столкновений передается нейтральным молекулам среды. В результате карбонилоксиды либо нейтрализуются водой, либо распадаются по единственному каналу – с образованием радикалов OH [19–25]. Поскольку в экспериментах интермедиаты Криге зарегистрировать экспериментально обычно не удается, то для их исследования применяются косвенные методы, в которых важную роль играет компьютерное моделирование химических процессов. Сравнение теоретически рассчитанных и экспериментально наблюдаемых выходов продуктов реакций дает основание делать выводы о реальном ходе реакций.
Большой интерес представляют процессы, протекающие при столкновениях молекул метилкарбонилоксида CH3CHOO с молекулами метана в разреженной среде стратосферы и мезосферы, где влияние межмолекулярных столкновений мало. В этих условиях значительная часть молекул CI обладает собственной колебательной энергией, полученной при синтезе. Как правило, молекулы CI, вступающие в реакцию, являются возбужденными за счет поглощения фотонов в ультрафиолетовом (УФ) диапазоне, присутствующих в избытке на больших высотах. Их поглощение приводит либо к ионизации молекулы, либо к ее переходу в электронно-возбужденное состояние, сопровождающееся неадиабатическим переходом системы в нижележащее электронное состояние. Такой переход происходит через коническое пересечение термов с одновременным возбуждением внутримолекулярных колебаний, подробно описанных в работах [26–28]. Благодаря бирадикальной структуре электронной оболочки карбонилоксидов после ионизации УФ-излучением происходит сильное изменение электронного строения и химических свойств CI [19]. Аналогичные исследования проводились ранее для молекул пенталена и бензоциклобутадиена [29, 30].
В настоящей работе показано, что процесс столкновения молекул метана и CI, обладающих достаточным запасом суммарной кинетической энергии, инициирует образование радикалов OH и запускает последующий каскад химических реакций, дающих в качестве продуктов ацетон, радикал CH3, пропальдегид, ацетальдегид и метиловый спирт. Данные соединения, особенно радикалы OH и CH3, способны активно взаимодействовать с другими компонентами атмосферы и значительно изменять ее химические и физические свойства.
2. МЕТОДИКА РАСЧЕТОВ
Во всех исследуемых ниже реакциях молекулы, их интермедиаты и переходные состояния находились в основном синглетном электронном состоянии, соответствующем минимуму потенциальной энергии. Оптимизация геометрии поверхностей потенциальной энергии (ППЭ) молекул и образующихся фрагментов осуществлялась методом функционала плотности UB3LYP/aug-cc-pVTZ. Ввиду того, что отрыв OH-группы дает фрагменты с неспаренным электроном (радикалы), для расчета данного канала реакции требуется использовать волновые функции с открытыми электронными оболочками. Поэтому при расчете ППЭ вдоль этого пути реакции вычисления начинались с определения волновой функции триплетного состояния. Затем она использовалась как стартовая в последующих расчетах молекул с открытой электронной оболочкой. Энергии в точках минимумов и максимумов пересчитывались с помощью более точного квантовохимического метода UCCSD(T)/aug-cc-pVTZ. Константы скоростей реакций и конечный выход продуктов были рассчитаны в рамках статистического метода Райса–Рамспегера–Касселя–Маркуса (РРКМ) [31, 32]. Ввиду того, что канал отрыва OH не имеет выраженного максимума, константы скоростей реакций для него рассчитывались микроканоническим методом вариационного переходного состояния (ВПС) [33]. Практическое применение методов РРКМ и ВПС для каскадной диссоциации молекул подробно описано в работах [4, 34–38]. Квантовохимические расчеты выполнены с использованием пакета программ GAUSSIAN 09 [39].
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Рассматриваемый в данной работе интермедиат Криге существует в виде двух изомеров: syn-CH3CHOO и anti-CH3CHOO, которые различаются пространственной ориентацией COO-группы. Несмотря на кажущуюся легкость поворота этой группы относительно связи C–C, его энергетический барьер достаточно высок (около 34 ккал/моль) и значительно превышает барьер отрыва группы OH от этих изомеров (16.5 и 31.2 ккал/моль для syn- и anti-изомеров соответственно) и распада их на другие фрагменты (от 18.3 до 23.8 ккал/моль) [19, 20]. Поэтому далее будем считать два данных изомера различными веществами. При этом anti-изомер намного легче реагирует с водой [8–10] и около поверхности Земли сразу разрушается, в то время как в разреженной и/или холодной атмосфере (стратосфера, мезосфера, ионосфера) оба изомера могут присутствовать в сравнимых долях.
На рис. 1 схематично показана поверхность потенциальной энергии процесса столкновения молекул метана и CH3CHOO вдоль основных возможных каналов реакций. Барьер инициирования реакции слияния для anti- и syn-изомеров достаточно высок (27.9 и 30.8 ккал/моль соответственно). Однако реакция синтеза карбонилоксидов сопровождается выделением большого количества энергии (более 50 ккал/моль), и часть ее может перейти в поступательную энергию фрагментов. Кроме того, на больших высотах атмосферу нельзя считать термодинамически равновесной. В условиях интенсивного поглощения фотонов, а также при рекомбинации положительно заряженных молекулярных ионов с электронами возникают электронно-возбужденные молекулы с большим запасом энергии, которая затем переходит в их колебательную энергию [26–28]. Если эта энергия оказывается ниже предела диссоциации молекулы, то она может перейти в поступательную энергию при столкновениях с другими молекулами среды [40, 41].
Рис. 1.
Поверхности потенциальной энергии химических реакций при столкновении молекул интермедиатов Криге CH3CHOO с метаном вдоль основных каналов диссоциации. Энергии в минимумах и максимумах приведены в ккал/моль.

В результате химической реакции, протекающей при столкновительном процессе, высвобождается большое количество энергии (38.5 ккал/моль в случае syn-изомера) и образуется молекулярный комплекс CH3CH3CHOOH. Для удобства далее будем рассматривать этот интермедиат в качестве исходной точки, из которой начинаются все реакции. Как видно из рис. 1, фрагмент OH сравнительно слабо связан с основным остовом CH3CH3CHO однократной ковалентной связью и отрывается от исходного интермедиата без барьера через ВПС3. С учетом того, что для прохождения барьеров ПС1 и ПС2 молекулы имеют поступательную энергию не ниже высот этих барьеров (27.9 и 30.8 ккал/моль) и эта энергия преобразуется во внутреннюю энергию интермедиата CH3CH3CHOOH, этого оказывается достаточно для отрыва OH-группы. Кроме того, согласно результатам многочисленных экспериментов с реакциями в молекулярных пучках, при безбарьерном разрыве однократной ковалентной связи доля энергии, переходящей в кинетическую энергию фрагментов, чрезвычайно мала, т.е. она практически вся переходит в колебательную энергию [26, 42–44]. Поэтому внутренней энергии остова CH3CH3CHO достаточно для вторичной диссоциации, в результате чего образуются ацетальдегид, ацетон, а также атомарный водород и CH3-радикал, которые химически активны и могут существенно влиять на состав и физико-химические свойства верхней атмосферы.
Следующей по высоте энергетического барьера (9.7 ккал/моль) является реакция образования ацетона и воды через ПС5. Однако симметрийный фактор этого канала (т.е. число равнозначных путей реакции) равен единице, в то время как у рассматриваемых ниже каналов он выше, что уменьшает вклад данного канала в суммарный выход продуктов распада.
Реакция образования пропальдегида и воды протекает с энергетическим барьером ПС4, равным 18.3 ккал/моль, и осуществляется через перемещение атома водорода от CH3-группы к группе OH с последующей перестройкой геометрии молекулы. Так как исходный интермедиат имеет две равноценные CH3-группы по три атома водорода в каждой, то симметрийный фактор данной реакции равен шести. С другой стороны, барьер разрыва связи C–H обычно имеет узкий профиль сечения, что уменьшает константу скорости реакции.
Последняя из рассматриваемых на рис. 1 реакций – образование ацетальдегида и метанола через ПС6 с высотой энергетического барьера 30.2 кал/моль. Она связана с перемещением фрагмента OH к одной из CH3-групп. Так как их две, то симметрийный фактор данной реакции равен двум. Поскольку OH-группа относительно слабо связана с центральным атомом углерода интермедиата CH3CH3CHOOH и реакция фактически сводится к отрыву этой группы и ее присоединению к группе CH3 с последующим разрывом связи C–C, профиль сечения этого барьера довольно пологий, что обычно ведет к повышению значения константы скорости реакции.
На рис. 2 дана принципиальная схема реакции диссоциации промежуточного интермедиата CH3CH3СHOOH в соответствии с каналами реакций, представленными на рис. 1. Для того чтобы оценить вклад обратной диссоциации данного интермедиата в syn- или trans-CH3CHOO, предполагается, что ПС1 и ПС2 тоже ведут к распаду CH3CH3СHOOH – в данном случае на метан и CH3CHOO. В табл. 1 указан относительный выход (в %) продуктов диссоциации CH3CH3СHOOH, исходя из предположения, что реакция начинается с него. При расчете констант скоростей реакций отсчет энергии ведется от энергии этого интермедиата. Из табл. 1 видно, что вклад обратных реакций через ПС1 и ПС2, т.е. образование молекул trans-CH3CHOO и syn-CH3CHOO из промежуточного соединения CH3CH3СHOOH, ничтожно мал даже при высоких значениях внутренней энергии, поэтому ими можно пренебречь.
Рис. 2.
Упрощенная принципиальная схема реакции диссоциации промежуточного изомера CH3CH3СHOOH, получаемого при столкновении CH3CHOO с метаном. Энергии приведены в ккал/моль. Курсивными числами указаны высоты барьеров, обычным шрифтом – энергии минимумов ППЭ.

Таблица 1.
Относительный выход (в %) продуктов диссоциации промежуточного соединения CH3CH3CHOOH, образующегося в результате столкновения молекулы метана с интермедиатом Криге CH3CHOO (в скобках указаны переходные состояния для данных каналов реакций в соответствии с рис. 1)
| Колебательная энергия молекул, ккал/моль | CH3CH3CHO + + OH (ВПС3) |
Ацетальдегид + + метанол (ПС6) |
Пропальдегид + + H2O (ПС4) |
Ацетон +
+ H2O (ПС5) |
syn-CH3CHOO + + CH4 (ПС1) | anti-CH3CHOO + + CH4 (ПС2) |
|---|---|---|---|---|---|---|
| 100 | 99.8 | 0.0 | 0.0 | 0.2 | 0.0 | 0.0 |
| 125 | 99.3 | 0.0 | 0.2 | 0.5 | 0.0 | 0.0 |
| 150 | 98.3 | 0.3 | 0.6 | 0.8 | 0.0 | 0.0 |
| 175 | 96.4 | 1.0 | 1.3 | 1.3 | 0.0 | 0.0 |
| 200 | 93.6 | 2.4 | 2.2 | 1.7 | 0.1 | 0.0 |
| 225 | 87.5 | 5.3 | 4.1 | 2.7 | 0.3 | 0.1 |
| 250 | 79.7 | 9.6 | 6.3 | 3.7 | 0.5 | 0.2 |
| 275 | 70.0 | 15.9 | 8.6 | 4.5 | 0.7 | 0.3 |
| 300 | 60.5 | 22.5 | 10.4 | 5.1 | 1.0 | 0.5 |
На рис. 3 приведен относительный выход продуктов диссоциации интермедиата CH3CH3СHOOH. Значения энергии на графике отсчитываются от энергии этой молекулы на ППЭ. Численные значения для приводимых на рисунке кривых выхода продуктов реакций взяты из табл. 1. Кривые, соответствующие каналам образования trans-CH3CHOO + CH4 и syn-CH3CHOO + CH4, на графиках не представлены ввиду их незначительного вклада в общую картину процесса.
Рис. 3.
Относительный выход продуктов реакции диссоциации промежуточного изомера CH3CH3СHOOH, рассчитанный согласно схеме, представленной на рис. 2, где в качестве исходной точки начала реакции взят данный изомер. Значения энергий по оси абсцисс приведены относительно энергии изомера CH3CH3СHOOH.

При значениях внутренней энергии ниже 200 ккал/моль канал отрыва OH-группы является практически единственным значимым каналом реакции. Здесь следует учитывать, что при своем образовании молекула CH3CH3СHOOH приобретает не менее 70 ккал/моль внутренней энергии. С ростом величины последней до 300 ккал/моль относительный выход OH-радикала снижается, а выход ацетальдегида и метилового спирта быстро растет и достигает примерно 22% при значении энергии 300 ккал/моль. В случае высоких значений колебательной энергии исходной молекулы другие рассматриваемые вещества (ацетон, пропальдегид и вода) также дают заметный вклад в общее распределение продуктов реакции.
Вполне возможно, что молекулы в верхних слоях атмосферы обладают большой внутренней энергией из-за интенсивного УФ-излучения, которое может как колебательно возбудить молекулы ниже порога диссоциации, так и ионизировать их, создавая плазму. Последующая рекомбинация катионов и электронов в плазме создает “горячие” колебательно-возбужденные молекулы. При столкновениях энергия колебательных возбуждений молекул переходит в поступательную энергию. Поэтому исходные молекулы CH4 и CH3CHOO изначально обладают высокой кинетической энергией. В ходе рассматриваемой нами реакции предполагается, что все упомянутые энергии аккумулируются во внутреннюю энергию интермедиата CH3CH3СHOOH, позволяя ему в сумме иметь большую величину внутренней энергии.
Таким образом, при столкновении молекулы метана с интермедиатом Криге CH3CHOO в условиях верхней атмосферы протекает химическая реакция, в результате которой образуются радикалы OH и CH3, атомарный водород, ацетальдегид и ацетон. При достаточно высоких значениях внутренней энергии становится возможным образование пропальдегида, метилового спирта и воды.
4. ЗАКЛЮЧЕНИЕ
Стремительный рост выбросов метана в атмосферу, наблюдаемый в последние годы, особенно в приполярных широтах, создает высокую вероятность его попадания в стратосферу и мезосферу посредством грозовых штормов и полярных вихрей, интенсивно перемешивающих атмосферу в верхних широтах. Метан в верхней атмосфере не только создает хорошо известный парниковый эффект, но и активно изменяет химический состав атмосферы, меняя ее физико-химические свойства.
В настоящей работе было показано, что в условиях верхней атмосферы Земли столкновение молекул метана и интермедиатов Криге CH3CHOO приводит к химической реакции, в результате которой образуются радикалы OH и CH3, атомарный водород, ацетон, ацетальдегид, и в меньших количествах – пропальдегид, метиловый спирт и вода. Радикалы OH являются основными “очистителями” атмосферы от антропогенных загрязнителей, участвуют в большом количестве физико-химических процессов в атмосфере Земли, запуская каскады циклических вторичных реакций, включая образование атомарного кислорода, HO2, NO2, перекиси водорода и др. [45–48]. Поскольку спектр излучения и поглощения радикалов ОН на вращательных переходах включает СВЧ-диапазон [49, 50], то они также принимают активное участие в ослаблении радиосигналов глобальных навигационных спутниковых систем [51–53].
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (регистрационный номер № АААА-А19-119010990034-5) и при финансовой поддержке Министерства науки и технологии Тайваня (грант MOST 109-2111-M-001-001), Академии наук Тайваня (грант AS-TP-107-M10) и проекта поддержки высшего образования и развития университета Ченг Кунг Министерством образования Тайваня.
Список литературы
Climate Change 2014: Synthesis Report. Contribution of Working Groups I, II, and III to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change / Eds. Core Writing Team, Pachauri R.K., Meyer L.A. Geneva: IPCC, 2014.
Nair P.R., Kavitha M. // Intern. J. Remote Sens. 2020. V. 41. № 21. P. 8380.
Choi W., Kim S., Grant W.B. et al. // J. Geophys. Res. 2002. V. 107. № D24. 8209.
Sharifi M., Kong F., Chin S.L. et al. // J. Phys. Chem. A. 2007. V. 111. № 38. P. 9405.
Criegee R., Wenner G. // Just. Lieb. Ann. Chem. 1949. V. 564. № 1. P. 9.
Kanakidou M., Seinfeld J.H., Pandis S.N. et al. // Atmos. Chem. Phys. 2005. V. 5. № 4. P. 1053.
Hallquist M., Wenger J.C., Baltensperger U. et al. // Atmos. Chem. Phys. 2009. V. 9. № 14. P. 5155.
Chao W., Hsieh J.T., Chang C.H. et al. // Science. 2015. V. 347. № 6223. P. 751.
Long B., Bao J.L., Truhlar D.G. // J. Amer. Chem. Soc. 2016. V. 138. № 43. P. 14409.
Taatjes C.A., Welz O., Eskola A.J. et al. // Science. 2013. V. 340. № 6129. P. 177.
Sheps L., Scully A.M., Au K. // Phys. Chem. Chem. Phys. 2013. V. 16. № 48. P. 26701.
Welz O., Eskola A.J., Sheps L. et al. // Ang. Chem. Intern. Ed. 2014. V. 53. № 18. P. 4547.
Foreman E.S., Kapnas K.M., Murray C. // Ang. Chem. Intern. Ed. 2016. V. 55. № 35. P. 10419.
Chhantyal-Pun R., McGillen M.R., Beames J.M. et al. // Ang. Chem. Intern. Ed. 2017. V. 56. № 31. P. 9044.
Taatjes C.A., Khan M.A.H., Eskola A.J. et al. // Env. Sci. Techn. 2019. V. 53. № 3. P. 1245.
Taatjes C.A., Shallcross D.E., Percival C.J. // Phys. Chem. Chem. Phys. 2014. V. 16. № 5. P. 1704.
Khan M., Percival C., Caravan R. et al. // Env. Sci. Proc. Imp. 2018. V. 20. № 3. P. 437.
Herron J.T., Martinez R.I., Huie R.E. // Intern. J. Chem. Kinet. 1982. V. 14. № 3. P. 201.
Дьяков Ю.А., Адамсон С.О., Ванг П.К. и др. // Химическая физика. 2021. Т. 40. № 5. С. 68.
Wang Z., Dyakov Y.A., Bu Y. // J. Phys. Chem. A. 2019. V. 123. № 5. P. 1085.
Zhou X.H., Liu Y.Q., Dong W.R. et al. // J. Phys. Chem. Lett. 2019. V. 10. № 17. P. 4817.
Wang X.H., Bowman J.M. // J. Phys. Chem. Lett. 2016. V. 7. № 17. P. 3359.
Kidwell N.M., Li H.W., Wang X.H. et al. // Nature Chem. 2016. V. 8. № 5. P. 509.
Fang Y., Liu F., Barber V.P. et al. // J. Chem. Phys. 2016. V. 144. № 6. 061102.
Nguyen T.L., McCaslin L., McCarthy M.C. et al. // J. Chem. Phys. 2016. V. 145. № 13. 131102.
Lin M.F., Tseng C.M., Dyakov Y.A. et al. // J. Chem. Phys. 2007. V. 126. № 24. 241104.
Dyakov Y.A., Ho Y.C., Hsu W.H. et al. // Chem. Phys. 2018. V. 515. P. 543.
Dyakov Y.A., Toliautas S., Trakhtenberg L.I. et al. // Chem. Phys. 2018. V. 515. P. 672.
Дьяков Ю.А., Пузанков А.А., Адамсон С.О. и др. // Хим. физика. 2020. Т. 39. № 10. С. 3.
Dyakov Y.A., Adamson S.O., Golubkov G.V. et al. // Proc. SPIE Intern. Soc. Opt. Eng. 2019. V. 11322. 113221Q.
Eyring H., Lin S.H., Lin S.M. Basic Chemical Kinetics. N.Y.: JohnWiley & Sons, 1980.
Robinson P.J., Holbrook K.A. Unimolecular Reactions. New York: Wiley, 1972.
Steinfeld J.I., Francisco J.S., Hase W.L. Chemical kinetics and dynamics. Upper Saddle River: Prentice Hall, 1999.
Zyubina T.S., Dyakov Y.A., Lin S.H. et al. // J. Chem. Phys. 2005. V. 123. № 13. 134320.
Mebel A.M., Zyubina T.S., Dyakov Y.A. et al. // Intern. J. Quant. Chem. 2005. V. 102. № 5. P. 506.
Wang Q.Q., Wu D., Jin M.X. et al. // J. Chem. Phys. 2008. V. 129. № 20. 204302.
Wang Q.Q., Wu D., Jin M.X. et al. // J. Phys. Chem. C. 2009. V. 113. № 27. P. 11805.
Wang Q.Q., Dyakov Y.A., Wu D. et al. // Chem. Phys. Lett. 2013. V. 586. P. 21.
Frisch M.J., Trucks G.W., Schlegel H.B., Scuseria G.E., Robb M.A., Cheeseman J.R., Scalmani G., Barone V., Petersson G.A., Nakatsuji H., Li X., Caricato M., Marenich A.V., Bloino J., Janesko B.G., Gomperts R., Mennucci B., Hratchian H.P., Ortiz J.V., Izmaylov A.F., Sonnenberg J.L., Williams-Young D., Ding F., Lipparini F., Egidi F., Goings J., Peng B., Petrone A., Henderson T., Ranasinghe D., Zakrzewski V.G., Gao J., Rega N., Zheng G., Liang W., Hada M., Ehara M., Toyota K., Fukuda R., Hasegawa J., Ishida M., Nakajima T., Honda Y., Kitao O., Nakai H., Vreven T., Throssell K., Montgomery J.A., Jr., Peralta J.E., Ogliaro F., Bearpark M.J., Heyd J.J., Brothers E.N., Kudin K.N., Staroverov V.N., Keith T.A., Kobayashi R., Normand J., Raghavachari K., Rendell A.P., Burant J.C., Iyengar S.S., Tomasi J., Cossi M., Millam J.M., Klene M., Adamo C., Cammi R., Ochterski J.W., Martin R.L., Morokuma K., Farkas O., Foresman J.B., Fox D.J. Gaus-sian 09. Rev. A.02. Wallingford CT: Gaussian, Inc., 2009.
Hsu H.C., Tsai M.T., Dyakov Y.A. et al. // J. Chem. Phys. 2011. V. 135. № 5. 054311.
Hsu H.C., Tsai M.T., Dyakov Y.A. et al. // Intern. Rev. Phys. Chem. 2012. V. 31. P. 201.
Tseng C.M., Dyakov Y.A., Huang C.L. et al. // J. Amer. Chem. Soc. 2004. V. 126. № 28. P. 8760.
Dyakov Y.A., Bagchi A., Lee Y.T. et al. // J. Chem. Phys. 2010. V. 132. № 1. 014305.
Tseng C.M., Dyakov Y.A., Huang H.C. et al. // J. Chem. Phys. 2010. V. 133. № 7. 074307.
Levy H. // Science. 1971. V. 173. № 3992. P. 141.
Lelieveld J., Dentener F., Peters W. et al. // Atmos. Chem. Phys. 2004. V. 4. № 9–10. P. 2337.
Mauldin R.L., Berndt T., Sipila M. et al. // Nature. 2012. V. 488. № 7410. P. 193.
Vereecken L., Harder H., Novelli A. // Phys. Chem. Chem. Phys. 2012. V. 14. № 42. P. 14682.
Голубков Г.В., Манжелий М.И., Лушников А.А. // Хим. физика. 2014. Т. 33. № 7. С. 101.
Адамсон С.О., Харлампиди Д.Д., Голубков Г.В. и др. // Хим. физика. 2018. Т. 37. № 12. С. 20.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2016. Т. 35. № 1. С. 5.
Kuverova V.V., Adamson S.O., Berlin A.A. et al. // Adv. Space Res. 2019. V. 64. № 10. P. 1876.
Голубков Г.В., Манжелий М.И., Берлин А.А. и др. // Хим. физика. 2021. Т. 40. № 3. С. 86.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


