Химическая физика, 2021, T. 40, № 10, стр. 30-35
Определение константы скорости реакции бензола с атомарным фтором методом конкурирующих реакций
Е. С. Васильев 1, Н. Д. Волков 1, Г. В. Карпов 1, И. И. Морозов 1, *, Д. Р. Нигматуллин 1, Е. А. Сайгина 3, С. А. Савилов 2, С. Я. Уманский 1, Н. И. Бутковская 1
1 Федеральный исследовательский центр химической физики
им. Н.Н. Семёнова Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Российский химико-технологический университет им. Д.И. Менделеева
Москва, Россия
* E-mail: igormrzv@gmail.com
Поступила в редакцию 18.03.2021
После доработки 14.04.2021
Принята к публикации 20.04.2021
Аннотация
Методом конкурирующих реакций изучена кинетика реакции фтора с бензолом при температуре T = 293 K. Исследования проводили в проточном реакторе низкого давления с масс-спектрометрическим детектированием реагентов и продуктов реакции. В качестве конкурирующих реакций использованы реакции атомов фтора с циклогексаном, трифторуксусной и трихлоруксусными кислотами. Впервые определены соотношения констант скорости бензола и этих конкурирующих реакций с атомарным фтором. На основе полученных экспериментальных данных и известных из литературы констант скорости реакций рассчитана величина константы скорости реакции атомов фтора с бензолом: k1 (293 K) = (2.0 ± 0.6) · 10–10 см3 · молекула–1 · с–1.
1. ВВЕДЕНИЕ
Бензол относится к одному из наиболее распространенных в промышленности классов химических веществ. В 2019 г. в России было произведено порядка 1500 тыс. т бензола. Некоторая часть его попадает в окружающую среду вследствие техногенных аварий, при испарении растворителей и другими способами. Известно, что бензол и его производные токсичны и негативно влияют на окружающую среду и животный мир. Бензол воздействует на организм человека через неповрежденную кожу, при вдыхании его паров способен вызвать лейкемию и анемию [1, 2]. Поэтому вопросы трансформации бензола в атмосфере представляют значительный интерес. Установить продукты его трансформации в атмосфере очень важно, так как они также могут быть токсичными.
Окисление органических соединений в атмосфере в основном инициируется гидроксильным радикалом, атомами галогенов и нечетным кислородом. Первичная стадия окисления бензола в атмосфере имеет вид
В ходе этой стадии образуются фенильные радикалы, которые затем вступают в реакцию с молекулярным кислородом атмосферы. Эта реакция чрезвычайно важна для построения моделей изменения климата:
Метан использовали в качестве вещества-конкурента. Оказалось, что значение k1 существенно отличается от литературных данных. Для установления причины возможных расхождений было решено провести дополнительные исследования кинетики реакций атомов фтора с бензолом, используя в качестве конкурирующих реакций реакции атомов фтора с трихлоруксусной и трифторуксусной кислотами и циклогексаном.
Реакция атомов фтора с бензолом (k1) может протекать по двум каналам: в одном – образуется фенильный радикал (Ia), а в другом – происходит замещение атома водорода на атом фтора в бензольном кольце (Iб). Представим возможную схему этой реакции:
(Ia)
$\begin{gathered} {{{\text{F}}}^{\centerdot }} + {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{6}} \to {\text{HF}} + {{{\text{С}}}_{{\text{6}}}}{\text{Н}}_{5}^{\centerdot }, \\ \Delta H_{R}^{^\circ } = --108.4\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(Iб)
$ \to {{{\text{H}}}^{\centerdot }} + {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{F}},\,\,\,\,\Delta H_{R}^{^\circ } = --53.2\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}},$(IIa)
$\begin{gathered} {{{\text{F}}}^{\centerdot }} + {\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{COOH}} \to {\text{HF}} + {\text{C}}{{{\text{F}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{\centerdot }}, \\ \Delta H_{R}^{^\circ } = --93.3\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(IIб)
$\begin{gathered} {{{\text{F}}}^{\centerdot }} + {\text{CС}}{{{\text{l}}}_{{\text{3}}}}{\text{COOH}} \to {\text{HF}} + {\text{CС}}{{{\text{l}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{\centerdot }}, \\ \Delta H_{R}^{^\circ } = --99.4\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(IIв)
$\begin{gathered} {{{\text{F}}}^{\centerdot }} + {\text{CС}}{{{\text{l}}}_{{\text{3}}}}{\text{COOH}} \to {\text{FCl}} + {\text{CСl}}_{2}^{\centerdot }{\text{COOH}}, \\ \Delta H_{R}^{^\circ } = 7\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(IIг)
$\begin{gathered} {{{\text{F}}}^{\centerdot }} + {\text{c - }}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{12}}} \to {\text{HF}} + {\text{c - }}{{{\text{C}}}_{{\text{6}}}}{\text{H}}_{{11}}^{\centerdot }, \\ \Delta H_{R}^{^\circ } = --169.9\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $В настоящей работе в качестве веществ-конкурентов использовались: трихлоруксусная кислота (ТХК), трифторуксусная кислота (ТФК) и циклогексан, для которых константы скорости реакций с атомами фтора установлены.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Масс-спектрометрия с модулированным молекулярным пучком была применена для детектирования реагентов и продуктов реакции, включая свободные радикалы. Кинетику и механизм реакции атома фтора с бензолом изучали методом конкурирующих реакций в проточном реакторе при температуре 293 K и давлении 1 мбар. Подробно экспериментальная установка описана в работах [6, 7]. Здесь приведем краткое описание экспериментальной установки и методики проведения опытов. Схема экспериментальной установки представлена на рис. 1. Проточный цилиндрический реактор из пирекса имел длину 50 см и внутренний диаметр 2.3 см. Атомы фтора получали в высокочастотном разряде из смеси F2 и He (избыток He – более 99%). Степень диссоциации фтора составляла ~97%, при этом концентрация атомов была ~25 ⋅ 1012 атом ⋅ см–3. По трубке реактора регулируемый поток газа-носителя гелия в смеси с атомами фтора подавался реакционную зону. Вдоль оси реактора располагалась цилиндрическая трубка диаметром 1.7 см, по которой в реактор вводилась газовая смесь, состоящая из бензола и реагента конкурирующей реакции. Типичная скорость газового потока в реакторе составляла 2.7 м/с, общее давление в реакторе – 1.0 мбар. Разрядная кварцевая трубка (2) помещалась в 40 см от напускного сопла масс-спектрометра. Внутри разрядной трубки из пирекса находилась цилиндрическая вставка из синтетического сапфира (Al2O3), которая значительно снижала гибель атомов фтора на поверхности разрядной трубки.
Рис. 1.
Схема экспериментальной установки: 1 – инжектор, 2 – разрядная труба, 3 – термостатируемая рубашка, 4 – зона реакции, 5 – напускной конус масс-спектрометра, 6 – модулятор пучка, 7 – ионный источник, 8 – электроды квадрупольного масс-спектрометра, 9 – электронный умножитель, 10 – усилитель тока, 11 – ПК.

Для приготовления смесей реагентов использовали гелий марки 6.0 (99.9999%), трихлоруксусная кислота, трифторуксусная кислота и циклогексан. В табл. 1 приведены концентрации и чистота реагентов, используемых в экспериментах. Реактивы применяли без предварительной очистки. Трихлоруксусную кислоту вводили в реактор с помощью продувки потоком гелия кристаллов кислоты. Бензол подавался по отдельной линии из колбы, в которой он хранился. При подаче в реактор происходило смешивание потоков бензола и одного из веществ-конкурентов. Концентрации веществ, подаваемых в реактор, определяли по скорости падения давления в колбе определенного объема. Давление в реакторе измеряли мембранным манометром MKS Baratron модель 122A (США). Отбор пробы из реакционной зоны в масс-спектрометр осуществляли в виде модулированного молекулярного пучка. Система его формирования состояла из сопла и сепаратора. Пучок модулировался в камере между сепаратором и входной диафрагмой ионного источника масс-спектрометра.
Таблица 1.
Концентрации и чистота реагентов, используемых при проведении реакций в проточном реакторе
| Реагент | Концентрация в He, % | Производитель; чистота реагента |
|---|---|---|
| Гелий | 100 | ООО “НИИ КМ марка 6.0; 99.9999% |
| Бензол | 8.8 | АО “Экос-1”, ХЧ; 99.8% |
| Циклогексан | 5.6 | Sigma-Aldrich; 99% |
| Трифторуксусная кислота | 3.7 | Sigma-Aldrich; >97% |
| Трихлоруксусная кислота | кристаллы | Sigma-Aldrich; >97% |
| Фтор | 5 | ИПХФ РАН; 98% |
Для откачки камеры между соплом и сепаратором использовались паромасляные диффузионные насосы вакуумных агрегатов ВА-05 и ВА-01. Ионизация реагентов и продуктов реакции производилась электронным ударом. Энергия электронов регулировалась в пределах 12–100 эВ. Электронный ток устанавливали в диапазоне 0–2 мА. Детектирование ионов проводили при помощи квадрупольного масс-спектрометра МС7303 (Россия). Система регистрации включала в себя: вторичный электронный умножитель, синхронный детектор (Princeton Applied Research, модель 124A, США), соединенный с персональным компьютером. Предел детектирования бензола и веществ-реагентов составлял ∼1010 молекул ⋅ см–3 при накоплении сигнала в течение 300 с.
Методика кинетических измерений
Бензол и вещество-конкурент в определенных концентрациях в смесях с избытком газа-носителя гелия поступали в зону реакции. По расходу обоих веществ в реакции определяли отношение констант скоростей исследуемой реакции (k1) и конкурирующей реакции (k2) согласно уравнению:
(1)
${{\ln \left( {\frac{{{{{\left[ {{{{\text{C}}}_{6}}{{{\text{H}}}_{6}}} \right]}}_{0}}}}{{\left[ {{{{\text{C}}}_{6}}{{{\text{H}}}_{6}}} \right]}}} \right)} \mathord{\left/ {\vphantom {{\ln \left( {\frac{{{{{\left[ {{{{\text{C}}}_{6}}{{{\text{H}}}_{6}}} \right]}}_{0}}}}{{\left[ {{{{\text{C}}}_{6}}{{{\text{H}}}_{6}}} \right]}}} \right)} {\ln \left( {\frac{{{{{\left[ {{\text{Конкурент}}} \right]}}_{0}}}}{{\left[ {{\text{Конкурент}}} \right]}}} \right)}}} \right. \kern-0em} {\ln \left( {\frac{{{{{\left[ {{\text{Конкурент}}} \right]}}_{0}}}}{{\left[ {{\text{Конкурент}}} \right]}}} \right)}} = {{\left( {{{{{k}_{1}}} \mathord{\left/ {\vphantom {{{{k}_{1}}} {{{k}_{2}}}}} \right. \kern-0em} {{{k}_{2}}}}} \right)}_{{{\text{эксп}}}}},$где [C6H6]0, [Конкурент]0 и [C6H6], [Конкурент] – концентрации исследуемого вещества и вещества-конкурента в реакциях без атомарного фтора и после ввода его в реакционную смесь, k1 – константа скорости реакции бензола с атомарным фтором, k2 – константа скорости реакции конкурирующего вещества с атомарным фтором, (k1/k2)эксп – экспериментально определенное отношение константы скорости реакции бензола с атомарным фтором к константе скорости реакции конкурирующего вещества с атомарным фтором. Использованный метод конкурирующих реакций позволяет сравнить результаты, полученные различными экспериментальными методиками.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение масс-спектра бензола
Выбор веществ-конкурентов должен отвечает двум критериям:
1. Масс-спектры исследуемых веществ не должны перекрываться.
2. Величины констант скорости реакции исследуемого вещества и веществ-конкурентов должны не сильно отличаться друг от друга.
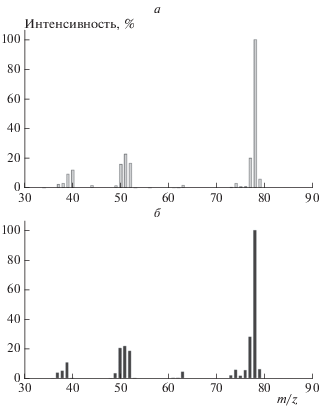
В предварительных опытах было проведено измерение масс-спектра бензола при ионизации электронным ударом, который сравнивался со спектром, известным из базы данных NIST [8]. Энергия электронов составила 70 эВ. Напуск реагентов в смеси с гелием и продуктов реакции, включая свободные радикалы, в ионный источник масс-спектрометра осуществляли в виде молекулярного пучка, что обеспечивало минимальное влияние гетерогенных процессов на стенках электродов ионного источника. Оба спектра представлены на рис. 2 для диапазона значений m/z = 30–90, в котором расположены 20 наиболее интенсивных пиков. Полученный нами масс-спектр оказался подобен спектру NIST. В обоих масс-спектрах присутствует наиболее интенсивный молекулярный пик с m/z = 78.
Определение k1 с использованием реакций атомов фтора с реагентами-конкурентами
Конкурирующие реакции были подобраны так, чтобы бензол можно было бы детектировать по линии с m/z = 78, а молекул конкурентов – по наиболее интенсивной линии масс-спектра. На рис. 3. приведены совместные масс-спектры бензола и ТХК (а), бензола и ТФК (б), бензола и циклогексана (в). Из этих рисунков видно, что основные линии масс-спектров этих соединений не пересекаются с линиями бензола, поэтому расход веществ детектировался по следующим линиям масс-спектров: бензол – на молекулярной линии с m/z = 78, циклогексан – на молекулярной линии с m/z = 84, ТФК и ТХК – на линиях осколков COOH+ с m/z = = 45.
Кинетические эксперименты
Реакции изучались в проточном реакторе при температуре 293 K и давлении 1 мбар: определяли концентрации бензола и вещества-конкурента в отсутствие атомов фтора и в реакции с атомами. При различной подаче реагентов производили несколько десятков таких измерений.
Отношение констант k1/k2= (k1/k2)эксп определено из наклона прямой линии, полученного в результате линейного регрессионного анализа, согласно уравнению (1):
(2)
${{k}_{1}} = {{\left( {{{{{k}_{1}}} \mathord{\left/ {\vphantom {{{{k}_{1}}} {{{k}_{2}}}}} \right. \kern-0em} {{{k}_{2}}}}} \right)}_{{{\text{эксп}}}}}{{k}_{2}},$Рис. 4.
Зависимость глубины превращения бензола в реакции с атомарным фтором по отношению к глубине превращения циклогексана в реакциях с атомарным фтором.

Одним из продуктов реакции бензола и атомарного фтора является фторбензол. Это подтверждается тем, что в масс-спектрометре во время проведения эксперимента были зарегистрированы пики, которые соответствуют определенному нами ранее спектру фторбензола. При подаче бензола в отсутствие атомарного фтора не удалось зарегистрировать наличие фторбензола в проточном реакторе. Из данных, приведенных на рис. 4, получено следующее отношение: (k1/k2)эксп = 0.99 ± 0.04. Используя значение константы скорости реакции атомов фтора с циклогексаном k2 = 1.3 ⋅ 10–10 cм3 ⋅ ⋅ молекула–1 ⋅ с–1 [9], получаем величину константы скорости реакции атомов фтора с бензолом:
Зависимость глубины превращения бензола в реакции с атомарным фтором по отношению к глубине превращения трихлоруксусной кислоты в реакциях с атомарным фтором представлена на рис. 5. Из данных, приведенных на рис. 5, получено следующее отношение: (k1/k2)эксп = 5.4 ± 0.2.
Рис. 5.
Зависимость глубины превращения бензола в реакции с атомарным фтором по отношению к глубине превращения трихлоруксусной кислоты в реакциях с атомарным фтором.

Используя значение константы скорости реакции атомов фтора с трихлоруксусной кислотой k2 = (4.3 ± 0.8) ∙ 10–11 cм3 ∙ молекула–1 ∙ с –1 [10], получаем величину константы скорости реакции атомов фтора с бензолом: k1 = (2.3 ± 0.4) ∙ 10–10 cм3 ∙ ∙ молекула–1 ∙ с –1. Зависимость глубины превращения бензола в реакции с атомарным фтором по отношению к глубине превращения трифторуксусной кислоты в реакциях с атомарным фтором представлена на рис. 6. Из данных, приведенных на рис. 6, получено следующее отношение: (k1/k2)эксп = = 3.5 ± 0.4. Используя значение константы скорости реакции атомов фтора с трифторуксусной кислотой k2 = (4.72 ± 1.08) ∙ 10–11 cм3 ∙ молекул–1 ∙ с–1 [10], получаем величину константы скорости реакции атомов фтора с бензолом: k1 = (1.7 ± 0.8) ∙ 10–10 cм3 ∙ ∙ молекула–1 ∙ с–1.
Рис. 6.
Зависимость глубины превращения бензола в реакции с атомарным фтором по отношению к глубине превращения трифторуксусной кислоты в реакциях с атомарным фтором.

Значения (k1/k2)эксп и экспериментально полученных констант скорости реакций представлены в табл. 2, где для сравнения приведены литературные данные. Средняя константа скорости реакции рассчитана по трем экспериментам и результату нашей ранней работы [6]:
Таблица 2.
Отношения константы скорости реакции атомов фтора с бензолом к константе скорости реакции атомов фтора с веществом-конкурентом, (k1/k2)эксп, и рассчитанные значения константы скорости k1 этих реакций
| Вещество-конкурент | (k1/k2)эксп | k1, 10–10 cм3 ∙ молекула–1 ∙ с–1 |
|---|---|---|
| Циклогексан | 0.99 ± 0.04 | 1.3 ± 0.4 (настоящая работа) |
| Трихлоруксусная кислота | 5.4 ± 0.2 | 2.3 ± 0.4 (настоящая работа) |
| Трифторуксусная кислота | 3.5 ± 0.4 | 1.7 ± 0.8 (настоящая работа) |
| Метан | 4.4 ± 0.3 | 2.7 ± 0.5 [6] |
| Абсолютное измерение | – | 0.5 ± 0.1 [5] |
| Метан | – | 0.97 [3] |
4. ЗАКЛЮЧЕНИЕ
Масс-спектральным методом изучена кинетика реакции фтора с бензолом при температуре T = = 293 K с использованием метода конкурирующих реакций. Реакция изучена в проточном реакторе низкого давления. В качестве конкурирующих реакций использовались реакции атомов фтора с циклогексаном, трифторуксусной и трихлоруксусными кислотами. Впервые определены соотношения констант скорости исследуемой и этих конкурирующих реакций. На основе полученных данных рассчитана средняя константа скорости реакции атомов фтора с бензолом: kср (293 K) = (2.0 ± 0.6) ∙ ∙ 10–10 см3 ∙ молекула–1 ∙ с–1. В продуктах реакции зарегистрирован фторбензол. Следует отметить, что настоящая работа продолжает систематические исследования ФИЦ ХФ РАН влияния органических загрязнителей на окружающую среду в водной [11–13] и газовой [10, 14] средах.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации (регистрационный номер АААА-А20-120021390044-2) и поддержана грантом Российского фонда фундаментальных исследований (№ 19-05-50076 – Микромир).
Список литературы
Bruckner J.V., Anand S.S., Warren D.A. // Casarett and Doull’s Toxicology: The Basic Science of Poisons. 7th edition. Ch. 24. Ed. Klaasen C.D. N.Y.: McGraw Hill Medical, 2008. P. 1007.
Омельяненко Л.М., Сенкевич Н.А. Клиника и профилактика отравлений бензолом. М.: Медгиз, 1957.
Smith D.J., Setser D.W., Kim K.C. et al. // J. Phys. Chem. 1977. V. 81. № 9. P. 898; https://doi.org/10.1021/j100524a019
Moehlmann J.G., McDonald J.D. // J. Chem. Phys. 1975. V. 62. № 8. P. 3061; https://doi.org/10.1063/1.430904
Ebrecht J., Hack W., Wagner H.G. // Ber. Bunsenges. Phys. Chem. 1989. V. 93. № 5. P. 619; https://doi.org/10.1002/bbpc.19890930520
Васильев Е.С., Волков Н.Д., Карпов Г.В. и др. // ЖФХ. 2020. Т. 94. № 10. С. 1484; https://doi.org/10.31857/S0044453720100295
Васильев Е.С., Морозов И.И., Хак В. и др. // Кинетика и катализ. 2006. Т. 47. № 6. С. 859.
“Mass Spectra” in NIST Chemistry WebBook. NIST Standard Reference Database Number 69 / Eds. Linstron P.J., Mallard W.G. Gaithersburg MD: National Institute of Standards and Technology, 2018.
Pearson R.K., Cowles J.O., Hermann G.L. et al. // IEEE J. Quantum Electron. 1973. V. 9. P. 723; https://doi.org/10.1109/JQE.1973.1077725
Vasiliev E.S., Morozov I.I., Karpov G.V. // Intern. J. Chem. Kinet. 2019. V. 51. P. 909; https://doi.org/10.1002/kin.21319
Васильев Е.С., Карпов Г.В., Волков Н.Д. и др. // Хим. физика. 2021. Т. 40. № 3. С. 17; https://doi.org/10.31857/S0207401X20120171
Карпов Г.В., Виноградова О.А., Васильев Е.С. и др. // Хим. физика. 2018. Т. 37. № 7. С. 26; https://doi.org/10.1134/S0207401X18070087
Карпов Г.В., Васильев Е.С., Волков Н.Д. и др. // Хим. физика. 2020. Т. 39. № 10. С. 40; https://doi.org/10.31857/S0207401X20100076
Дьяков Ю.А., Пузанков А.А., Адамсон С.О. и др. // Хим. физика. 2020. Т. 39. № 10. С. 3; https://doi.org/10.31857/S0207401X20100040
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика