Химическая физика, 2021, T. 40, № 11, стр. 9-13
Окисление молекулярным кислородом тройной системы эпоксид циклогексена – хлорид меди(II) – ионол
Л. В. Петров 1, *, В. М. Соляников 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: plv@icp.ac.ru
Поступила в редакцию 04.02.2021
После доработки 19.02.2021
Принята к публикации 22.02.2021
Аннотация
Впервые изучено окисление тройной системы эпоксид – хлорид Cu(II) – ароматический спирт, содержащей эпоксидное производное алициклического ряда. Концентрационная зависимость скорости поглощения кислорода тройной системой ЦЭ – CuCl2 – ИОЛ, где ЦЭ – эпоксид циклогексена, ИОЛ – ионол, выражается как V = k [ЦЭ]0 [CuCl2]0.6[ИОЛ]0.7 при [ЦЭ] $ \gg $ [ИОЛ] > [CuCl2] в растворе метанола. Аррениусовская зависимость эффективной константы скорости окисления в интервале температур 313–328 К имеет вид k = 8.0 · 106exp(–54.0/RT). Предложен механизм реакции, в основе которого лежит катализированный хлоридом меди перенос электрона от OH-связи замещенного фенола на C–O-связь эпоксида с образованием оксиалкильного радикала. Выход свободных радикалов, оцененный по величине отношения скорости поглощения кислорода к скорости расходования эпоксида, составляет около 50%.
ВВЕДЕНИЕ
Катализированные кислотами превращения эпоксидов в подавляющем большинстве являются реакциями гетеролитическими [1]. Недавно показано, что расходование эпоксида стирола (ЭС) под действием сильных кислот в спиртовом растворе происходит двумя путями. Основной маршрут – гетеролитический [2]. Параллельно ему идет реакция с разрывом связей ЭС C–C и C–O с появлением фрагмента эпоксида, содержащего ненасыщенный атом углерода со свободной парой электронов. Эти активные промежуточные частицы: карбены, фенилметилены, способны реагировать с кислородом [3] и с гидропероксидами [4]. Поглощение O2 тройными медьсодержащими системами, включающими ЭС, по-видимому, связано с образованием в качестве промежуточных частиц свободных радикалов. Парадоксальным выглядит то обстоятельство, что необходимыми компонентами этих легкоокисляющихся систем являются ароматические спирты: гидрохинон [5], α-нафтол [6], 2,6-ди-трет-бутил-4-метилфенол (ионол) [7], известные акцепторы свободных радикалов и широко используемые ингибиторы радикального окисления углеводородов кислородом. Существенный элемент новизны в постановке данной работы состоит в том, что во всех предыдущих исследованиях по изучению радикальной составляющей процессов катализированного превращения использовали эпоксид стирола в качестве непременного компонента двойных (с кислотой) и тройных (с металлом) систем. В работе изучали окисление тройной системы (ТрС) эпоксид циклогексена – хлорид меди(II) – ионол (ЦЭ–Cu(II)–ИОЛ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Метанол и ионол, использованные в работе, предварительно очищали: метанол ректифицировали, ионол перекристаллизовывали из этанола. Дигидрат хлорида меди(II) марки “Ч” и эпоксид циклогексена производства компании Sigma-Aldrich (USA) с содержанием основного продукта 98% использовали без какой-либо предварительной подготовки.
Опыты по окислению тройной системы ЦЭ–CuCl2–ИОЛ проводили в кварцевых реакторах на манометрической установке при постоянном давлении кислорода. Время опыта отсчитывали с момента погружения реактора в термостатирующую жидкость. Опытным путем проверяли независимость скоростей окисления от частоты встряхивания реактора, т.е. от интенсивности перемешивания рабочего раствора.
Скорости расходования ЦЭ и ИОЛ находили по данным опытов в стеклянной барботажной ячейке. Отобранные в ходе опытов пробы анализировали на содержание ЦЭ и ИОЛ методом газожидкостной хроматографии. Анализ проводили с использованием стальной колонки (1200 × 3 мм), заполненной носителем Chromaton N-AW, с 15% неподвижной фазы Carbowax-6000. Температура колонки при анализе ЦЭ – 85 °C, анализ ИОЛ проводили при 156 °C, температура испарителя в обоих случаях составляла 170 °C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
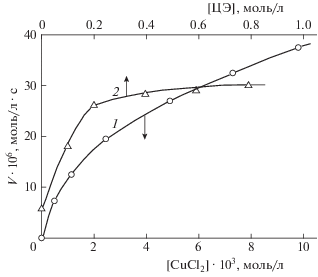
Примеры кинетических кривых окисления приведены на рис. 1: поглощение кислорода начинается на 3-й минуте, в течение 2 мин реакционная смесь прогревается до температуры опыта. Скорости окисления определяли как тангенсы углов наклона начальных участков кинетических кривых поглощения кислорода. Как следует из данных серии опытов, проведенных с различными концентрациями ионола (кривые 1–5 рис. 1), при наибольшей из них (кривая 5) число каталитических оборотов медного катализатора в брутто-процессе окисления (отношение [O2]погл/[CuCl2]) равно четырем. В отсутствие ИОЛ, по своей природе ингибитора окисления углеводородов, окисление не идет (кривая 1 рис. 1), т.е. двойная система ЦЭ–CuCl2 кислород не поглощает. Доказательством окисляемости именно тройной системы является также сам вид концентрационных зависимостей скорости окисления V от [ИОЛ] (кривая 1 рис. 2), а также от [CuCl2] и [ЦЭ] (кривые 1 и 2 рис. 3). Кривые зависимости V от концентраций соли меди и ионола идут строго из нуля координат, т.е. пары ИОЛ–ЦЭ и CuCl2–ЦЭ кислород не поглощают. Поглощение кислорода двойной системой CuCl2–ИОЛ заметно по небольшому отсечению на оси ординат (зависимость 2 рис. 3), вклад его уменьшается с увеличением [ЦЭ]. В целом, вид кривых зависимостей V от [ЦЭ], [CuCl2] и [ИОЛ] свидетельствует о сложности механизма окисления тройной системы. Частные порядки реакции по ионолу и соли меди, рассчитанные по данным кривых 1 рис. 2 и 3, равны 0.7 и 0.6 соответственно. Выражение скорости через концентрации реагентов системы имеет вид V = k [ЦЭ]0 [CuCl2]0.6[ИОЛ]0.7 при [ЦЭ] $ \gg $ [ИОЛ] > [CuCl2], 323 K. В опытах по окислению ТрС при температурах 313.5, 317.5, 323 и 328 K при [ЦЭ] = 0.29, [CuCl2] = 2.5 ∙ 10–3, [ИОЛ] = = 0.02 моль/л получены следующие величины скорости поглощения кислорода: 14 ∙ 10–6, 18 ∙ 10–6, 25 ∙ 10–6 и 32.5 ⋅ 10–6 моль/л ∙ с соответственно. Этой температурной зависимости соответствует величина брутто-энергии активации (54 ± 4) кДж/моль, аррениусовская зависимость эффективной константы скорости окисления при 313–328 К имеет вид k = 8.0 ∙ 106 exp (–54.0/RT).
Рис. 1.
Кинетические кривые поглощения кислорода растворами тройной системы ЦЭ–CuCl2–ИОЛ в метаноле при 323 K, [ЦЭ] = 0.29 моль/л, [CuCl2 ∙ 2H2O] = = 2.5 ∙ 10–3 моль/л и следующих концентрациях ИОЛ: 1 – 0, 2 – 3.3 ∙ 10–3, 3 – 6.9 ∙ 10–3, 4 – 9.9 ∙ 10–3, 5 – 0.0205 моль/л.

Рис. 2.
Зависимость скорости окисления тройной системы ЦЭ–CuCl2–ИОЛ в растворителе метаноле при 323 К, [ЦЭ] = 0.29 моль/л, [CuCl2] = 2.5 ∙ 10–3 моль/л от [ИОЛ] (1) и от объемного содержания кислорода в газе-окислителе – смеси O2 с Ar при [ИОЛ] = = 0.0205 моль/л (2).

Рис. 3.
Зависимости скорости окисления тройной системы ЦЭ–CuCl2–ИОЛ от [CuCl2] при [ЦЭ] = = 0.29 моль/л и [ИОЛ] = 1.37 ∙ 10–2 моль/л (1) и от [ЦЭ] при [CuCl2] = 4.9 ∙ 10–3 моль/л (1) и [ИОЛ] = 1.37 ∙ ∙ 10–2 моль/л (2) (растворитель – метанол, 323 K).
Важная информация о реакции получена из опытов в барботажной ячейке. Из отношения величин скоростей поглощения O2 и расходования ЦЭ определен выход свободных радикалов в расчете на израсходованный эпоксид. Данные этих опытов приведены на рис. 4, 5. Средняя скорость расходования ЦЭ по данным, полученным из кривых 1, 2 рис. 4 (барботаж кислорода), равна VЦЭ = 2.8 ∙ 10–5 моль/л ∙ с. Расходование ИОЛ в этих условиях идет с начальной скоростью VИОЛ = = 1.96 ∙ 10–5 моль/л ∙ с по усредненным данным (штриховая линия) кривых 1, 2 рис. 5. Скорость расходования эпоксида в ~1.5 раза больше скорости расходования ИОЛ. В этих условиях ${{V}_{{{{{\text{O}}}_{2}}}}}$ = 1.5 ∙ ∙ 10–5 моль/л ∙ с (манометрические измерения) отношение ${{{{V}_{{{{{\text{O}}}_{2}}}}}} \mathord{\left/ {\vphantom {{{{V}_{{{{{\text{O}}}_{2}}}}}} {{{V}_{{{\text{ЦЭ}}}}}}}} \right. \kern-0em} {{{V}_{{{\text{ЦЭ}}}}}}}$ ≈ 0.53, выход радикалов равен ≈53% в расчете на израсходованный эпоксид. Это высокий показатель, который сопоставим, например, с выходом в объем радикалов из азобисизобутиронитрила – известного радикального инициатора.
Рис. 4.
Кинетические кривые расходования эпоксида циклогексена при [ЦЭ] ~ 0.3 моль/л, [ИОЛ] = 0.02 моль/л, [CuCl2 ∙ 2H2O] = 2.5 ∙ 10–3 моль/л в растворе метанола при 313 K: 1, 2 – барботаж O2, 3 – барботаж Ar.
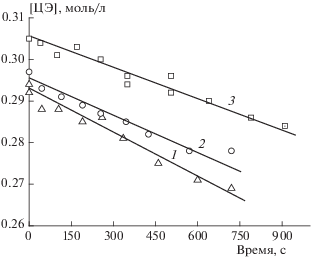
Рис. 5.
Кинетические кривые расходования ионола при [ЦЭ] ~ 0.3 моль/л, [ИОЛ] = 0.02 моль/л, [CuCl2 ∙ 2H2O] = 2.5 ∙ 10–3 моль/л в метаноле при 313 K: 1, 2 – барботаж O2, 3 – барботаж Ar.

Ниже обобщены результаты и обозначены проблемы изучения медьсодержащих ТрС в общем и тройной системы ЦЭ–CuCl2–ИОЛ в частности (см. табл. 1). Сходство четырех систем, представленных в табл. 1, прежде всего в том, что это синергистические системы. Скорость окисления VТрС $ \gg $ Σ VДС, где Σ VДС – сумма скоростей окисления входящих в систему пар эпоксид – CuCl2, эпоксид – ароматический спирт, CuCl2 – ароматический спирт. Низкие величины энергий активации свойственны окислению тройных систем. Для сравнения: окислению двойной системы ЭС – п-толуолсульфокислота отвечает величина Eа > > 80 кДж/моль [2]. Судя по сообщению [7] и по данным представленной работы, способность образовывать в присутствии CuCl2 легкоокисляемые системы свойственна ряду эпоксидов и ароматических спиртов. Соответственно, сама тематика изучения такого рода окисления при надлежащем интересе может оказаться большой по объему и трудозатратам.
Таблица 1.
Кинетические характеристики реакций окисления тройных систем эпоксид – CuCl2 – ароматический спирт молекулярным кислородом
| Тройная система, среда | k | V/k | Порядок по O2 |
Ссылки |
|---|---|---|---|---|
| ЭС–CuCl2–αНФ, CH3OH | 2.5 ∙ 106 exp(–44/RT) | [ЭС]1[Cu]1[α-НФ]0.7 | 1 | [6] |
| ЭС–CuCl2–ИОЛ, CH3OH | 4.8 ∙ 106 exp(–50.2/RT) | [ЭС]0.4[Cu]0.5[ИОЛ]1 | 1 | [7] |
| ЦЭ–CuCl2–ИОЛ, CH3OH | 8.0 ∙ 106 exp(–54/RT) | [ЦЭ]0[Cu]0.6[ИОЛ]0.7 | 1 | Настоящая работа |
| ЭС–CuCl2–ГХ, ButOH–H2O (4 : 1) | 92.5 exp(–22/RT) | [ЭС]0[Cu]1[ГХ]0 | ~1 | [5] |
Сложности изучения тройных систем наглядно представлены в третьем столбце табл. 1: наблюдается такое различие концентрационных выражений скорости, что сколько-то адекватный и универсальный подбор кинетической модели окисления практически невозможен. Поэтому целесообразна попытка, осторожно выражаясь, обозначить хотя бы приблизительно вероятную основную линию механизма начальной макростадии окисления, определить тип механизма окислительного превращения тройной системы ЦЭ–CuCl2–ИОЛ. Для выбора типа механизма окисления ТрС существенно то, что катализатором реакции является соль меди. Соединения меди не обладают способностью кислот Льюиса катализировать процессы гетеролиза, но катализируют реакции с переходом одного электрона, например радикальное разрушение гидропероксидов. Предположительно, окисление ТрС есть сложная реакция окисления ароматического спирта, сопряженная с образованием из эпоксида свободного радикала, а не карбена, как в случае двойной системы ЭС–кислота [3]. Обратимся к данным рис. 3 (кривая 2). При [ЦЭ] = 0 двойная система Cu(II)–ИОЛ поглощает кислород с малой скоростью: ~5 ∙ 10–6 моль/л ∙ с (см. отсечение на оси ординат отрезка кривой рис. 3). Детальный механизм окисления ИОЛ в метаноле с катализатором CuCl2 неизвестен, но установлено, что химическое окисление фенолов до соответствующих радикалов включает не отрыв атома водорода, а перенос одного электрона с последующим отщеплением протона от образующегося катион-радикала [8]. Не вдаваясь в детали, запишем для двойной системы CuCl2–ИОЛ последовательность трех брутто-реакций с поглощением в итоге молекулы O2:
(1)
${\text{C}}{{{\text{u}}}^{{{\text{II}}}}}{\text{Cl}} + {\text{HO}}{\kern 1pt} - {\kern 1pt} {\text{Ar}} \to {\text{C}}{{{\text{u}}}^{{\text{I}}}}{\text{Cl}} + {{{\text{H}}}^{ + }} + {\text{Ar}}{{{\text{O}}}^{\centerdot }},$(2)
${\text{C}}{{{\text{u}}}^{{\text{I}}}}{\text{Cl}} + {{{\text{O}}}_{{2~}}} \to {\text{C}}{{{\text{u}}}^{{{\text{II}}}}}{\text{Cl}} + {\text{O}}_{2}^{{\centerdot - }},$В полярном растворе метанола хлорид CuCl2 ∙ ∙ H2O присутствует в двух хлорсодержащих формах: в форме исходной соли и в форме монохлорида CuII, образующегося при диссоциации CuCl2 → → CuIICl + Cl–. Выбор активной единицы CuIICl сделан на основе данных работы [7]: хлор-ион необходим как участник окисления тройной системы. Отсечение на оси ординат отрезка (кривая 2 рис. 3) предположительно есть следствие протекания реакций (1)–(3) в отсутствие ЦЭ. В основу гипотетического механизма окисления тройной системы ЦЭ–CuCl2–ИОЛ положено допущение того, что реакция (1) входит в него составной частью:
В соответствии с (4) в переходном комплексе синхронно перемещаются два электрона: один от связи O–H ароматического спирта к атому меди, другой – от атома меди на связь C–O эпоксида. Возможно, электрон от связи ArO–H прямо передается на связь С–О оксиранового цикла через электронную систему атома меди. Оксиалкильный радикал R•, предположительно, есть частица, ответственная за поглощение O2 тройной системой. Поглощение кислорода в этой интерпретации есть хорошо известная реакция, одна из основных реакций механизма окисления углеводородов: R• + O2 → ${\text{RO}}_{{\text{2}}}^{ \bullet }.$ В оксидате тройной системы невозможно продолжение цепи окисления по реакции ${\text{RO}}_{{\text{2}}}^{ \bullet }$ + RH. Пероксидный радикал гибнет или по реакции с акцептором ионолом, или реагирует с арилоксильным радикалом.
Выявленная для окисления ряда ТрС зависимость скорости от содержания кислорода в газе-окислителе (см. табл. 1) противоречит предложенному механизму: при радикальном (радикально-цепном) окислении скорость перестает возрастать с увеличением [O2] уже при менее чем 10%-ном его содержании в газовой смеси. Такой тип кислородной зависимости (жаргонный термин – “запределивание”) есть следствие присоединения кислорода к алкильным радикалам с высокими константами скорости: k = 107–109 л/моль ∙ с [9]. Возможной причиной зависимости величины VТрС (табл. 1, рис. 2) от [O2] может быть протекающая в оксидате реакция с участием радикала R•. Скорость такой реакции должна быть соизмеримой со скоростью V = k [R•][O2]. Рассмотрение вариантов и поиск возможных реакций – конкурентов реакции R• + O2 привел к следующему выводу: реакция монохлорида двухвалентной меди (CuIICl) с алкильными радикалами R• вполне может конкурировать с реакцией R• + O2. В растворе ацетонитрила CuIICl реагирует с алкильными радикалами, перенос лиганда – хлора происходит по реакции
из-за близости величин k и k'. Экспериментальные значения концентраций [CuCl2 ∙ 2H2O] ≤ 10–2 моль/л (рис. 3), а концентрация O2 в растворе метанола при его давлении 1 атм и температуре 40 °C составляет ~5 ⋅ 10–3 моль/л [11], т.е. V/V ' ≈ 1. Следовательно, изменение [O2] может влиять на ${{V}_{{{{{\text{O}}}_{{\text{2}}}}}}},$ что и наблюдается на опыте. Объяснить иным образом зависимость VТрС от содержания кислорода в газовой смеси трудно.
ЗАКЛЮЧЕНИЕ
Использование в окисляющейся тройной системе новой эпоксидной компоненты, эпоксида циклогексена, доказывает, что окисление такого рода – не частный случай, а реакция, свойственная ряду ароматических спиртов и эпоксидов, способных реагировать с кислородом в тройной системе, включающей в качестве катализатора хлорид меди. Впервые представлена версия механизма окисления такого рода.
Работа выполнена по теме госзадания (регистрационный номер АААА-А19-119071890015-6).
Список литературы
Parker R.E., Isaacs N.S. // Chem. Revs. 1959. V. 59. № 4. P. 737.
Петров Л.В., Соляников В.М. // Нефтехимия. 1999. Т. 39. № 2. С. 107.
Спирин М.Г., Бричкин С.Б., Петров Л.В. // Изв. АН. Сер. хим. 2016. № 10. С. 2452.
Петров Л.В., Соляников В.М. // Нефтехимия. 2005. Т. 45. № 3. С. 225.
Петров Л.В., Соляников В.М. // Хим. физика. 2020. Т. 39. № 1. С. 19.
Петров Л.В., Соляников В.М. // Изв. АН. Сер. хим. 2020. № 10. С. 1869.
Петров Л.В., Соляников В.М. // Хим. физика. 2021. Т. 40. № 7. С. 11.
Походенко В.Д., Дегтярев Л.С., Кошечко В.Г., Куц В.С. Проблемы химии свободных радикалов. Киев: Наук. думка, 1984. С. 110.
Денисов Е.Т. Константы скорости гомолитических жидкофазных реакций. М.: Наука, 1971. С. 328.
Jenkins C.L., Kochi J.K. // J. Org. Chem. 1971. V. 36. № 21. P. 3103.
Науменко Н.К. Исследование растворимости кислорода в органических жидкостях. Автореферат дис. … канд. хим. наук. Л.: ЛТИ им. Ленсовета, 1970.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика



