Химическая физика, 2021, T. 40, № 11, стр. 14-21
Термодинамическая оценка режимов некаталитической конверсии природного газа с получением синтез-газа
Е. А. Салганский 1, *, М. В. Цветков 1, А. Ю. Зайченко 1, Д. Н. Подлесный 1, И. В. Седов 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: sea@icp.ac.ru
Поступила в редакцию 29.01.2021
После доработки 11.02.2021
Принята к публикации 22.02.2021
Аннотация
На основе термодинамических расчетов проведена оценка режимов некаталитической конверсии природного газа с получением синтез-газа. Рассмотрены режимы конверсии: воздушная, паровоздушная, с повышенным содержанием кислорода, а также с повышенной начальной температурой смеси. Представлены результаты расчетов для смесей с адиабатической температурой горения не ниже 1000 К, так как при более низких температурах в продуктах появляется непрореагировавший метан. Показано, что при использовании воздуха в качестве окислителя максимальное содержание водорода и монооксида углерода в газообразных продуктах может составить 28.2 и 13.2 об.%, соответственно, при значении стехиометрического коэффициента φ = 2.6. В этом случае из 1 моль метана максимальные выходы водорода и монооксида углерода составляют 1.65 и 0.77 моль соответственно. При паровоздушной конверсии метана максимальный выход водорода и монооксида углерода меньше, чем при воздушной конверсии. При конверсии метана с повышенным содержанием кислорода максимальный выход водорода меньше, а монооксида углерода больше, чем при воздушной конверсии. Увеличение начальной температуры смеси приводит к повышению адиабатической температуры горения и выхода монооксида углерода, а также к снижению выхода водорода в продуктах.
ВВЕДЕНИЕ
Природный газ, состоящий на 80–90% из метана, – чрезвычайно важное сырье для химической промышленности, так как он является одним из основных источников получения синтез-газа. Последний используется для производства метанола, аммиака, а также чистого водорода [1–3]. Однако производство синтез-газа требует больших энергетических затрат и осуществляется преимущественно путем риформинга легких углеводородов или при парокислородной газификации угля [4, 5]. Известно достаточно большое число способов получения синтез-газа при парциальном окислении углеводородов, прежде всего природного газа [6–8]. Данная технология получила широкое распространение в связи с низкой себестоимостью: она в 2–3 раза дешевле, чем получение водорода путем электролитического разложения воды [9]. Помимо природного газа, синтез-газ также можно получать при газификации как жидких [10], так и твердых топлив [11, 12].
В связи с тем, что в последнее время водород рассматривается в качестве перспективного экологически чистого энергоносителя, возникает необходимость создания энергоэффективных крупнотоннажных производств водорода, обеспечивающих нужды и инфраструктуру водородной энергетики [13]. Наиболее дешевым способом получения водорода остается его получение из природного газа (“голубой” водород), однако существующие технологии не всегда обеспечивают приемлемую глубину извлечения водорода и сложны по причине использования быстро закоксовывающихся катализаторов. Наиболее привлекательным разрабатываемым методом получения водорода из углеводородных газов является процесс некаталитического парциального окисления [14], обладающий рядом преимуществ в сравнении с каталитическими методами и имеющий лишь термодинамические ограничения.
В работе [15] был проведен термодинамический анализ получения синтез-газа посредством парциального окисления биогаза. Было исследовано влияние различных параметров, таких как температура, давление, соотношение компонентов топлива, содержание CO2, на производство синтез-газа и образование сажи. Было показано, что повышение температуры играет ключевую роль в улучшении качества продукта и уменьшении образования сажи. В работе был предложен оптимальный рабочий режим для снижения неблагоприятных последствий увеличения давления и достижения желаемых количеств водорода и монооксида углерода. В работе [16] авторами проведен анализ результатов термодинамического расчета парового риформинга метана методом минимизации свободной энергии Гиббса для получения водорода или синтез-газа в диапазонах соотношения пар/метан от 0.5 до 3, рабочего давления от 1 до 50 бар и температуры в зоне реакции от 600 до 1200 К. Было показано, что для достижения максимального отношения Н2 к СО температура в зоне реакции должна превышать 900 К, а соотношение Н2О/СН4 должно быть в области высоких значений.
Сравнение результатов численного моделирования парового риформинга в условиях термодинамического равновесия с экспериментальными данными представлено в работе [17]. Анализ показал снижение энергетического КПД риформинга углеводородов с увеличением карбонового числа. Показано, что эффективность риформинга дизельного топлива по крайней мере на 15% ниже, чем у природного газа. В работе [18] был проведен подробный термодинамический анализ химического риформинга метана с повышенной сорбцией с использованием CaO и NiO в качестве сорбента CO2 и материала для переноса кислорода соответственно. Присутствие CaO приводит к более высокой конверсии метана при низких температурах. Добавление NiO сводит к минимуму тепловые требования и приводит к лучшим характеристикам по сравнению с использованием чистого кислорода в качестве окислителя или продувочного газа. Процесс парового риформинга биогаза, в котором эта реакция и адсорбция CO2 происходят в одном устройстве, предложен в работе [19]. Результаты показали, что концентрация H2 в продуктах парового риформинга биогаза растет с увеличением рабочих температур и соотношения пар/метан. В работе [20] с помощью термодинамического анализа изучены и сравнены характеристики реакций получения водорода в одностадийном (ATR – автотермический риформинг метана) и двухстадийном (POM + WGSR – частичное окисление метана с последующей реакцией водяного газа) процессах. Сравнение процессов ATR и POM в сочетании с WGSR, исходя из условия стехиометрического соотношения CH4 : O2 : H2O = 1 : 0.5 : 1, показывает, что двухстадийный процесс обеспечивает более высокую производительность по Н2.
По результатам исследований в области получения водорода из природного газа в режимах фильтрационного горения можно заключить, что при использовании воздуха в качестве окислителя максимальное содержание водорода в газообразных продуктах может составить 34 об.% [21]. При этом в большинстве работ максимальное содержание водорода в продуктах составило ~25 об.% [14, 22, 23]. Повысить концентрацию водорода в продуктах можно за счет применения катализаторов и/или обогащенного кислородом окислителя. Применение катализаторов позволяет значительно повысить концентрацию водорода в продуктах, которая может достигать 80 об.% в случае каталитического риформинга метана [24]. Однако последний сопровождается “отравлением” поверхности катализаторов углеродными отложениями, а следовательно, их последующей регенерацией. Использование в риформинге обогащенного кислородом окислителя, в свою очередь, сопровождается значительными энергозатратами на его производство [25, 26], и накладывает жесткие требования к технике безопасности и конструкционным материалам для создания оборудования.
Для оптимизации способов получения водородосодержащего газа методом некаталитической конверсии (парциального окисления) природного газа необходимо провести моделирование указанного процесса. Цель настоящей работы – термодинамическая оценка оптимальных условий получения водорода и синтез-газа при некаталитической конверсии природного газа при атмосферном давлении. В работе проводится сравнение двух режимов конверсии – с совместной и раздельной подачей реагентов.
МЕТОДИКА РАСЧЕТА
Расчеты с использованием моделей термодинамического равновесия для изучения поведения сложных химических систем часто применяются и описаны в промышленной и научной литературе [27, 28]. Установление фазового и химического равновесия в каждой системе является необратимым процессом и в соответствии со вторым началом термодинамики характеризуется увеличением энтропии. Таким образом, вычисление параметров равновесия изолированных многокомпонентных термодинамических систем упрощается и сводится к задаче установления состояния, характеризующегося максимальной энтропией. Применяется также подход расчета термодинамического равновесия путем поиска минимума свободной энергии Гиббса системы [16–20]. Эти подходы являются равнозначными. Для определения условий получения горючего газа с максимальным содержанием водорода и монооксида углерода проведен термодинамический анализ конверсии природного газа с помощью программы расчета высокотемпературных термохимических равновесий TERRA [27] при варьировании состава и энтальпии смеси.
Рассматривали систему, состоящую из метана, азота и кислорода, с различным содержанием водяного пара ([H2O]/[O2] = 0, 0.5, 1). Расход метана в смеси был фиксированным (1 г/с), а стехиометрический коэффициент φ, который равен отношению количества кислорода, необходимого для полного окисления метана, к подаваемому количеству кислорода варьировали в диапазоне от 1 до 2.6. Богатые топливные смеси имеют стехиометрическое отношение больше единицы, значения φ < 1 соответствуют бедным смесям, значение φ = 1 соответствует полному окислению метана до углекислого газа и воды. Расчеты проводили при атмосферном давлении (0.1 МПа). Изменяли начальную температуру реагентов и, соответственно, энтальпию, которую рассчитывали по закону Кирхгофа. При всех значениях начальной температуры условно считали, что вода находится в газообразном состоянии. В результате расчетов получили равновесный состав продуктов и значение адиабатической температуры горения. В работе не представлены результаты расчетов с адиабатической температурой горения ниже 1000 К. Скорость химической реакции имеет сильную зависимость от температуры, и при низких значениях температуры термодинамическое равновесие устанавливается довольно долго [29, 30].
Для оценки эффективности конверсии рассчитывали мольный выход водорода и СО из 1 моль метана. Из 1 моль метана максимальный выход водорода может составить 2 моль, а монооксида углерода – 1 моль.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Конверсия природного газа с воздухом и водяным паром
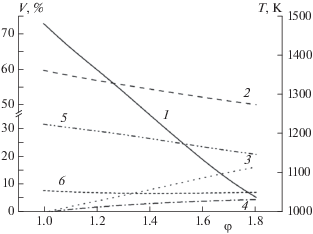
Первоначальные термодинамические расчеты проведены для простейшего случая конверсии метана с воздухом – без добавления водяного пара. На рис. 1 представлены данные расчета по составу продуктов и адиабатической температуре горения при конверсии метана с воздухом без добавления водяного пара.
Рис. 1.
Зависимости адиабатической температуры горения (T) и объемного содержания газов (V) от стехиометрического коэффициента φ при [H2O]/[O2] = 0 и [O2] = 21 об.%: 1 – температура, 2 – N2, 3 – H2, 4 – CO, 5 – H2O, 6 – CO2.

Содержание водорода линейно растет с увеличением φ: с 0 при φ = 1 до 28.2 об.% при φ = 2.6 (рис. 1). Содержание монооксида углерода логарифмически зависит от значения φ и с его увеличением изменяется от 0 до 13.2 об.%. С увеличением φ объемная доля паров воды в продуктах снижается с 18.8 до 5.7%, также снижаются концентрации азота и диоксида углерода. С повышением значения φ адиабатическая температура горения практически линейно снижается с 2148 до 1005 К. Объемное отношение водорода к монооксиду углерода изменяется в диапазоне от 0.4 до 2.1 с увеличением φ.
Максимальные выходы водорода и монооксида углерода составляют 1.65 и 0.77 моль, соответственно, при значении φ = 2.6. При этом значении φ в продуктах содержится непрореагировавший метан в количестве 0.17 об.%, что подтверждает нецелесообразность конверсии при температуре ниже 1000 К.
При добавлении пара к исходной смеси в соотношении [H2O]/[O2] = 0.5 моль/моль по сравнению со случаем без пара адиабатическая температура снижается на 250–400 К при аналогичных значениях φ (рис. 2). При паровоздушной конверсии метана содержание водорода линейно растет с увеличением φ от 0 до 23.2 об.%. С повышением значения φ объемная доля паров воды снижается с 26.1 до 12.6%, также снижаются концентрации азота и диоксида углерода. С увеличением φ содержание СО в продуктах растет от 0 до 8.5 об.%. Объемное соотношение водород/монооксид углерода изменяется в диапазоне от 0.8 до 2.7 с увеличением φ. В этом случае максимальное количество водорода наблюдается при меньших значениях φ (с учетом Т > 1000 K), а именно при φ = 2.2 [H2] = 23.2 об.% по сравнению с воздушной конверсией.
Максимальные выходы водорода и монооксида углерода составляют 1.58 и 0.58 моль, соответственно, при значении φ = 2.2. При этом значении φ в продуктах содержится непрореагировавший метан в количестве 0.02 об.%.
Расчет материального баланса показал, что в продуктах содержание паров воды превышает их начальное содержание примерно в 2–3 раза. При паровоздушной конверсии метана в случае [H2O]/[O2] = 1 моль/моль содержание водорода линейно растет с увеличением φ от 0 до 16.5 об.% (рис. 3). С повышением значения φ объемная доля паров воды в продуктах снижается с 32.0 до 21.1%. Зависимость концентрации монооксида углерода от φ аналогична предыдущим случаям, при этом содержание СО растет от 0 до 4.7 об.% с увеличением φ. При [H2O]/[O2] = 1 снижение адиабатической температуры составляет примерно 300 К для аналогичных значений φ при [H2O]/[O2] = 0.5. При φ = 1.8 в продуктах содержится непрореагировавший метан в количестве 0.002 об.%.
Максимальные выходы водорода и монооксида углерода составляют 1.36 и 0.39 моль, соответственно, при значении φ = 1.8. Таким образом, можно заключить, что при температуре горения не ниже 1000 К максимальный выход водорода и монооксида углерода реализуется для случая воздушной конверсии метана.
В продуктах содержание паров воды превышает их начальное содержание примерно в 1.5–2 раза. С увеличением содержания паров воды в исходных реагентах их объемная концентрация в продуктах возрастает, а концентрация азота падает (см. рис. 1–3).
Однако напрямую сравнивать значения объемной концентрации водорода в продуктах для различных смесей не следует, так как изменяется исходный состав реагентов. В случае добавления паров воды, например для смеси с фиксированным значением φ = 1.67, при увеличении мольного отношения [H2O]/[O2] от 0 до 1.5 выход водорода увеличивается от 0.87 до 1.39. Дальнейшее увеличение содержания паров воды приводит к падению температуры значительно ниже 1000 К, уменьшению выхода водорода и появлению в продуктах непрореагировавшего метана. С увеличением содержания паров воды выход водорода проходит через максимальное значение. Адиабатическая температура и содержание монооксида углерода монотонно снижаются с увеличением содержания паров воды.
Максимальное содержание водорода в смеси при температуре не менее 1000 K достигается в следующих случаях:
1) при φ = 2.6, [H2O]/[O2] = 0 оно равно 28.2 об.%;
2) при φ = 2.2, [H2O]/[O2] = 0.5 – 23.2 об.%;
3) при φ = 1.8, [H2O]/[O2] = 1 – 16.5 об.%.
Эти составы примем за базовые и проведем дополнительную оптимизацию выхода синтез-газа.
Конверсия природного газа с воздухом, обогащенным кислородом, и водяным паром
Главным эффектом обогащения воздуха кислородом при конверсии природного газа является повышение температуры процесса и увеличение концентрации компонентов синтез-газа: Н2 и СО. Однако на практике существует ограничение по температуре сверху, связанное со стойкостью огнеупорных материалов, и снизу, связанное с неполным расходованием метана и образованием сажи при равновесных условиях [31].
Рассмотрим случай [H2O]/[O2] = 0. Для этих случаев фиксировали значения φ, т.е. с повышением концентрации кислорода росла концентрация метана и уменьшалась концентрация азота в исходной смеси.
С повышением концентрации кислорода в смеси от 21 до 41 об.% происходит линейный рост концентрации водорода от 28.2 до 38.8 об.% и концентрации монооксида углерода от 13.2 до 21.2 об.% (рис. 4). Адиабатическая температура горения с ростом [O2] практически линейно растет от 1005 до 1285 К. Содержание диоксида углерода не зависит от начальной концентрации кислорода и равняется примерно 3–4 об.%. Содержание паров воды в продуктах возрастает, а содержание азота снижается при увеличении начальной концентрации кислорода.
Рис. 4.
Зависимости адиабатической температуры горения (T) и объемного содержания газов (V) от содержания O2 при φ = 2.6 и [H2O]/[O2] = 0. Обозначения те же, что и на рис. 1.

Повышение температуры горения при увеличении содержания кислорода в газе позволяет использовать более богатые смеси, которые при конверсии с воздухом имеют адиабатические температуры ниже 1000 К. Например, при содержании кислорода 31 об.% конверсия метана с φ = 2.9 позволяет получать газ с содержанием водорода 38.0 об.% и содержанием монооксида углерода 18.1 об.%; при этом температура горения равняется 1000 К. Максимальные выходы водорода и монооксида углерода составляют 1.62 и 0.84 моль соответственно.
При содержании кислорода 41 об.% конверсия метана с φ = 3.0 позволяет получать газ с содержанием водорода 44.3 об.% и содержанием монооксида углерода 21.4 об.%; при этом температура горения равняется 1021 К. Максимальные выходы водорода и монооксида углерода составляют 1.58 и 0.87 моль соответственно.
Рассмотрим случай паровоздушной конверсии метана при φ = 1.8 и [H2O]/[O2] = 1 с повышенным количеством кислорода в смеси (рис. 5). С повышением концентрации кислорода от 21 до 41 об.% концентрация водорода растет аналогично предыдущему случаю (см. рис. 4). Максимальное количество водорода составляет 20.7 об.%. Концентрация монооксида углерода растет от 4.7 до 13.6 об.%. Адиабатическая температура горения с ростом [O2] при φ = 1.8 и [H2O]/[O2] = 1 линейно растет от 1039 до 1662 К. Как и в предыдущем случае (см. рис. 4), содержание диоксида углерода не зависит от начальной концентрации кислорода. Содержание паров воды в продуктах возрастает, а содержание азота снижается при увеличении начальной концентрации кислорода.
Повышение температуры горения при увеличении содержания кислорода в газе позволяет использовать более богатые смеси. При содержании кислорода 31 об.% конверсия метана с φ = 2.2 и [H2O]/[O2] = 1 позволяет получать газ с содержанием водорода и монооксида углерода 28.3 и 8.3 об.%, соответственно; при этом температура горения равняется 1006 К. Максимальные выходы водорода и монооксида углерода составляют 1.26 и 0.5 моль соответственно.
При содержании кислорода 41 об.% конверсия метана с φ = 2.4 и [H2O]/[O2] = 1 позволяет получать газ с содержанием водорода и монооксида углерода 35.3 и 10.8 об.%, соответственно; при этом температура горения равняется 1007 К. Максимальные выходы водорода и монооксида углерода составляют 1.2 и 0.57 моль соответственно. Таким образом, можно заключить, что при температуре горения не ниже 1000 К максимальный выход водорода снижается, а выход монооксида углерода увеличивается в случае обогащения воздуха кислородом.
Повышение кислорода в исходной смеси при фиксированном значении отношения [H2O]/[O2] приводит к увеличению содержания пара. Однако, как было показано в предыдущем разделе, добавление пара приводит к снижению концентраций водорода и монооксида углерода. Для оптимизации получаемой газовой смеси по водороду при паровой конверсии метана проведены дополнительные термодинамические расчеты при повышенной доле кислорода. Рассматривали смеси со значениями отношения [H2O]/[O2] = 0.5 и φ = 2.2, а также [H2O]/[O2] = 1 и φ = 1.8. В этих случаях с повышением доли кислорода мы не фиксировали соотношение [H2O]/[O2], а фиксировали исходное количество пара, поэтому значение [H2O]/[O2] уменьшалось пропорционально повышению [O2]. Содержание основных горючих газов и адиабатическая температура горения в зависимости от содержания кислорода в смеси представлены в табл. 1.
Таблица 1.
Содержание основных горючих газов (CO, H2) и адиабатическая температура горения в зависимости от содержания кислорода в смеси
| [O2], об.% | [H2O]/[O2], моль/моль | φ | [CO], об.% | [H2], об.% | T, K |
|---|---|---|---|---|---|
| 0.21 | 0.5 | 2.2 | 8.5 | 23.2 | 1018 |
| 0.31 | 0.34 | 2.2 | 13.8 | 27.1 | 1271 |
| 0.41 | 0.26 | 2.2 | 17.6 | 30.3 | 1474 |
| 0.21 | 1 | 1.8 | 4.7 | 16.5 | 1039 |
| 0.31 | 0.68 | 1.8 | 9.8 | 18.9 | 1379 |
| 0.41 | 0.51 | 1.8 | 13.6 | 20.8 | 1661 |
Для оптимизированных по водороду расчетов при φ = 2.2 с повышением концентрации кислорода в смеси от 21 до 41 об.% происходит линейный рост концентрации водорода от 23.2 до 30.3 об.% и концентрации монооксида углерода от 8.5 до 17.6 об.%. Адиабатическая температура горения с увеличением [O2] от 21 до 41 об.% возрастает от 1018 до 1474 К.
Для оптимизированных по водороду расчетов при φ = 1.8 с повышением концентрации кислорода от 21 до 41 об.% рост концентрации водорода незначителен по сравнению с предыдущим случаем (φ = 2.2). Максимальное количество водорода составляет 20.8 об.%. Концентрация монооксида углерода растет от 4.7 до 13.6 об.%. Адиабатическая температура горения с ростом [O2] от 21 до 41 об.% растет от 1039 до 1663 К.
Конверсия природного газа при повышенной начальной температуре реагентов
Для увеличения эффективности конверсии метана предложен способ с раздельной подачей реагентов [32]. Раздельная подача реагентов подразумевает, что происходит подогрев одного или двух из реагентов (окислитель, пар, метан) до их попадания в зону горения. Будем предполагать, что подогревается вся смесь, т.е. задаем начальную температуру выше 298 К. Подогрев исходных реагентов происходит при организации процесса с рекуперацией энергии [33]. Для оптимальных составов рассчитываем дополнительные варианты с повышенной начальной температурой смеси, равной 400, 500 и 600 К.
Содержание и выход основных горючих газов в продуктах и адиабатическая температура горения в зависимости от начальной температуры смеси для случаев воздушной и паровоздушной конверсии метана представлены в табл. 2. Увеличение начальной температуры смеси приводит к повышению адиабатической температуры горения, концентрации и выхода монооксида углерода в продуктах. Содержание и выход водорода при этом снижаются. Увеличение начальной температуры смеси на каждые 100 К приводит к повышению адиабатической температуры примерно на ту же величину. При этом зависимость между концентрациями продуктов и начальной температурой смеси довольно слабая.
Таблица 2.
Содержание и выход (YCO, ${{Y}_{{{{H}_{2}}}}}$) основных горючих газов и адиабатическая температура горения в зависимости от начальной температуры смеси
| Т0, К | [H2O]/[O2], моль/моль | φ | [CO], об.% | YCO | [H2], об.% | ${{Y}_{{{{{\text{H}}}_{2}}}}}$ | T, K |
|---|---|---|---|---|---|---|---|
| 298 | 0 | 2.6 | 13.2 | 0.77 | 28.2 | 1.65 | 1005 |
| 400 | 0 | 2.6 | 13.8 | 0.81 | 28.0 | 1.64 | 1076 |
| 500 | 0 | 2.6 | 14.3 | 0.84 | 27.6 | 1.62 | 1155 |
| 600 | 0 | 2.6 | 14.6 | 0.86 | 27.2 | 1.59 | 1241 |
| 298 | 1 | 1.8 | 4.7 | 0.39 | 16.5 | 1.36 | 1039 |
| 400 | 1 | 1.8 | 5.3 | 0.44 | 16.1 | 1.33 | 1112 |
| 500 | 1 | 1.8 | 5.9 | 0.49 | 15.6 | 1.28 | 1193 |
| 600 | 1 | 1.8 | 6.4 | 0.53 | 15.1 | 1.24 | 1279 |
На рис. 6 представлена зависимость предельного значения стехиометрического коэффициента (φ*) от начальной температуры смеси для случаев воздушной (линия 1) и паровоздушной (линия 2) конверсии метана. Под предельным значением понимается такое значение φ*, при котором адиабатическая температура равняется 1000 ± 5 К. При увеличении начальной температуры смеси повышается адиабатическая температура горения (см. табл. 2), что позволяет использовать более богатые смеси, для которых температура горения будет не ниже 1000 К. Из графика видно, что с увеличением начальной температуры смеси увеличивается значение φ*, при котором температура горения равняется 1000 К. Для начальной температуры 1000 К наблюдается нулевой эффект реакции, т.е. выделившееся тепло экзотермических реакций полностью ушло на поглощение в эндотермических реакциях. В случае воздушной конверсии метана нулевой эффект реакции реализуется для смеси с φ* = 5.2, а в случае паровоздушной ([H2O]/[O2] = = 1) – при φ* = 3.4.
Рис. 6.
Зависимость предельного значения стехиометрического коэффициента (φ*) от начальной температуры смеси (Т0): 1 – [H2O]/[O2] = 0, 2 – [H2O]/[O2] = 1.

Для смесей с предельным значением стехиометрического коэффициента в продуктах наблюдается непрореагировавший метан. Его содержание колеблется от десятых долей до нескольких объемных процентов. Таким образом, можно заключить, что конверсия метана с температурой горения ниже 1000 К нецелесообразна.
ЗАКЛЮЧЕНИЕ
В работе рассмотрены следующие режимы конверсии метана: воздушная, паровоздушная, с повышенным содержанием кислорода, а также с повышенной начальной температурой смеси. Представлены результаты расчетов для смесей с адиабатической температурой горения не ниже 1000 К, так как при более низких температурах в продуктах появляется непрореагировавший метан.
По результатам исследований можно заключить, что при парциальном окислении природного газа с воздухом в качестве окислителя максимальное содержание водорода и монооксида углерода в газообразных продуктах может составить 28.2 и 13.2 об.%, соответственно, при значении φ = 2.6. В этом случае из 1 моль метана максимальные выходы водорода и монооксида углерода составляют 1.65 и 0.77 моль соответственно.
Добавление пара в газообразный окислитель приводит к снижению температуры процесса и объемного содержания монооксида углерода в продуктах для фиксированного значения стехиометрического коэффициента. С увеличением содержания пара в исходной смеси концентрация водорода повышается, достигая максимального значения, после чего начинает снижаться. Однако при паровоздушной конверсии метана для смесей с адиабатической температурой горения не ниже 1000 К максимальный выход водорода и монооксида углерода меньше, чем при воздушной конверсии.
Повышая концентрацию кислорода при конверсии метана, можно увеличить содержание водорода и монооксида углерода, но при этом увеличивается температура горения. С повышением концентрации кислорода в исходной смеси от 21 до 41 об.% происходит практически линейный рост концентрации водорода от 28.2 до 38.8 об.% и концентрация монооксида углерода от 13.2 до 21.2 об.% при использовании воздуха в качестве окислителя при φ = 2.6. Температура горения при этом увеличивается на 280 К.
Повышение температуры горения при увеличении содержания кислорода в газе позволяет использовать более богатые смеси, для которых при конверсии с воздухом характерны низкие температуры. Так, при содержании кислорода 31 об.% конверсия метана с φ = 2.9 позволяет получать газ с содержанием водорода и монооксида углерода 38.0 и 18.1 об.%, соответственно; при этом температура горения равняется 1000 К. Максимальные выходы водорода и монооксида углерода составляют 1.62 и 0.84 моль соответственно.
При содержании кислорода 41 об.% конверсия метана с φ = 3.0 позволяет получать газ с содержанием водорода и монооксида углерода 44.3 и 21.4 об.%, соответственно; при этом температура горения равняется 1021 К. Максимальный выход водорода и монооксида углерода составляет 1.58 и 0.87 моль соответственно. Таким образом, при конверсии метана с повышенным содержанием кислорода для смесей с адиабатической температурой горения не ниже 1000 К максимальный выход водорода меньше, а выход монооксида углерода больше, чем при воздушной конверсии.
Увеличение начальной температуры смеси приводит к повышению адиабатической температуры горения, концентрации и выхода монооксида углерода в продуктах. Содержание и выход водорода при этом снижаются. Увеличение начальной температуры смеси на каждые 100 К приводит к повышению адиабатической температуры примерно на ту же величину. При этом зависимость между концентрациями продуктов и начальной температурой смеси довольно слабая.
Термодинамический расчет равновесных параметров парциального окисления природного газа позволяет получить оценку сверху по составу продуктов и температуре процесса.
Исследование выполнено в рамках госзадания (регистрационный номер № АААА-А19-119022690098-3).
Список литературы
Chen F., Zhang P.P., Zeng Y. et al. // Appl. Catal. B: Environ. 2020. V. 279. ID 119382; https://doi.org/10.1016/j.apcatb.2020.119382
Bodhankar P., Patnaik S., Kale G.R. // Intern. J. Energ. Res. 2020; https://doi.org/10.1002/er.6283
Ebrahimi P., Kumar A., Khraisheh M. // Emerg. Mater. 2020. P. 881; https://doi.org/10.1007/s42247-020-00116-y
Gao N., Śliz M., Quan C., Bieniek A., Magdziarz A. // Renew. Energy. 2021. V. 167. P. 652; https://doi.org/10.1016/j.renene.2020.11.134
Рубцов Н.М., Виноградов А.Н., Калинин А.П. и др. // Хим. физика. 2019. Т. 38. № 4. С. 53; https://doi.org/10.1134/S0207401X19040101
Tu X., Gallon H.J., Twigg M.V., Gorry P.A., Whitehead J.C. // J. Phys. D: Appl. Phys. 2011. V. 44. № 27. ID 274007; https://doi.org/10.1088/0022-3727/44/27/274007
Wang C., Wang B., Liu S., Zou J. // ChemistrySelect. 2020. V. 5 № 44. P. 13781; https://doi.org/10.1002/slct.202002890
Буравцев Н.Н., Колбановский Ю.А., Россихин И.В., Билера И.В. // Хим. физика. 2019. Т. 38. № 3. С. 30; https://doi.org/10.1134/S0207401X19030026
Timmerberg S., Kaltschmitt M., Finkbeiner M. // Energy Convers. Manage.: X. 2020. V. 7. P. 100043;https://doi.org/10.1016/j.ecmx.2020.100043
Зайченко А.Ю., Глазов С.В., Салганский Е.А. и др. // Теорет. основы хим. технологии. 2017. Т. 51. № 5. С. 525; https://doi.org/10.7868/S0040357117050153
Тереза А.М., Агафонов Г.Л., Андержанов Э.К. и др. // Хим. физика. 2020. Т. 39. № 8. С. 58; https://doi.org/10.31857/S0207401X20080129
Кислов В.М., Салганский Е.А., Цветков М.В., Цветкова Ю.Ю. // ЖПХ. 2017. Т. 90. № 5. С. 579.
Haghi S.B., Salehi G., Azad M.T. et al. // Pet. Chem. 2020. V. 60. P. 1251; https://doi.org/10.1134/S0965544120110109
Nikitin A., Ozersky A., Savchenko V. et al. // Chem. Eng. J. 2019. V. 377. ID 120883; https://doi.org/10.1016/j.cej.2019.01.162
Nourbakhsh H., Shahrouzi J.R., Zamaniyan A., Ebrahimi H., Nasr M.R.J. // Intern. J. Hydrog. Energy. 2018. V. 43. № 33. P. 15703; https://doi.org/10.1016/j.ijhydene.2018.06.134
Tabrizi F.F., Mousavi S.A.H.S., Atashi H. // Energy Convers. Manage. 2015. V. 103. P. 1065; https://doi.org/10.1016/j.enconman.2015.07.005
Lutz A., Bradshaw R.W., Keller J.O., Witmer D.E. // Intern. J. Hydrog. Energy. 2002. V. 28. № 2. P. 163; https://doi.org/10.1016/S0360-3199(02)00053-8
Antzara A., Heracleous E., Bukur D.B., Lemonidou A.A. // Energy Procedia. 2014. V. 63. P. 6576; https://doi.org/10.1016/j.egypro.2014.11.694
Saebea D., Authayanun S., Patcharavorachot Y., Arpornwichanop A. // Energy Procedia. 2014. V. 61. P. 2254; https://doi.org/10.1016/j.egypro.2014.12.120
Chen W.H., Lin M.R., Lu J.J., Chao Y., Leu T.S. // Intern. J. Hydrog. Energy. 2010. V. 35. № 21. P. 11787; https://doi.org/10.1016/j.ijhydene.2010.08.126
Dmitrenko Yu.M., Klevan P.A. // J. Eng. Phys. Thermophys. 2011. V. 84. № 6. P. 1296; https://doi.org/10.1007/s10891-011-0597-2
Guerrero F., Espinoza L., Ripoll N. et al. // Front. Chem. 2020. V. 8. P. 145; https://doi.org/10.3389/fchem.2020.00145
Ruiz G., Ripoll N., Fedorova N. et al. // Intern. J. Heat Mass Transf. 2019. V. 136. P. 383; https://doi.org/10.1016/j.ijheatmasstransfer.2019.03.009
Horn R., Williams K.A., Degenstein N.J., Schmidt L.D. // J. Catal. 2006. V. 242. № 1. P. 92; https://doi.org/10.1016/j.jcat.2006.05.008
Otsuka K., Wang Y., Sunada E., Yamanaka I. // J. Catal. 1998. V. 175. № 2. P. 152; https://doi.org/10.1006/jcat.1998.1985
Kostenko S.S., Ivanova A.N., Karnaukh A.A., Polianczyk E.V. // Chem. Eng. J. 2014. V. 238. P. 100; https://doi.org/10.1016/j.cej.2013.09.012
Трусов Б.Г. // Матер. XIV Междунар. конф. по химической термодинамике. Спб: НИИХ СПбГУ, 2002. С. 483.
Петров В.В., Варзарев Ю.Н., Старникова А.П., Абдуллин Х.А. // Хим. физика. 2020. Т. 39. № 2. С. 37; https://doi.org/10.31857/S0207401X20020089
Тереза А.М., Андержанов Э.К. // Хим. физика. 2019. Т. 38. № 8. С. 58; https://doi.org/10.1134/S0207401X19080120
Tereza A.M., Medvedev S.P., Smirnov V.N. // Acta Astronaut. 2020. V. 176. P. 653; https://doi.org/10.1016/j.actaastro.2020.03.045
Кислов В.М., Глазов С.В., Салганский Е.А., Жолудев А.Ф., Салганская М.В. // Физика горения и взрыва. 2014. Т. 50. № 5. С. 22.
Salgansky E.A., Zaichenko A.Y., Podlesniy D.N. et al. // Intern. J. Hydrog. Energy. 2020. V. 45. P. 17270; https://doi.org/10.1016/j.ijhydene.2020.04.177
Mujeebu M.A. // Appl. Energy. 2016. V. 173. P. 210; https://doi.org/10.1016/j.apenergy.2016.04.018
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика