Химическая физика, 2021, T. 40, № 2, стр. 11-17
Элементарные фотохимические процессы с участием мезо-замещенных анионных цианиновых красителей в растворах и комплексах с сывороточными альбуминами
А. С. Татиколов *
Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
* E-mail: tatikolov@mail.ru
Поступила в редакцию 02.07.2020
После доработки 02.07.2020
Принята к публикации 21.09.2020
Аннотация
Методом импульсного фотолиза изучены первичные фотохимические процессы (фотоизомеризация, образование триплетного состояния) с участием мезо-замещенных анионных цианиновых красителей 3,3'-ди(γ-сульфопропил)-4,5,4',5'-дибензо-9-этилтиакарбоцианин-бетаина, 3,3'-ди(γ-сульфопропил)-4,5,4',5'-дибензо-9-метилтиакарбоцианин-бетаина, 3,3'-ди(γ-сульфопропил)-5,5'-диметокси-9-этилтиакарбоцианин-бетаина и 3,3'-ди-(γ-сульфопропил)-5,6,5',6'-ди-(метилендиокси)-9-этилтиакарбоцианин-бетаина, связанных в нековалентные комплексы с сывороточными альбуминами человека и быка. Для сравнения изучена фотохимия этих красителей в растворах (в воде и диоксане). Обнаружено, что при импульсном фотолизе растворов красителей в воде не наблюдается фотоизомеризации и образования триплетного состояния, однако в неполярном растворителе – диоксане образуются неустойчивые фотоизомеры. При этом не наблюдается образования триплетного состояния красителей в отсутствие кислорода. В то же время при импульсном фотолизе красителей в водном растворе в присутствии сывороточных альбуминов фотоизомеризации не наблюдается, но (в отсутствие кислорода) происходит образование (с последующей гибелью) триплетного состояния красителей. Определены константы скорости тушения триплетного состояния красителей молекулярным кислородом, которые оказались гораздо ниже константы скорости диффузионно-контролируемого тушения, что возможно объясняется затрудненным доступом кислорода к молекуле красителя в комплексе с альбумином.
ВВЕДЕНИЕ
Широкое использование цианиновых (полиметиновых) красителей в науке и технике обусловлено уникальным набором спектрально-флуоресцентных и фотохимических свойств, в частности зависимостью их свойств от молекулярного окружения [1]. Это особенно характерно для мезо-замещенных карбоцианиновых красителей, для которых наблюдается подвижное равновесие между цис- и транс-изомерами красителя, которое зависит от полярности среды. При этом в полярных растворителях равновесие сдвинуто в сторону цис-изомера, а в неполярных – в сторону транс-изомера [2]. Спектрально-флуоресцентные и фотохимические свойства цис- и транс-изомеров мезо-замещенных цианинов сильно различаются [2], что дает возможность использовать такие красители в качестве зондов для анализа и изучения различных структурно-организованных сред. В частности, мезо-замещенные карбоцианины были использованы в качестве спектрально-флуоресцентных зондов для биомолекул: ДНК, сывороточных альбуминов, коллагенов, гиалуроновой кислоты, хондроитин-4-сульфата, солей желчных кислот [3–9]; при этом подробно изучались спектрально-флуоресцентные свойства красителей в присутствии биомолекул. Изучены также элементарные фотохимические процессы с участием цианиновых красителей в комплексах с биомолекулами, однако эти работы были посвящены главным образом красителям в комплексах с ДНК и в мицеллах солей желчных кислот [10–13]. Хотя известно, что ряд анионных полиметиновых красителей образует нековалентные комплексы с сывороточными альбуминами с высокими константами связывания [14], фотохимические процессы в таких комплексах ранее не изучались.
В настоящей работе методом импульсного фотолиза изучены элементарные фотохимические процессы в молекулах мезо-замещенных анионных тиакарбоцианиновых красителей в комплексах с сывороточными альбуминами – человеческим и бычьим (САЧ и САБ соответственно). При этом изучались образование и гибель фотоизомеров и триплетного состояния красителей, а также тушение триплетного состояния кислородом. Были взяты анионные цианиновые красители, образующие с альбуминами комплексы с высокими константами связывания [14, 15]: 3,3'-ди(γ-сульфопропил)-4,5,4',5'-дибензо-9-этилтиакарбоцианин-бетаин (ДЭЦ), 3,3'-ди(γ-сульфопропил)-4,5,4',5'-дибензо-9-метилтиакарбоцианин-бетаин (ДМЦ), 3,3'-ди(γ-сульфопропил)-5,5'-диметокси-9-этилтиакарбоцианин-бетаин (ДМЭЦ) и 3,3'-ди-(γ-сульфопропил)-5,6,5',6'-ди-(метилендиокси)-9-этилтиакарбоцианин-бетаин (ДОЭЦ). Для сравнения изучалась также фотохимия данных красителей в растворах (в воде и диоксане).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Красители ДЭЦ, ДМЦ, ДМЭЦ и ДОЭЦ предоставлены проф. Б.И. Шапиро (НИИ “Химфотопроект”, Москва); их чистота проверена методом тонкослойной хроматографии. Сывороточные альбумины (САЧ и САБ) приобретены у компании Sigma-Aldrich (USA). В качестве растворителей использовались: дистиллированная вода, диметилсульфоксид, диоксан (х.ч.). Для изучения фотохимии красителей в присутствии альбуминов были взяты концентрации альбуминов, достаточные для эффективного связывания красителей в комплекс с альбуминами. Для приготовления раствора красителей в диоксане предварительно готовили концентрированный раствор красителя в диметилсульфоксиде, затем его небольшой объем растворяли в диоксане (разбавление 1 : 1000, в случае ДМЦ и ДЭЦ – 1 : 16). Переход красителей в транс-форму в диоксане контролировали по спектру поглощения: возникала длинноволновая полоса поглощения с максимумом при 603 нм для ДЭЦ [15], 595 нм – для ДМЦ, 585 нм – для ДМЭЦ, 600 нм для – ДОЭЦ. Спектры поглощения регистрировали на спектрофотометре СФ-2000 (Россия). Эксперименты по импульсному фотолизу проводили на установке с возбуждением светом ксеноновой лампы типа ИФП-5000 (длительность вспышки на полувысоте – 10 мкс, энергия разряда – 50 Дж), использовали кварцевую кювету с длиной оптического пути, равной 20 см. Фотовозбуждение красителей осуществлялось через светофильтры ЗС-8. Освобождение растворов от кислорода при регистрации триплет-триплетного поглощения проводили на вакуумной установке. При определении констант скорости тушения триплетного состояния красителей кислородом изменяли давление воздуха в равновесии с раствором красителя в кювете, которое измеряли с помощью манометрической установки и использовали для определения концентрации кислорода в растворе [16] (по закону Генри с учетом парциального давления растворителя – воды). Все эксперименты выполнены при температуре (22 ± 2) °С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
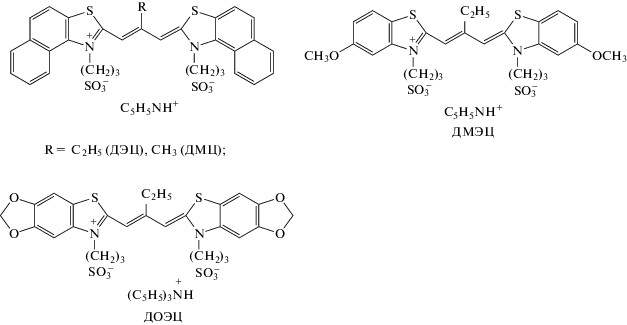
Одно из основных фотохимических свойств цианиновых красителей – фотоизомеризация (в результате поворота относительно одной из С–С-связей полиметиновой цепи) при фотовозбуждении, за которым следует обратная темновая изомеризация фотоизомера – превращение в исходный изомер красителя. Процесс протекает через короткоживущее S1-состояние красителя (время жизни < 1 нс), поэтому кислород воздуха на фотоизомеризацию практически не влияет. Вследствие стерического влияния мезо-заместителя изучаемые красители в воде и других полярных растворителях находятся главным образом в виде цис-изомеров [2, 9, 15]. Как правило, мезо-замещенные тиакарбоцианиновые красители в форме цис-изомеров не фотоизомеризуются [2]. В соответствии с этим при импульсном фотолизе изучаемых красителей в водных растворах сигналы фотоизомеров не наблюдались (для ДЭЦ см. также [13]). Однако в неполярном растворителе – диоксане, где красители находятся в виде транс-изомеров [2, 9, 15], в присутствии воздуха наблюдаются сигналы, характерные для образования и гибели фотоизомеров красителей: отрицательное поглощение (выцветание) в области стационарного спектра поглощения транс-изомера красителя (λmax = 585–600 нм) и положительное поглощение в более коротковолновой области (< 560–570 нм). Это указывает на расходование исходного транс-изомера в результате фотоизомеризации в цис-изомер и последующего возврата транс-изомера вследствие обратной темновой изомеризации образовавшегося цис-фотоизомера (дифференциальные спектры и кинетические кривые приведены на рис. 1):
(1)
$\begin{gathered} {\text{Кр}}(транс,{{S}_{0}}) + h\nu \to {\text{Кр}}(транс,{{S}_{{\text{1}}}}) \to \\ \to {\text{Кр}}(цис,{{S}_{0}})\xrightarrow{{{{k}_{i}}}}{\text{Кр}}(транс,{{S}_{0}}), \\ \end{gathered} $Рис. 1.
Дифференциальные спектры поглощения фотоизомеров, полученные при импульсном фотолизе воздушно-насыщенных растворов красителей ДЭЦ (1), ДМЦ (2), ДОЭЦ (3) и ДМЭЦ (4) ((1–2) ⋅ 10–6 моль/л) в диоксане через 70 мкс после появления переднего фронта вспышки; на вставках – кинетические кривые гибели фотоизомера ДМЦ при λ = 570 и 595 нм и их экспоненциальные аппроксимации.
где Кр – молекула красителя в форме транс- или цис-изомера в основном (S0) или возбужденном (S1) синглетном состоянии; ki = 1/τi – константа скорости обратной цис-транс-изомеризации (τi – время жизни фотоизомера). Времена жизни цис-фотоизомеров изученных красителей близки и составляют 0.25–0.35 мс. Эти величины гораздо меньше, чем для цис-фотоизомера красителя 3,3'-диэтилтиакарбоцианина (DTC), не имеющего мезо-заместителя (2–7 мс в различных растворителях [17]), что можно объяснить понижением изомеризационного барьера вследствие стерического влияния мезо-заместителя, приводящего к искажению плоской структуры цис-изомера красителя.
При импульсном фотолизе красителей в растворах (в воде и диоксане) в отсутствие кислорода не обнаружено сигналов помимо вышеописанных сигналов фотоизомеров в диоксане, что указывает на отсутствие интеркомбинационной конверсии красителей (в виде как цис-, так и транс-изомеров) в триплетное состояние при прямом фотовозбуждении (для ДЭЦ см. также [13]). В то же время в водном растворе в присутствии САЧ и САБ данные красители, связываясь в нековалентные комплексы с альбуминами, по крайней мере частично, переходят из цис-изомера (в мономерной и димерной форме) в форму транс-мономера, что можно наблюдать по появлению в спектре поглощения длинноволновой полосы (или плеча) с максимумом при 585–610 нм и росту интенсивности флуоресценции [15]. При импульсном фотолизе таких растворов в присутствии воздуха сигналов, которые можно было бы отнести к образованию фотоизомеров, не наблюдается, а в отсутствие воздуха регистрируются сигналы поглощения в длинноволновой области (> 600 нм). Тушение сигналов кислородом, а также сопоставление сигналов для ДЭЦ и ДМЦ с сигналами, наблюдавшимися ранее для триплетного состояния ДЭЦ в присутствии солей желчных кислот [13], а для ДМЭЦ и ДОЭЦ – с сигналами триплетного состояния других мезо-замещенных цианинов в присутствии биомолекул [12, 13], позволяют приписать данные сигналы образованию триплетного состояния красителей в результате интеркомбинационной конверсии S1 → T. Образование и гибель красителей в триплетном состоянии (путем интеркомбинационной конверсии T → S0) можно описать следующей схемой:
(2)
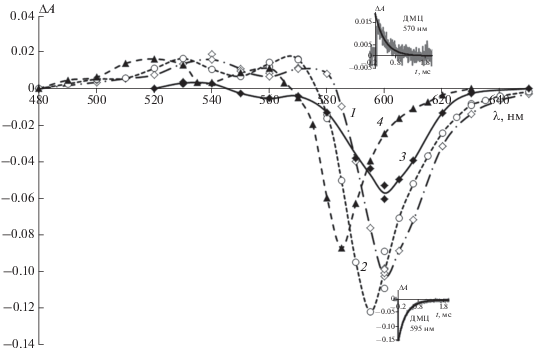
$\begin{gathered} {\text{Кр}}\left( {{{S}_{0}}} \right) + h\nu \to {\text{Кр}}\left( {{{S}_{{\text{1}}}}} \right) \to \\ \to {\text{Кр}}\left( T \right)\xrightarrow{{{{k}_{T}}}}{\text{Кр}}({{S}_{0}}), \\ \end{gathered} $где kT = 1/τT – константа скорости интеркомбинационной конверсии T → S0; τT – время жизни красителя в триплетном состоянии. Дифференциальные спектры триплет-триплетного поглощения красителей в присутствии САЧ и САБ приведены на рис. 2.
Рис. 2.
Дифференциальные спектры поглощения триплетных состояний: а – ДЭЦ (1, 2) и ДМЭЦ (3, 4), б – ДМЦ (1, 2) и ДОЭЦ (3, 4) ((5–8) ⋅ 10–6 моль/л) в водном растворе в присутствии САЧ (1, 3) или САБ (2, 4) (5 ⋅ 10–5 моль/л) через 70 мкс после появления переднего фронта вспышки.
Усиление интеркомбинационной конверсии в триплетное состояние наблюдалось ранее при импульсном фотолизе мезо-замещенных тиакарбоцианинов 3,3',9-триэтилтиакарбоцианина (ТЭТЦ) и 3,3'-диэтил-9-метилтиакарбоцианина (ДЭМТЦ) в комплексе с ДНК [18, 19], а также 3,3',9-триметилтиакарбоцианина (Cyan 2) с ДНК и хондроитин-4-сульфатом [12]. Аналогичный эффект наблюдался при связывании ДЭЦ и Cyan 2 с мицеллами солей желчных кислот [13]. Рост квантового выхода в триплетное состояние для вышеперечисленных красителей в присутствии биомолекул, так же как и рост интенсивности флуоресценции, объяснялся подавлением конкурирующих процессов безызлучательного рассеяния (путем внутримолекулярных вращений и колебаний) энергии возбуждения состояния S1 вследствие повышения жесткости молекулы красителя при ее связывании с биомолекулами [10, 11, 13]. Очевидно, аналогичным образом объясняется и рост интеркомбинационной конверсии в триплетное состояние при связывании красителей ДЭЦ, ДМЦ, ДМЭЦ и ДОЭЦ с САЧ и САБ. Повышение жесткости молекул красителей в комплексах с альбуминами проявляется также в отсутствии фотоизомеризации красителей, связанных с альбуминами, хотя транс-изомеры красителей в растворе диоксана фотоизомеризуются.
Отметим следующие особенности генерации триплетного состояния при импульсном фотолизе изучаемых красителей в комплексах с альбуминами.
1. Дифференциальные спектры триплет-триплетного поглощения красителей ДЭЦ и ДМЦ в комплексах с САЧ и САБ качественно сходны (см. рис. 2а), хотя красители взаимодействуют с альбуминами по-разному: эффективно взаимодействуют с САЧ и гораздо менее эффективно – с САБ [6]. При этом ДЭЦ и ДМЦ в комплексе с САЧ практически полностью переходят в транс-изомер, в то время как в комплексе с САБ красители находятся в виде транс- и цис-изомеров (при этом в случае ДЭЦ цис-изомер является основным в комплексе [6]). Спектры триплет-триплетного поглощения транс- и цис-изомеров ДЭЦ близки [13]; то же можно предположить и для его близкого аналога ДМЦ. Следовательно, можно считать, что в интеркомбинационной конверсии в триплетное состояние участвуют оба изомера ДЭЦ и ДМЦ в комплексах с альбуминами.
2. В случае красителей ДМЭЦ и ДОЭЦ дифференциальные спектры триплет-триплетного поглощения их комплексов с САЧ и САБ несколько различаются: спектры для комплексов с САБ более длинноволновые, чем для комплексов с САЧ (рис. 2). ДМЭЦ, как ДЭЦ и ДМЦ, в комплексе с САЧ находится главным образом в виде транс-изомера, тогда как в комплексе с САБ – в виде обоих (транс и цис) изомеров. Поэтому несовпадение спектров триплет-триплетного поглощения для ДМЭЦ можно объяснить различием спектров триплетного состояния транс- и цис-изомеров для этого красителя. Краситель ДОЭЦ в комплексах с обоими альбуминами практически полностью переходит в транс-изомер, но его спектры поглощения в комплексах с САЧ и САБ несколько различаются и имеют максимумы при 603 и 587 нм соответственно. При этом спектр поглощения ДОЭЦ в комплексе с САЧ соответствует спектру ДОЭЦ в диоксане (транс-изомер) с максимумом при 603 нм. Можно предположить, что ДОЭЦ в комплексе с САЧ имеет обычную транс-конфигурацию, в то время как коротковолновый сдвиг спектра поглощения ДОЭЦ в комплексе с САБ по сравнению с наблюдаемым в диоксане вызван несколько искаженной формой транс-изомера. Такое искажение конфигурации может являться причиной длинноволнового сдвига спектра триплет-триплетного поглощения красителя в комплексе с САБ.
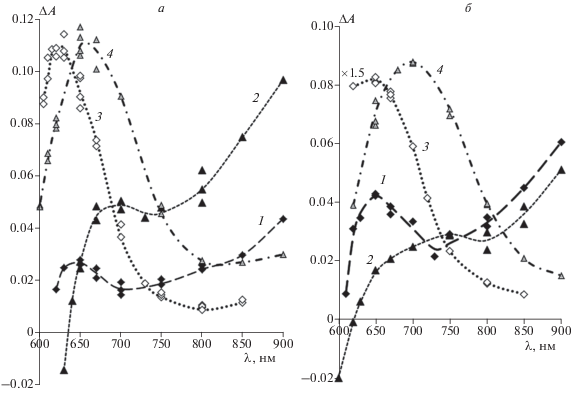
3. Кинетические кривые гибели триплетного состояния исследованных красителей в ряде случаев несколько отклоняются от моноэкспоненциальных и хорошо аппроксимируются суммой двух экспонент, что особенно ярко проявляется для комплексов красителей ДЭЦ, ДМЦ и ДМЭЦ с САБ (рис. 3). Это также можно объяснить одновременным связыванием транс- и цис-изомеров красителей с альбумином и, соответственно, наложением кинетик гибели триплетных состояний обоих изомеров при регистрации. Следует заметить, что в случае комплексов ДЭЦ, ДМЦ и ДМЭЦ с САЧ, когда красители практически полностью переходят в единственную форму – транс-изомер, кинетики гибели триплетного состояния хорошо описываются моноэкспоненциальными зависимостями. Усредненные (аппроксимированные одной экспонентой) времена жизни триплетного состояния красителей в комплексах с альбуминами находятся в интервале 0.35–1.2 мс (табл. 1).
Рис. 3.
Кинетическая кривая гибели триплетного состояния ДЭЦ в водном растворе в присутствии САБ (5 ⋅ 10–5 моль/л) и ее экспоненциальные компоненты (1 и 2) (длина волны регистрации – 800 нм).
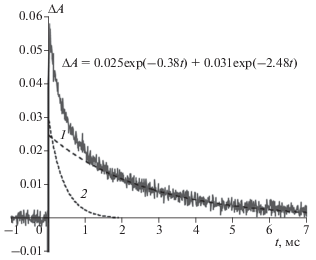
Таблица 1.
Усредненные времена жизни триплетных состояний красителей ДЭЦ, ДМЦ, ДМЭЦ и ДОЭЦ в комплексах с САЧ и САБ
| Альбумин | τT, мс | |||
|---|---|---|---|---|
| ДЭЦ | ДМЦ | ДМЭЦ | ДОЭЦ | |
| САЧ | 0.7 ± 0.1 | 0.54 ± 0.05 | 0.57 ± 0.08 | 1.2 ± 0.4 |
| САБ | 1.2 ± 0.1 | 0.39 ± 0.05 | 1.0 ± 0.1 | 0.35 ± 0.04 |
Были проведены эксперименты по тушению триплетного состояния красителей кислородом воздуха. Из наклона кривых линейных зависимостей константы скорости гибели триплетного состояния от концентрации кислорода в растворе определены константы скорости тушения триплетного состояния изучаемых красителей молекулярным кислородом kq:
где kT0 – усредненная константа скорости гибели триплетного состояния в отсутствие тушителя, kT – константа скорости гибели триплетного состояния в присутствии тушителя (рис. 4).
Рис. 4.
Кривые линейных зависимостей из уравнения (3) тушения кислородом триплетных состояний ДЭЦ (1) и ДМЭЦ (2) в присутствии САБ и ДОЭЦ в присутствии САЧ (3), из которых были определены константы скорости тушения kq = 1.7 ⋅ 108, 1.5 ⋅ 108 и 2.4 ⋅ 108 л ⋅ моль–1 ⋅ с–1 соответственно; концентрации альбуминов – 5 ⋅ 10–5 моль/л.
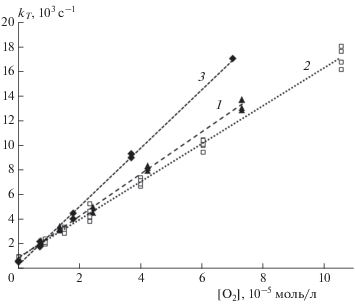
Значения kq оказались в интервале (1.3–2.5) ⋅ ⋅ 108 л ⋅ моль–1 ⋅ с–1, что гораздо ниже, чем у константы скорости диффузионно-контролируемого тушения триплетного состояния красителя кислородом (порядка 1.2 ⋅ 109 л ⋅ моль–1 ⋅ с–1 [18]). Низкая величина kq = 3 ⋅ 108 л ⋅ моль–1 ⋅ с–1, близкая к значениям, полученным в настоящей работе, наблюдалась ранее при тушении кислородом триплетного состояния красителя DTC в комплексе с ДНК, что объяснялось затрудненным доступом кислорода к молекулам красителя в комплексе [18, 19]. Аналогичным образом, вероятно, можно объяснить низкие значения констант kq для изучаемых красителей в комплексах с альбуминами.
ЗАКЛЮЧЕНИЕ
При импульсном фотолизе воздушно-насыщенных растворов красителей ДЭЦ, ДМЦ, ДМЭЦ и ДОЭЦ в диоксане наблюдаются сигналы, обусловленные фотоизомеризацией транс-изомеров красителей и обратной темновой изомеризацией образующихся цис-фотоизомеров. Времена жизни фотоизомеров красителей близки и составляют 0.25–0.35 мс. При импульсном фотолизе водных растворов данных красителей в присутствии САЧ и САБ в отсутствие кислорода наблюдается интеркомбинационная конверсия в триплетное состояние красителей и последующий возврат в исходное основное синглетное состояние. Фотоизомеризации красителей при этом не наблюдается. Предполагается, что в интеркомбинационной конверсии в триплетное состояние участвуют как транс-, так и цис-изомеры красителей в комплексах с альбуминами. Кинетические кривые гибели триплетного состояния ДЭЦ, ДМЦ и ДМЭЦ в комплексах с САБ хорошо описываются суммой двух экспонент, что можно объяснить одновременным связыванием транс- и цис-изомеров красителей с альбумином. Определены константы скорости тушения триплетного состояния красителей молекулярным кислородом, которые оказались гораздо ниже константы скорости диффузионно-контролируемого тушения, что, вероятно, обусловлено затрудненным доступом кислорода к молекуле красителя в комплексе с альбумином.
Автор выражает благодарность проф. Б.И. Шапиро за предоставление полиметиновых красителей.
Работа выполнена в рамках госзадания № 001201253314 (ИБХФ РАН).
Список литературы
Shindy H.A. // Dyes Pigm. 2017. V. 145. P. 505; https://doi.org/10.1016/j.dyepig.2017.06.029
Khimenko V., Chibisov A.K., Görner H. // J. Phys. Chem. A. 1997. V. 101. P. 7304; https://doi.org/10.1021/jp971472b
Акимкин Т.М., Татиколов А.С., Ярмолюк С.М. // Химия высоких энергий. 2011. Т. 45. № 3. С. 252.
Panova I.G., Sharova N.P., Dmitrieva S.B. et al. // Anal. Biochem. 2007. V. 361. P. 183; https://doi.org/10.1016/j.ab.2006.11.029
Татиколов А.С., Акимкин Т.М., Кашин А.С., Панова И.Г. // Химия высоких энергий. 2010. Т. 44. № 3. С. 252.
Татиколов А.С., Панова И.Г. // Там же. 2014. Т. 48. № 2. С. 116.
Татиколов А.С., Панова И.Г. // Там же. 2005. Т. 39. № 4. С. 275.
Татиколов А.С., Пронкин П.Г., Шведова Л.А., Панова И.Г. // Хим. физика. 2019. Т. 38. № 12. С. 11.
Tatikolov A.S., Pronkin P.G., Panova I.G. // Spectrochim. Acta, Part A. 2019. V. 216. P. 190; https://doi.org/10.1016/j.saa.2019.03.017
Пронкин П.Г., Татиколов А.С., Скляренко В.И., Кузьмин В.А. // Химия высоких энергий. 2006. Т. 40. № 4. С. 295.
Пронкин П.Г., Татиколов А.С., Скляренко В.И., Кузьмин В.А. // Там же. № 6. С. 451.
Tatikolov A.S., Akimkin T.M., Pronkin P.G., Yarmoluk S.M. // Chem. Phys. Lett. 2013. V. 556. C. 287; https://doi.org/10.1016/j.cplett.2012.11.097
Татиколов А.С., Пронкин П.Г. // Журн. прикл. спектроскопии. 2018. Т. 85. № 6. С. 861.
Tatikolov A.S., Costa S.M.B. // Biophys. Chem. 2004. V. 107. P. 33; https://doi.org/10.1016/S0301-4622(03)00218-7
Pronkin P.G., Shvedova L.A., Tatikolov A.S. // Ibid. 2020. V. 261. P. 106378; https://doi.org/10.1016/j.bpc.2020.106378
Справочник химика 21. Химия и химическая технология. С. 158; https://chem21.info/
Tatikolov A.S., Costa S.M.B. // Chem. Phys. Lett. 2007. V. 440. P. 73; https://doi.org/10.1016/j.cplett.2007.04.003
Anikovsky M.Y., Tatikolov A.S., Kuzmin V.A. // Intern. J. Photoenergy. 1999. V. 1. № 1. P. 35.
Аниковский М.Ю., Татиколов А.С., Шведова Л.А., Кузьмин В.А. // Изв. АН. Сер. хим. 2001. № 7. С. 1134.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика