Химическая физика, 2021, T. 40, № 4, стр. 27-33
Роль теории цепных реакций Н.Н. Семёнова в формировании современных представлений о процессах горения, взрыва и детонации газов
В. В. Азатян *
Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
* E-mail: vylenazatyan@yandex.ru
Поступила в редакцию 01.10.2020
После доработки 01.10.2020
Принята к публикации 20.10.2020
Аннотация
Представлены результаты теоретических и экспериментальных исследований воспламенения, распространения пламени, взрыва и детонации газов, показывающие, что вопреки прежним представлениям цепные механизмы в реакциях горения играют определяющую роль не только при давлениях в десятки раз ниже атмосферного в отсутствие саморазогрева, но также при более высоких давлениях и любых температурных режимах. Приводятся примеры химического управления всеми этими процессами. Результаты вместе с тем показывают выдающую роль теории цепных реакций Н.Н. Семёнова в развитии учения о скоростях химических реакций и процессах горения.
Выдающийся вклад Н.Н. Семёнова в мировую науку о химических процессах общеизвестен. Открытие же разветвленно-цепных процессов и создание теории этих реакций [1–3] ознаменовало наступление качественно нового, важного этапа в развитии науки о кинетике и механизме химических процессов, так же как и науки о горении. Значимость этого открытия не ограничивается обнаружением закономерностей и механизма процессов горения, не имеющих аналогов. Еще более значимым оказалось выявление принципиально нового фактора, отличного от саморазогрева, определяющего прогрессивное самоускорение реакций и неизвестных ранее критических явлений в процессах горения. Н.Н. Семёновым было установлено, что большие скорости процессов цепного горения, протекающих при сверхнизких концентрациях исходных реагентов, определяются реакциями высокоактивных промежуточных частиц: свободных атомов и радикалов. В реакциях с исходными реагентами эти частицы не только регенерируются, но также размножаются. В результате этого реализуются разветвленные реакционные цепи, обеспечивающие прогрессирующее самоускорение процесса даже без повышения температуры. Вскоре после открытия Н.Н. Семёновым разветвленно-цепных реакций на примере горения паров фосфора С. Хиншельвудом был также установлен цепной характер горения водорода с кислородом [4, 5]. В последующих исследованиях было выяснено, что по цепному пути при низких давлениях протекает горение также многих других газов [3, 6]. Приведенные в настоящей работе результаты показывают, что основные положения теории цепных процессов относятся также к важным для практики процессам горения газов, протекающим при высоких давлениях.
Воспламенением и развивающимся горением принято называть кинетический режим усиливающегося самоускорения химической реакции, приводящего к большим скоростям процесса, сопровождающегося выделением света и тепла. К воспламенению и горению способны привести два разных по своей природе фактора: цепная лавина и саморазогрев.
ЦЕПНОЕ ВОСПЛАМЕНЕНИЕ
Разветвленно-цепным процессам соответствует следующая обобщенная схема:
где x и y – свободные атомы и радикалы, A и B – исходные молекулы, Р – конечный продукт.
Примером является модельный разветвленно-цепной процесс окисления водорода, в котором атомы и радикалы – носители цепей (НЦ) образуются, регенерируются и размножаются в следующих реакциях:
Поскольку НЦ, появившиеся на стадиях (I)–(III), участвуют в развитии реакционных цепей, образуя новые ветви, то цепь разветвляется. Методом частичных квазистационарных концентраций [3] система кинетических уравнений для концентраций атомов и радикалов приводится к одному уравнению, относящемуся к той частице, реакции которой лимитируют разветвление цепей. В данном процессе этой реакцией является стадия (I). Из приведенной выше схемы следует, что скорость расходования О2 равна
(1)
$~W = - \frac{{d\left[ {\text{B}} \right]}}{{dt}} = {{w}_{0}} + {{k}_{1}}\left[ {\text{B}} \right]n,$где w0 – скорость реакции (0); n – концентрации атомов и радикалов – носителей цепей; k1 – эффективная константа скорости лимитирующей стадии процесса, обычно – стадии разветвления; [В] – концентрация О2.
Носители цепей вступают также в реакции образования малоактивных продуктов, не способных участвовать в цепном горении. В таких реакциях цепь обрывается. В процессе окисления водорода такими стадиями являются адсорбция НЦ и реакция
если радикал HO2 затем адсорбируется или вступает, например, в реакцию
а также реагирует с ингибитором (In), что приводит к обрыву цепей:
Из схемы реакции следует, что величина n изменяется согласно уравнению [2, 3]
где f и g – скорости размножения или гибели НЦ при их единичных концентрациях, равные
(3)
$f = 2{{k}_{1}}\left[ {\text{B}} \right] = 2k_{1}^{0}\exp \left( {--~\frac{{{{E}_{1}}}}{{RT}}} \right)\left[ {\text{B}} \right],$В последнем выражении kln – константа скорости ингибирования, [ln] – концентрация ингибитора, g1 – эффективная суммарная константа скорости других реакций обрыва цепей.
Очевидно, что если g > f, то устанавливается низкая концентрация активных частиц, определяемая соотношением скоростей их образования по медленной реакции (0) и реакции гибели. Если же f > g, т.е. размножение НЦ протекает быстрее гибели, то происходит их лавинное размножение. Соответственно, лавинообразно ускоряется также расходование исходных реагентов, реагирующих с этими активными частицами. Таким образом, условием цепного воспламенения является неравенство φ = f – g > 0.
Длительное время цепное горение изучали лишь для выяснения особенностей химического механизма цепных реакций. С этой целью реакции проводились при давлениях во много десятков и сотен раз ниже атмосферного, при которых горение практически не сопровождается саморазогревом. Поэтому положения теории цепного горения относились к изотермическим режимам. На базе теории цепных реакций получили количественное объяснение все обнаруженные и предсказанные закономерности процессов в условиях разреженного пламени. Был подтвержден в том числе вывод из теории о сверхравновесных концентрациях свободных атомов и радикалов в пламени. Эти активные частицы в концентрациях, на несколько порядков превышающих равновесные значения, были обнаружены методом электронного парамагнитного резонанса в пламени самых разных горючих веществ [7, 8]. Примечательно, что зарегистрированные большие концентрации атомарного кислорода в пламени паров фосфора были предсказаны Н.Н. Семёновым еще в 1934 г. [2]. Эксперименты подтвердили также вывод теории об определяющей роли реакций свободных атомов и радикалов во всех закономерностях распространения разреженного пламени [7–9]. Процессы же горения газов, сопровождающиеся саморазогревом, рассматривались отдельно, с позиций только тепловых явлений.
ТЕПЛОВОЕ ВОСПЛАМЕНЕНИЕ
Другим фактором, приводящим к воспламенению и горению, является прогрессивное ускорение саморазогрева реакционной системы. Такое горение принято называть тепловым. Н.Н. Семёновым [3, 6] было показано, что тепловое воспламенение реализуется, если скорость тепловыделения (q+) больше, чем скорость теплоотвода (q–), и если при этом с повышением температуры тепловыделение ускоряется больше, чем теплоотвод:
(6)
${{d{{q}_{ + }}} \mathord{\left/ {\vphantom {{d{{q}_{ + }}} {dT}}} \right. \kern-0em} {dT}} \geqslant {{d{{q}_{--}}} \mathord{\left/ {\vphantom {{d{{q}_{--}}} {dT}}} \right. \kern-0em} {dT}}.$Здесь Т – температура; q+ равна произведению скорости реакции (W) и теплового эффекта $\left( {\bar {Q}} \right){\text{:}}$
Соотношение (5) относится к саморазогреву. Соотношение же (6) соответствует режиму, в котором при повышении температуры скорость тепловыделения возрастает больше, чем скорость теплоотвода. Одновременное выполнение условий (5) и (6) приводит к прогрессирующему накоплению тепла в системе и к более интенсивному ускорению реакции в режиме воспламенения. Теорию горения, рассматривающую саморазогрев как единственный фактор самоускорения реакции, принято называть тепловой.
Значительный саморазогрев горючей смеси при давлениях выше нескольких сотых долей атмосферного служил причиной того, что горение газов при таких давлениях до недавнего времени считали результатом только саморазогрева. До последнего времени в теории горения взрыва и детонации газов, а также в работах, использующих основные положения этой теории, в том числе во всех статьях, фундаментальных монографиях и энциклопедиях, роль реакционных цепей в горении при атмосферном давлении не учитывалась, а в ряде случаев она даже отрицалась (см., например, [10–18]). Химический процесс представляли гипотетической одностадийной реакцией между исходными молекулами. Такой реакции приписывают эмпирическую константу скорости, определенную из кинетических данных брутто-процесса при допущении о его первом кинетическом порядке. Публикации, игнорирующие цепной характер горения, встречаются и в настоящее время [19–21]. Температурную зависимость скорости реакции было принято характеризовать законом Аррениуса, который, однако, относится не к скорости реакции, а к константе скорости. Гипотетическим реакциям приписывали эффективные величины “энергии активации”, превышающие 40 ккал/моль. Эти представления позволяли условно описать протекание горения при принятых гипотетически расчетных параметрах.
Вопреки этим представлениям в серии теоретических и экспериментальных работ [22–27]) было показано, что межмолекулярные газофазные реакции в силу больших энергий активации крайне медленные и не способны обеспечить даже сколько-нибудь значительный саморазогрев и тем более воспламенение и горение. Таким образом, традиционная теория теплового горения, основанная на модели реакции только валентно-насыщенных молекул, не может объяснить даже факт горения. Кажущееся согласие одностадийной модели с экспериментом достигается только при допущении о протекании реакции горения по первому кинетическому порядку и использовании эмпирических параметров, определенных из данных по изучению того же процесса горения. При этом рассматривается только та или иная частная закономерность. В результате произвольного характера выбора кинетического порядка величины большинства таких эмпирических параметров не соответствуют физическому смыслу.
Доказательства цепной природы реакций в распространении пламени, взрыве и детонации газов
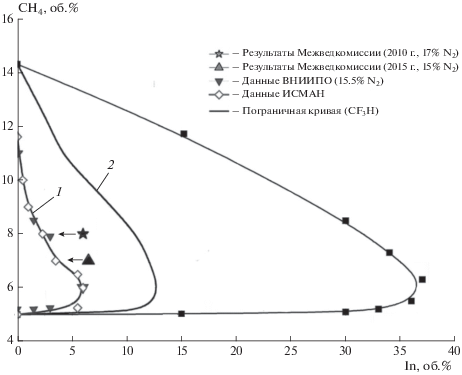
Одним из основных доказательств протекания всех режимов горения газов по цепному механизму является иллюстрация невозможности воспламенения и горения при исключении цепной лавины с помощью малых присадок ингибиторов [8, 22–27]. Рисунок 1 показывает, что, например, 3 об.% ингибиторов серии АКМ (низшие олефины) предотвращают воспламенение любых смесей водорода с воздухом: при всех составах смесей правее кривых 1 и 2 концентрационных пределов таких смесей даже сильное инициирование не вызывает воспламенение. Между тем для предотвращения воспламенения инертным газом требуются в десятки раз большие добавки (кривая 3), т.е. необходимо сильное разбавление смеси. Блокирование горения ингибитором происходит в результате быстрой реакции:
(VII)
${\text{Н}} + i{\text{ - }}{{{\text{С}}}_{{\text{4}}}}{{{\text{Н}}}_{8}} = {{{\text{С}}}_{{\text{4}}}}{{{\text{Н}}}_{7}},$Рис. 1.
Области воспламенения смесей водорода с воздухом в присутствии изобутена (1), пропилена (2) и азота (3).
в которой активные частицы – атомы Н заменяются на радикалы изобутена, не способные участвовать в цепной реакции горения водорода.
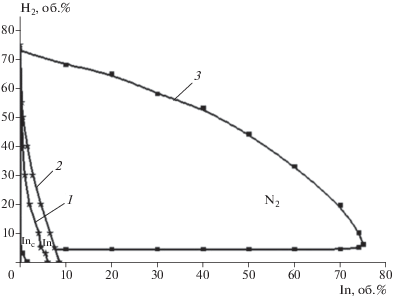
Было установлено, что воспламенение имеет цепную природу также при высоких начальных температурах [25–27]. Разработанные в этих исследованиях методы позволяют повысить температуру газа c помощью падающей ударной волны (УВ) за доли микросекунды на тысячи градусов, инициировать горение и следить за влиянием ингибиторов на возникновение и развитие горения при заданных начальных температурах, однородных по объему реактора. Параметры газа во фронте УВ рассчитывались для каждого эксперимента с использованием известной программы по измеренной скорости УВ и начальным параметрам смеси. Сигналы регистрируются четырехлучевыми цифровыми осциллографами, соединенными с компьютером. Осциллограммы позволяют следить также за переходом горения в детонацию, происходящим при сильном инициировании. Эти эксперименты показывают, что даже при высоких начальных температурах и при очень сильном инициировании в присутствии ингибиторов воспламенение не происходит. Например, из рис. 2 видно, что, смесь, воспламеняющаяся в отсутствие ингибиторов при 930 К и 60 кПа, не воспламеняется даже при 1130 К и давлении 84 кПа в результате подавления цепной лавины 0.7 об.% пропилена. Не регистрируются ни свечение, ни кратковременный рост давления, присущий воспламенению. Для воспламенения смеси с таким содержанием пропилена приходится увеличить скорость инициирующей УВ и тем самым повысить температуру и давление соответственно до 1140 К и 0.85 атм. При дальнейшем увеличении содержания ингибитора минимальная температура самовоспламенения становится еще выше (рис. 2). Повышаются и критические давления воспламенения. Очевидно, что предотвращение воспламенения исключает также последующее распространение пламени и взрыв. Ингибирование пламени, распространяющегося со сверхзвуковой скоростью, и предотвращение перехода в детонацию иллюстрирует рис. 3.
Рис. 2.
Влияние пропилена (1) и паров изопропанола (2) на минимальную температуру воспламенения смесей водорода с воздухом; 3, 4 – температуры воспламенения пропена изопропанола в воздухе.
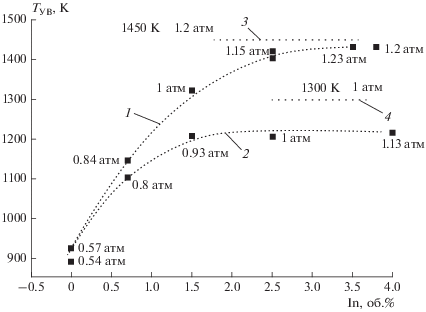
Рис. 3.
Изменение скорости и пламени стехиометрической водородовоздушной смеси вдоль трубы при содержаниях пропилена (в %): 1 – 0, 2 – 0.382, 3 – 0.764, 4 – 1.15.
Таким образом, даже при очень высоких температурах молекулярные реагенты непосредственно между собой практически не реагируют, и, значит, в согласии с нашим выводом горение протекает только по цепному пути. Независимым подтверждением является отмеченное выше обнаружение в пламени различных горючих веществ свободных атомов и радикалов в сверхравновесных концентрациях, а также сильное превышение величин констант скорости реакций этих активных частиц с ингибиторами по сравнению с реакцией разветвления цепей (I).
Кинетика неизотермического цепного горения
Из уравнения (2) следует, что скорость изменения концентрации активных частиц находится в обратной связи с величиной их концентрации n. Это значит, что эта величина экспоненциально зависит от разности удельных скоростей разветвления и обрыва цепей: f – g. Поскольку в величину f входит константа скорости разветвления k1 со своим фактором Больцмана в соответствии с выражением (2), то при f > g величина n зависит от температуры по закону экспоненты, находящейся в положительном показателе степени [8, 23, 27]:
(8)
$n = {{n}_{0}}\exp \mathop \smallint \limits_{{{t}_{0}}}^t \left[ {{{f}_{0}}\exp \left( {--\frac{{{{E}_{p}}}}{{RT}}} \right) - g} \right]dt,$где t0 – время, после которого можно пренебречь скоростью межмолекулярной реакции w; n0 – концентрация НЦ в момент t0.
Из уравнений (1) и (2) получается следующая зависимость скорости цепной реакции от времени, температуры и разности скоростей разветвления и обрыва цепей:
(9)
$\frac{W}{{\left[ {\text{B}} \right]}} = {{k}_{p}}{{n}_{0}}\exp \mathop \smallint \limits_{{{t}_{0}}}^t \left\{ {2k_{p}^{0}\exp \left( {--\frac{{{{E}_{p}}}}{{RT}}} \right)\left[ {\text{B}} \right]--g} \right\}dt.$Видно, что скорость цепного процесса также зависит от температуры по закону экспоненты, содержащей фактор Больцмана в положительном показателе степени. Поскольку этот закон осуществляется при каждой данной температуре, то он выполняется в ходе горения.
Благодаря учету цепной природы горения получили объяснение также все закономерности процессов в области атмосферного и повышенных давлений: наблюдаемые очень большие скорости реакций цепного горения и их сильная температурная зависимость, принципиально отличная от закона Аррениуса. Уравнение (8), содержащее величину g и, значит, скорость акта ингибирования в показателе степени, описывает также наблюдаемую в эксперименте высокую эффективность ингибиторов в процессах горения. Замедление реакции сопровождается снижением температуры, что, в свою очередь, приводит к дальнейшему падению скорости по закону экспоненты, содержащей фактор Больцмана в положительном показателе степени. Из уравнения (9) видно также, что если концентрация ингибитора настолько велика, что величина g больше первой слагаемой в подынтегральном выражении уравнения (8), то подынтегральная функция оказывается отрицательной, и, значит, прогрессирующий рост скорости процесса, воспламенение и взрыв становятся невозможными, т.е. ингибитор предотвращает возгорание и взрыв. При меньших концентрациях ингибитора подынтегральная функция остается положительной, но уменьшенной. Соответственно, скорость реакции и скорость распространения пламени оказываются уменьшенными. Это и показывает рис. 3.
Из уравнений (4) и (9) следует также, что даже при небольшом разбавлении смеси инертным газом вследствие снижения концентрации окислителя В экспоненциально уменьшаются скорости реакции и тепловыделения, усиливается воздействие ингибиторов. Этот эффект (синергизм инертного газа) был использован для более рационального использования ингибиторов. На рис. 4 представлены результаты проведенных в различных организациях испытаний предотвращения возгораний и взрывов метановоздушных смесей с использованием (кривая 1) и без использования явления синергизма (кривая 2) [8]. Количественное согласие результатов всех испытаний между собой, несмотря на различия формы и объемов реакционных камер – от 3.2 л до 43 м3, указывает на то, что ингибитор предотвращает возгорание у самого очага инициирования. Становится возможным вводить ингибитор локально у очага возгорания и источника инициирования.
Определяющая роль цепного механизма реакций в детонации и большие возможности химического управления этим режимом горения
По особенностям кинетики реакций и газодинамики, по роли в технике и проявлениям в природе детонация сильно отличается от других режимов горения. Из анализа величины скорости детонации, например стехиометрической смеси водорода с воздухом, и толщины фронта горения следует, что разогрев газа до температуры взрыва и расходование реагентов происходят за малые доли миллисекунды. В теории детонации, обстоятельно объясняющей газодинамические характеристики явления [10, 17, 28, 29], однако не рассматривались причины и химический механизм столь больших скоростей и ускорений. Участие реакционных цепей в детонации и возможность ее ингибирования считались и в настоящее время нередко считаются невозможными (см., например, [30, 31]). До недавнего времени встречались также численные расчеты, игнорирующие участие реакционных цепей в детонации, с использованием явно нереальных кинетических параметров (см., например, [21]). Между тем в серии работ [8, 24–27] путем предотвращения перехода горения в детонацию и разрушения стационарных детонационных волн с помощью ингибиторов было доказано, что без цепной лавины детонация невозможна. Было показано, что скорости реакций, обеспечивающие протекание взрыва и детонации за миллионные доли секунды, определяются, прежде всего, реакциями быстро размножающихся атомов и радикалов с исходным реагентами. Только стремительный рост концентраций этих носителей реакционных цепей во времени, усиливаемый растущей температурой по закону экспоненты, содержащей фактор Больцмана в положительном показателе степени (9), обеспечивает такое же ускорение реакции и тепловыделения. После того как характеристическое время ускоряющейся реакции становится значительно меньше времени теплоотвода, процесс становится адиабатическим, переходит в режим взрыва и детонации.
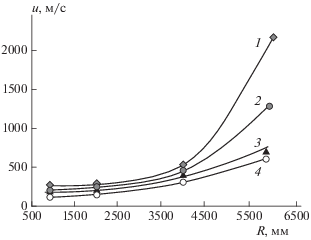
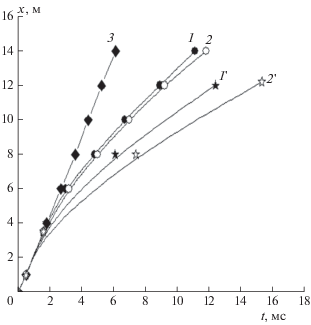
Экспоненциальный характер зависимости скорости процесса от скорости акта ингибирования является причиной не только большой эффективности ингибиторов, но также чувствительности кинетики процесса детонации к различиям реакционных способностей присадок. Рисунок 5 иллюстрирует зависимость времени распада стационарной детонации от химических свойств ингибиторов, членов одного и того же гомологического ряда олефинов [8].
Рис. 5.
х–t-диаграммы ударных волн (1, 2), фронтов горения (1', 2 ') и детонации (3) в смеси 45% Н2 в воздухе при наличии 2.5% пропена (1, 1') и 2.5% изобутена (2, 2 ') и в отсутствие присадки (3) [25].
Таким образом, открытие Н.Н. Семёновым разветвленно-цепных реакций и последующее доказательство цепной природы горения газов в режимах распространения пламени, взрыва и детонации позволили объяснить все основные закономерности этих процессов, не находившие объяснения ранее. Стало возможным регулировать с помощью присадок следующие характеристики процесса: преддетонационное расстояние и период задержки перехода горения в детонацию, концентрационные пределы и скорость стационарной детонации, а также осуществить распад стационарной волны путем воздействия на эти процессы малыми количествами присадок. Стало развиваться новое научно-техническое направление: химическое управление горением, взрывом и детонацией газов.
Список литературы
Semenoff N.N. // Z. Phys. 1927. V. 46. № 2. P. 109.
Семенов Н.Н. Цепные реакции. Л.: Госхимтехиздат, 1934.
Семенов Н.Н. Избранные труды. Т. 3. М.: Наука, 2005.
Thomson H.W., Hinshelwood C.N. // Proc. Roy. Soc. A. 1929. V. 122. № 790. P. 610.
Hinshelwood C.N., Williamson A.T. The Reaction between Hydrogen and Oxygen. N.Y.: Oxford University Press, 1934.
Семенов Н.Н. О некоторых проблемах химической кинетики и реакционной способности. М.: Изд-во АН СССР, 1958.
Семенов Н.Н., Сорока Л.Б., Азатян В.В. // Кинетика и катализ. 1975. Т. 16. № 3. С. 576.
Азатян В.В. Цепные реакции в процессах горения, взрыва и детонации газов. М.: Изд-во РАН, 2017.
Бородулин Р.Р., Маркевич Е.А., Азатян В.В. и др. // Кинетика и катализ. 1976. Т. 17. № 4. С. 834.
Зельдович Я.Б., Баренблатт Г.И., Либрович В.Б. и др. Математическая теория горения и взрыва. М.: Наука, 1980.
Кондратьев В.Н., Никитин Е.Е. Химические процессы в газах. М.: Наука, 1981.
Lewis B., von Elbe G. Combustion, Explosions and Flame in Gases. N.Y., London: Academic Press, 1987.
Химическая энциклопедия. Горение. Т. 1. М.: Сов. энциклопедия, 1988. С. 594.
Физическая энциклопедия. Горение. Т. 1. М.: Сов. энциклопедия, 1988. С. 515.
Мержанов А.Г., Хайкин Б.И. Теория волн горения в гомогенных средах. Черноголовка: ОИХФ РАН, 1992.
Франк-Каменецкий Д.А. Основы макрокинетики: диффузия и теплопередача в химической кинетике. Долгопрудный: Издат. дом “Интеллект”, 2008.
Зельдович Я.Б., Компанеец А.С. Теория детонации. М.: Гостехиздат, 1955.
Вильямс Ф.А. Теория горения. М.: Наука, 1971.
Tang S., Chernovsky M.K., Im H.G. и дp. // Combust. and Flame. 2010. V. 157. № 1. P. 118.
Палесский Ф.С., Фурсенко Р.В., Минаев С.С. // Физика горения и взрыва. 2014. Т. 50. № 6. С. 3.
Дубровский А.В., Иванов В.С., Зангиев А.Э. и др. // Хим. физика. 2016. Т. 35. № 6. С. 49.
Азатян В.В., Бакулев В.И., Калканов В.А. и др. Способ питания газового двигателя внутреннего сгорания. Пат. RUS 1835139, 1992.
Азатян В.В. // Успехи химии. 1999. Т. 62. № 12. С. 1122.
Азатян В.В., Вагнер Г.Г., Ведешкин Г.К. // ЖФХ. 2004. Т. 78. № 6. С. 1036.
Азатян В.В., Павлов В.А., Шаталов О.П. // Кинетика и катализ. 2005. Т. 46. № 6. С. 835.
Азатян В.В. // ЖФХ. 2011. Т. 85. № 8. С. 1405.
Азатян В.В. // Кинетика и катализ. 2020. Т. 61. № 3. С. 291.
Митрофанов В.В. Детонация гомогенных и гетерогенных систем. Новосибирск: Изд-во СО РАН, 2003.
Transient Combustion and Detonation Phenomena. Fundamentals and Applications. Moscow: Torus Press, 2014.
Соколик А.С. Самовоспламенение, пламя и детонация в газах. М.: Изд-во АН СССР, 1960.
Гельфанд Б.Е. // Физика горения и взрыва. 2002. Т. 38. № 5. С. 101.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика