Химическая физика, 2021, T. 40, № 6, стр. 38-46
Селективное гидрирование фурфурола в присутствии платиносодержащих катализаторов
К. Р. Кутлугильдина 1, П. А. Чистякова 1, С. А. Николаев 1, 2, И. Н. Кротова 2, Д. И. Эзжеленко 1, 2, А. В. Чистяков 1, *
1 Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: chistyakov@ips.ac.ru
Поступила в редакцию 24.07.2020
После доработки 10.08.2020
Принята к публикации 20.08.2020
Аннотация
В настоящей работе установлено, что фурфурол в присутствии Pt–M/Al2O3-катализаторов (где М – Cu, Ni) при температуре 90 °С превращается в фурфуриловый спирт с селективностью, достигающей 90%, а при 150 °С – в α-метилфуран с селективностью, составляющей 92%. Особо следует отметить, что выход продуктов осмоления фурфурола в проведенных экспериментах не превышает 5%. Показано, что наиболее эффективным растворителем, препятствующим осмолению фурфурола, является тетралин, а использование оксида алюминия в качестве носителя позволяет при равных температурах увеличить степень конверсии фурфурола по сравнению с оксидом кремния и сибунитом. Полученные результаты позволяют предложить эффективный способ производства ценных продуктов нефтехимии из возобновляемого сырья.
ВВЕДЕНИЕ
В связи с ограниченным количеством и неравномерной локализацией ископаемых ресурсов и растущими экологическими проблемами, связанными с их добычей, внимание мирового сообщества привлекает каталитическое преобразование устойчивых ресурсов биомассы в топливо и химикаты с высокой добавленной стоимостью [1, 2]. Решение проблем эффективной конверсии производных биомассы чрезвычайно важно для повышения экологической приемлемости процессов получения ее производных с высокой добавленной стоимостью и позволит предложить новые подходы к получению энергоносителей на основе возобновляемого сырья. Несомненными преимуществами использования возобновляемого сырья являются: сокращение выбросов CO2, оксидов серы и азота, потребление диоксида углерода на стадии роста, а также диверсификация источников энергии, повышение энергетической безопасности в районах, лишенных источников ископаемых, источников энергии или отдаленных от их инфраструктуры и стимулирования развития аграрной экономики [3, 4].
В связи со сложным составом биосырья и трудностью его прямой переработки исследуют превращения так называемых молекул-платформ, которые впоследствии конвертируют в продукты с высокой добавленной стоимостью. Одной из важнейших таких молекул-платформ является фурфурол, который может быть получен дегидратацией пентоз, ключевых соединений гемицеллюлозной фракции лигноцеллюлозы [2]. Около 60–70% произведенного в мире фурфурола идет на получение фурфурилового спирта [2, 5]. Фурфуриловый спирт находит широкое применение для получения смол [6] по реакциям самоконденсации и конденсации с фенолом и ацетоном или с мочевиной и другими веществами. Такие смолы обладают повышенной химической, термической и механической стойкостью, а также устойчивы к коррозии [7], поэтому используются в производстве стекловолокна, некоторых деталей самолетов и автомобильных тормозов [8].
В течение последних десятилетий для получения фурфурилового спирта путем гидрирования фурфурола были изучены и использовались различные методы и типы катализаторов. Одними из наиболее распространенных в производстве были медно-хромовые катализаторы [9–12]. Ранее промышленное производство фурфурилового спирта проводилось в присутствии катализаторов на основе 1–2% хромита меди в диапазоне давлений 69–103 бар в стационарном режиме при 175 °C [13]. Войцик и соавт. [14] обнаружили, что при гидрировании соединений фурана в присутствии никелевых катализаторов Ренея и медно-хромовых (Cu–CrO) возникает большое количество побочных реакций. В присутствии катализатора на основе меди и оксида хрома выход фурфурилового спирта составлял 96–99% от теоретического при 175 °C, при этом фурановое кольцо оставалось практически не затронутым. Повышение температуры до 250 °C и увеличение давления приводило к образованию 2-метилфурана (36%), пентанола (36%), 1,5-пентандиола (15%) и 1,2-пентандиола (14%). Процесс гидрирования фурфурола в настоящее время активно изучается, внимание исследователей направлено на изучение механизма реакции и разработки новых каталических процессов, которые могли бы быть внедрены в промышленность.
В литературе довольно широко представлены подходы к переработке фурфурола в фурфуриловый спирт, тетрагидрофурфуриловый спирт, 2-метилфуран и 2-метилтетрагидрофуран. В основном реакции проводят в периодических условиях [15–19], реже в проточном режиме [20, 21], в присутствии катализаторов на основе благородных или переходных металлов. Тетрагидрофурфуриловый спирт считается “зеленым” растворителем, используется в сельскохозяйственных целях, в печатных красках, как промышленное чистящее средство. Традиционный тетрагидрофурфуриловый спирт получают путем двухстадийного каталитического гидрирования фурфурола через промежуточное соединение фурфурилового спирта в присутствии CuCr и катализаторов на основе благородных металлов [17–21], однако ввиду токсичности хрома поиски новых катализаторов гидрирования фурфурола продолжают быть весьма актуальными.
В настоящей работе изучены закономерности каталитического действия моно- и биметаллических катализаторов для гидрирования фурфурола (ФФ) в фурфуриловый спирт (ФС) и α-метилфуран. Продемонстрирована высокая важность выбора носителя для синтеза нанесенных систем, изучены закономерности протекания реакции в присутствии различных алифатических спиртов и сделан вывод о перспективах дальнейших исследований.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1. Синтез катализаторов
Методом пропитки по влагоемкости из солей соответствующих металлов были синтезированы следующие катализаторы, содержащие 1 мас.% активного компонента: Fe/Al2O3, Co/Al2O3, Ni/Al2O3, Cu/Al2O3, и катализаторы, содержащие 0.5–1 мас.%: Аu/Al2O3, Pt/Al2O3, Pt/SiO2, Pt/C.
В синтезах образцов использовали: стандартный раствор (I) HAuCl4 ⋅ 3H2O (Sigma-Aldrich, 98%) с концентрацией золота 2.4 ⋅ 10–2 г/мл; Fe(NO3)3 ⋅ 6H2O (Sigma-Aldrich, 98%); Co(NO3)2 ⋅ ⋅ 6H2O (Sigma-Aldrich, 98%); Ni(NO3)2 ⋅ 6H2O (Sigma-Aldrich, 98%); PtCl4 (Sigma-Aldrich, 98%), NaOH – гидроксид натрия (Реахим, 0.1 М); H2O – дистиллят. В качестве носителей использовали: гранулы γ-Al2O3 (АОК-63-11(В), Ангарский завод катализаторов и адсорбентов, удельная поверхность S = 160 м2/г, средний размер пор dпор = 3–15 нм); гранулы SiO2 (марка КСКГ, Салаватский катализаторный завод, S = 450 м2/г, dпор = 20–40 нм); гранулы углеродного материала (сибунит, Институт проблем переработки углеводородов СО РАН, S = 260 м2/г, dпор = 20–50 нм). Перед нанесением металлов гранулы прокаливали при 350 °С в течение 3 ч для очистки пор от адсорбированных из воздуха молекул.
2. Методика проведения каталитических испытаний
Каталитические испытания проводили на мультиреакторной установке автоклавного типа Parr 5000 Series (Parr Instruments, США), объем реактора – 45 мл. Перед началом экспериментов реактор с загруженными в него растворителем, реагентом и катализатором продувался водородом. Начальное давление водорода в реакторе составляло 50 атм. Температура процесса варьировалась в интервале 70–150 °С. Перемешивание реакционной массы обеспечивалось магнитной мешалкой (частота вращения – 750 об/мин). По завершении времени эксперимента реактор быстро охлаждали водой до комнатной температуры, после чего отбирали весь реакционный газ в газгольдер, затем раскручивали реактор и отбирали для анализа жидкие продукты.
Газообразные продукты реакции анализировали методом газовой хроматографии: газообразные углеводороды С1–С5 – на хроматографе “Кристаллюкс-4000М”, Мета-Хром, Россия (пламенно-ионизационный детектор, хроматографическая колонка HP-PLOT); СО, СО2 и Н2 – на хроматографе “Кристаллюкс-4000М” (детектор по теплопроводности, колонка СКТ). Качественный состав жидких органических продуктов определяли методом хромато-масс-спектрометрии на приборах фирмы Agilent (США) “MSD 6973” (колонка HP-5MS) и фирмы Delsi Nermag (Франция) “Automass-150” (колонка CPSil-5) с энергией ионизации, равной 70 эВ. Количественное содержание жидких органических веществ определяли методом газо-жидкостной хроматографии на приборе “Varian 3600” (колонка Хроматэк SE-30, 0.25 мм × 25 м, толщина неподвижной фазы Df = 0.3 мкм, 50 °С (5 мин), 10 °/мин, 280 °С, Тинж = 250 °С, Ринж = 1 бар, деление потока – 1/200, ПИД, внутренний стандарт – н-октан).
3. Методы исследования катализаторов
Микрофотографии катализаторов получали с помощью просвечивающей электронной микроскопии (ПЭМ) на приборе фирмы JEOL (Япония) JEM 2100F с разрешающей способностью 0.2 нм. Перед исследованием 0.1 г образца помещали в 30 мл C2H5OH и обрабатывали ультразвуком в течение 300 с. Каплю полученной смеси помещали на сетку ПЭМ, покрытую аморфным углеродом, сушили 1 ч, помещали в микроскоп и проводили исследования. Для исследования Pt–Ni/Al2O3-катализатора использовали медную сетку для ПЭМ, а для исследования Pt–Cu/Al2O3-катализатора – никелевую сетку. Размер частицы определяли как максимальный линейный размер. Для построения распределения частиц по размерам обрабатывали данные по 300 частицам [22, 23]. Элементный анализ состава частиц проводили с помощью энергодисперсионного анализа (ЭДА) на приборе JED-2300, входящего в комплектацию JEM 2100F.
Рентгеновские фотоэлектронные спектры Pt(4 f ), Cu(2p) и Ni(2p) уровней в нанесенных металлах получены на приборе Axis Ultra DLD (Kratos, Великобритания) с использованием Al(Kα)-излучения (1486.6 эВ). Спектры регистрировали с энергией пропускания анализатора 10–40 эВ и шагом 0.02–0.05 эВ. Разложение спектров на ряд линий, соответствующих различным химическим состояниям металлов, проводили после вычитания фоновой составляющей по методу Ширли. Аппроксимацию формы пиков проводили с использованием функций Гаусса и Лоренца GL(30) и значений энергий связи электронов для наноразмерных соединений золота и палладия.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Каталитические испытания
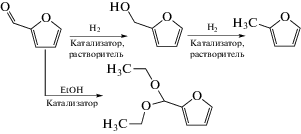
В табл. 1 представлены значения селективности образования основных продуктов превращения фурфурола (ФФ) и его конверсии при температуре 90 °С в присутствии синтезированных монометаллических катализаторов (время контакта – 2 ч, растворитель – этанол (объемный избыток к реагенту – 10), 50 атм Н2, скорость перемешивания – 750 об/мин). Основным продуктом гидрирования фурфурола при данных условиях является фурфуриловый спирт (Схема 1 ). Максимальная селективность образования фурфурилового спирта, равная 43.2%, достигается в присутствии Pt/Al2O3-катализатора. Образцы с нанесенными металлами триады железа и медью показали близкие значения по селективности образования фурфурилового спирта (ФС), равные 19.3–22.5%. Наименьшую селективность образования фурфурилового спирта, равную 10.5%, продемонстрировал золотосодержащий катализатор. Ацеталь фурфурола является основным продуктом реакции на всех исследованных образцах монометаллических катализаторов (Схема 1 ), селективность образования которого достигает 74.6%; также присутствуют продукты самоконденсации и осмоления фурфурола – до 14.9%.
Схема 1 . Вероятные превращения фурфурола в исследуемых условиях
Таблица 1.
Влияние состава катализатора на конверсию фурфурола и селективность образования продуктов при температуре 90 °С
| Катализатор | Конверсия фурфурола, x(ФФ), % | Селективность образования фурфурилового спирта, S(ФС), % | Селективность образования ацеталя фурфурилового спирта, S(АЦФ), % | Селективность образования сопутствующих продуктов, S(СП), % |
|---|---|---|---|---|
| Fe/Al2O3 | 21.2 | 21.8 | 74.1 | 4.1 |
| Co/Al2O3 | 19.6 | 19.3 | 74.2 | 6.5 |
| Ni/Al2O3 | 21.8 | 22.6 | 71.6 | 5.8 |
| Au/Al2O3 | 28.4 | 10.5 | 74.6 | 14.9 |
| Cu/Al2O3 | 20.6 | 22.5 | 73.0 | 4.5 |
| Pt/Al2O3 | 34.1 | 43.2 | 52.6 | 4.2 |
Полученные данные показывают, что платиносодержащий катализатор является наиболее перспективным для дальнейшего исследования, так как обладает наибольшими значениями активности и селективности среди рассмотренных систем. Однако следует отметить, что в присутствии всех изученных катализаторов наблюдается доминирование ацеталя фурфурола в продуктах реакции, что свидетельствует об интенсивном алкилировании фурфурола и значительно более медленном его гидрировании. Возможно, высокая интенсивность алкилирования связана с высокой реакционной способностью этанола в присутствии оксида алюминия, поэтому следующим этапом работы стало выявление влияния природы носителя и типа растворителя на параметры процесса гидрирования фурфурола.
В табл. 2 представлены значения селективности образования основных продуктов превращения фурфурола при температуре 90 °С в присутствии Pt/Al2O3-катализатора с различными растворителями. Из данных табл. 2 следует, что максимальная селективность образования фурфурилового спирта достигается при использовании этанола в качестве растворителя. При использовании пропанола-1, пропанола-2 или бутанола-1 селективность образования фурфурилового спирта снижается, а увеличивается выход сопутствующих продуктов – соответствующих ацеталей фурфурола и продуктов его осмоления. Вероятно, все использованные в данной работе спирты одинаково легко хемосорбируются поверхностью катализатора и затем алкилируют фурфурол. Косвенно данное предположение подтверждает снижение конверсии фурфурола с ростом углеводородной цепи спирта, т.е., вероятно, хемосорбированные спирты закрывают металлические центры от фурфурола, тем самым препятствуя протеканию реакции гидрирования. В литературе встречаются примеры использования алифатических спиртов в качестве растворителей для гидрирования фурфурола в присутствии гетерогенных катализаторов, обладающих различными кислотными центрами, в том числе и оксида алюминия [24]. Однако используемый нами оксид алюминия оказался непригоден для гидрирования фурфурола в среде спиртов. Разница в свойствах оксида алюминия обусловлена тем, что в настоящее время в России “гостированы” только примесные количества железа и натрия в оксиде алюминия и производители никак не контролируют наличие других элементов, что довольно часто приводит к технологическим сложностям на предприятиях нефтехимического комплекса при замене катализаторов [24].
Таблица 2.
Влияние природы растворителя на конверсию фурфурола и селективность образования продуктов при температуре 90 °С в присутствии Pt/Al2O3 катализатора
| Растворитель | Конверсия фурфурола, x(ФФ), % | Селективность образования фурфурилового спирта, S(ФС), % | Селективность образования ацеталя фурфурилового спирта, S(АЦФ), % | Селективность образования сопутствующих продуктов, S(СП), % |
|---|---|---|---|---|
| Этанол | 34.1 | 43.2 | 52.6 | 4.2 |
| Пропанол-2 | 28.9 | 32.8 | 55.8 | 11.4 |
| Пропанол-1 | 32.4 | 26.9 | 63.8 | 9.3 |
| н-бутанол | 28.3 | 27.8 | 61.3 | 10.9 |
Учитывая, что для протекания реакции алкилирования спиртом альдегида (фурфурола) необходима стадия протонирования кислорода карбонильной группы, существует высокая вероятность того, что природа кислотно-основных свойств носителя окажет заметное влияние на селективность процесса. С этой целью были изучены закономерности протекания реакции гидрирования фурфурола в присутствии платиносодержащих катализаторов на основе оксида кремния и сибунита. В табл. 3 представлены значения селективности образования основных продуктов гидрирования фурфурола при температуре 90 °С в присутствии платиносодержащих катализаторов на основе различных носителей и с различным содержанием активного компонента
Таблица 3.
Влияние природы носителя и количества активного металла на конверсию фурфурола и селективность образования продуктов при температуре 90 °С
| Носитель | Конверсия фурфурола, x(ФФ), % | Селективность образования фурфурилового спирта, S(ФС), % | Селективность образования ацеталя фурфурилового спирта, S(АЦФ), % | Селективность образования сопутствующих продуктов, S(СП), % |
|---|---|---|---|---|
| 0.5 Pt/Al2O3 | 19.5 | 31.2 | 63.7 | 5.1 |
| 0.5 Pt/SiO2 | 44.2 | 12.4 | 55.7 | 31.9 |
| 0.5 Pt/C | 17.5 | 94.8 | 2.1 | 3.1 |
| 1.0 Pt/Al2O | 34.1 | 43.2 | 52.6 | 4.2 |
| 1.0 Pt/C | 21.6 | 95.6 | 1.6 | 2.8 |
Из данных табл. 3 видно, что максимальная селективность достигается при использовании в качестве носителя сибунита. Аналогичный результат был достигнут авторами работы [25] при использовании палладия в качестве активного компонента. При использовании оксида кремния в качестве носителя наблюдается резкое снижение селективности образования фурфурилового спирта и увеличение выхода продуктов осмоления фурфурола. Таким образом, можно заключить, что оксид кремния не подходит в качестве носителя катализаторов гидрирования фурфурола в предложенных условиях. Следует обратить внимание на то, что производительности по фурфуриловому спирту, достигаемые в присутствии катализаторов на основе оксида алюминия и сибунита, идентичны. С целью повышения производительности системы Pt/C были проведены исследования с увеличенной концентрацией активного компонента (табл. 3). Оказалось, что повышение концентрации нанесенной на сибунит платины с 0.5 до 1 мас.% увеличивает конверсию фурфурола с 17.5 до 21.6% и увеличивает селективность образования фурфурилового спирта с 94.8 до 95.6%. Высокая селективность действия катализатора на основе сибунита связана с подавлением реакции алкилирования фурфурола спиртом-растворителем. Эффект увеличения концентрации активного компонента на оксиде алюминия значительно более заметен: так, конверсия фурфурола увеличивается в 1.5 раза, а селективность образования фурфурилового спирта – на 12%.
Следующим этапом работы стало изучение свойств биметаллических систем Pt–Ni/Al2O3 и Pt–Cu/Al2O3, полученных нанесением смеси монометаллических солей соответствующих металлов на γ-оксид алюминия. В качестве растворителя использовали тетралин, поскольку он не алкилирует фурфурол в присутствии кислотных катализаторов, а также может являться эффективным жидкофазным донором водорода для процесса гидрирования.
В табл. 4 представлены значения селективности образования основных продуктов гидрирования фурфурола в среде тетралина при различных температурах в присутствии биметаллических катализаторов. Установлено, что использование биметаллических катализаторов и тетралина в качестве растворителя позволяет значительно увеличить активность и селективность процесса гидрирования уже при 90 °С. Основным продуктом является фурфуриловый спирт, селективность образования которого достигает 90%. При температуре 150 °С в присутствии биметаллических катализаторов основным продуктом гидрирования фурфурола является α‑метилфуран, селективность образования которого составила 92.1% в присутствии изучаемых катализаторов. Кроме α-метилфурана, также еще образуется небольшое количество фурфурилового спирта, продукта крекинга α-метилфурана – фурана и продуктов осмоления фурфурола. Следует отметить, что при достигаемых высоких степенях конверсии 66–99% продуктов осмоления фурфурола образуется не более 5%.
Таблица 4.
Влияние температуры на конверсию фурфурола и селективность образования продуктов в присутствии биметаллических катализаторов
| Катализатор | Конверсия фурфурола, x(ФФ), % | Селективность образования S(фуран), % | Селективность образования S(α-метилфуран), % | Селективность образования ацеталя фурфурилового спирта, S(АЦФ), % | Селективность образования сопутствующих продуктов, S(СП), % |
|---|---|---|---|---|---|
| Температура 90 °С | |||||
| Pt–Cu | 69.6 | – | 11.8 | 86.6 | 1.5 |
| Pt–Ni | 66.3 | – | 7.9 | 90.0 | 2.1 |
| Температура 150 °С | |||||
| Pt–Cu | 73.1 | 3.5 | 92.1 | 1.4 | 3.1 |
| Pt–Ni | 99.7 | 4.7 | 92.1 | 0.7 | 0.8 |
Структурные исследования биметаллических катализаторов
Типичная микрофотография Pt–Ni/Al2O3-катализатора приведена на рис. 1. На фотографии видна частица округлой формы, контрастирующая с поверхностью носителя. В спектре локального ЭДА отмеченной частицы присутствуют линии Cu, C, Al, O, а также линии Pt и Ni. Наличие в спектре линий меди и углерода обусловлено присутствием этих элементов в используемой для анализа сетке ПЭМ [26, 27]. Наличие линий алюминия и кислорода обусловлено присутствием в катализаторе носителя – Al2O3. Оставшаяся комбинация элементов (Pt и Ni) относится к частице и позволяет сделать вывод о том, что она является биметаллической. Гистограмма распределения частиц образца Pt–Ni/Al2O3 по размерам приведена на рис. 2. Видно, что гистограмма узкая, мономодальная. Из гистограммы видно, что размер детектируемых частиц лежит в интервале от 1 до 10 нм. Средний размер частиц равен (3 ± 1) нм.
Рис. 1.
Микрофотография нанесенной частицы катализатора Pt–Ni/Al2O3, полученная с помощью ПЭМ в режиме темного поля.

Рис. 2.
Гистограммы распределения частиц по размерам в образцах катализаторов: темные столбцы – Pt–Ni/Al2O3, светлые – Pt–Cu/Al2O3.
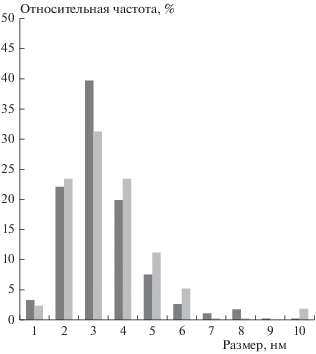
Типичная микрофотография образца Pt–Cu/Al2O3 приведена на рис. 3. На фотографии видна частица округлой формы, контрастирующая с поверхностью носителя. В спектре локального ЭДА отмеченной частицы присутствуют интенсивные линии Ni, C, Al, O и слабые линии Pt и Cu. Наличие в спектре линий никеля и углерода обусловлено присутствием этих элементов в используемой для анализа сетке ПЭМ. Наличие линий алюминия и кислорода обусловлено присутствием в катализаторе носителя – Al2O3. Оставшаяся комбинация элементов (Pt и Cu) относится к частице и позволяет сделать вывод о том, что она является биметаллической. Гистограмма распределения частиц образца Pt–Cu/Al2O3 по размерам приведена на рис. 2. Видно, что гистограмма узкая, мономодальная. Из гистограммы видно, что размер детектируемых частиц лежит в интервале от 1 до 10 нм. Средний размер частиц равен (3 ± 1) нм.
Рис. 3.
Микрофотография нанесенной частицы катализатора Pt–Cu/Al2O3, полученная с помощью ПЭМ в режиме темного поля.

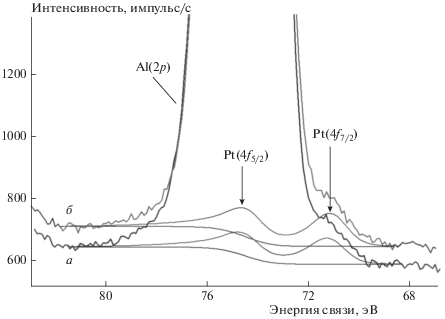
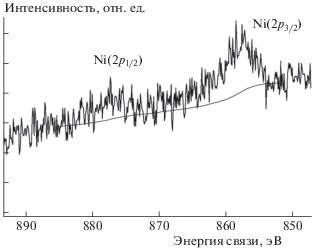
Рассчитанные из спектров РФЭС концентрации элементов на поверхности образцов приведены в табл. 5. Спектры РФЭС высокого разрешения в области 68–80 эВ приведены на рис. 4. В спектрах наблюдается интенсивная линия Al(2p), которая накладывается на низкоинтенсивный спектр Pt(4f)-электронов. Тем не менее со стороны меньших энергий связи в спектрах на рис. 4 можно заметить слабое плечо в области 71.1 эВ, которое можно отнести к линии Pt(4 f7/2) металлической платины: (71.0 ± 0.1) эВ. Таким образом, есть основания полагать, что платина в образцах Pt–Ni/Al2O3 и Pt–Cu/Al2O3 находится в состоянии Pt0. Спектр Ni(2p) образца Pt–Ni/Al2O3 приведен на рис. 5. Спектр представляет собой низкоинтенсивный дублет линий Ni(2p3/2) и Ni(2p1/2) с энергиями связи, которые характерны для окисленных форм никеля. Ввиду малого количества металла зарегистрировать спектр Cu(2p) образца Pt–Cu/Al2O3 не представляется возможным. Тем не менее, исходя из структурных данных по высокопроцентным Pd–Cu/Al2O3-катализаторам, полученных тем же способом, что и Pt–Cu/Al2O3, наиболее вероятными формами содержания меди в Pt–Cu/Al2O3 являются ее оксиды [28, 29].
ЗАКЛЮЧЕНИЕ
Проведен скрининг активности монометаллических катализаторов на основе γ-оксида алюминия, модифицированного металлами триады железа, медью, золотом и платиной. Установлено, что при пониженной температуре 90 °С наибольшую активность и селективность в гидрировании фурфурола в фурфуриловый спирт проявляет Pt/Al2O3-катализатор.
Изучение влияния природы носителя на параметры реакции гидрирования фурфурола показало высокую чувствительность процесса к кислотно-основным свойствам поверхности носителя. При использовании в качестве разбавителя фурфурола алифатических спиртов наибольшую селективность в образовании фурфурилового спирта, достигающую 96%, проявляют катализаторы на основе сибунита. Катализаторы на основе γ-оксида алюминия наиболее активны в превращении фурфурола, однако при использовании в качестве разбавителя алифатических спиртов С2–С4 основными продуктами превращения являются соответствующие ацетали фурфурола. Изучение влияния природы спирта-разбавителя фурфурола на параметры процесса гидрирования показали, что в ряду этанол–пропанол–бутанол варьирование растворителя мало влияет на селективность реакции, а основными продуктами превращения фурфурола являются ацетали фурфурола.
Варьирование количества нанесенного компонента показало, что наиболее заметный эффект достигается в катализаторах на основе γ-оксида алюминия. При увеличении доли нанесенной платины с 0.5 до 1 мас.% увеличивается конверсия фурфурола в 1.5 раза и селективность образования фурфурилового спирта увеличивается на 20%.
Синтезированы биметаллические катализаторы на основе γ-оксида алюминия с нанесенными парами активных компонентов: Pt–Ni, Pt–Cu. Изучение каталитической активности разработанных катализаторов показало их большой потенциал. Установлено, что при температуре 90 °С основным продуктом гидрирования фурфурола является фурфуриловый спирт, селективность образования которого достигает 90% при конверсии фурфурола 67–74%. При температуре 150 °С кардинально меняется селективность процесса – основным продуктом является α-метилфуран, селективность образования которого достигает 92% при степени конверсии фурфурола 73–99%. Особо следует отметить, что выход продуктов осмоления фурфурола в проведенных экспериментах не превышает 5%.
Работа выполнена при финансовой поддержке Российским научным фондом (грант № 18-73-10216).
Список литературы
Жарова П.А., Чистяков А.В., Лесин С.В., Константинов Г.И., Арапова О.В., Цодиков М.В. // Хим. физика. 2019. Т. 38. № 6. С. 35.
Chatterjee C., Pong F., Sen A. // Green Chem. 2015. V. 17. № 1. P. 40.
Serrano-Ruiz J.C., Luque R., Sepulveda-Escribano A. // Chem. Soc. Rev. 2011. V. 40. № 11. P. 5266.
Alonso D.M., Wettstein S.G., Dumesic J.A. // Ibid. 2012. V. 41. № 24. P. 8075.
Luo Y., Li Z., Li X. et al. // Catal. Today. 2019. V. 319. P. 14.
Alipour S., Omidvarborna H., Kim D.S. // Renew. Sustain. Energy. Rev. 2017. V. 71. P. 908.
Agirrezabal-Telleria I., Gandarias I., Arias P.L. // Catal. Today. 2014. V. 234. P. 42.
Клещевников Л.И., Логинова И.В., Харина М.В. и др. // Вестн. технол. ун-та. 2015. Т. 18. № 19. С. 95.
Ullmann’s Encyclopedia of Industrial Chemistry. The Sixth edition. Weinheim: Wiley-VCH, 2007. P. 313.
Barr J.B., Wallon S.B. // J. Appl. Polym. Sci. 1971. V. 15. № 5. P. 1079.
Schneider M.H., Phillips J.G. Furfuryl alcohol and lignin adhesive composition. Пaтeнт US 6747076 B2, 2004.
Adkins H., Connor R. // J. Amer. Chem. Soc. 1931. V. 53. P. 1091.
Connor R., Folkers K., Adkins H. // J. Amer. Chem. Soc. 1932. V. 54. №. 3. P. 1138.
Wojcik B.H. // Ind. Eng. Chem. 1948. V. 40. № 2. P. 210.
Panagiotopoulou P., Vlachos D.G. // Appl. Catal. A–Gen. 2014. V. 480 P. 17.
Sharma R.V., Das U., Sammynaiken R. et al. // Ibid. 2013. V. 454. P. 127.
Villaverde M.M., Bertero N.M., Garetto T.F. et al. // Catal. Today. 2013. V. 213. P. 87.
Biradar N.S., Hengne A.A., Birajdar S.N. et al. // Org. Process Res. Dev. 2014. V. 18. P. 1434.
Fulajtárova K., Soták T., Hronec M. et al. // Appl. Catal. A–Gen. 2015. V. 502. P. 78.
Selishcheva S.A., Smirnov A.A., Fedorov A.V. et al. // Catalysts. 2019. V. 9. № 10. P. 816.
Селищева С.А., Смирнов А.А., Федоров А.В. и др. // Катализ в промышленности. 2019. Т. 19. № 2. С. 95.
Гришин М.В., Гатин А.К., Дохликова Н.В. и др. // Хим. физика. 2019. Т. 38. № 1. С. 3.
Badalyan S.M., Rumyantseva M.N., Nikolaev S.A. et al. // Inorg. Mater. 2010. V. 46. № 3. P. 232.
Смирнов А.А., Шилов И.Н., Алексеева М.В. и др. // Катализ в промышленности. 2017. Т. 17. № 6. С. 517.
Li H., Luo H., Zhuang L. et al. // J. Mol. Catal. A-Chem. 2003. V. 203. № 1–2. P. 267.
Zanaveskin K.L., Lukashev R.V., Makhin M.N. et al. // Ceram. Intern. 2014. V. 40. № 10. P. 16577.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2018. Т. 37. № 9. С. 74.
Гришин М.В., Гатин А.К., Сарвадий С.Ю. и др. // Хим. физика. 2020. Т. 39. С. 1.
Nikolaev S.A., Golubina E.V., Shilina M.I. // Appl. Catal. B-Environ. 2017. V. 208. P. 116.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика