Химическая физика, 2022, T. 41, № 1, стр. 48-51
Кинетика разложения 1,1-диамино-2,2-динитроэтилена (FOX-7). 3. Реакция в растворах
Г. М. Назин 1, В. В. Дубихин 1, А. И. Казаков 1, *, А. В. Набатова 1, А. В. Шастин 1
1 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: akazakov@icp.ac.ru
Поступила в редакцию 04.02.2021
После доработки 16.04.2021
Принята к публикации 20.04.2021
- EDN: RQXWUK
- DOI: 10.31857/S0207401X22010125
Аннотация
Манометрическим и калориметрическим методами исследована кинетика термического разложения 1,1-диамино-2,2-динитроэтилена (FOX-7) в растворах при температурах 180–240 °С и концентрации FOX-7 ~1 вес.%. В качестве растворителей использованы хлор- и о-дихлорбензол, нитробензол и н-нитротолуол. Показана независимость скорости разложения от полярности растворителя и определены кинетические параметры реакции в растворе. Полученные данные использованы для обсуждения механизма реакции, а также для прогнозирования величин скоростей превращения FOX-7 в жидком и твердом состояниях.
ВВЕДЕНИЕ
Исследование кинетики разложения взрывчатых веществ (ВВ) в растворах позволяет измерить скорость мономолекулярной стадии разложения, не осложненной воздействием побочных факторов, которые обычно проявляются при проведении реакции в твердой или жидкой (расплав) фазах [1–3]. Перевод реакции в раствор позволяет полностью исключить роль твердой фазы и уменьшить влияние сильных автокаталитических реакций, характерных для жидкофазных процессов. В случае 1,1-диамино-2,2-динитроэтилена (FOX-7) заметными побочными процессами являются сублимация и быстрый распад вещества в паровой фазе [4]. В растворе эти явление также исчезают.
Между скоростями мономолекулярной реакции в газовой фазе, растворах и жидком состоянии существует количественная связь [5]. В отсутствие полярного эффекта растворителя, т.е. при независимости скорости реакции от диэлектрической проницаемости среды, константы скорости и энергия активации в газовой фазе, растворе и в жидком состоянии (Eр, Eг и Eж соответственно) имеют практически одинаковое значения. Это дает возможность использовать Eр для сравнения эксперимента с квантовохимическими расчетами Eг и обсуждения механизма реакции, который согласуется с результатами этих расчетов. В свою очередь, через равенство Eр= Еж данные, полученные в растворе, оказываются связанными с разложением в твердой фазе. Полуэмпирические модели мономолекулярных реакций в твердой фазе (см. [6]) позволяют, при знании плотности или теплоты плавления вещества, расчетным путем находить разность ∆Е = Етв – Еж и отношение констант kж/kтв при любой температуре.
При наличии полярного эффекта связь константы kр с kг теряется, но параметры kж и Еж могут быть определены из данных, полученных в растворе, после внесения поправки на полярный эффект, который определяется экспериментально. Из-за высокой температуры плавления проведение экспериментов с FOX-7 в жидкой фазе невозможно, поэтому исследование кинетики разложения ВВ в растворах является единственным способом нахождения параметров жидкофазной реакции.
Цель данной работы заключалась в том, чтобы исследовать кинетику разложения FOX-7 в разбавленных растворах и определить полярный эффект растворителя. Проблема выбора растворителей, пригодных для изучения С-нитросоединений при повышенных температурах, рассмотрена в работе [7]. Результаты, полученные в [7], будут использованы при выполнении данного исследования.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Согласно [7], наиболее подходящими растворителями для исследования С-нитросоединений при высоких температурах являются ароматические углеводороды, хлор- и нитропроизводные бензола. Эти растворители термически устойчивы до 300 °С, не взаимодействуют с нитросоединениями и не окисляются диоксидом азота. Ряд полярности, установленный для этих растворителей по значениям диэлектрической проницаемости ɛ при комнатной температуре, сохраняется и при высоких температурах и охватывает весь диапазон значений ɛ, возможных для нитросоединений.
В связи с очень плохой растворимостью FOX-7 в углеводородах в качестве растворителей использованы только полярные соединения – нитробензол (ɛ = 38.5 при 25 °С), хлорбензол (ɛ = 5.0), о‑дихлорбензол (ɛ = 5.6) и п-нитротолуол, который по своей полярности, по-видимому, близок к нитробензолу.
Измерения выполнены манометрическим методом. Аппаратура для применения этого метода при повышенных давлениях описана в работе [4].
Реакции проводились при концентрациях FOX-7 С = 0.5–1.5 вес.% (0.034–0.10 моль/л). Все опыты доводились до конца, что позволяло найти такую важную характеристику реакции, как степень разложения η = Р/Р∞. Наиболее подробно кинетика разложения исследована в нитробензоле.
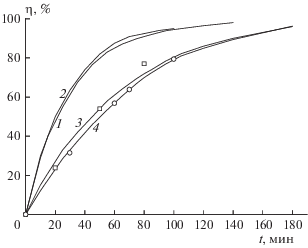
Примеры кинетических кривых распада при пониженных температурах приведены на рис. 1. При 210 °С и более низких температурах реакция в нитробензоле идет с небольшим ускорением, величина которого зависит от концентрации вещества, однако начальная скорость остается постоянной, по крайней мере в интервале значений С = 0.5–1.5 вес.%. При повышении температуры каталитическая реакция становится незаметной, и при 230–240 °С распад описывается уравнением первого порядка (рис. 2). Кинетические кривые, полученные в нитробензоле, хлорбензоле, о-дихлорбензоле и п-нитротолуоле при 230 °С, практически совпадают. То же самое наблюдается для реакции в нитробензоле и в о-дихлорбензоле при 240 °С. Из равенства скоростей в разных растворителях следует, что полярный эффект растворителя при разложении FOX-7 отсутствует.
Рис. 1.
Примеры кинетических кривых разложения FOX-7 в нитробензоле при следующих значениях температуры (°С) и концентрации FOX-7 (вес.%): 1 – 210 и 1.0, 2 – 190 и 1.5, 3 – 190 и 0.5, 4 – 180 и 0.8.

Рис. 2.
Примеры кинетических кривых разложения FOX-7 в растворах при температурах 140 °С (1, 2) и 130 °С (3, 4). Растворитель и концентрация FOX-7 (мас.%): 1 – нитробензол, 1.0; 2 – о-дихлорбензол, 1.0; 3 – нитробензол, 0.5; 4 – хлорбензол, 1.0. Квадратами и кружками обозначены данные для разложения в о-дихлорбензоле и н-нитротолуоле, соответственно, при 130 °С и С = 0.5 вес.%.
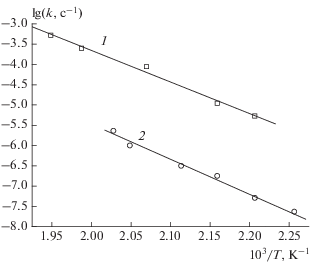
В координатах уравнения Аррениуса константы скорости в нитробензоле представлены на рис. 3. Там же приведены данные для твердой фазы, взятые из работы [8]. Видно, что прямые для раствора и твердой фазы идут практически параллельно, т.е. энергии активации в растворе и в твердом состоянии различаются незначительно. Данные в растворе описываются уравнением kр = 1011.9 ± 0.9 × × exp(–149.0 ± 8.4)/RT. Ранее [8] было получено kтв = 1011.3 ± 0.9 exp(–161.2 ± 8.4)/RT, где R = = 8.314 Дж/моль · град.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
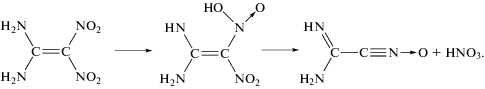
Независимость скорости разложения FOX-7 от полярности растворителя свидетельствует о том, что структура переходного состояния в лимитирующей стадии процесса соответствует дипольному моменту, близкому к аналогичному параметру для FOX-7. Это согласуется с механизмом реакции, который заключается в изомеризации FOX-7 в аци-форму [4]:
В переходном состоянии первичного акта происходит перенос водорода от аминогруппы к нитрогруппе, при этом общий дипольный момент изменяется мало.
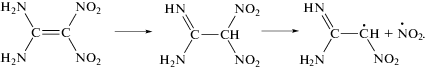
В теоретических работах [9, 10] обсуждается также возможность такого канала реакции, как перенос атома водорода от аминогруппы на атом углерода с образованием динитросоединения:
Эта реакция имеет энергию активации около 200 кДж/моль. Экспериментальное значение Ер ≈ ≈ Ег = 149 кДж/моль лучше соответствует реакции (1).
В твердой фазе разложение FOX-7 идет с энергией активации 161.2 кДж/моль, что на 12 кДж/моль больше, чем для жидкой фазы. Эта разница лежит в пределах экспериментальной ошибки. Константа скорости разложения в твердой фазе при 200 °С в 100 раз меньше, чем в растворе. Найденное отношение kр/kтв и близость значений Ер и Етв согласуются с существующими в настоящее время полуэмпирическими моделями мономолекулярных реакций в твердой фазе.
Первая модель, разработанная Боном [11], основывается на весьма веском предположении, что реакции разложения в молекулярных кристаллах идут на поверхности микроблоков, т.е. в местах скопления всех дефектов кристаллической решетки. Модель включает два постулата: 1) все молекулы, лежащие на поверхности, имеют одинаковую реакционную способность; 2) энергия активации в твердой фазе Етв остается такой же, как в жидкой фазе, т.е. ∆Е = Етв − Еж = 0, а скорость реакции уменьшается из-за снижения числа реакционноспособных молекул. Формально это сводится к уменьшению предэкспоненциального множителя в n раз, Аж/Aтв = n, где n – доля молекул микроблока, лежащих на его поверхности.
Величина n зависит от формы и размеров как микроблоков, так и молекул. Поэтому расчеты kж/kтв, выполненные в рамках модели Бона, являются приближенными. В то же время эта модель позволяет достаточно надежно оценить практически важную величину – максимальное изменение kж/kтв, которое может быть достигнуто при переходе реакции из жидкого состояния в твердое. Это значение, равное примерно 100, должно наблюдаться для веществ с молекулярным весом М < 500 г/моль и с размером микроблоков не менее 500 нм.
Условия, при которых реакция локализуется на поверхности микроблоков, позволяет определить модель расплавленной клетки (см. [6]), которая рассматривает реакцию в ненарушенной кристаллической решетке, т.е. в объеме кристалла: для этого случая Aтв = Aж и ∆Е = 0.6Qпл, где Qпл – теплота плавления. При Qпл > 25 кДж/моль kж/kтв > > 100, торможение реакции в объеме становится слишком большим и преобладает реакция на поверхности. Для многих взрывчатых веществ, особенно для соединений, имеющих высокие температуры плавления, условие Qпл > 25 кДж/моль выполняется, и разложение идет только на поверхности.
Максимально возможное снижение скорости в твердом состоянии, предсказанное в рамках модели Бона, экспериментально найдено для таких известных и хорошо изученных ВВ, как гексоген, октоген, ТЭН, тетрил и CL-20 [6]. По тормозящему влиянию кристаллической решетки на скорость реакции разложения FOX-7 не отличается от этих соединений.
ЗАКЛЮЧЕНИЕ
Константа скорости разложения FOX-7 в растворах не зависит от полярности растворителя, что дает возможность считать кинетические параметры реакции, измеренные в растворе (Е = 149 кДж/моль, A = 1011.9 с–1), близкими к аналогичным параметрам при разложении FOX-7 в газовой и жидкой фазах. Опытное значение Ег = Ер близки к величине, полученной квантовохимическим расчетом (131 кДж/моль), сделанным для реакции изомеризации FOX-7 в аци-форму.
Энергия активации Еж ≈ Ер отличается от энергии активации в твердом состоянии Етв на 12 кДж/моль, что не превышает ошибку эксперимента. Близость величин Еж и Етв, предсказанная моделью твердофазных реакций, локализованных на дефектах кристаллической решетки, подтверждает найденное в работе [8] значение Етв.
Работа выполнена на средства ИПХФ РАН в рамках госзаданий (регистрационные номера АААА-А19-119101690058-9 и АААА-А19-119100800130-0).
Список литературы
Захаров В.В., Чуканов Н.В., Зюзин И.Н. и др. // Хим. физика. 2019. Т. 38. № 2. С. 3; https://doi.org/10.1134/S0207401X19020146
Захаров В.В., Чуканов Н.В., Шилов Г.В. и др. // Хим. физика. 2019. Т. 38. № 4. С. 45; https://doi.org/10.1134/S0207401X19040137
Корсунский Б.Л., Ларикова Т. С., Захаров В.В. и др. // Хим. физика. 2019. Т. 38. № 8. С. 64; https://doi.org/10.1134/S0207401X19080065
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2021. Т. 40. № 6. С. 54.
Денисов Е. Т. Константы скорости гомолитических жидкофазных реакций. М.: Наука, 1971.
Манелис Г.Б., Назин Г.М., Прокудин В.Г. // Изв. РАН. Сер. хим. 2011. № 7. С. 1417; https://doi.org/10.1007/s11172-011-0215-7
Назин Г.М., Дубихин В.В., Далингер И.Л. и др. // Хим. физика. 2021. Т. 40. № 1. С. 30.
Назин Г.М., Дубихин В.В., Гончаров Т.К. и др. // Хим. физика. 2021. Т. 40. № 7. С. 16.
Kiselev V.G., Gritsan N.P. // J. Phys. Chem. A. 2014. V. 118. № 36. P. 8002; doi.org/https://doi.org/10.1021/jp507102x
Krisyuk B. // Cent. Eur. J. Energ. Mater. 2020. V 17. № 1. P. 20; https://doi.org/10.22211/cejem/118513
Химия твердого состояния / Под ред. Гарнера В.Е. М.: Изд-во иностр. лит., 1961.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика