Химическая физика, 2022, T. 41, № 1, стр. 60-65
Вода, активированная струей аргоновой СВЧ-плазмы, как фактор, стимулирующий прорастание семян растений
К. Ф. Сергейчев 1, *, Н. А. Лукина 1, Л. М. Апашева 2, Е. Н. Овчаренко 2, А. В. Лобанов 2, 3
1 Институт общей физики им. А.М. Прохорова Российской академии наук
Москва, Россия
2 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
3 Российский экономический университет им. Г.В. Плеханова
Москва, Россия
* E-mail: k-sergeichev@yandex.ru
Поступила в редакцию 28.01.2021
После доработки 11.06.2021
Принята к публикации 21.06.2021
- EDN: TYKXTQ
- DOI: 10.31857/S0207401X22010137
Аннотация
Благодаря новой безэлектродной СВЧ-технике генерации плазмы в открытой атмосфере получены растворы пероксида водорода и соединений азота. Метод основан на активации дистиллированной воды струей термической аргоновой плазмы безэлектродного СВЧ-разряда на воздухе при атмосферном давлении. Активированная плазмой вода оказывает стимулирующее действие на прорастание семян и рост растений, что по эффективности значительно превосходит влияние растворов промышленного пероксида водорода со стабилизирующими добавками.
ВВЕДЕНИЕ
В происхождении жизни на Земле и в процессе эволюции биосферы разряды молнии в атмосфере играли конструктивную роль [1]. Разряды – это инициатор химических реакций, образующих соединения, важные для жизни растений, такие как оксиды азота NOx и пероксид водорода H2O2 (далее – пероксид). Атмосферный воздух по объему состоит на 78% из азота, на 20% из кислорода, на 0.03% из углекислого газа и на 1% из аргона. Молекула азота химически стабильна благодаря прочной связи ее атомов. Чтобы разорвать связь атомов для образования оксидов азота, требуется высокая энергия, которая выделяется при разрядах молнии [2]. В результате электрических разрядов образуются оксиды азота NOx, которые в отличие от газообразного азота легко растворяются в дождевой воде, и растения потребляют азот из растворов нитратов.
Пероксид, выпадающий с дождем, весьма важен для растений. Концентрация пероксида, а также другие метеорологические и химические параметры осадков определялись в Майами (США) в сезоны 1995 и 1996 гг. [3]. Значения измеренных концентраций H2O2 находились в диапазоне от 0.3 до 38.6 мкМ и составляли в среднем 6.9 мкМ. Наблюдалась сильная сезонная зависимость концентрации пероксида в дождевой воде; была отмечена тенденция к значительному увеличению его концентрации при увеличении температуры дождевой воды и продолжительности грозы.
В агропромышленных комплексах для стимуляции прорастания семян начали использовать дождевую воду, а затем – водные растворы пероксида, чтобы побудить семена потреблять больше кислорода и воды [4–7], вместо обычных методов активации для их прорастания, таких как стратификация семян, механическая или химическая скарификация. Существуют публикации, посвященные повышению всхожести семян путем их прямой обработки так называемой “холодной плазмой” барьерного [8] и коронного [9] электрических разрядов, лазерным или СВЧ-облучением [10], что в той или иной степени воздействует на их биохимический состав.
Пероксид ранее считали токсичной молекулой, которая повреждает растительные клетки. Со временем стало ясно, что пероксид естественным образом синтезируется в самих клетках растений. Его роль в качестве сигнальной молекулы растения стала предметом обсуждения в конце ХХ века [11, 12]. Функция пероксида в растительных клетках проявляется во время роста и развития растения, выступая в качестве его иммунного ответа на опасность, возникающую при изменениях внешних условий [13]. При абиотических/биотических стрессах продукция активных форм кислорода (АФК) усиливается, что может вызывать окислительное повреждение структур растительных клеток и приводит к ингибированию роста растений, а в конечном итоге – к гибели. Среди различных АФК наиболее долгоживущий и свободно диффундирующий пероксид играет роль стрессового сигнала для стимуляции адаптации растений к неблагоприятным условиям. Для использования пероксида в качестве сигнальной молекулы необходимо поддерживать его концентрацию на безопасном уровне. Среди других молекул-защитников растений от различных абиотических/биотических стрессов оксид азота (II) NO в последнее время привлекает все большее внимание [14]. Молекулы NO являются важнейшими функционально-метаболическими компонентами клеток растения, которые принимают участие в сложных физиологических процессах, таких как прорастание, развитие корней и старение. Под контролем клеточного гомеостаза оксида азота и молекул, полученных из NO, можно смягчить стрессы растений, подвергшихся неблагоприятным факторам окружающей среды, таким как соленость, тяжелые металлы, ультрафиолетовое излучение B, озон и механические повреждения [14].
Прорастание семян является определяющей фазой жизненного цикла растений [15, 16]. Роль пероксида при прорастании семян и дальнейшем развитии растений была проиллюстрирована рядом исследований [17, 18]. Активное участие пероксида водорода в химических стадиях фотосинтеза было показано для ряда молекулярных моделей на основе хлорофилла и его синтетических аналогов, в которых образуется или расходуется Н2О2 наряду с другими активными формами кислорода [19–22]. В обзоре [23] пероксид рассматривается как сигнальная молекула в физиологии семян и подчеркивается важность перекрестных эффектов между пероксидом и, например, фитогормонами растений, такими как абсцизовая кислота, гиббереллины, а также химически активными оксидами азота и сероводородом, который также участвует в передаче сигнала при прорастании семян. Подчеркивается, что высокая концентрация пероксида не требуется для выполнения функции сигнализации. Согласно сообщению [24], темпы прорастания семян и роста растений сильно зависят от комбинации двух компонентов, генерируемых плазмой в воде: H2O2 и NOx, между которыми проявляется синергизм в действии на высвобождение семян из состояния покоя.
В сельскохозяйственной практике используют коммерческий пероксид, который производится химической промышленностью в больших объемах. Растворы пероксида промышленного производства содержат определенное количество ионов переходных металлов, железа, марганца, меди, которые являются катализаторами распада пероксида и проникают из сырья в конечный продукт. Следы солей кобальта и хрома являются также “вредными” катализаторами разложения пероксида при хранении. Поэтому в пероксид вводятся специальные стабилизирующие добавки, чтобы минимизировать его разложение при хранении и использовании.
В настоящей работе предлагается новая методика получения комплексного раствора из воды, активированной плазмой (ВАП), содержащего пероксид и нитраты, в котором отсутствуют другие примеси и который оказывает стимулирующие действие на развитие растений. Метод основан на активации чистой (дистиллированной) воды струей термической аргоновой плазмы безэлектродного СВЧ-разряда в воздушной среде при атмосферном давлении. Цель работы – сравнение эффективности действия на прорастание семян двух качественно разных типов водных растворов, а именно комплексного раствора на основе ВАП, полученного из дистиллированной воды с помощью термической плазменной СВЧ-струи, и раствора коммерческого пероксида, который в своем составе имеет производственные примеси и стабилизаторы.
ОПИСАНИЕ УСТАНОВКИ
Устройство для производства BАП было разработано на основе технологии плазмохимического осаждения из паровой фазы углеродной пленки на подложку путем ее обработки термической микроволновой плазменной струей, работающей при атмосферном давлении. Схема установки представлена на рис. 1. В качестве источника энергии использовался коммерческий магнетрон 1 Samsung OM75P (31) мощностью 0.9 кВт, работающий на частоте 2.45 ГГц в режиме непрерывной генерации. Сверхвысокочастотная энергия от магнетрона распространяется внутри волновода 2 прямоугольного сечения и, проходя через изолятор 3, поступает в плазмотрон, где преобразуется в волну типа ТЕM коаксиального волновода 4. Поршень 6 служит для согласования плазмотрона с целью оптимальной передачи энергии в плазменную струю. Центральный проводник 5 коаксиального волновода представляет собой полую медную трубку диаметром 6 мм с заостренным наконечником и соплом диаметром 1.5 мм, из которого аргон вытекает в виде слегка расширяющейся струи. Под действием СВЧ-поля, излучаемого с конца коаксиального волновода, струя аргона превращается в плазменную струю. Пространство коаксиального волновода изолировано от остальной волноводной системы кварцевой трубкой 7, через которую азот в качестве буферного газа пропускается для стабилизации плазменной струи 8. Нисходящая струя плазмы позволяет готовить BАП в открытых чашках из термостойкого стекла. Плазмообразующий аргон вытекает из сопла при давлении р ≥ 1 атм. При направленной скорости потока 30–50 м/с скорость газа составляла 3–5 л/мин. Плазменная струя отрывается от сопла, поскольку скорость нейтральной струи аргона выше скорости фронта ионизации, который распространяется вдоль газового потока в направлении сопла. Микроволновая мощность передается в плазменную струю благодаря емкостной связи между соплом и плазменной струей.
Рис. 1.
Принципиальная схема установки: 1 – магнетрон Samsung OM75P(31); 2 – прямоугольный волновод сечением 45 × 90 мм2; 3 – циркулятор; 4 – коаксиальный волновод; 5 – центральный проводник коаксиальной линии – трубка, заканчивающаяся внизу соплом; 6 – настроечный поршень; 7 – кварцевая трубка; 8 – плазменный факел; 9 – кварцевый стакан с водой; 10 – подвижный стол (лифт); 11 – спектрометр AvaSpec-3648.

Линии меди в спектре оптической эмиссии плазмы не обнаруживаются, поскольку медное сопло не нагревается и не распыляется плазмой, что позволяет считать СВЧ-разряд безэлектродным. Таким образом, активированная вода не содержит ионов меди, и свойственное им участие в образовании радикальных частиц [25] в данном случае можно исключить. Яркое светящееся ядро струи имеет диаметр 0.2–0.3 см и длину не превышающую четверти длины волны микроволнового излучения в свободном пространстве: λ/4 ≈ 3 см; температура электронов в ядре горячей плазмы ~1.5 эВ, температура газа ~4000 К [26]. Плазма состоит из ионов аргона и возбужденных атомов аргона и азота, падающих на поверхность воды с большой направленной скоростью. Газодинамическое давление плазменной струи в проводнике 5 (рис. 1) на ее коротком расстоянии от поверхности воды создает яму глубиной и диаметром, равными 1.5 см. Ультрафиолетовое излучение, которое создает ореол фотоионизации и возбуждения в газах, окружающих плазменную струю: азоте, воздухе и водяном паре, также является фактором активации воды. Обработку дистиллированной воды объемом 100 мл проводят в чашке 9 из термостойкого стекла, помещенную на настольный подъемник 10, который после поджига плазмы служит для приведения поверхности воды в контакт с плазменной струей и ее погружения в воду. Радиационные, акустические, оптические и плазмохимические процессы в воде происходят в полости вокруг плазменной струи под действием неравновесной плазмы. Озон, образующийся в водном растворе пероксида, нестабилен и распадается с константой скорости k = (0.023 ± 0.002) л/моль · с [27], что позволяет не учитывать его концентрацию в успокоившемся растворе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Концентрацию пероксида в комплексном растворе ВАП измеряли спектрально-иодометрическим методом [28]. Концентрацию растворенных оксидов азота определяли из измерений электропроводности раствора в соответствии с установленным коэффициентом пропорциональности между концентрацией [НNO3] = 10−3 М и проводимостью раствора 358 · 10−6 См/см [29]. Поскольку максимально достижимое значение проводимости раствора пероксида в воде с концентрацией [Н2О2] = = 14.7 М (его весовое отношение к воде составляет 1 : 1) не превышает 6 · 10−6 См/см [30], правомерно не учитывать вклад H2O2 в проводимость раствора, что позволяет точно определять концентрацию НNO3 – продукта превращения NOх.
Тест-объектами были семена следующих растений: огурца сорта “Конкурент” и редиса сорта “Жара” (семена редиса с пониженной всхожестью). Дистиллированную воду с pH = 6.7 использовали для активации плазмы микроволнового разряда в количестве 100 мл в ячейке из термостойкого стекла диаметром 7.5 см и высотой 8 см. Плазменная струя микроволнового разряда была частично погружена в воду при расстоянии между поверхностью воды и концом сопла 1.5 см. Плазменная обработка воды продолжалась 15 мин. Из-за активного испарения воды из ямки вокруг плазменной струи объем полученного раствора уменьшился до 75 мл. Контрольным образцом служил промышленный пероксид производства ООО “Прохим” (г. Санкт-Петербург, Россия).
Сравнение влияния растворов на всхожесть семян изучали в растворах с равной и фиксированной концентрацией пероксида. Растворы готовили путем многократного разведения исходных растворов в дистиллированной воде. Семена проращивали в стеклянных чашках Петри диаметром 9 см. Семена в каждом эксперименте в количестве 30 шт. выкладывали на фильтровальную бумагу, увлажненную тестируемыми растворами в объеме 3 мл. Затем чашки помещали в термостат с температурой +20 °С. После инкубации в течение 48 ч регистрировали количество проросших семян.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В зависимости от времени обработки плазмой концентрация образующегося Н2О2 изменяется в диапазоне от 1 · 10−6 до 4 · 10−3 М. Общая концентрация образующихся оксидов азота [NOx], определенная по проводимости [НNO3] раствора при 20 °C, имеет предельное значение, равное 3.1 · 10−2 М. Начальную концентрацию растворов пероксида задавали посредством разбавления непосредственно перед опытом. Использовали следующие рабочие концентрации пероксида: 4 · 10−3, 2 · 10−4, 4 · 10−4, 4 · 10−5, 4 · 10−6 М. Концентрация NOx в этой серии уменьшалась от указанного выше предельного значения в соответствии со степенью разбавления. После инкубации в течение 48 ч в темноте количество проросших семян в каждой группе было разным (проросшими считали семена с длиной корня не менее 1.5 мм). Контрольные эксперименты проводили в дистиллированной воде, в которой всхожесть семян огурца достигала 70%, а семян редиса – 30%.
Результаты экспериментов с семенами огурца и редиса представлены на рис. 2 и 3 соответственно. Графики, приведенные на рис. 2 и 3, показывают всхожесть (G, %), т.е. процент проросших семян относительно их общего изначального количества в зависимости от абсолютных значений концентрации пероксида в водных растворах. Оптимум всхожести семян огурца (~90%) достигается при концентрации перекиси 4 · 10−5 М в растворе ВАП, тогда как эффективность прорастания в промышленном растворе пероксида при той же концентрации значительно меньше. Для семян редиса с пониженной всхожестью эффективность прорастания в воде, активированной плазмой, была более значительной. Прорастание семян редиса в растворе ВАП с концентрацией пероксида 4 · 10−5 М существенно возросло с 30% до 85%, тогда как в растворе промышленного пероксида при его максимальной концентрации 4 · 10−3 М всхожесть семян редиса не достигла 60%.
Рис. 2.
Прорастание семян огурца: 1 – вода, активированная в плазме СВЧ-разряда; 2 – раствор промышленного Н2О2. Контроль: прорастание в дистиллированной воде – 70%.
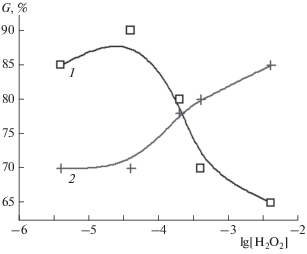
Рис. 3.
Прорастание семян редиса пониженной всхожести: 1 – вода, активированная плазмой СВЧ-разряда; 2 – раствор промышленного Н2О2. Контроль: прорастание в дистиллированной воде – 30%.

Прорастание семян обеих культур в растворе промышленного пероксида характеризуется медленным монотонным ростом с увеличением его концентрации на порядки значений. Несколько различный характер кривых, возможно, отражает специфическое действие стабилизаторов, содержащихся в коммерческом Н2О2. В то же время прорастание семян в растворе ВАП характеризуется быстрым ростом до концентрации пероксида, равной 4 · 10−5 М, выше которой наблюдается снижение всхожести. Обращает на себя внимание тот факт, что максимальный стимулирующий эффект соответствует приблизительно одной и той же концентрации пероксида водорода в случаях обеих растительных тест-культур, что может объясняться общностью физиологических механизмов действия Н2О2 в фотосинтезе или связанных с ним процессов. Для опыта с водой, содержащей исходно 4 · 10−5 М Н2О2 и 3 · 10−4 М NOx, после контакта с прорастающими семенами огурца в течение 48 ч конечная концентрация действующих веществ составила 5 · 10−6 М для Н2О2 и 7 · 10−5 М для NOx.
Из результатов экспериментов видно, что влияние растворов промышленного пероксида на всхожесть семян значительно ниже, чем влияние растворов ВАП. Скорость прорастания семян огурца и редиса в промышленном растворе пероксида при низких концентрациях последнего не отличается от такового в дистиллированной воде, а затем равномерно увеличивается на порядки с ростом концентрации пероксида. В отличие от этого, всхожесть семян в растворе ВАП резко возрастает при концентрации пероксида 3 · 10−6 М и достигает максимума при 4 · 10−5 М. С дальнейшим увеличением концентрации пероксида в ВАП эффект прорастания снижается до уровня контроля. Наблюдаемое снижение всхожести может быть связано с повышенной концентрацией пероксида или NOx. Последнее обстоятельство потребует поиска условий для получения ВАП со значительно более низким содержанием нитратов. Важно подчеркнуть, что область оптимальных по стимулирующему действию значений концентрации пероксида в интервале от 4 · 10−6 до 4 · 10−5 М совпадает со средними значениями количества пероксида в атмосферных осадках [3].
Влияние промышленного раствора перекиси водорода на всхожесть семян при низких концентрациях, вероятно, ослабляется в присутствии стабилизатора, добавляемого для длительного хранения, что препятствует его действию. Стабилизаторы, с одной стороны, образуя комплексы с пероксидом водорода, предотвращают его нахождение в свободной активной форме и тем самым не дают семенам получать достаточное количество кислорода для их прорастания. С другой стороны, сами по себе стабилизаторы могут представлять собой вещества, действующие угнетающе на развитие и рост растений.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящей работе создана установка для получения водных растворов, проявляющих биологическую активность в отношении прорастания семян значимых сельскохозяйственных растений. Метод основан на активации воды струей термической аргоновой плазмы безэлектродного СВЧ-разряда в воздушной среде при атмосферном давлении. Образующаяся активированная вода содержит пероксид водорода и соединения азота. Показано, что эффективность стимулирующего влияния на прорастание семян растворов после плазменной активации воды существенно выше, чем действие эквимолярных растворов Н2О2, полученных путем разведения коммерческого пероксида. Наряду с практическим аспектом, результаты работы указывают на колоссальную важность учета состава атмосферных осадков и природной воды в функционировании агропромышленных установок открытого типа [31, 32].
Работа выполнена в рамках госзадания Министерства науки и высшего образования Российской Федерации (тема 0082–2018–0006, регистрационный номер № АААА-А18-118020890097-1).
Список литературы
Miller S.L., Urey H.C. // Science. 1959. V. 130. № 3370. P. 245; https://doi.org/10.1126/science.130.3370
Stark M.S., Anastasi C., Harrison J.T.H. // J. Geophys. Res. 1996. V. 101. P. 6963.
Zuo Y., Deng Y. // Geochim. Cosmochim. Acta. 1999. V. 63. № 19. 3451; https://doi.org/10.1016/S0016-7037(99)00274-4
Wojtyla L., Garnczarska M., Zalewski T. et al. // J. Plant Physiol. 2006. V. 163. 1207; https://doi.org/10.1016/j.jplph.2006.06.014
Barba-Espin G., Diaz-Vivancos P., Clemente-Moreno M.J. et al. // Plant Cell Environ. 2010. V. 33. № 6. P. 981; https://doi.org/10.1111/j.1365-3040.2010.02120.x
Naumova I.K., Maksimov A.I., Khlyustova A.V. // Surf. Eng. Appl. Electrochem. 2011. V. 47. № 3. P. 263.
Duval J.R., NeSmith D.S. // Hortscience. 2000. V. 35. № 1. P. 85; https://doi.org/10.21273/HORTSCI.35.1.85
Fridman A., Chirokov A., Gutsol A. // J. Phys. D: Appl. Phys. 2005. V. 38. № 2. P. R1; https://doi.org/10.1088/0022-3727/38/2/R01
Brandenburg R. // Plasma Sources Sci. Technol. 2017. V. 26. № 5. 053001; https://doi.org/10.1088/1361-6595/aa6426
Chang J.-S., Lawless P.A., Yamamoto T. // IEEE Trans. Plasma Sci. 1991. V. 19. № 6. P. 1152.
Chien C.T., Lin T.P. // Seed Sci. Technol. 1994. V. 22. P. 231.
Breusegem F.V., Vranova E., Dat J.F., Inze D. // Plant Sci. 2001. V. 161. P. 405.
Hossain M.A., Bhattacharjee S., Armin S.M. et al. // Front Plant Sci. 2015. V. 6. 420; https://doi.org/10.3389/ fpls.2015.00420
Khan M.N., Mobin M., Mohammad F., Corpas F.J. Nitric Oxide in Plants: Metabolism and Role in Stress Physiology. Switzerland: Springer, 2014.
Jann R.C., Amen R.D. // The Physiology and Biochemistry of Seed Dormancy and Germination / Ed. Khan A.A. Amsterdam: North Holland Publishing, 1977. P. 728.
Ismail S.Z., Khandaker M.M., Mat N., Boyce A.N. // J. Agronomy. 2015. V. 14. № 4. P. 331; https://doi.org/10.3923/ja.2015.331.336
Thirumdas R., Kothakota A., Annapure U. et al. // Trends in Food Science & Technology. 2018. V. 77. P. 21; https://doi.org/10.1016/j.tifs.2018.05.007
Комиссаров Г.Г. // Хим. физика. 2003. Т. 22. № 1. С. 24.
Лобанов А.В., Холуйская С.Н., Комиссаров Г.Г. // Хим. физика. 2004. Т. 23. № 5. С. 44.
Лобанов А.В., Холуйская С.Н., Комиссаров Г.Г. // ДАН. 2004. Т. 399. № 1. С. 71.
Lobanov A.V., Nevrova O.V., Ilatovskii V.A., Sin’ko G.V., Komissarov G.G. // Macroheterocycles. 2011. V. 4. № 2. P. 132.
Сультимова Н.Б., Левин П.П., Лобанов А.В., Музафаров А.М. // Химия высоких энергий. 2013. Т. 47. № 3. С. 186.
Alvarez M.E., Pennell R.I., Meijer P.J. et al. // Cell. 1998. V. 92. P. 773.
Liu Y., Ye N., Liu R., Chen M., Zhang J. // J. Exp. Bot. 2010. V. 61. № 11. P. 2979; https://doi.org/10.1093/jxb/erq125
Лобанов А.В., Голубева Е.Н., Зубанова Е. М., Мельников М.Я. // Химия высоких энергий. 2009. Т. 43. № 5. С. 438.
Sergeichev K.F., Lukina N.A., Arutyunyan N.R. // Plasma Phys. Rep. 2019. V. 45. P. 551; https://doi.org/10.1134/S1063780X19060096
Разумовский С.Д., Гриневич Т.В., Коровина Г.В. // Хим. физика. 2011. Т. 30. № 10. С. 54.
Лобанов А.В., Рубцова Н.А., Веденеева Ю.А., Комиссаров Г.Г. // ДАН. 2008. Т. 421. № 6. С. 773.
Weast R.C. CRC Handbook of Chemistry, and Physics. 70th ed. Florida: CRC Press, Boca Raton, 1989. P. D-221.
Schumb W.C., Satterfield C.N., Wentworth R.L. Hydrogen Peroxide. ACS Monograph. N.Y.: Reinhold Publishing Corp., 1955.
Скурлатов Ю.И., Штамм Е.В., Шишкина Л.Н. и др. // Хим. физика. 2020. Т. 39. № 2. С. 50; https://doi.org/10.31857/S0207401X20020132
Ларин И.К. // Хим. физика. 2020. Т. 39. № 3. С. 85; https://doi.org/10.31857/S0207401X20030085
Ларин И.К. // Хим. физика. 2020. Т. 39. № 4. С. 44; https://doi.org/10.31857/S0207401X20040111
Родионов И.Д., Родионов А.И., Родионова И.П. и др. // Хим. физика. 2019. Т. 38. № 7. С. 30; https://doi.org/10.1134/S0207401X19070136
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


