Химическая физика, 2022, T. 41, № 1, стр. 69-76
Высокотемпературное взаимодействие углеродных волокон с расплавом никеля
А. Е. Сычев 1, *, С. Г. Вадченко 1, А. С. Щукин 1, А. В. Аборкин 2, А. В. Карпов 1, П. А. Лазарев 1, 2, О. Д. Боярченко 1
1 Институт структурной макрокинетики и проблем материаловедения им. А.Г. Мержанова
Российской академии наук
Черноголовка, Россия
2 Владимирский государственный университет им. А.Г. и Н.Г. Столетовых
Владимир, Россия
* E-mail: sytschev@ism.ac.ru
Поступила в редакцию 19.03.2021
После доработки 07.04.2021
Принята к публикации 20.04.2021
- EDN: LCVMHL
- DOI: 10.31857/S0207401X22010150
Аннотация
В работе исследованы особенности высокотемпературного взаимодействия углеродных волокон с расплавом никеля при воздействии короткого электрического импульса и формировании на поверхности никеля многослойного графитового покрытия. Насыщение никелевой капли углеродом достигается в результате диффузии при контакте с углеродными волокнами. Формирование на поверхности никеля многослойного графитового покрытия толщиной около 3 мкм происходит за счет сегрегации атомов углерода, растворенных в расплавленной капле никеля.
ВВЕДЕНИЕ
Благодаря своим превосходным механическим свойствам и высокой коррозионной и износостойкости никелевые сплавы и композиты нашли применение в области инструментальной и аэрокосмической промышленности [1, 2]. Композиты Ni–C привлекают интерес исследователей из-за их разнообразного применения, которое включает защитные прокладки [3], гидрирование [4], хранение водорода [5] и синтез углеродных наноразмерных трубок (УНТ) [6]. Большое внимание уделено взаимодействию углерода с различными металлами с образованием структурированных наноразмерных покрытий и композитов [7–9].
Взаимодействие в системе углерод–металл играет важную роль в материаловедении, особенно когда речь идет о металлах переходной группы. В процессе их взаимодействия происходит образование твердых растворов или соединений, в которых углерод занимает промежуточные участки. Существует также способность переходных металлов (Ti, V, Cr, Zr, Nb, Mo, Ta и др.) к образованию карбидов. Остается малоизученным вопрос применения наноразмерного углерода в виде УНТ или волокон, а также графеноподобного углерода на структурообразование и формирование свойств композитов.
Смачивание графита жидкими металлами происходит, как правило, в тех случаях, когда металл достаточно интенсивно химически взаимодействует с углеродом [10]. Сравнительно полный анализ опытных данных проведен Ю.В. Найдичем [11]. Графит сочетает ковалентные связи со слабо выраженной металличностью. Железо, кобальт, никель в жидком состоянии интенсивно взаимодействуют с бором и углеродистыми материалами и хорошо смачивают их. Контактные углы смачивания не превышают 50°. Однако данные по смачиваемости актуальны для равновесных фаз и могут отличаться для случаев быстропротекающих неравновесных процессов. По-видимому, поверхностные слои металлов, насыщенные углеродом, формируют графитоподобные ковалентные связи, вследствие чего взаимодействие этих слоев с поверхностью оказывается слабым.
Хорошо изучен процесс роста графитовых покрытий на поверхности металлов, который состоит не менее чем из двух этапов: растворение (освобождение) атомов углерода в металле при высоких температурах (700–1000 °С) и их кристаллизация на поверхности металла в форме графена [12]. Известна каталитическая активность никелевых подложек в процессах выращивания УНТ [13, 14]. Никель является привлекательной системой в качестве подложки для производства графена, поскольку рассогласование решетки между графеном и Ni(111) невелико (~1%), рост графена происходит преимущественно в геометрии top-fcc, сохраняя ту же ориентацию, что и никелевая подложка [15].
Цель данной работы – исследование особенностей высокотемпературного взаимодействия углеродных волокон с расплавом никеля при воздействии короткого электрического импульса.
МЕТОДИКА ЭКСПЕРИМЕНТА
Порошок Ni наносили в виде небольшой насыпной навески (1–2 г) на углеродные волокна длиной 15 мм (рис. 1), закрепленные между медными электрическими контактами нагревательного элемента (рис. 2). Нагревательный элемент размещали в реакционной камере вакуумного универсального поста ВУП-5, которую откачивали до 10–4 Па. Через углеродные волокна пропускался регулируемый постоянный электрический ток (до 500 А, 12 В) до плавления порошков, которое определяли визуально через смотровое окно экспериментальной установки. Установка позволяет нагревать образцы до температуры около 3900 °С, что было определено в предыдущих экспериментах по плавлению образца-свидетеля из HfC, температура плавления которого составляет 3927 °C [16]. После плавления порошковой навески нагревательный элемент выключали; образец оставался в камере до полного остывания. В работе использовали образцы углеродных волокн (Quorum Technologies Ltd., UK) [17] диаметром 10–15 мкм (рис. 1) и порошка никеля (марка ПНК-УТ).
Рис. 1.
Изображение углеродных волокон, полученное с использованием сканирующего электронного микроскопа.

Образцы исследовали на автоэмиссионном сканирующем электронном микроскопе Ultra Plus (Carl Zeiss, Германия) на базе микроскопа Ultra 55 с системой энергодисперсионного микроанализа INCA Energy 350 XT (Oxford Instruments, UK). Методом спектроскопии комбинационного рассеяния (КР) регистрировали спектры в диапазоне 200–3000 см–1 с помощью установки “Нанолаборатория ИНТЕГРА Спектра” (НТ–МДТ, Россия). Химический элементный состав поверхности синтезированного продукта, а также ионное травление и картирование проводили с помощью метода времяпролетной масс-спектрометрии на масс-спектрометре вторичных ионов TOF.SIMS 5-100P (ION-TOF GmbH, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
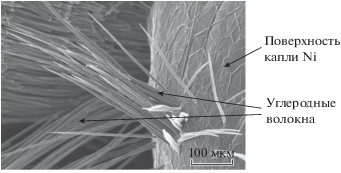
При пропускании электрического тока через нагревательный элемент образцы нагреваются выше температуры плавления никеля; графитовые волокна, контактирующие с расплавом, начинают в нем растворяться. В результате плавления порошковой навески (температура плавления никеля составляет 1452 °С) происходит коагуляция расплавленного порошка с формированием сферических частиц диаметром до 2 мм (рис. 3). Микроструктурное исследование показало, что углеродные волокна частично растворяются в расплаве Ni, на что указывает характерная коррозия (растворение) углеродных нитей (см. рис. 4 и 5).
Рис. 5.
а – Микроструктура взаимодействия углеродных волокон с расплавленным никелем, б – увеличенный фрагмент.

Коэффициент диффузии C в твердофазном Ni при температуре 1400 °C составляет ∼10–9 м2/с [18], т.е. в твердой фазе при температуре, близкой к температуре плавления, время диффузии углерода на глубину всего образца толщиной 600 мкм будет ∼10–20 с. Однако скорость диффузии в порошках может значительно отличаться из-за наличия межфазных границ между отдельными частицами металла. Твердофазная растворимость C в Ni достигает 2.7 ат.% при температуре эвтектики 1319 °С и снижается при увеличении температуры. Интенсивность диффузии значительно возрастает в жидкой фазе (расплаве Ni), поскольку Ni и C неограниченно взаимно растворимы при температурах выше температуры эвтектики и содержании C в Ni, равном 10 ат.% [19, 20]. Растворимость C в расплаве Ni ограничена линией ликвидуса и закономерно возрастает с ростом температуры.
При охлаждении образца, которое происходит преимущественно за счет излучения, градиент температуры направлен по нормали к поверхности капли расплава и точка минимума температуры находится на границе раздела фаз (т.е., на поверхности), что приводит к интенсивной преципитации углеродных пленок из пересыщенного раствора C в Ni в приповерхностном слое капли расплава. Снижение температуры вплоть до эвтектической (1319 °С) приводит к пересыщению и преципитации углеродных структур во всем объеме капли расплава, что ведет к образованию межзеренных углеродных прослоек. Другой возможный вариант формирования углеродных прослоек внутри объема никелевой капли заключается в выделении избыточного С из метастабильного пересыщенного твердого раствора Ni(C) при снижении температуры ниже эвтектической, так как при этом растворимость C в Ni уменьшается [21].
В результате переплавки никелевого порошка на углеродных волокнах сформировалась капля, покрытая слоем углерода (рис. 3). Можно предположить, что имеет место растворимость углерода в расплаве при максимальной температуре нагрева выше температуры плавления никеля. По мере охлаждения расплава после выключения нагревательного элемента вследствие уменьшения растворимости углерод образует графитовые покрытия на поверхности никелевой капли (рис. 3б).
Растворимость углерода С в Ni при температуре 1319 °С составляет 2.7 ат.%, а при температуре 700 °С – 0.4 ат.% [20]. Ni практически не растворяется в графите. Микроструктурный анализ показал также присутствие углеродных волокон в образовавшихся сферических частицах Ni (рис. 3а).
На рис. 3а и 4 показан слой графита, образовавшийся на поверхности никеля после кристаллизации металла из расплава. Пленка имеет специфическую морфологию гладких участков (фасеток), отделенных друг от друга внеплоскостными гранями. Границы фасеток имеют полигональную форму, что является характерной чертой граненого роста графита [22].
На рис. 5а представлено изображение микроструктуры капли и результаты ЭДА в области взаимодействия углеродных волокон с расплавленным никелем. На рис. 5б показан фрагмент в области взаимодействия углеродного волокна с расплавленным никелем. Интересно отметить, что изменилась форма и размеры графитового волокна в области контакта с никелевой каплей. Углеродное волокно довольно интенсивно меняет первоначальную форму при нагреве в контакте с никелем – происходит растворение углерода без образования химических соединений. Ni очень активен в процессах растворения углерода, а его карбид (Ni3C) является метастабильным соединением и образуется лишь при высоких скоростях охлаждения и высоком давлении [17]. Поэтому, отсутствие диффузионных затруднений на межфазной границе при взаимодействии никеля с углеродом не препятствует массопереносу углерода в расплав. Согласно данным из [23], лимитирующей стадией массопереноса является только атомарное растворение и переход в расплав микрогруппировок углерода.
Анализ микроструктуры поперечного сечения никелевой капли с сформированным на ее поверхности многослойным графитовым покрытием (рис. 6а) позволил оценить его толщину – около 3 мкм. На рис. 6б представлена фотография микроструктуры многослойного графитового покрытия, состоящего из наноразмерных слоев толщиной менее 30 нм. Для идентификации аллотропной формы формируемого углеродного покрытия проведено изучение структуры поверхности образца с использованием спектроскопии комбинационного рассеяния (КР). По измеренным рамановским спектрам выявлены четыре характерных типа углеродных структур c различным числом графитовых слоев, сформированных в ходе кристаллизации расплава (рис. 7).
Рис. 6.
Микроструктура графитового покрытия (а) на никелевой капле со стороны поперечного сечения, многослойная структура покрытия (б).

Рис. 7.
Результаты спектроскопии комбинационного рассеяния графитового покрытия (а); увеличенные фрагменты в области рамановского сдвига для D-, G-, D'- (б) и 2D-полос (в).

Полнопрофильные спектры комбинационного рассеяния, а также увеличенные фрагменты полос D, G и 2D приведены на рис. 7. Для первого типа структуры отмечено наличие D-, G-, D'- и 2D-полос, свойственных графиту с высокой степенью трехмерной упорядоченности. При этом ширина линии на половине максимума пиков (FWHM) велика по сравнению с другими фиксируемыми типами структур и составляет 34.4 и 66.5 см–1 для G- и 2D-пиков соответственно (рис. 7б, в). Соотношение интенсивностей пиков, I2D/IG, составляет ~0.5.
Особенностями второго типа структуры являются значительное снижение интенсивности D-линии до уровня, близкого к нулевому и уменьшение величины FWHM основных G- и 2D-пиков в ~1.7 раз – до 19.4 и 37.3 см–1. Также следует отметить бифуркацию 2D-линии и формирование низкочастотной компоненты, что свойственно графену, состоящему из нескольких слоев. Соотношение I2D/IG составляет ∼0.52.
Для третьего типа, помимо отсутствия D-пика, характерно увеличение интенсивности 2D-линии. При этом соотношение I2D/IG составляет ∼1.35, что свидетельствует о дальнейшем снижении числа слоев по сравнению с третьим типом.
И наконец, четвертый тип углеродной структуры имеет D- и G-пики малой интенсивности и узкий (FWHM = 26.1 см–1) высокоинтенсивный 2D-пик. Соотношение I2D/IG составляет ∼6.7, что позволяет идентифицировать структуру этого типа как однослойный графен.
С целью изучения внутреннего строения графитового покрытия на поверхности никеля с помощью времяпролетного масс-спектрометра TOF.SIMS 5 было проведено растровое ионное травление (рассеяние); размер растра составлял 150 × 150 мкм2. Послойное травление покрытия проводилось ионами кислорода ${\text{О}}_{2}^{ + }$ с энергией 2 кэВ под углом 45°. На рис. 8а представлена схема проведения ионного рассеяния. Рассеяние покрытия проводилось в течение 40 мин с образованием кратера травления до появления на масс-спектре пиков ионов Ni–. Размер области, анализируемой пучком ионов Bi+ на границе растра травления “графитовое покрытие – капля никеля”, имел площадь 100 × 100 мкм2. Ионное картирование, представленное на рис. 8б, наглядно демонстрирует границу области травления “графитовое покрытие–никелевая капля”. В области шириной около 20 мкм (рис. 8в) происходит падение концентрационных профилей интенсивности пиков ионов Ni– и рост интенсивности пиков ионов C–. В графитовом покрытии полностью отсутствует никель Ni.
Рис. 8.
а – Схема проведения ионного рассеяния, б – ионное картирование, в – концентрационные профили Ni и C в области травления.

Детальный анализ микроструктуры кратера распыления проводили с помощью метода электронной микроскопии. На рис. 9 представлена фотография микроструктуры и данные энергодисперсионного анализа (ЭДА) границы области травления “графитовое покрытие–никелевая капля” (рис. 8а). Поверхность травления имеет террасную (ступенчатую) структуру. Данные ЭДА подтверждают результаты, полученные методом времяпролетной масс-спектрометрии об элементном составе графитового покрытия. В графитовом покрытии никель не обнаружен. В тоже время в никелевой капле обнаружен растворенный углерод.
Рис. 9.
Микроструктура и данные энергодисперсионного анализа (концентрационные профили Ni и C) поперечного сечения области “графитовое покрытие–никелевая капля”.

Интегральный энергодисперсионный микроанализ поперечного шлифа капли Ni показал наличие C (до 20 ат.%), который присутствует в виде межзеренных прослоек и в качестве твердого раствора в объеме Ni. Концентрация C в расплаве Ni может достигать значения в 20 ат.% при температуре около или даже выше 3000 °C [24], что вполне достижимо для используемой экспериментальной установки.
ЗАКЛЮЧЕНИЕ
Пропускание короткого электрического импульса через углеродные волокна создает условия для плавления и кристаллизации, расположенных на их поверхности капель никеля. Насыщение никелевых капель углеродом достигается в результате диффузии при контакте с углеродными волокнами. Формирование на поверхности никеля многослойного графитового покрытия толщиной около 3 мкм происходит за счет сегрегации атомов углерода, растворенных в расплавленной капле никеля. В объеме капли Ni также присутствует до 20 ат.% С, который расположен в межзеренных прослойках и в виде включений метастабильного пересыщенного твердого раствора Ni(C).
Список литературы
Zhong Z.Y., Xiong Z.T., Sun L.F., Luo J.Z., Chen P., Wu X. et al. // J. Phys. Chem. B. 2002. V. 106. № 37. P. 9507.
Li J.L., Xiong D.S. // Wear. 2008. V. 265. № 3–4. P. 533.
Afanasov I.M., Shornikova O.N., Avdeev V.V., Lebedev O.I. et al. // Carbon. 2009. V. 47. № 2. P. 513.
Mani C.M., Braun M., Molinari V., Antonietti M., Fechler N. // ChemCatChem. 2017. V. 9. № 17. P. 3388.
Mehrabi M., Parvin P., Reyhani A., Mortazavi S.Z. // Mater. Res. Express. 2017. V. 4. № 9. P. 095030.
Akbarzadeh R., Dehghani H. J. // Solid State Electrochem. 2018. V. 22. № 2. P. 395.
Гришин М.В., Гатин А.К., Сарвадий С.Ю., Слуцкий В.Г., Шуб Б.Р. и др. // Хим. физика. 2020. Т. 39. № 7. С. 63; https://doi.org/10.31857/S0207401X20070067
Гришин М.В., Гатин А.К., Дохликова Н.В., Колченко Н.Н., Сарвадий С.Ю., Шуб Б.Р. // Хим. физика. 2019. Т. 38. № 1. С. 3. https://doi.org/10.1134/S0207401X18120063
Галашев А.Е., Рахманова О.Р., Елшина Л.А. // Хим. физика. 2018. Т. 37. № 6. С. 18; https://doi.org/10.7868/S0207401X18060031
Андреева А.В. Основы физикохимии и технологии композитов. Учебное пособие для вузов. М.: ИПРЖР, 2001.
Naidich Yu.V. // Prog. Surf. Memb. Sci. 1981. V. 14. P. 353.
Baraton L., He Z.B., Lee C.S., Cojocaru C.S., Chatelet M. et al. // EPL (Europhysics Letters). 2011. V. 96. № 4. P. 46003; https://doi.org/10.1209/0295-5075/96/46003
Rodriguez N.M. // J. Mater. Res. 1993. V. 8. № 12. P. 3233.
Булярский С.В., Зенова Е.В., Лакалин А.В., Молоденский М.С., Павлов А.А. и др. // ЖТФ. 2018. Т. 88 № 12. С. 1873.
Bianchini F., Patera L.L., Peressi M., Africh C., Comelli G. // J. Phys. Chem. Lett. 2014. V. 5. № 3. P. 467; https://doi.org/10.1021/jz402609d
Buinevich V.S., Nepapushev A.A., Moskovskikh D.O., Trusov G.V., Kuskov K.V. et al. // Ceram. Intern. 2020. V. 46. P. 16068; https://doi.org/10.1016/j.ceramint.2020.03.158
https://www.quorumtech.com/wp-content/uploads/ 2020/08/Carbon-consumables.pdf
Le Claire A.D. Landolt-Börnstein. Diffusion in Solid Metals and Alloys. Figures for 8. Group III Condensed Matter. V. 26 / Ed. Mehrer H. Berlin Heidelberg: Springer-Verlag, 1990; https://doi.org/10.1007/10390457_91
Landolt-Börnstein. Group IV Physical Chemistry. V. 19C1 (Ternary Steel Systems: Phase Diagrams and Phase Transition Data). Part 1 / Eds. Franke P., Seifert H.J // Berlin Heidelberg: Springer-Verlag, 2012; https://doi.org/10.1007/978-3-540-88142-1_69
Лякишев Н.П. Диаграммы состояния двойных металлических систем. В 3-х т. М.: Машиностроение, 1996–2000.
Predel B. (Carbon-Nickel) // Landolt-Börnstein. Group IV Physical Chemistry. V. 12B (B-Ba…Cu-Zr). Berlin Heidelberg: Springer-Verlag, 2012; https://doi.org/10.1007/978-3-540-44756-6_100
Amini S., Kalaantari H., Garay J., Balandin A., Abbaschian R. // J. Mater. Sci. 2011. V. 46. P. 6255; https://doi.org/10.1007/s10853-011-5432-9
Бубненков И.А., Кошелев Ю.И., Степарева Н.Н. // XI Междунар. конф. “Углерод: фундаментальные проблемы науки, материаловедение, технологи’’. Сб. тез. докл. Москва (Троицк): Технологический ин-т сверхтвердых и новых углеродных материалов, 2018. С. 80.
Predel B. (Carbon-Nickel) // Landolt-Bornstein. Group IV Physical Chemistry. V. 5B. Berlin Heidelberg: Springer-Verlag, 1992; https://doi.org/10.1007/10040476_647
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика