Химическая физика, 2022, T. 41, № 1, стр. 17-24
Изучение механизма и кинетики восстановления гематита
Б. П. Юрьев 1, *, В. А. Дудко 1
1 Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
* E-mail: yurev-b@mail.ru
Поступила в редакцию 26.01.2021
После доработки 27.05.2021
Принята к публикации 21.06.2021
- EDN: DKQCEX
- DOI: 10.31857/S0207401X22010174
Аннотация
Установлено влияние процесса восстановления гематита до магнетита на прочностные характеристики железорудных материалов, используемых в доменных и шахтных печах металлизации. Проведено изучение механизма и кинетики протекания процесса восстановления гематита на образцах различной крупности с учетом влияния на него температуры и состава газовой фазы. Рассмотрено электрохимическое поведение образцов из различных гематитов, позволяющее судить о степени дефектности структуры исходного оксида железа. На дилатометрической установке проведено изучение изменения размеров образцов из гематитов в ходе восстановительно-тепловой обработки. Выполнены минералогический и рентгеноструктурный анализы, результаты которых использованы при проведении кинетического анализа, позволившего объяснить основные закономерности и механизмы протекания процессов при восстановлении гематита до магнетита. Для описания таких процессов использовались уравнения для сжимающейся сферы. Проведен анализ величин удельных скоростей перехода гематита в магнетит при разном содержании оксида углерода в атмосфере. Полученные результаты представляют определенный интерес и позволяют разрабатывать технологии, которые обеспечивают сохранение исходного магнетита в железорудных концентратах в процессе его термической обработки, либо переносить начало восстановления гематита в доменных и шахтных печах металлизации в область более высоких температур.
ВВЕДЕНИЕ
Реакция восстановления гематита как оксидом углерода, так и водородом, особенно на начальной стадии процесса получения железа, оказывает большое влияние на работу доменных и шахтных печей, в которых используются железорудные окатыши. Это связано с тем, что протекание реакции восстановления гематита до магнетита сопровождается значительным увеличением объема железорудных окатышей, что приводит к их разбуханию и разрушению [1–10]. В результате образуется большое количество мелких фракций, уменьшается газопроницаемость слоя шихты, нарушается газодинамический режим работы тепловых агрегатов. Их производительность уменьшается, а удельный расход топлива возрастает.
Следовательно, для решения отмеченной проблемы необходимо перенести начало восстановления гематита в область более высоких температур. Этого можно достичь путем формирования шлаковых связок определенного состава и структуры [11]. При получении окатышей на конвейерной обжиговой машине можно сохранить исходный магнетит из концентрата или провести частичную диссоциацию полученного при окислении гематита до вторичного магнетита [12]. Установлено, что окатыши с гематитомагнетитовой структурой имеют высокую прочность в исходном состоянии и незначительно разрушаются в условиях доменной печи [11]. Полученные в работе результаты позволяют сделать предположение о том, что снизить разрушение окатышей при их металлизации в шахтных печах можно и путем выбора оптимального соотношения гематита и магнетита в их структуре. Однако исследований, посвященных этой проблеме, не проводилось.
Так как до настоящего времени не найдено способов получения легковосстановимых железооксидных окускованных материалов, слабо разрушающихся при восстановительно-тепловой обработке, то цель данной работы состояла в изучении кинетики и механизма протекания процесса восстановления гематита с учетом влияния на него температуры и состава газовой фазы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для исследований использовали гематит, который получали путем окисления порошка ольховского магнетита. Природные монокристаллы магнетита дробили и после истирания рассеивали на фракции 0–0.074, 0.074–0.1 и 0.1–0.2 мм. Каждую фракцию подвергали мокрой магнитной сепарации для возможно более полного отделения пустой породы. Содержание железа в монокристаллическом магнетите после его измельчения и магнитной сепарации составляло 71.29–71.79%, что близко к теоретическому значению в 72.30%, а количество примесей не превышало 1.0%.
Магнетит после сепарации подвергали окислительному обжигу в потоке воздуха в течение 2 ч при температуре 1000 °C. После обжига каждый из порошков истирали до исходной крупности. Характеристики состава и структуры полученных гематитовых фракций приведены в табл. 1. Практическое отсутствие монооксида железа свидетельствует о полном превращении магнетита в гематит. Рентгеноструктурный анализ показал, что периоды кристаллической решетки незначительно отличаются от стандартных (а = 5.029 · 10–10 м, с = 13.73 · 10–10 м). Просмотр гематитовых зерен под микроскопом показал их плотное строение. Отсутствие микропористости подтверждается также сравнительно невысокими значениями удельной поверхности Sуд (табл. 1), определенными методом тепловой десорбции аргона. Четкая корреляция среднего диаметра частиц с величиной Sуд также указывает, что внутренняя пористость отсутствует [13].
Таблица 1.
Характеристика исследованных образцов гематита
| Номер образца гематита | Параметры решетки | Содержание, % | Крупность, мм | Sуд · 10–1, м2/кг | ||||
|---|---|---|---|---|---|---|---|---|
| a · 1010, м | с · 1010, м | с/2а | Feобщ | FeO | SiO2 | |||
| 1 | 5.025 | 13.79 | 1.372 | 68.83 | 0.10 | 0.089 | 0–0.074 | 52 |
| 68.70 | 0.21 | 0.450 | 0.074–0.1 | 15 | ||||
| 68.46 | 0.26 | 0.992 | 0.1–0.2 | 13 | ||||
| 2 | 4.957 | 13.75 | 1.386 | 65.70 | 0.43 | 3.000 | 0–0.074 | 305 |
| 0.074–0.1 | 292 | |||||||
| 0.1–0.2 | 290 | |||||||
| 3 | 4.968 | 13.81 | 1.390 | 69.70 | <0.5 | – | 0.074–0.1 | 329 |
| 4 | 4.956 | 13.79 | 1.391 | 70.10 | <0.5 | – | 0.074–0.1 | 1162 |
Для сравнения исследовали ольховский окисленный магнетит (образец № 1), а также гематит (образец № 2), полученный окислительным обжигом при 650 °C пирита (FeS) и пирротина (FeS2), выделенных из остатков после мокрой магнитной сепарации Соколовско-Сарбайского горно-обогатительного комбината. Следующими разновидностями гематита являлись порошки, полученные при термической диссоциации синтетических сульфатов (при 500 °C) и нитратов (при 132 °C) железа (образцы №№ 3, 4). Крупность исходных веществ Fe2(SO4)3 и Fe(NO3)3 находилась в пределах 0.074–0.1 мм, а их характеристики, как и образцов № 1 и № 2, приведены в табл. 1.
Различные методы синтеза гематитов не только изменяют профиль поверхности зерен, но и искажают кристаллическую решетку и микронапряжения второго рода. Это, в свою очередь, изменяет потенциал Гиббса гематитов [14] и отражается на их реакционной способности. Одним из критериев дефектности структуры оксидов железа может служить величина тока на пастовом электроде, погруженном в водно-кислотный раствор [15]. Электрохимическое поведение различных гематитов изучено с помощью угольного пастового электрода (УПЭ). Информацию об электрохимических характеристиках образцов, диспергированных в объеме угольной пасты, получали из анализа кривых зависимости I(φ), снятых в потенциодинамическим режиме поляризации УПЭ.
Результаты исследований показали, что гематиты, полученные окислением ольховского магнетита, разложением сульфатов и нитратов железа, имеют схожую форму I(φ)-кривых, аналогичную поляризационным кривым природного гематита. Поляризационные кривые кека отличаются катодными (φm, 1 = –0.2, φm, 2 = –0.6 В) и анодными (φm = –0.1 В) пиками.
Наличие характерных сигналов на I(φ)-кривых кека (образец № 2) связано со значительным искажением кристаллической решетки α-Fe2O3. Дополнительный обжиг образца при температуре выше 800 °C приводит к стабилизации кристаллической решетки α-Fe2O3 (табл. 2) и, как следствие, к исчезновению характерных пиков на соответствующих I(φ)-кривых.
Таблица 2.
Изменение кристаллической решетки кека (образец № 2) в ходе обжига при температуре выше 800 °С
| Параметры решетки | Значение параметров для образцов | ||
|---|---|---|---|
| исходного кека | кека после обжига при 1000 °С | гематита стандартного (по справочникам) | |
| a · 1010, м | 4.957 | 5.003 | 5.029 |
| с · 1010, м | 13.975 | 13.640 | 13.730 |
| с/2а | 1.386 | 1.360 | 1.360 |
Согласно данным [15], в интервале потенциалов 0.4–0.8 В величина тока определяется реакцией восстановления Fe3+ → Fe2+ с переходом в раствор ионов Fe2+. Способность гематита к электрохимическому восстановлению возрастает в следующей последовательности: ольховский окисленный магнетит (образец № 1), гематит из нитратов (образец № 4), кек (образец № 2), гематит из сульфатов (образец № 3).
При катодных потенциалах, более отрицательных, чем –0.9 В, наблюдается электрохимическое восстановление гематита до металла. По величине пика анодного растворения образовавшегося металлического железа (Fмет) можно судить о способности гематитовых образцов к электрохимическому восстановлению. Значения максимального анодного тока окисления Feмет приведены в табл. 3. По величине анодного тока растворения металлического железа можно судить о степени дефектности структуры исходного оксида железа Fe2O3.
Таким образом, полученные образцы гематитов различаются между собой как по величине удельной поверхности (при одной крупности), так и по концентрации дефектов. Поэтому есть все основания предполагать их различную восстановимость не только в условиях электрохимической ячейки, но и при восстановлении газом.
Исследование кинетики восстановления гематитов проводили с использованием дериватографа ОД-102, допускающего нагрев до 1100 °C. Во всех опытах поддерживалась скорость нагрева, равная 10 °C/мин. Образцами для исследования служили порошки гематитов. В качестве газа-восстановителя использовали смесь CO–CO2 с разным содержанием CO.
В качестве генератора оксида углерода служил металлургический кокс крупностью 1–3 мм. Его нагревали в трубчатой электропечи до определенной температуры, и над поверхностью пропускали диоксид углерода. В зависимости от температуры в газогенераторе изменялось отношение CO/CO2 в соответствии с равновесием реакции Будуара:
Контроль состава газа проводили посредством отбора газа непосредственно из печной камеры на уровне верхнего среза тигля с порошком гематита.
Степень (α) и скорость (dα/dτ) восстановления оценивали по изменениям массы и скорости изменения массы пробы по формулам
(2)
${{\alpha }} = {{\Delta G} \mathord{\left/ {\vphantom {{\Delta G} {G_{{{{{\text{O}}}_{2}}}}^{n}}}} \right. \kern-0em} {G_{{{{{\text{O}}}_{2}}}}^{n}}},$(3)
${{d\alpha } \mathord{\left/ {\vphantom {{d\alpha } {d\tau }}} \right. \kern-0em} {d\tau }} = {{d\Delta G} \mathord{\left/ {\vphantom {{d\Delta G} {d{{\tau }}G_{{{{{\text{O}}}_{2}}}}^{n}}}} \right. \kern-0em} {d{{\tau }}G_{{{{{\text{O}}}_{2}}}}^{n}}},$Расчет содержания кислорода в пробе проводили по данным химического анализа:
(5)
${{\left[ {{{{\text{O}}}_{2}}} \right]}_{n}} = 0.43\left( {{{{\left[ {{\text{Fe}}} \right]}}_{{{\text{общ}}}}} - 0.26\left[ {{\text{FeO}}} \right]} \right),$Изменение размера образцов в ходе восстановительно-тепловой обработки измеряли либо на дилатометрической приставке к дериватографу, либо на высокотемпературном нагревательном микроскопе МНО-2. В дилатометрической приставке одновременно записывалась и скорость изменения размера. В обоих случаях для испытаний приготовлялись брикеты. Для дериватографа они были цилиндрические диаметром 10 и высотой 15 мм, а для микроскопа – кубические с ребром, равным 3 мм. В цилиндрических брикетах с торца высверливалось отверстие диаметром 4 и глубиной 5 мм для термопары. При испытаниях на микроскопе термопара устанавливалась рядом с образцом.
Погрешность определения относительного изменения размера образца на дериватографе (l0 = = 15 мм) составляла ±0.5%. Воспроизводимость внутри партии однородных образцов составляла 90–92%. Погрешность измерений на микроскопе была выше и достигала ±4%.
Восстанавливали порошки гематита трех крупностей (0.0–0.074, 0.074–0.1 и 0.1–0.2 мм) в газовых средах, содержащих 10, 20, 30, 50 и 70% СО в смеси с СО2. Полученные данные показали, что для всех исследуемых проб наблюдается плавное нарастание степени и скорости превращения, начиная с температуры 500 °С. При достижении степени восстановления α = 11% на кривой зависимости α(Т) отмечается площадка, соответствующая полной остановке процесса (dα/dτ = 0). Степень восстановления, равная 11%, точно соответствует полному превращению гематита в магнетит. При содержании оксида углерода, равном 10 и 20%, процесс в исследуемом интервале температур (при температуре меньше 1100 °С) дальше не идет. При содержаниях СО, равных 30, 50 и 70%, для всех исследуемых порошков после площадки отмечается новый рост степени восстановления, свидетельствующий о появлении вюстита. Минералогический и рентгеноструктурный анализы подтверждают, что в пробках нагретых до 600–700 °С, имеется магнетит.
Установлено, что особенностью первого пика на кривой скорости изменения массы образца, соответствующего переходу гематита в магнетит, является независимость температуры достижения максимальной скорости от крупности и содержания СО в газе (табл. 4). Несколько бóльшие значения температур наблюдаются только для низких значений содержаний СО.
Таблица 4.
Зависимость температуры первого пика кривой ДТГ при восстановлении образца гематита № 1 до магнетита от содержания СО и крупности образцов
| СО, % | Температура первого пика, °С | ||
|---|---|---|---|
| 0–0.074* | 0.074–0.1* | 0.1–0.2* | |
| 10 | 670 | 680 | 660 |
| 20 | 600 | 630 | 660 |
| 30 | 580 | 630 | 660 |
| 50 | 580 | 620 | 570 |
| 70 | 575 | 550 | 550 |
Таблица 5.
Зависимость температуры (tm) и степени восстановления (αm) при достижении максимальной скорости разбухания гематита (образец № 1) крупностью 0–0.074 мм от содержания СО
| СО, % | tm, °С | αm, % |
|---|---|---|
| 10 | 650 | 1.8 |
| 20 | 560 | 3.3 |
| 30 | 520 | 2.0 |
| 50 | 500 | 2.0 |
| 70 | 500 | 2.0 |
Начало восстановления гематита в магнетит сопряжено с интенсивным разбуханием зерен. Связь температуры максимума скорости разбухания с достигаемой при этом степенью восстановления показана в табл. 5. Из этой таблицы видно, что независимо от содержания СО разбухание достигает максимальной скорости при степени восстановления ∼2%, т.е. когда магнетита практически нет. При температурах 600–700 °С, когда восстановление гематита до магнетита заканчивается (α ≈ 11%), разбухание максимально: ${{\Delta l} \mathord{\left/ {\vphantom {{\Delta l} {{{l}_{0}}}}} \right. \kern-0em} {{{l}_{0}}}} \approx 6{\kern 1pt} - {\kern 1pt} 8\% .$ Дальнейшее повышение температуры приводит к спеканию образца, о чем свидетельствует уменьшение его размеров.
Отличительной особенностью образцов № 1 является практическое отсутствие связи между максимальной величиной разбухания и содержанием СО в атмосфере. В то же время количество магнетита в пробах, восстанавливаемых при содержании СО 10%, в момент достижения максимального разбухания меньше, чем при содержании СО 30–70%.
Для проведения кинетического анализа, позволяющего объяснить описанные закономерности, необходимы сведения о минералогических особенностях процесса замещения гематита магнетитом. Для минералогического анализа восстановления гематита из ольховского магнетита порошки нагревали в дериватографе до определенных температур при содержании в газе СО 10 и 30%, а затем охлаждали в той же атмосфере. Часть материала поступала на рентгеновский анализ, а часть – на микроскопический. Результаты качественного просмотра и расчетов параметров кристаллической решетки гематита и вновь образующегося магнетита приведены в табл. 6. Видно, что по мере развития процесса параметр a гематита уменьшается, а отношение с/2а достигает 1.415. Столь высокие величины характерны для дефектных решеток гематитов, полученных низкотемпературным методом синтеза (см. табл. 1). О нарушениях в решетке гематита косвенно можно судить и по интенсивному разбуханию в самом начале процесса перехода гематита в магнетит (см. табл. 5).
Таблица 6.
Влияние температуры нагрева образцов гематита № 1 в токе газа, содержащего 10% СО, на параметры кристаллической решетки и структуру зерен
| t, °С | Гематит | Магнетит | Характеристика структуры зерен | ||
|---|---|---|---|---|---|
| a · 1010, м | с · 1010, м | с/2а | a · 1010, м | ||
| 20 | 5.025 | 1.79 | 1.372 | – | плотные однородные зерна гематита |
| 620 | 4.982 | 13.81 | 1.385 | – | на поверхности гематитовых зерен в участках с нарушенной структурой появляется магнетит |
| 700 | 4.956 | 13.78 | 1.390 | 8.412 | мелкие зерна гематита восстановлены полностью |
| 800 | 4.869 | 13.78 | 1.415 | 8.412 | крупные зерна окружены магнетитовой каймой |
Частично восстановленные зерна имеют четко выраженную зональную структуру: с поверхности – магнетит, а внутри – гематит. Обе фазы имеют широко развитую систему микропор, трещиноватости практически нет. Следует заметить, что характер замещения гематита магнетитом при низких (500 и 600 °С) и высоких (700, 800 °С) температурах несколько различается. В первом случае преимущественно восстанавливаются дефектные участки, сопряженные с плоскостями спайности, и отдельности монокристаллов, а во втором – вся поверхность зерна.
Отмеченное протекание процесса по закону сжимающейся сферы может иметь место как при замедленной диффузии газообразных восстановителей через слой магнетита, так и при медленной реакции на границе фаз [16]. В связи с этим для количественного анализа описания степени превращения гематита в магнетит в неизотермическом режиме были проверены соответствующие уравнения.
При математическом описании перехода гематита в магнетит (образец № 1) в неизотермическом режиме использовали уравнения, приведенные в работе [15] для изотермических условий:
(6)
${{[1 - {{\left( {1 - R} \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}]}^{2}} = {{k}_{1}}\tau ,$Уравнение (6) выведено из предположения замедленной диффузии газа-восстановителя через сферический слой продукта. Уравнение (7) получено для медленной химической реакции на сферической границе раздела фаз.
Для использования соотношений (6)–(8) в условиях неизотермического нагрева допустим, что в течение бесконечно малого промежутка времени температура не изменяется. Для описания зависимости степени превращения от времени в этом случае достаточно продифференцировать уравнения (6) и (7) при постоянной температуре. Для неизотермического описания процесса необходимо вновь проинтегрировать полученные выражения, но при этом уже считать температуру линейной функцией времени: $T = 293 + a\tau ,$ где а – скорость нагрева.
Проводя указанные операции по методике, изложенной в работе [17], получим конечные выражения для неизотермического режима:
(6a)
$[1 - {{\left( {1 - R{{)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}} \right]}^{2}}~ \approx \frac{{{{A}_{{0,1}}}R{{T}^{2}}}}{{{{E}_{1}}a}}\exp \left( { - \frac{{{{E}_{1}}}}{{RT}}} \right)\left( {1 - ~\frac{{2RT}}{{{{E}_{1}}}}} \right),$(7a)
$1 - {{(1 - R)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}} \approx \frac{{{{A}_{{0,2}}}R{{T}^{2}}}}{{{{E}_{2}}a}}\exp \left( { - \frac{{{{E}_{2}}}}{{RT}}} \right)\left( {1 - ~\frac{{2RT}}{{{{E}_{2}}}}} \right).$Если учесть, что для пирометаллургических реакций значение E, как правило, много больше RT, то соотношения (6а) и (7а) упростятся. После логарифмирования и некоторых преобразований они примут вид
(6б)
${\text{lg}}\frac{{{{{\left[ {1 - {{{(1 - R)}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}} \right]}}^{2}}}}{{{{T}^{2}}}} = \lg \frac{{{{A}_{{0,1}}}R{{T}^{2}}}}{{{{E}_{1}}a}} - \frac{{{{E}_{1}}}}{{2.3RT}},$(7б)
$~{\text{lg}}\frac{{1 - {{{(1 - R)}}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}}}{{{{T}^{2}}}} = \lg \frac{{{{A}_{{0,2}}}R{{T}^{2}}}}{{{{E}_{2}}a}} - \frac{{{{E}_{2}}}}{{2.3RT}}.$Из соотношений (6б) и (7б) следует, что зависимости в координатах
линейны, если экспериментальные термогравиметрические кривые им подчиняются. Для проверки из дериватограмм по формуле (2) рассчитывали значения α и находили значения функций в левой части уравнений (6б) и (7б). По соответствующим значениям температур для каждого значения α находили величину 1/Т. Затем с помощью ЭВМ описывали полученные точки уравнением прямой
где х принимает значения соответствующих функций в левой части уравнений (6б) и (7б):Зная величины С и B, можно по уравнениям (9) и (10) найти кинетические константы ${{A}_{{0,i}}}$ и ${{E}_{i}}.$ Были рассчитаны коэффициенты корреляции, показывающие степень соответствия экспериментальных данных уравнению (6б), а также определена среднеквадратичная ошибка при непосредственном описании опытной зависимости степени восстановления от температуры уравнением
полученным при решении (6б) относительно (1 – α). Аналогичные результаты имеются для уравнения (7б).
Уравнения сжимающейся сферы типа (6) и (7) хорошо описывают процесс восстановления гематита до магнетита. Средний коэффициент корреляции составляет 0.88, среднеквадратичная ошибка не превышает 3%. Однако из этих данных трудно сделать заключение о механизме и режиме реакции, так как диффузионные и кинетические уравнения – (6) и (7) соответственно дают сходные результаты. Для более определенного суждения о кинетике и механизме реакции необходимо анализировать связь удельных скоростей гетерогенных реакций с параметрами, изменяемыми в эксперименте.
Проведен анализ удельных скоростей реакции перехода гематита (образец № 1) в магнетит. Принимая форму частиц исходного гематита близкой к сферической и допуская, что реакция идет только на границе раздела фаз, нетрудно показать [18–21], что радиус (r) и скорость сжатия невосстановленной части ядра (vч) связаны со степенью и скоростью восстановления выражениями
(11)
$\begin{gathered} r = {{r}_{0}}{{\left( {1 - mR} \right)}^{{{1 \mathord{\left/ {\vphantom {1 3}} \right. \kern-0em} 3}}}}, \\ \frac{{~d{\text{r}}}}{{d{{\tau }}}} = {{v}_{{\text{ч}}}} = \frac{{{{r}_{0}}}}{3}{{\left( {1 - m\alpha } \right)}^{{{{ - 2} \mathord{\left/ {\vphantom {{ - 2} 3}} \right. \kern-0em} 3}}}}m\frac{{d\alpha }}{{d\tau }}, \\ \end{gathered} $(12)
$m = {{C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}}} \mathord{\left/ {\vphantom {{C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}}} {\left( {C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}} - C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{м}}}} \right)}}} \right. \kern-0em} {\left( {C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}} - C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{м}}}} \right)}};$Для системы реальных зерен, форма которых отклоняется от идеальной сферы, удобно использовать среднестатистическое зерно, радиус которого связан с удельными поверхностью и объемом исходного гематита следующим соотношением:
где ρ – удельный объем гематита.С учетом соотношений (12), (13) уравнение (11) примет вид
Для вычисления удельной скорости восстановления, т.е. скорости, приходящейся на единицу реагирующей поверхности, примем, что за бесконечно малый промежуток времени dτ прирост объема восстановленной части составит $dV = {{\Psi \pi }}{{r}_{{\text{я}}}}dr,~$ где ${{r}_{{\text{я}}}}$ – радиус невосстановленной части ядра.
Прирост объема в единицу времени равен
Количество кислорода, отнятое в восстановительном слое в единицу времени, составит
(14)
$~\frac{{dV}}{{d\tau }}\left( {C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}} - C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{м}}}} \right) = 4{{\pi }}{{r}_{{\text{я}}}}\frac{{dr}}{{d\tau }}\left( {C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}} - C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{м}}}} \right).$Удельная скорость химической реакции ${{v}_{{{\text{уд}}}}},$ равная количеству отнятого кислорода в единицу времени с единицы поверхности, равна
Для перехода от объемной концентрации кислорода в гематите к массовой использовали соотношение
(15)
$~C_{{{{{\text{O}}}_{{\text{2}}}}}}^{{\text{г}}} = {{\left( {{{{\text{О}}}^{{\text{г}}}}} \right)}^{{\text{2}}}}{{\rho }^{{ - 1}}}.$С учетом соотношений (14) и (15)
Запишем конечное выражение для удельной скорости ${{v}_{{{\text{уд}}}}}\left( {{\% \mathord{\left/ {\vphantom {\% {{{{\text{м}}}^{2}} \cdot {\text{с}}}}} \right. \kern-0em} {{{{\text{м}}}^{2}} \cdot {\text{с}}}}} \right),$ восстановления гематита до магнетита:
(16)
$~{{v}_{{{\text{уд}}}}} = \frac{{{{{(1 - 9\alpha )}}^{{{{ - 2} \mathord{\left/ {\vphantom {{ - 2} 3}} \right. \kern-0em} 3}}}}}}{{{{S}_{{{\text{уд}}}}}}}30\frac{{d\alpha }}{{d\tau }}~.$Анализ формулы (16) показал, что расчет $~{{v}_{{{\text{уд}}}}}$ можно вести непосредственно по данным дериватограмм, определяя величины α и ${{d\alpha } \mathord{\left/ {\vphantom {{d\alpha } {d\tau }}} \right. \kern-0em} {d\tau }}$ при определенной температуре. Из этого следует, что удельная скорость восстановления не зависит от степени превращения, а определяется только природой реагирующего вещества и условиями протекания реакций (давлением реагентов, температурной и т.п.). Анализ влияния этих параметров необходим для понимания механизма реакции.
В работе рассчитаны значения ${{v}_{{{\text{уд}}}}}$ для всех испытуемых фракций гематита (образец № 1) в интервале содержаний [СО] = 10–70% для двух температур: 550 и 700 °С. Первая соответствует начальной стадии процесса, когда еще не образовалось сплошного магнетитового кольца вокруг гематитовых зерен, а вторая – конечной стадии, когда кольцо есть.
Результаты расчета показаны на рис. 1 в виде зависимостей удельной скорости восстановления гематита от содержания СО в атмосфере. Зависимости для мелкой фракции наименее характерны, так как при больших содержаниях СО начинаются спекание пробы и снижение ${{v}_{{{\text{уд}}}}}$ при [СО] = 70%, что связано с затрудненным доступом восстановителя в слой. Для средней и тем более крупной фракции не наблюдалось спекания в области температур 550 °С во всем изученном диапазоне концентраций оксида углерода в атмосфере, поэтому удельные скорости восстановления отражают ход процесса непосредственно на рудных зернах.
Рис. 1.
Зависимости удельной скорости изменения содержания гематита при его восстановлении до магнетита от содержания в атмосфере СО и крупности материалов – цифры у кривых в мм: а – гематит 1, 550 °С; б – то же, 700 °С.
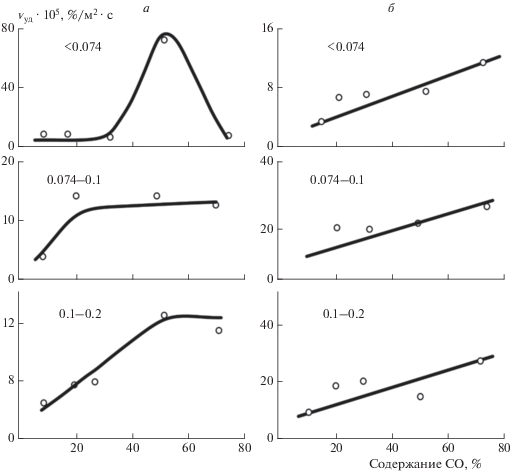
В сравнительно широком диапазоне содержания СО (20–70% для фракции 0.074–0.1 мм и 50–70% для фракции 0.1–0.2 мм) отмечается независимость удельной скорости от концентрации при температуре 550 °С. При более высокой температуре скорость восстановления линейно растет с увеличением концентрации СО для всех проб (первый порядок реакции). Аномальное отсутствие зависимости ${{v}_{{{\text{уд}}}}}$ от концентрации восстановителя невозможно объяснить в рамках обычных представлений о скорости топохимических реакций, и эта задача требует специального анализа.
ЗАКЛЮЧЕНИЕ
Изучение реакции восстановления гематита до магнетита представляет не только теоретический, но и практический интерес при использовании железорудных окатышей в шихте доменных печей. При низких температурах она протекает с увеличением объема окатышей и их разрушением, что приводит к увеличению гидравлического сопротивления слоя шихты и затруднению процесса ведения плавки. Для решения этой проблемы предложен ряд рекомендаций. Одна из них связана с процессом обжига железорудных окатышей на конвейерных машинах в слабоокислительной или нейтральной атмосфере. Это позволит сохранить исходный магнетит в окатышах и исключить нежелательные процессы восстановления гематита в магнетит в доменных печах. Другая связана с получением частично диссоциированных окатышей при их обжиге при высоких температурах 1300–1350 °С, что обеспечит получение стеклообразной связки и восстановление окатышей при температурах выше 700 °С, когда не происходит их интенсивного разбухания и разрушения на стадии перехода гематита в магнетит. Внедрение отмеченных рекомендаций позволит повысить качество и эффективность использования железорудных окатышей при производстве чугуна.
Список литературы
Вяткин Г.П., Михайлов Г.Г., Кузнецов Ю.С. и др. // Черная металлургия. 2012. № 2. С. 53.
Горбачев В.А., Шаврин С.В. // Изв. вузов. Черная металлургия. 1983. № 2. С. 3.
Архипов В.С., Смольников С.И. // Известия вузов. Чер. металлургия. 1989. № 1. С. 10.
Гофман Э.Э., Раут Х., Тум В., Айзерман Э. // Черные металлы. 1970. № 13. С. 21.
Крутилин А.Н., Кухарчук М.Н., Сычева О.А. // Литье и металлургия. 2012. № 2(65). С. 11.
Теплов О.А., Коваленко Л.В., Фолланис Г.Э., Федотов М.А., Фолланис Ю.Г. // Перспективные материалы. 2014. № 9. С. 53.
Гасымова А.М., Самедзаде Г.М., Келбалиев Г.И. и др. // Междунар. журн. прикл. и фунд. исследований. 2017. № 9. С. 36.
Блейфус Р.Л. // Экспресс-информация. Черная металлургия. 1972. № 14. С. 1.
Brill-Edwards P. // Iron Steel Inst. 1969. V. 207. № 12. P. 1565.
Мамедов А.Н., Самедзаде Г.М., Гасымова А.М. и др. // Междунар. журн. прикл. и фунд. исследований. 2016. № 2. С. 174–177.
Авдонина М.П. Дис. … канд. техн. наук. Свердловск: СГИ, 1975.
Меламуд С.Г., Юрьев Б.П., Спирин Н.А. // Изв. вузов. Черн. металлургия. 2010. № 12. С. 9.
Третьяков Ю.Д. Твердофазные реакции. М.: Химия, 1978.
Михайлов Г.Г., Леонович Б.И., Кузнецов Ю.С. Термодинамика металлургических процессов и систем. М.: Изд. Дом МИСиС, 2009.
Уэндландт У. Термические методы анализа. М.: Мир, 1978.
Сапожников Э.Я., Райзенблат Е.М., Климов В.В. // Изв. АН СССР. Неорган. материалы. 1974. Т. 10. № 6. С. 1085.
Чернышев А.М., Корнилова Н.К. // Докл. АН СССР. 1978. Т. 242. № 2. С. 360.
Минеев Г.Г., Минеева Т.С., Жучков И.А. Теория металлургических процессов. Иркутск: Изд-во Иркутского гос. техн. ун-та, 2010.
Федотов В.Х., Кольцов Н.И., Косьянов П.М. // Хим. физика. 2020. Т. 39. № 3. С. 48.
Гриднев А.А., Гудков М.В., Бехли Л.С., Мельников В.П. // Хим. физика. 2018. Т. 37. № 12. С. 33.
Кольцов Н.И. // Хим. физика. 2020. Т. 39. № 9. С. 23.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


