Химическая физика, 2022, T. 41, № 2, стр. 41-50
Фотохимические свойства октафенилзамещенного фталоцианина эрбия
И. Д. Бурцев 1, А. Е. Егоров 1, А. А. Костюков 1, А. В. Шибаева 1, М. А. Климович 1, А. Д. Косов 2, М. Ю. Селиверстов 2, Т. В. Дубинина 2, А. А. Маркова 1, 3, В. А. Кузьмин 1, *
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
Москва, Россия
* E-mail: vak@sky.chph.ras.ru
Поступила в редакцию 27.07.2021
После доработки 10.08.2021
Принята к публикации 20.08.2021
- EDN: GBHHXZ
- DOI: 10.31857/S0207401X22020029
Аннотация
Установлены спектрально-кинетические характеристики синглетного и триплетного возбужденных состояний октафенилзамещенного фталоцианина эрбия. Показано, что соединение обладает высокими значениями квантовых выходов флуоресценции (0.50) и синглетного кислорода (0.43). Определены значения времени жизни возбужденного синглетного (4.9 нс) и триплетного состояний (1.4 мс). Рассчитана величина константы связывания фталоцианина с бычьим сывороточным альбумином (5.5 · 106 М–1), указывающая на эффективное связывание исследуемого вещества с альбумином. На модельной клеточной линии аденокарциномы толстой кишки (линия клеток HCT116) было установлено преимущественное накопление красителя в цитоплазме клеток. Методом конфокальной микроскопии установлена локализация фталоцианина в митоходриях и структурах эндоплазматического ретикулума.
ВВЕДЕНИЕ
Фталоцианины (Pc) лантанидов (Ln) находят широкое применение в областях, связанных с исследованием различных флуоресцентных материалов, проводников, в нелинейной оптике и фотомедицине [1–4]. Они представляют собой макроциклические соединения, которые, благодаря наличию четырех изоиндольных фрагментов, обладают симметричной π-сопряженной ароматической системой. Наличие такой системы в молекуле приводит к повышению ее химической и термической стабильности, а также к появлению ряда важных химических и фотофизических свойств. Данный класс соединений обладает интенсивным поглощением в области 600–700 нм с высокими значениями коэффициента молярной экстинкции [5, 6].
Расширенная ароматическая система молекул фталоцианинов увеличивает вариативность в синтезе соединений ввиду возможности введения широкого спектра заместителей в периферические положения [7, 8]. Введение Ln в качестве центрального иона металла позволяет в том числе координировать два и более макроциклических фталоцианиновых остова, что дает возможность получения производных фталоцианинов вида LnPc2 или Ln2Pc3 [9–11].
Многие фталоцианины, как и их ближайшие природные аналоги – порфирины, используются также в области фотомедицины в качестве агентов для фотодинамической терапии (ФДТ) рака [12–17]. Метод ФДТ основан на фотохимическом действии фотосенсибилизатора (ФС), локализованного в опухоли, способствующего генерации цитотоксически активных форм кислорода (АФК) в присутствии молекулярного кислорода при облучении светом на определенной длине волны [18]. Результатом поглощения энергии света являются фотохимические реакции с переносом энергии и электрона, в ходе которых образуются АФК: синглетный кислород 1О2 и супероксидый анион-радикал, приводящие к гибели опухолевых клеток.
Соединения лантанидов с органическими лигандами и наночастицы на их основе успешно применяются в ФДТ в качестве цитотоксичных агентов и ингибиторов [19], а также обладают значительными люминесцентными свойствами и применяются в биоимиджинге [20, 21]. Введение в структуру фталоцианина эрбия способствует батохромному сдвигу спектров поглощения и флуоресценции в область важного для ФДТ “терапевтического окна” [22, 23].
Целью настоящей работы было исследование фотохимических и фотофизических свойств нового октафенилзамещенного фталоцианина эрбия в качестве аксиального лиганда, который может быть рассмотрен для дальнейших испытаний в качестве ФС для ФДТ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследуемое соединение 2,3,9,10,16,17,23,24-октафенилфталоцианината эрбия ацетат, PhPcEr(OAc), было получено согласно методике, описанной в работе [24].
Спектральные измерения
Электронные спектры поглощения PhPcEr(OAc) регистрировали с использованием спектрофотометра “Shimadzu UV-3101PC” фирмы “Shimadzu” (Japan) в диапазоне длин волн 300–800 нм в кварцевой кювете с длиной оптического пути 1 см при комнатной температуре.
Спектры флуоресценции PhPcEr(OAc) регистрировали на спектрофлуориметре FluoTime 300 фирмы “PicoQuant” (Germany) с использованием ксеноновой лампы в качестве источника возбуждающего света в кварцевых кюветах размером 1.0 × 1.0 см при комнатной температуре. Во избежание эффекта внутреннего фильтра оптическая плотность растворов стандарта и образцов в точке возбуждения подбиралась не выше 0.07.
Квантовые выходы флуоресценции PhPcEr(OAc) регистрировали в растворе диметилсульфоксида (ДМСО) с использованием раствора метиленового синего в метаноле в качестве стандарта (Φf = 0.80 [25]) при возбуждении ксеноновой лампой на длине волны 620 нм. Квантовые выходы флуоресценции были рассчитаны согласно формуле [26]
где $\Phi _{f}^{s}$ – квантовый выход флуоресценции стандарта, ${{F}_{i}}$ и ${{F}_{s}}$ – площади под спектрами флуоресценции образца и стандарта, $n_{i}^{2}$ и $n_{s}^{2}$ – квадраты коэффициентов преломления в используемом растворителе для образца и стандарта соответственно; ${{f}_{i}} = 1 - {{10}^{{ - {{A}_{x}}}}},$ (Ах – поглощение соединения на длине волны возбуждения).Кинетику гибели флуоресценции для PhPcEr(OAc) регистрировали на спектрофлуориметре FluoTime 300 фирмы “PicoQuant” (Germany) с использованием лазера SOLEA. Сигнал собственной функции прибора (IRF) был получен с использованием рассеивающей среды Ludox производства компании DuPont (USA) в качестве стандарта. Эксперименты проводили при комнатной температуре. Кинетические кривые гибели флуоресценции обрабатывали с использованием полиэкспоненциальной модели при помощи программного обеспечения FluoFit Software фирмы “PicoQuant” (Germany). Время жизни флуоресценции было рассчитано согласно уравнению
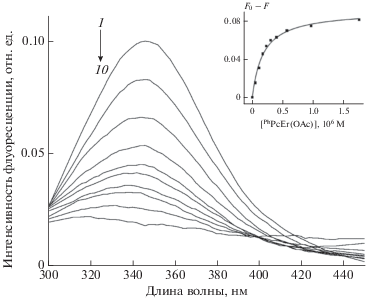
Константу связывания фталоцианина с бычьим сывороточным альбумином (БСА) определяли методом тушения флуоресценции тирозина и триптофана в структуре белковой молекулы. Флуоресценцию регистрировали в растворе БСА в фосфатном буфере (pH = 7.4) при возбуждении на длине волны 280 нм. Спектры флуоресценции регистрировали в диапазоне 300–450 нм. Полученные данные аппроксимировали гиперболой
Квантовые выходы синглетного кислорода определяли по соответствующей формуле [27]:
Спектрально-кинетические характеристики триплетных состояний в экспериментах по импульсному фотолизу PhPcEr(OAc) в растворе ДМСО измеряли в кварцевой кювете с длиной оптического пути l = 20 см на установке импульсного фотолиза с использованием ксеоновой лампы (фильтр КС-18, пропускание – от 690 нм) с энергией вспышки 80 Дж и временем вспышки 20 мкс [29]. Регистрацию поглощения осуществляли с помощью фотоумножителя ФЭУ-38 в диапазоне длин волн 400–800 нм. Удаление кислорода из рабочих растворов проводили с помощью вакуумирования.
Культуру клеток аденокарциномы толстой кишки (линия клеток HCT116, полученная из Американской коллекции типовых культур) инкубировали в питательной среде DMEM (Dulbecco’s modified Eagles medium) производства компании ПанЭко (Россия) с добавлением 5%-ной фетальной бычьей сыворотки производства компании HyClone (USA), 2 мМ L-глутамина, 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина (ПанЭко, Россия) при 37 °C, 5%-ной CO2 во влажной атмосфере. В экспериментах использовали культуры в логарифмической фазе роста. Клетки в количестве 2 · 105 в 3 мл культуральной среды вносили в чашки Петри для микроскопии производства компании SPL Lifesciences (USA) диаметром 35 мм и инкубировали при указанных выше условиях. Через 48 ч добавляли PhPcEr(OAc) в конечной концентрации 5 · 10–6 М и инкубировали в течение 17 ч. В часть чашек краситель не вносили, их использовали в качестве контрольной среды. После инкубации монослой клеток промывали солями Хенкса для последующего окрашивания клеточными маркерами. Для визуализации внутриклеточного распределения органелл клетки окрашивали фуоресцентными красителями: ER tracker Green (BODIPY™ FL Glibenclamide, ThermoFisher Scientific) в концентрации 1 мкМ для окрашивания эндоплазматического ретикулума при инкубации в течение 30 мин (λex = 488 нм, λem = 500–580 нм); Dihydrorhodamine 123 производства компании ThermoFisher Scientific, митохондриальный трекер для детекции активных форм кислорода (10 мкМ, 30 мин, λex = 488 нм, λem = 500–580 нм), лизосомный маркер LysoTracker Green DND-26 производства компании ThermoFisher Scientific (1 мкМ, 30 мин, λex = 488 нм, λem = 500–580 нм) и Hoechst 33342 для окрашивания ядер (0.01 мг, 15 мин, λex = 405 нм, λem = 420–480 нм).
Исследование повреждения клеточных мембран для проницаемости пропидия иодидом проводили методом конфокальной микроскопии с такой же пробоподготовкой, как в эксперименте с анализом внутриклеточного распределения PhPcEr(OAc). В культуральную среду клеток добавляли PhPcEr(OAc) в конечной концентрации 5 · 10–6 М и инкубировали в течение 17 ч. После инкубации монослой клеток промывали солями Хенкса для последующего окрашивания клеточными маркерами. Для визуализации внутриклеточного распределения органелл клетки окрашивали красителем Hoechst 33342 для окрашивания ядер (характеристики красителя приведены выше), промывали солями Хенкса и добавляли соли Хенкса с пропидия иодидом в конечной концентрации 0.1 мкг/мл (λex = 488 нм, λem = 550–700 нм). Изображения получали на конфокальном микроскопе Leica TCS SP5 компании Leica Microsystem GmbH (Germany), исключая фоновую флуоресценцию PhPcEr(OAc) путем ограничения мощностей лазера и детекторов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектральные фотохимические характеристики фталоцианина PhPcEr(OAc)
Структурная формула исследуемого фталоцианина PhPcEr(OAc) представлена на рис. 1. Фталоцианин PhPcEr(OAc) характеризуется наличием восьми фенильных заместителей в периферических положениях и ацетата в качестве аксиального лиганда у центрального иона эрбия, который может являться уходящей группой при синтезе последующих производных, содержащих два и более фталоцианиновых лиганда [24].
Рис. 2.
Нормализованные спектры поглощения и флуоресценции PhPcEr(OAc) в растворе ДМСО; λex = 620 нм.
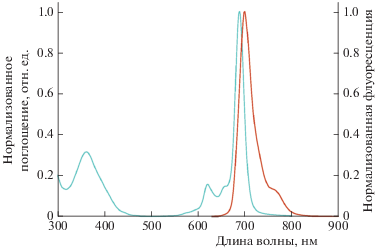
Для исследуемого фталоцианина PhPcEr(OAc) были зарегистрированы спектры поглощения и флуоресценции его в растворе ДМСО (рис. 2). Спектр поглощения PhPcEr(OAc) характеризуется наличием S-полосы в области 350–370 нм и интенсивной узкой Q-полосы с максимумом поглощения при 690 нм. Q-Полоса обладает ярко выраженной сопутствующей полосой поглощения при 620 нм, что характерно для фталоцианинов редкоземельных элементов [2]. Спектр флуоресценции характеризуется наличием интенсивной полосы флуоресценции с максимумом при 704 нм (стоксов сдвиг – 14 нм). Квантовый выход флуоресценции PhPcEr(OAc) составил Φfl = 0.50.
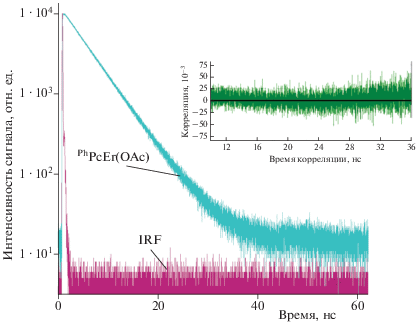
Была исследована кинетика гибели флуоресценции для описываемого соединения (рис. 3). Время жизни флуоресценции исследованного соединения в растворе ДМСО составляет 4.9 нс. Кинетика гибели флуоресценции PhPcEr(OAc) является моноэкспоненциальной (χ2 = 1.03).
Рис. 3.
Кинетика гибели флуоресценции PhPcEr(OAc) в растворе ДМСО (C = 5.6 · 10–6 М); λex = 620 нм, λreg = 700 нм. На вставке: функция автокорреляции для аппроксимации моноэкспоненциальной зависимости интенсивности сигнала от времени.
Константа связывания с БСА, рассчитанная по тушению флуоресценции белка (рис. 4), составила Kb = (5.5 ± 1.0) · 106 М–1. Высокое значение Kb при взаимодействии БСА с PhPcEr(OAc) в сравнении со константой, полученной для фталоцианина цинка в работе [30], вероятно, обусловлено тем, что эрбий находится вне плоскости молекулы фталоцианина и связан с ацетатом. Высокая эффективность кулоновского взаимодействия между положительно заряженным центральным фрагментом молекулы фталоцианина и отрицательно заряженной молекулой белка является подтверждением этого предположения [31].
Спектрально-кинетические характеристики триплетных состояний
Методом импульсного фотолиза были получены дифференциальный триплет-триплетный спектр поглощения дегазированного раствора PhPcEr(OAc) в ДМСО (рис. 5) и кинетика гибели триплетного состояния данного соединения (см. реакцию (I) ниже).
Рис. 5.
Дифференциальный триплет-триплетный спектр поглощения PhPcEr(OAc) (С = 7 · 10–7 M в растворе ДМСО) по прошествии 300 мкс после вспышки. На вставке: кинетика гибели триплетного состояния при 520 нм.
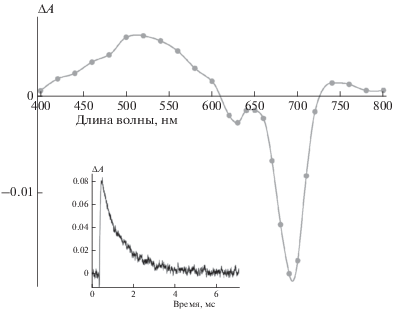
Триплет-триплетный спектр характеризуется наличием интенсивной полосы триплетного поглощения в области 400–600 нм, а также менее интенсивным поглощением в области 740–780 нм и областью выцветания синглетного состояния при 600–720 нм, соответствующей максимуму спектра синглетного поглощения (рис. 2). Кинетика гибели триплетного состояния является моноэкспоненциальной и описывается уравнением $\Delta A = \Delta {{A}_{0}}{\text{exp}}\left( {{{ - t} \mathord{\left/ {\vphantom {{ - t} {{{\tau }_{T}}}}} \right. \kern-0em} {{{\tau }_{T}}}}} \right),$ где ΔA – изменение триплет-триплетного поглощения в течение заданного времени, ΔA0 – триплет-триплетное поглощение непосредственно после вспышки, t – время. Время жизни триплетного состояния τT = 1/kT, где kT – константа скорости гибели триплетного состояния. Время жизни триплетного состояния составило 1.4 мс.
Синглетный кислород генерируется в результате переноса энергии от триплетного состояния молекулы ФС к молекулам кислорода в основном состоянии:
(III)
${\text{T}} + {{\,}^{3}}{{{\text{O}}}_{2}}\xrightarrow{{{{k}_{q}}}}{{{\text{S}}}_{0}} + {{\,}^{1}}{{{\text{O}}}_{2}}{\text{,}}$Для PhPcEr(OAc) была определена квантовая эффективность синглетного кислорода. По регистрации спектров люминесценции синглетного кислорода (рис. 6, реакция (IV)) в ближней ИК-области (λmax ~ 1270 нм) было рассчитано значение его квантового выхода, которое для PhPcEr(OAc) составило ΦΔ = 0.43. Полученное значение указывает на эффективность процесса переноса энергии (см. табл. 1).
Рис. 6.
Спектры люминесценции синглетного кислорода метиленового синего и PhPcEr(OAc) в ДМСО: 1 – метиленовый синий, 2 – PhPcEr(OAc); λex = 650 нм.
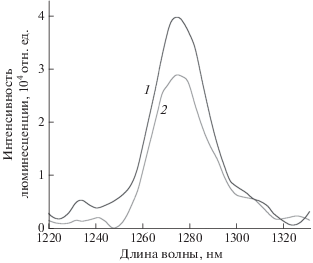
Таблица 1.
Фотохимические характеристики PhPcEr(OAc)
| Соединение | λabs, нм | λfl, нм | Δλ, нм | Φfl | τfl, нс | λt – t, нм | τt – t, мс | ΦΔ | kb, М–1 |
|---|---|---|---|---|---|---|---|---|---|
| PhPcEr(OAc) | 690 | 704 | 14 | 0.50 | 4.87 | 520 | 1.4 | 0.43 | (5.5 ± 1.0) · 106 |
| PhPcH2 | 688 (Q1), 718 (Q2) | 708 | 20 | 0.20 | 5.73 | – | – | 0.55 | – |
Примечания: λabs – максимум поглощения, λfl – максимум флуоресценции, Δλ – стоксов сдвиг, Φfl – квантовый выход флуоресценции, τfl – время жизни флуоресценции, λt – t – максимум триплетного поглощения, τt – t – время жизни триплетного состояния, ΦΔ – квантовый выход синглетного кислорода, kb – константа связывания комплекса фталоцианина с БСА.
Значения квантовых выходов флуоресценции и синглетного кислорода для PhPcEr(OAc) сравнивали с соответствующими значениями для аналогичного безметалльного флатоцианина PhPcH2: Φfl = 0.20 и ΦΔ = 0.55 в табл. 1. Усиление флуоресценции PhPcEr(OAc) хорошо согласуется с ранее полученными сведениями о гомолептических бисфталоцианинах эрбия [32]. Включение металла в структуру фталоцианина приводит к исчезновению расщепления уровня энергии, соответствующего нижней свободной молекулярной орбитали. Данный процесс выражается в уменьшении квантового выхода интеркомбинационной и внутренней конверсии, что приводит к увеличению квантового выхода флуоресценции. Описанный эффект основан на взаимодействии σ‑орбиталей металла с π‑электронным сопряжением орбиталей атомов азота в лиганде фталоцианина, перпендикулярных плоскости кольца.
Исследования на клетках
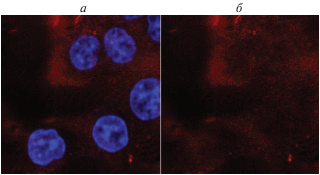
Для визуализации клеток использовался краситель ядер Hoechst 33342. На рис. 7 показано, что PhPcEr(OAc) накапливается в клетках модельной клеточной линии аденокарциномы толстой кишки (линия клеток HCT116). Накопление происходит преимущественно в цитоплазме. В ядре краситель накапливается в меньшей степени, но сигнал обнаруживается и в ядрах клеток. Способность PhPcEr(OAc) накапливаться в клеточных структурах может быть во многом обусловлена его способностью связываться с белковыми молекулами (Kb = (5.5 ± 1.0) · 106 М–1).
Рис. 7.
Накопление PhPcEr(OAc) в клетках аденокарциномы толстой кишки (линия клеток HCT116). а – наложение сигналов PhPcEr(OAc) и Hoechst 33342, б – сигнал PhPcEr(OAc).
В дальнейшем были окрашены некоторые клеточные органеллы с целью соотнести сигнал от PhPcEr(OAc) c сигналами от митохондрий, эндоплазматического ретикулума и лизосом. Кроме того, в качестве контроля были окрашены соответствующими маркерами клетки, которые не подвергались воздействию PhPcEr(OAc).
В контрольных чашках наблюдали нормальную морфологию клеток (рис. 8). В клетках, которые инкубировались с PhPcEr(OAc), происходила регистрация в соответствующих его спектральным характеристикам диапазонах: λex = 633 нм, Em = 650–750 нм (красный сигнал). Наложение сигналов от PhPcEr(OAc) и от окрашиваемых клеточных органелл позволяет проанализировать преимущественное накопление исследуемого красителя. Для визуализации митохондрий использовался краситель Dihydrorhodamine 123. Особенность данного красителя заключается в том, что он не только накапливается в митохондриях клеток, но и является сенсором активных форм кислорода [33] (рис. 9).
Рис. 8.
Визуализация ядра (“синий” сигнал, более темные области) и клеточных органелл (“зеленый” сигнал (более светлые области) соответствует следующим органеллам: а – митохондрии, б – эндоплазматический ретикулум и в – лизосомы) в контрольных образцах.
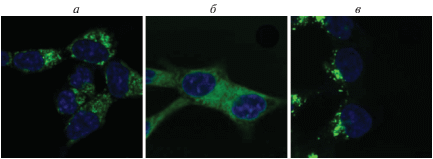
Рис. 9.
Исследование солокализации PhPcEr(OAc) с клеточными митохондриями: а – ядра клеток, окрашенные Hoechst 33342; б – сигнал от митохондрий, окрашенных Dihydrorhodamine 123; в – сигнал PhPcEr(OAc); г – наложение сигналов а и б.
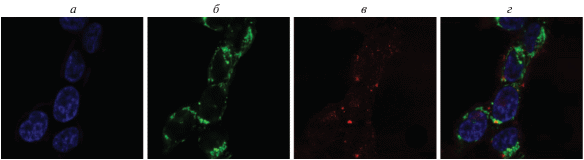
Активные формы кислорода окисляют Dihydrorhodamine 123 и превращают его в флуоресцентный родамин 123. При наложении сигналов (рис. 9г) происходит значительное, но неполное перекрывание сигналов. Можно предположить, что в некоторой степени PhPcEr(OAc) способен накапливаться в митохондриях клеток. Аналогичным образом происходило сопоставление сигналов от ER-Tracker и PhPcEr(OAc), см. рис. 10.
Рис. 10.
Исследование солокализации PhPcEr(OAc) с эндоплазматическим ретикулумом; а – ядра клеток, окрашенные Hoechst 33342; б – сигнал от эндоплазматического ретикулума, окрашенного ER-Tracker; в – сигнал PhPcEr(OAc); г – наложение сигналов а и б.
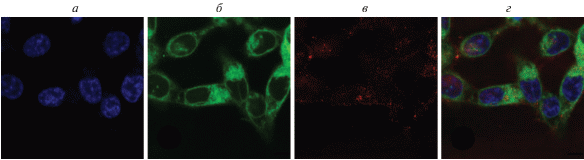
Заметно значительное перекрывание сигналов PhPcEr(OAc) и ER-Tracker, что может говорить о способности PhPcEr(OAc) накапливаться в структурах эндоплазматического ретикулума. Вместе с тем полного совпадения сигналов мы не наблюдаем, что говорит о неселективном характере накопления PhPcEr(OAc).
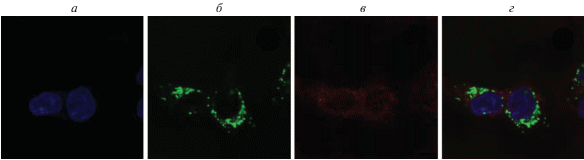
Исследование солокализации PhPcEr(OAc) и лизосом (рис. 11) позволяет говорить о совсем незначительном перекрывании сигналов, накопление PhPcEr(OAc) в лизосомах не происходит.
Рис. 11.
Исследование солокализации PhPcEr(OAc) с лизосомами: а – ядра клеток, окрашенные Hoechst 33342; б – сигнал от лизосом, окрашенных LysoTracker Green; в – сигнал PhPcEr(OAc); г – наложение сигналов а и б.
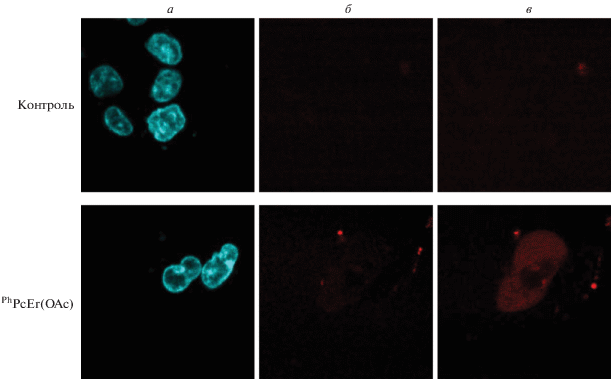
Конфокальная микроскопия клеток, нагруженных PhPcEr(OAc), показала отсутствие летального фотоповреждения мембран клеток в течение 1 ч после освещения. Клетки, накопившие PhPcEr(OAc) и окрашенные красителем ядер Hoechst 33342, облучались при λex = 633 нм до достижения плотности дозы в 300 Дж/см2 в клеточном буфере, содержащем пропидия иодид (рис. 12). Последний иодид не способен проникать через неповрежденные цитоплазматические мембраны клеток, а в случае их повреждения он проходит в цитоплазму и ядро, интеркалируя с нуклеиновыми кислотами (РНК в цитоплазме и ДНК в ядре) с увеличением флуоресценции в своем канале. Через 1 мин после фотовозбуждения клеток, нагруженных PhPcEr(OAc), мембраны клеток были не повреждены, а окрашивание пропидия иодидом цитоплазмы (и ядрышек) развивалось медленно – в течение 1 ч и не на всех клетках в пробе. Это свидетельствует о незначительном фотоповреждении мембран клеток при высоких дозах фотовозбуждения PhPcEr(OAc) и, следовательно, об отсутствии быстрого фотоиндуцированного некроза клеток.
Рис. 12.
Исследование фотоповреждения цитоплазматических мембран на клетках НСТ116, накопивших PhPcEr(OAc). На двух снимках а – ядра клеток, окрашенные Hoechst 33342, на остальных снимках (красный цвет) – цитоплазма и ядрышки клеток с поврежденными мембранами, проницаемыми для пропидия иодида: б – время после возбуждения 1 мин, в – 60 мин.
ЗАКЛЮЧЕНИЕ
Октафенилзамещенный фталоцианин PhPcEr(OAc) обладает значительными флуоресцентными свойствами, что выражается в высоком квантовом выходе и продолжительном времени жизни флуоресценции. Введение эрбия приводит к батохромному сдвигу спектров поглощения и флуоресценции, что хорошо согласуется с требованиями к фотосенсибилизатору для ФДТ. Высокая флуоресценция позволяет визуализировать локализацию PhPcEr(OAc) в компартментах клеток.
Под воздействием “красного” света на PhPcEr(OAc) в результате интеркомбинационной конверсии образуется триплетное состояние фталоцианина. Триплетная природа образующегося возбужденного состояния подтверждена тушением молекулярным кислородом. Высокий квантовый выход синглетного кислорода позволяет рассматривать PhPcEr(OAc) в качестве эффективного фотосенсибилизатора. Также данное соединение обладает высоким значением константы связывания с молекулой БСА, что говорит о его высоком сродстве к белковым молекулам и, соответственно, о возможности его доставки и накопления в опухолевых клетках.
Исследуемое соединение обладает интенсивным сигналом флуоресценции в клетках аденокарциномы толстой кишки (линия клеток HCT116). Оно накапливается преимущественно в цитоплазме, и в значительно меньшей степени флуоресцентный сигнал красителя обнаруживается в ядре клетки. Сопоставление флуоресцентного сигнала PhPcEr(OAc) с сигналами ряда клеточных органелл позволило установить, что краситель может накапливаться в митохондриях и эндоплазматическом ретикулуме, при этом практически не обнаруживается в ядре и лизосомах. Исследуемый краситель PhPcEr(OAc) не обладает субмикромолярной темновой цитотоксичностью, его фотодинамическая активность на клетках требует высоких интенсивностей освещения, при этом фталоцианин накапливается в цитоплазме. Это открывает возможность дальнейшего исследования фталоцианина как соединения для фотовизуализации, применимого в длительных флуоресцентных методах анализа без фотодинамического повреждения клеточных структур. Полученные данные о незначительном фотоповреждении клеточных мембран свидетельствуют о перспективности применения PhPcEr(OAc) для фотовизуализации без повреждения клеток в процессе флуоресцентной микроскопии.
Спектроскопические измерения проведены на базе ЦКП “Новые материалы и технологии” ИБХФ РАН.
Исследование цитотоксичности выполнено при финансовой поддержке Министерством науки и высшего образования Российской Федерации на оборудовании Центра изучения молекулярного состава ИНЭОС РАН.
Работа выполнена в рамках госзадания № 1201253303 по теме “Кинетика и механизмы элементарных стадий сложных фотохимических и биофотохимических процессов”.
Синтез фталоцианиновых комплексов осуществлялся при финансовой поддержке грантом Президента РФ MK-1056.2020.3.
Список литературы
Katoh K., Yoshida Y., Yamashita M. et al. // J. Amer. Chem. Soc. 2009. V. 131. P. 9967.
Zugle R., Litwinski C., Nyokong T. // Polyhedron. 2011. V. 30. P. 1612.
Kuzmina E.A., Dubinina T.V., Vasilevsky P.N. et al. // Dyes Pigment. 2021. V. 185. P. 108871.
Kuzmina E.A., Dubinina T.V., Dzuban A.V. et al. // Polyhedron. 2018. V. 156. P. 14.
Wong R.C.H., Lo P.-C., Ng D.K.P. // Coord. Chem. Rev. 2019. V. 379. P. 30.
Roguin L.P., Chiarante N., Vior M.C.G. et al. // Intern. J. Biochem. Cell Biol. 2019. V. 114. P. 105575.
Dubinina T.V., Tychinsky P.I., Borisova N.E. et al. // Dyes Pigments. 2018. V. 156. P. 386.
Furuyama T., Maeda K., Maeda H. et al. // J. Org. Chem. 2019. V. 84. №. 21. P. 14306.
Feng G., Xiaowan F., Liu Y. et al // Dalton Trans. 2016. V. 45. P. 7476.
Wenbo L., Houhe P., Ziqian W. et al. // Chem. Commun. 2017. V. 53. P. 3765.
Barard S., Kreouzis T., Cammidge A.N. et al. // Semicond. Sci. Technol. 2018. V. 33. № 9. P. 095010.
Santos K.L.M., Barros R.M., Lima D.P.S. et al. // Photodiagnosis Photodyn. Ther. 2020. V. 32. P. 102032.
Martin-Gomis L., Fernandez-Lazaro F., Sastre-Santos A. // J. Mater. Chem. A. 2014. V. 2. P. 15672.
Urbani M., Ragoussi M.-E., Nazeeruddin M.K. et al. // Coord. Chem. Rev. 2019. V. 381. P. 1.
Бердникова Н.Г., Донцов А.Е., Ерохина М.В. и др. // Хим. физика. 2019. Т. 38. № 12. С. 48.
Клименко И.В., Лобанов А.В., Трусова Е.А. // Хим. физика. 2019. Т. 38. № 12. С. 74.
Климович М.А., Сажина Н.Н., Радченко А.Ш. и др. // Хим. физика. 2021. Т. 40. № 2. С. 33.
Dabrowski J.M. // Adv. Inorg. Chem. 2017. V. 70. P. 343.
Teo R.D., Termini J., Gray H.B. // J. Med. Chem. 2016. V. 59. № 13. P. 6012.
Zhigao Y., Zichao L., Xian Q. et al. // Acc. Chem. Res. 2020. V. 53. № 2. P. 2962.
Herlan C., Brase S. // Dalton Trans. 2020. V. 49. P. 2397.
Yigang L., Hong Y., Zian H. et al. // J. Mater. Res. 2005. V. 20 № P. 2940.
Shuhui B., Jin H., Qi W. et al. // Photochem. Photobiol. Sci. 2008. V. 7. P. 474.
Dubinina T.V., Paramonova K.V., Trashin S.A. et al. // Dalton Trans. 2014. V. 43. P. 2799.
Shahinyan G.A., Amirbekyan A.Y., Markarian S.A. // Spectrochim. Acta, Part A. 2019. V. 217. P. 170.
Brouwer A.M. // Pure Appl. Chem. 2011. V. 83. № 12. P. 2213.
Sainuddin T., McCain J., Pinto M. et al. // Inorg. Chem. 2016. V. 55. № 1. P. 83.
Redmond R.W., Gamlin J.N. // Photochem. Photobiol. 1999. V. 70. P. 391.
Кузьмин В.А., Волнухин В.А., Егоров А.Е. и др. // Хим. физика. 2019. Т. 38. № 12. С. 3.
Amitha G.S., Vasudevan S. // Polyhedron. 2019. V. 175. P. 114208.
Li X., Jeong K., Lee Y. et al. // Theranostics. 2019. V. 9. № 22. P. 6412.
Bo S., Tang D., Liu X., Zhen Z. // Dyes Pigment. 2008. V. 76. №. 1. P. 35.
Ortega-Villasante C., Buren S., Blazquez-Castro A. et al. // Free Radic. Biol. Med. 2018. V. 122. P. 202.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика