Химическая физика, 2022, T. 41, № 2, стр. 34-40
Моделирование механизмов спонтанной реактивации мутантов бутирилхолинэстеразы, ингибированной эхотиофатом
С. В. Лущекина 1, А. В. Немухин 1, 2, *, И. В. Поляков 1, 2, П. Массон 3, С. Д. Варфоломеев 1, 2, Б. Л. Григоренко 1, 2
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт фундаментальной медицины и биологии
Казанского федерального (Приволжского) университета
Казань, Россия
* E-mail: anem@lcc.chem.msu.ru
Поступила в редакцию 27.07.2021
После доработки 12.08.2021
Принята к публикации 20.08.2021
- EDN: MXEQKA
- DOI: 10.31857/S0207401X22020066
Аннотация
Методами молекулярного моделирования исследован механизм реакции реактивации двойного мутанта бутирилхолинэстеразы Asn322Glu/Glu325Gly, ингибированной фосфорорганическим соединением (ФОС) эхотиофатом. Способность данного мутанта к спонтанной реактивации была ранее показана экспериментально. Рассчитанный методом квантовой механики/молекулярной механики (КМ/ММ) энергетический профиль пути реакции подтверждает, что подобный механизм возможен. При помощи молекулярно-динамических расчетов с потенциалами КМ/ММ исследованы пути переноса протона и определено протонированное состояние глутаминовых кислот активного сайта двойного мутанта. Методами классической молекулярной динамики исследованы возможные пути повышения его конформационной стабильности.
ВВЕДЕНИЕ
“Биоловушками”, “биочистильщиками” или “биоскавенджерами” называют биологические объекты (ферменты, каталитические антитела), способные связывать и/или гидролизовать фосфорорганическим соединением (ФОС). Их использование представляется наиболее эффективной альтернативой традиционным антидотам для нейтрализации или детоксикации ФОС. При этом основными требованиями являются широкий спектр действия и приемлемая стоимость производства большого количества фермента. Введение биоловушек позволяет нейтрализовать молекулы токсиканта в кровотоке прежде, чем они достигнут своих биологических мишеней, обеспечивая тем самым защиту от отравления.
Биоловушки первого поколения нейтрализуют молекулы ФОС, стехиометрически связываясь с ними. Была показана безопасность и эффективность бутирилхолинэстеразы (БХЭ) человека при использовании ее для защиты от отравлений ФОС. Однако стехиометрическая нейтрализация ФОС требует введения огромного количества дорогостоящих биофармацевтических препаратов. Вторым поколением являются каталитические биоловушки – искусственные ферменты или катализаторы другого рода, способные расщеплять молекулы ФОС и восстанавливаться после реакции. Эти катализаторы либо расщепляют фосфорные эфиры (фосфотриэстеразная, органофосфатгидролазная активность), либо превращают их в менее токсичные соединения за счет окисления алкильных либо арильных цепей. Недавно было опубликовано несколько обзоров, посвященных биоловушкам второго поколения [1–6].
Анализ конфигураций интермедиатов реакций спонтанной реактивации конъюгатов с различными ФОС нативной формы, полиморфных вариантов и искусственных мутантов БХЭ показывает, что ключевую роль в ходе реакции играет ориентация каталитического гистидина [7, 8]. В случае, когда атом азота Nε имидазольного кольца и протон, полученный им в результате фосфорилирования или активации молекулы воды, лежат в одной плоскости с атомом Oγ каталитического серина, это облегчает переход протона, необходимый для реактивации фермента. Это может быть достигнуто за счет изменения положения третьего члена каталитической триады – глутаминовой кислоты. По результатам анализа кристаллографической структуры положение 322 представляется наиболее перспективным для введения мутации, облегчающей переход протона. Двойная мутация БХЭ Asn322Glu/Glu325Gly благоприятствует сохранению функциональной каталитической триады и изменению угла наклона имидазольного кольца. Мутации, затрагивающие каталитические аминокислоты, зачастую являются губительными для фермента, но в данном случае экспериментально было показано, что БХЭ с этой мутацией сохраняет эстеразную активность [9].
Экспериментально было получено свидетельство того, что этот мутант способен к спонтанной реактивации после ингибирования эхотиофатом. К сожалению, из-за сниженной конформационной стабильности этого мутанта экспериментально получить количественные характеристики реакции реактивации не представляется возможным. Экспериментальный перебор большого количества модификаций мутанта Asn322Glu/Glu325Gly для повышения его конформационной стабильности требует эффективной системы экспрессии и существенных финансовых затрат. Методы молекулярного моделирования позволяют оптимизировать этот процесс.
Таким образом, целью данной работы было изучение механизма спонтанной реактивации двойного мутанта БХЭ Asn322Glu/Glu325Gly с использованием методов суперкомпьютерного моделирования, а также исследование возможных путей повышения его конформационной стабильности.
МОДЕЛИ И МЕТОДЫ
Модели
Для построения моделей в качестве источника координат была использована кристаллографическая структура БХЭ человека из банка данных PDB 1P0I [10]. Недостающие фрагменты белковой молекулы (боковые цепи отдельных аминокислотных остатков и атомы водорода) были восстановлены, как описано в [9]; мутации были внесены, как описано в [11]. Полученные модельные системы были полностью сольватированы молекулами воды; были добавлены ионы натрия и хлора для нейтрализации заряда и для обеспечения физиологической концентрации NaCl, равной 0.15 моль/л.
Молекулярная динамика
Молекулярно-динамическое (МД) моделирование проводилось с помощью программы NAMD [12] в силовом поле CHARMM36 [13] согласно ранее опубликованному протоколу [14]. Для каждого мутанта были получены три параллельные траектории длиной 100 нс, которые использовались для анализа.
Метод квантовой механики/молекулярной механики (КМ/ММ)
Построение энергетического профиля реакции методом КМ/ММ проводилось согласно протоколу, опубликованному ранее [9], с использованием программы NWChem [15] с функционалом электронной плотности PBE0 и базисом cc-pvdz. Молекулярно-механическая подсистема моделировалась с помощью силового поля AMBER [16].
Метод молекулярной динамики с потенциалами КМ/ММ
Молекулярно-динамические расчеты с потенциалами КМ/ММ проводились при помощи общего интерфейса программ TeraChem и NAMD [17] с использованием схемы электростатического внедрения с функционалом электронной плотности PBE0-D3 и базисом cc-pvdz и силового поля CHARMM36 для ММ-подсистемы. Параметры МД-протокола были такими же, как и для классических молекулярно-динамических расчетов. Для исследования путей переноса протона в систему был добавлен ион гидроксония между остатками Glu441 и Glu322.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спонтанная реактивация после ингибирования эхотиофатом
На рис. 1 показан профиль минимальной энергии вдоль пути реакции реактивации мутанта Asn322Glu/Glu325Gly, ингибированного эхотиофатом. На первом этапе происходит нуклеофильная атака молекулой воды, активируемой остатком каталитического гистидина His438, атома фосфора конъюгата с образованием пентакоординированного интермедиата. Энергетический барьер этой стадии составляет 8.2 ккал/моль. Далее происходит практически безбарьерная реориентация образовавшегося имидазольного катиона. Затем происходит одновременный перенос протона с имидазольного катиона на кислород каталитического серина Ser198 и перенос протона с образующегося диэтилфосфата обратно на тот же самый остаток каталитического гистидина. Известное из литературы значение pKa = 1.39 [18] диэтилфосфата не противоречит этому механизму. Это приводит к высвобождению фермента с протонированным каталитическим гистидином, который может восстановить свою эффективность за счет переноса протона на остаток Glu197, обладающий аномально высокой основностью [8, 19, 20].
Рис. 1.
Энергетический профиль реакции спонтанной реактивации мутанта Asn322Glu/Glu325Gly БХЭ, ингибированного эхотиофатом; ФИ – фермент-ингибиторный комплекс, ПС – переходное состояние, ПИ – пентакоординированный интермедиат.
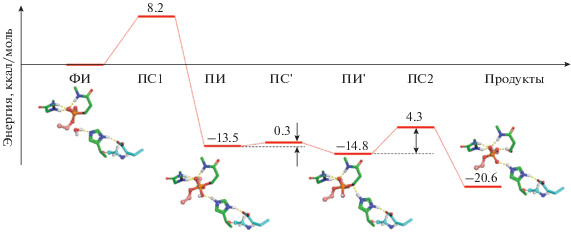
Полученные результаты свидетельствуют о протекании реакции спонтанной реактивации по механизму нуклеофильного присоединения-отщепления (AN + DN) [21]. Ориентация каталитического гистидина остатком новой каталитической глутаминовой кислоты Glu322 позволяет обеим стадиям – присоединению молекулы воды и отщеплению каталитического серина протекать с относительно низкими барьерами.
Протонированное состояние глутаминовых кислот активного сайта
Вопрос протонированного состояния двух некаталитических глутаминовых кислот активного сайта БХЭ Glu197 и Glu441, находящихся в непосредственной близости друг к другу, обсуждается в литературе на протяжении десятилетий [8]. Анализ конформационной подвижности мутанта Asn322Glu/Glu325Gly, выполненный с использованием метода цепей Маркова, показал, что протонированное состояние ионогенных групп, а именно двух некаталитических глутаминовых кислот активного сайта Glu197 и Glu441, оказывает существенное влияние на конформационные переходы в белке [9]. В рамках классической молекулярной динамики остался открытым вопрос перехода протона между молекулами воды и карбоксильными группами, окружающими активный сайт.
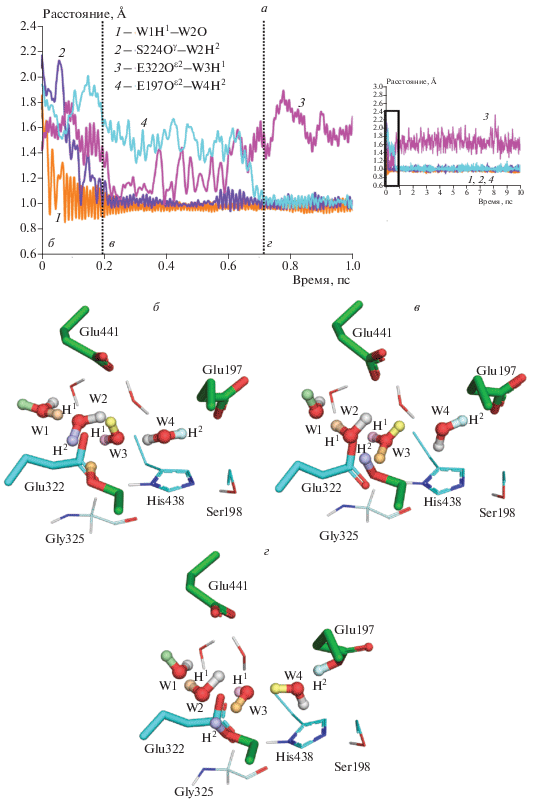
По результатам МД-расчетов с КМ/ММ-потенциалами в пределах доступных длин траекторий порядка десятков пикосекунд пути переноса протона оканчивались на Glu197. При этом пути переноса протона включали также гидроксильную группу аминокислотного остатка Ser224, обменивающегося протоном с соседними молекулами воды, кратковременное протонирование Glu322 и лишь затем перенос протона через две молекулы воды на Glu197. После чего система с протонированным Glu197 была довольно стабильна без признаков дальнейшего переноса протона на соседние молекулы воды или аминокислотные остатки (рис. 2).
Рис. 2.
Пути переноса протона в активном сайте двойного мутанта: а – изменение наиболее значимых расстояний между атомами кислорода и водорода вдоль КМ/ММ-МД-траектории; б–г – кадры траектории, соответствующие шагам, указанным на панели а; молекулы воды обозначены как W1, W2, W3, W4 и подписаны атомы водорода H1, H2, указанные на панели а.
Предыдущие результаты микросекундного классического МД-моделирования и анализа с использованием метода цепей Маркова свидетельствуют о том, что такому протонированному состоянию присуща большая конформационная подвижность с преобладанием конформаций с оперативной каталитической триадой [9]. В то же самое время Glu197 в непротонированном состоянии за счет образования ионной пары стабилизирует имидазольный катион, образующийся в качестве промежуточной стадии реакции реактивации. Поддержку Glu197 в протонированном состоянии можно обеспечить путем замены Glu441 на глутамин, что предотвратит перенос протона c Glu197 при протонировании His438 [8]. Такая мутация, помимо прочих, была рассмотрена как вариант дальнейшей оптимизации рассматриваемого мутанта Asn322Glu/Glu325Gly.
Повышение конформационной стабильности
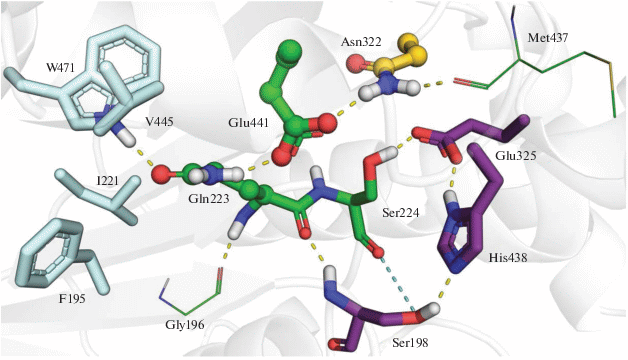
Аминокислотный остаток Asn322 не входит в непосредственное окружение каталитической триады, тем не менее он играет существенную роль в цепи водородных связей, поддерживающих целостность активного сайта. Ранее нами было показано [22], что возмущения в этой цепи водородных связей лежат в основе утраты каталитической активности полиморфным вариантом БХЭ Val204Asp [22]. Также снижение конформационной стабильности мутанта Asn322Glu/Glu325Gly связано с увеличением подвижности аминокислотных остатков с водородными связями с Asn322 в нативном ферменте, утративших эти стабилизирующие связи при замене Asn322Glu. При этом происходит изменение его роли со стабилизирующей на каталитическую. Восстановлению конформационной стабильности может способствовать создание новой цепи водородных связей взамен нарушенных за счет мутаций прилегающих гидрофобных остатков Phe195, Ile221, Val445, Trp471 (рис. 3).
Рис. 3.
Активный сайт нативной БХЭ и его окружение. Атомs углерода остатков каталитической триады (Ser198, His438, Glu325) показаны фиолетовым цветом. Желтым цветом показаны атомы углерода остатка Asn322, который превращен в каталитическую глутаминовую кислоту в двойном мутанте. Основные остатки, образующию сеть водородных связей, стабилизирующую активный сайт (Gln223, Asn322, Glu441), показаны с помощью шаростержневой модели. Атомы углерода гидрофобных остатков (Phe195, Ile221, Val445, Trp471), замена которых на гидрофильные рассматривается как способ повышения конформационной стабильности, показаны голубым цветом.
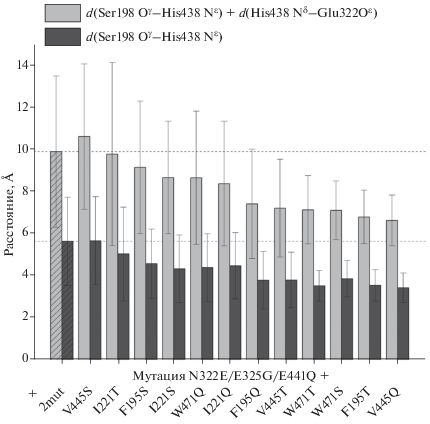
Таким образом, в качестве возможных направлений повышения конформационной стабильности мутанта Asn322Glu/Glu325Gly рассматривалось введение двух дополнительных замен: Glu441Gln и замены одного из остатков Phe195, Ile221, Val445, Trp471 на Ser, Thr, Asn, Gln (всего 16 вариантов). В свете изложенных выше результатов остаток Glu197 был протонирован.
В качестве критерия конформационной стабильности рассматриваемых мутантов было принято среднее по всем молекулярно-динамическим траекториям расстояние между каталитическими остатками: расстояние между атомами Ser198 Oγ и His438 Nε и его сумма с расстоянием между атомами His438 Nδ и Glu322 Oε.
Приведенные на рис. 4 результаты показывают, что введение этих мутаций в целом повышает конформационную стабильность рассматриваемых четверных мутантов по сравнению с Asn322Glu/ Glu325Gly. Хотя по приведенным данным трудно выделить наилучший вариант, но представляются перспективными мутанты Asn322Glu/Glu325Gly/ Glu441Gln/Phe195Thr и Asn322Glu/Glu325Gly/ Glu441Gln/Val445Gln.
ЗАКЛЮЧЕНИЕ
По результатам суперкомпьютерного молекулярного моделирования реакции спонтанной реактивации двойного мутанта БХЭ Asn322Glu/ Glu325Gly было показано, лимитирующий энергетический барьер этой реакции не превышает 8.5 ккал/моль, что согласуется с качественными экспериментальными данными. Как и в случае фермента дикого типа, некаталитическая глутаминовая кислота в позиции 197 находится в протонированном состоянии. Показано, что введение дополнительных мутаций, обеспечивающих создание новой сети водородных связей, может повысить конформационную стабильность мутанта Asn322Glu/Glu325Gly.
Работа выполнена при финансовой поддержке Российским фондом фундаментальных исследований (проект № 19-03-00076) с использованием оборудования Межведомственного суперкомпьютерного центра РАН и Центра коллективного пользования сверхвысокопроизводительными вычислительными ресурсами МГУ им. М.В. Ломоносова.
Список литературы
Worek F., Thiermann H., Wille T. // Toxicol. Lett. 2016. V. 244. P. 143; https://doi.org/10.1016/j.toxlet.2015.07.012
Masson P., Lushchekina S.V. // Chem.-Biol. Interact. 2016. V. 259. P. 319; https://doi.org/10.1016/j.cbi.2016.02.010
Masson P., Nachon F. // J. Neurochem. 2017. V. 142 Suppl 2. P. 26; https://doi.org/10.1111/jnc.14026
Goldsmith M., Ashani Y. // Chem.-Biol. Interact. 2018. V. 292. P. 50; https://doi.org/10.1016/j.cbi.2018.07.006
Masson P., Luschekina S. // Handbook of Toxicology of Chemical Warfare Agents / Ed. Gupta R.D. London: Acad. Press, 2020. P. 1199.
Lyagin I., Efremenko E. // Intern. J. Mol. Sci. 2021. V. 22; https://doi.org/10.3390/ijms22041761
Lushchekina S.V., Schopfer L.M., Grigorenko B.L. et al. // Front. Pharmacol. 2018. V. 9. P. 211; https://doi.org/10.3389/fphar.2018.00211
Lushchekina S., Masson P. // Toxicology. 2018. V. 409. P. 91; https://doi.org/10.1016/j.tox.2018.07.020
Grigorenko B.L., Novichkova D.A., Lushchekina S.V. et al. // Chem.-Biol. Interact. 2019. V. 306. P. 138; https://doi.org/10.1016/j.cbi.2019.04.019
Nicolet Y., Lockridge O., Masson P. et al. // J. Biol. Chem. 2003. V. 278. P. 41141; https://doi.org/10.1074/jbc.M210241200
Григоренко Б.Л., Хренова М.Г., Кулакова А.М. и др. // Хим. физика. 2020, Т. 39. С. 13; https://doi.org/10.31857/s0207401x20060023
Phillips J.C., Braun R., Wang W. et al. // J. Comput. Chem. 2005. V. 26. P. 1781; https://doi.org/10.1002/jcc.20289
Best R.B., Zhu X., Shim J. et al. // J. Chem. Theor. Comp. 2012. V. 8. P. 3257; https://doi.org/10.1021/ct300400x
Поляков И.В., Григоренко Б.Л., Немухин А.В. // Хим. физика. 2021. Т. 40. С. 44; https://doi.org/10.31857/s0207401x21020138
Valiev M., Bylaska E.J., Govind N. et al. // Comput. Phys. Commun. 2010. V. 181. P. 1477; https://doi.org/10.1016/j.cpc.2010.04.018
Case D.A., Cheatham T.E., 3rd, Darden T. et al. // J. Comput. Chem. 2005. V. 26. P. 1668; https://doi.org/10.1002/jcc.20290
Khrenova M.G., Tsirelson V.G., Nemukhin A.V. // Phys. Chem. Chem. Phys. 2020. V. 22. P. 19069; https://doi.org/10.1039/d0cp03560b
Kumler W.D., Eiler J.J. // J. Am. Chem. Soc. 1943. V. 65. P. 2355; https://doi.org/10.1021/ja01252a028
Amitay M., Shurki A. // Proteins. 2009. V. 77. P. 370; https://doi.org/10.1002/prot.22442
Eslami M., Hashemianzadeh S.M., Bagherzadeh K. et al. // J. Biomol. Struct. Dyn. 2016. V. 34. P. 855; https://doi.org/10.1080/07391102.2015.1057526
Allen K.N., Dunaway-Mariano D. // Trends Biochem. Sci. 2004. V. 29. P. 495; https://doi.org/10.1016/j.tibs.2004.07.008
Delacour H., Lushchekina S., Mabboux I. et al. // PLoS One. 2014. V. 9. P. e101552; https://doi.org/10.1371/journal.pone.0101552
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика