Химическая физика, 2022, T. 41, № 2, стр. 27-33
Исследование глазных патологий на биомодели японского перепела Coturnix japonica
Ю. С. Петронюк 1, *, Н. Н. Трофимова 1, П. П. Зак 1, Е. А. Храмцова 1, О. М. Андрюхина 2, А. С. Андрюхина 2, А. А. Рябцева 2, Т. С. Гурьева 3, Е. И. Медникова 3, С. А. Титов 4, В. М. Левин 1
1 Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
Москва, Россия
2 Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Москва, Россия
3 Государственный научный центр Российской Федерации – Институт медико-биологических проблем
Российской академии наук
Москва, Россия
4 Научно-технологический центр уникального приборостроения Российской академии наук
Москва, Россия
* E-mail: jps7@mail.ru
Поступила в редакцию 27.07.2021
После доработки 11.08.2021
Принята к публикации 20.08.2021
- EDN: OZXEWG
- DOI: 10.31857/S0207401X22020078
Аннотация
Проблема глазных патологий, таких как возрастная макулярная дистрофия и детская миопизация, становится с каждым годом все актуальнее. Влияние спектрального состава искусственного освещения, сопровождающего человека, начиная от самого рождения и до зрелости, становится все более заметным. Для выявления этой закономерности проведены экспериментальные исследования с использованием эффективной животной модели – японского перепела Coturnix japonica, одомашненная популяция которого широко используется в качестве лабораторного животного в офтальмологии и биомедицинских дисциплинах. Для выявления различия в развитии тканей глаза при повседневном освещении с разными спектральными характеристиками были исследованы птенцы и взрослые птицы. Методами оптической когерентной томографии наблюдалась структура переднего отдела глаза, а также толщина и строение хориоретинального комплекса. Ультразвуковыми методами получены данные о возрастных изменениях глазного яблока, роговицы, передней камеры, хрусталика, стекловидного тела, хориоретинального комплекса, склеры. Измерено содержание мелатонина в тканях глаза.
ВВЕДЕНИЕ
Исследование механизмов возникновения детской близорукости в настоящий момент имеет приоритетный характер и вызывает значительный интерес ученых. Прогрессирующий рост детской миопии связан прежде всего с массовым использованием дисплейных устройств, требующих напряженной зрительной работы. Глаза детей в возрасте до 7–8 лет, в отличие от взрослых, имеют укороченный размер по центральной оптической оси и являются дальнозоркими (+3D). По мере взросления глазное яблоко постепенно удлиняется, и в подростковом возрасте (10–14 лет) рост глаз останавливается по достижении нормальной сферической формы; в случае дальнейшего удлинения центральной оси глаза развивается близорукость (миопия). Форма глаза повседневно подстраивается под сохранение резкости изображения на сетчатке. По совокупности литературных данных в последние годы сформирована рабочая гипотеза, согласно которой миопический рост детского глаза по переднезадней оси стимулируется в результате возбуждения красночувствительных и зеленочувствительных колбочек сетчатки, а возбуждение синечувствительных фоторецепторов тормозит этот рост [1, 2]. Предположительными нейромодуляторами скорости роста могут быть мелатонин и допамин, секретируемые в противоположном циркадном ритме клетками сетчатки [3]. Мелатонин выполняет множество функций в организме человека: является сильным антиоксидантом, регулирует экспрессию большого числа генов, обладает противораковой активностью, повышает жизнеспособность клеток сетчатки, снижает внутриглазное давление. Известно, что миопия сопровождается высоким уровнем мелатонина в плазме крови, однако причинно-следственные связи этой корреляции до конца неясны и оказываются предметом современных исследований [4, 5].
За последние пять лет опубликовано около 50 работ по биомоделированию миопии на цыплятах кур [2]. Подобные исследования позволяют оценивать влияние повседневного освещения на развитие детского глаза и исследовать механизмы профилактического действия света. Во многих из этих работ показано, что при искусственной миопии, спровоцированной “дефокусом” изображения с помощью накладных линз, или же при “депривации” изображения матированными стеклами, красное освещение способствует миопическому росту глаза, а синий цвет тормозит миопизацию [1, 4, 6]. В некоторых из этих работ дополнительно исследовано содержание допамина [4, 6]. Домашний японский перепел Сoturnix japonica относится к отряду курообразных, и этот факт дает возможность проводить аналогичные исследования. В мировой литературе ссылок на работы, посвященные моделированию миопии на цыплятах перепелов, крайне мало [6]. Тем не менее важным преимуществом применения в качестве биомодели японского перепела является наличие высокой светозависимой циркадно-мелатониновой регуляции у этих птиц [6]. Эпифизарная система находится под тормозным контролем синечувствительных меланопсиновых ганглионарных клеток сетчатки, а ретинальная система сосредоточена непосредственно в самих фоторецепторных клетках. Выполнение работ в рамках данной биомодели позволяет исследовать как процессы миопизации, так и анализировать светорегуляторные функции мелатонина в этих процессах.
В данной работе исследовалось постнатальное развитие глаза японского перепела Сoturnix japonica в норме и при моделировании миопии путем коррекции спектра повседневного освещения. Исследование выполнялось в том числе и в целях развития неинвазивных, прижизненных методик, позволяющих изучать in vivo динамику процессов формирования патологических отклонений офтальмологической направленности на лабораторных животных.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Методы и образцы
Для выполнения экспериментов цыплята японского перепела инкубационно выводились из яиц, приобретенных в ООО “Генофонд” (Сергиев Посад). С момента вылупления из яиц цыплят разделили на две группы с разными условиями повседневного освещения: преимущественно с синим (450 нм) и желтым (500–700 нм) участками спектра. Источники освещения прошли необходимый контроль и спектрометрическую калибровку для обеспечения физиологического уровня освещенности ≈200 лк. Калибровку проводили с помощью спектрометра МК-350 компании Uptech (Taiwan). Суточный режим освещения задавали таймером на 9 ч (ночь) и 15 ч (день). Необходимый обогрев осуществляли инфракрасными обогревателями мощностью 50 Вт. Перед включением света разных длин волн всем птенцам давали провести сутки при стандартном освещении для адаптации к самостоятельному нахождению воды и пищи. Использовался стандартный корм для выращивания птиц ПК 5-41, разработанный специально для птенцов перепела. Содержание птиц и их вывод из эксперимента декапитацией выполнялся согласно “Правилам надлежащей лабораторной практики”, утвержденных Приказом Министерства Здравоохранения РФ от 1 апреля 2016 года N 199н.
Эксперименты по измерению анатомо-топографических структур глазного яблока выполнялись в условиях in vivo, in situ и in vitro. Исследовались глаза японского перепела в возрасте 10, 20, 30 и 65 дней развития. В измерениях in vivo применялась мягкая фиксация тела птицы и ее головы в руках экспериментатора. Веки фиксировались вручную и с применением векорасширителя. Для уменьшения чувствительности глаза использовалась инстилляционная анестезия 2%-ным раствором лидокаина. Для обследования переднего и заднего сегментов глаза перепела применялась оптическая когерентная томография (ОКТ) [7, 8]. С помощью аппаратов Topcon DRI OCT Triton и SPECTRALIS Heidelberg Engineering были получены изображения переднего и заднего отделов глаза перепела с микронным разрешением (рис. 1). Поскольку фиксация взгляда птицы затруднительна, проводились многократные записи (более 20) вблизи центральной оптической оси.
Рис. 1.
Оптическая когерентная спектроскопия глаза перепела в возрасте 65 сут: a – изображение переднего отдела глаза (Topcon DRI OCT Triton); б – изображение заднего отдела (SPECTRALIS Heidelberg Engineering); 1 – роговица, 2 – передняя камера глаза, 3 – хрусталик, 4 – сетчатка с ретинальным пигментным эпителием, 5 – сосудистый слой, 6 – склера.

Более полное исследование геометрических размеров структурных элементов глаза с точной юстировкой по центральной оси выполнялось с помощью ультразвуковых методов тех же глаз в условиях in situ и in vitro. Ультразвуковая микроскопия (УЗМ) традиционно используется в биологических [9], эмбриологических [10] и медицинских [11, 12] исследованиях. В данной работе для исследования структуры и геометрических размеров глаза перепела применялся импульсный акустический микроскоп, разработанный в ИБХФ РАН [13]. Микроскоп оснащен акустическим объективом с рабочей частотой 50–100 МГц, малой угловой апертурой 22° и фокусным расстоянием 13.5 мм. Перемещение акустической линзы осуществлялось прецизионными двигателями с шагом в 25 мкм. Основными традиционными режимами визуализации в медицинской практике являются режимы А, В и B/D-сканирование в виде сечений по глубине [1]. Режим динамической фокусировки – B/D-скан использовался для обеспечения высокого уровня контрастности акустических изображений по всей глубине продольного сечения. Эхо-импульсным методом измеряли продольные размеры структур глаза с погрешностью ±15 мкм. Измерения проводили со стороны роговицы при их естественном положении в глазных орбитах. В качестве иммерсии использовали ультразвуковой гель низкой вязкости и многокомпонентный физиологический раствор (Рингер-СОЛОФАРМ). Исследования проводили при комнатной температуре (23 ± 2) °C. Время проведения одного эксперимента составляло около 20 мин. С помощью сканирующей системы микроскопа были получены эхограммы сигналов (А‑скан) вдоль оптической оси глаза (рис. 2а). В процессе эксперимента измеряли время задержки эхо-импульсов t, отраженных от границ структурных элементов, а затем рассчитывали значения толщин (d) этих элементов: d = 0.5vt, где v – скорость звука в образце. Необходимо отметить, что ткани глаза являются сильно обводненными и величина скорости звука в них приближается к значению, характерному для воды – 1490 м/c. Однако значения скорости звука для роговицы, хрусталика и склеры несколько различаются, поскольку эти ткани имеют более плотную структуру [14]. В табл. 1 приведены значения скорости звука в этих тканях, использованные для определения толщины структурных элементов глаза в наших экспериментах.
Рис. 2.
Акустическая микроскопия глаза перепела в возрасте 65 сут в условиях in situ: а – B/D-скан; б – эхограмма импульсов, А-скан; 1 – роговица, 2 – передняя камера глаза, 3 – хрусталик, 4 – стекловидное тело, 5 – хориоретинальный комплекс, 6 – склера.
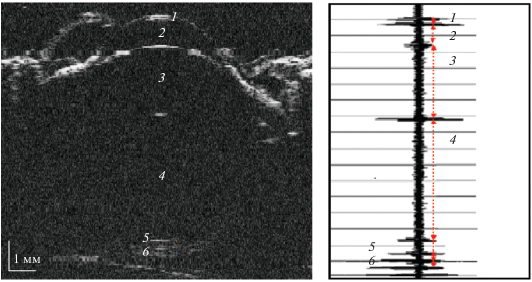
Таблица 1.
Скорость звука (м/c) в тканях глаза
| Ткань глаза | Скорость звука |
|---|---|
| Роговица | 1563 |
| Хрусталик | 1629 |
| Склера | 1639 |
| Стекловидное тело | 1520 |
Для получения большей достоверности при сравнительном анализе ультразвуковых данных птенцы перепела взвешивались и калибровались по весу ±10 г с точностью 1 г. Исследовались левый и правый глаз у трех птиц каждого возраста.
Измерения содержания мелатонина в тканях глаза выполняли на тандемном хромато-масс-спектрометре AB SCIEX QTRAP 5500 с использованием хроматографических колонок ACQUITY UPLC CSH C18 VanGuard Precolumn. Определение органических веществ в биологических системах с использованием масс-спектрометрии высокого разрешения имеет широкое применение в научной и клинической практике [15–18]. Прибор позволяет определять содержание мелатонина в одном-двух глазах перепела. Выделение образцов тканей глаза выполняли в определенное время суток – 13 ч 30 мин. Измеряли параметры четырех видов образцов: стекловидное тело, хориоретинальный комплекс, цилиарное тело вместе с радужкой, артериальная кровь. При получении образцов энуклеированные глаза разрезали по экватору, из задней камеры пинцетом вынимали стекловидное тело и далее – хориоретинальный комплекс; из сегмента глазного яблока вынимали цилиарное тело вместе с радужкой и хрусталиком. Пробоподготовка велась без доступа посторонней жидкости на сухой пластиковой чашке Петри и с удалением избытка влаги путем протаскивания образца по сухой пластиковой поверхности. Образцы весом от 15 мг помещали в заранее взвешенные микроцентрифужные пробирки Эппендорфа, взвешивали повторно и переносили в глубокую заморозку при температуре –80 °С. Время всей процедуры от момента декапитации птицы до замораживания образца составляло 5–7 мин. Непосредственно перед измерениями образцы размораживали, заливали фосфатным буфером, гомогенизировали в той же пробирке тефлоновым пестиком и центрифугировали.
Извлечение мелатонина проводили методом жидкостной экстракции. Для этого к 200 мкл супернатанта добавляли смесь из 10 мкл внутреннего стандарта, 200 мкл ацетона и 2000 мкл метил-трет-бутилового эфира. Смесь встряхивали в течение 2 мин, после чего замораживали 10 мин при –40 °C. Органический слой перемещали в стеклянную центрифужную пробирку и упаривали в токе азота досуха при 40 °C, а затем растворяли в 200 мкл метанол-водной смеси (1 : 1). Далее 10 мкл полученного раствора наносили на хроматографическую колонку. В эксперименте использовалась калибровочная рабочая кривая в пределах 25–5000 пг/мл. Конечные результаты выражались в пг/мг сырой массы ткани и пг/мл плазмы крови.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
С помощью оптической когерентной томографии определены значения толщины роговицы и размера передней камеры глаза перепела, характерные для особи в возрасте 65 сут развития при нормальном повседневном освещении (рис. 1). В переднем сегменте глазного яблока хорошо просматриваются размеры, форма и толщина роговицы, размеры передней камеры, радужка и передние отделы хрусталика; в заднем сегменте определяется сетчатка, сосудистая оболочка глаза и склера. Толщина роговицы составила 170 мкм, глубина передней камеры – 1250 мкм, толщина сетчатки – 300 мкм, сосудистой оболочки – 130 мкм. Данные цифры получены в условиях in vivo.
В табл. 2 приведены медианные экспериментальные значения для длины передне-задней оси, горизонтального диаметра глазного яблока, толщины роговицы, склеры и хрусталика, глубины передней камеры и передне-задний размер стекловидного тела для трех пар глаз перепелов различного возраста – 10, 20, 30 и 65 сут, измеренные in situ. Коэффициент сферичности определяли из отношения диаметра экватора глаза к осевой длине (передне-задняя ось). В табл. 2 также указаны значения (со звездочкой) для перепелов, развитие которых происходило при синем освещении. Ультразвуковые измерения показывают, что осевая длина (переднезадняя ось), размеры передней камеры, хрусталика и стекловидного тела, а также коэффициент сферичности несколько выше по сравнению со значениями для глаза при естественном освещении.
Таблица 2.
Результаты ультразвуковых биометрических измерений глаза японского перепела Сoturnix japonica в условиях in situ. Величина среднеквадратичного отклонения варьируется внутри погрешности измерения (±15 мкм)
| Возраст, сут | Вес, г | Осевая длина, мм | Коэффициент сферичности | Передняя камера, мм | Роговица, мм | Хрусталик, мм | Стекловидное тело, мм | Хориоретинальный комплекс, мм | Склера, мм |
|---|---|---|---|---|---|---|---|---|---|
| 10 | – | 5.85 | 0.71 | 0.60 | 0.14 | 1.85 | 3.05 | 0.30 | 0.14 |
| 20 | 75 | 6.45 | 0.74 | 0.58 | 0.14 | 2.01 | 3.55 | 0.33 | 0.13 |
| 20* | 69 | 7.50 | 0.75 | 0.63 | 0.14 | 2.15 | 4.32 | 0.35 | 0.125 |
| 30 | 127 | 7.20 | 0.73 | 0.61 | 0.16 | 2.05 | 3.97 | 0.34 | 0.14 |
| 65 | 181 | 8.15 | 0.78 | 0.85 | 0.15 | 2.52 | 4.37 | 0.44 | 0.16 |
Сравнительный анализ экспериментальных значений, полученных в условиях in situ ультразвуковым методом (рис. 2б) и in vivo с помощью ОКТ (рис. 1) на одной и той же птице в возрасте 65 сут, выявил некоторые различия. Существенно различаются данные по размеру передней камеры: ОКТ – 1250 мкм, УЗМ – 900 мкм, что может быть обусловлено частичным обезвоживанием передней камеры в результате выведения перепела из эксперимента.
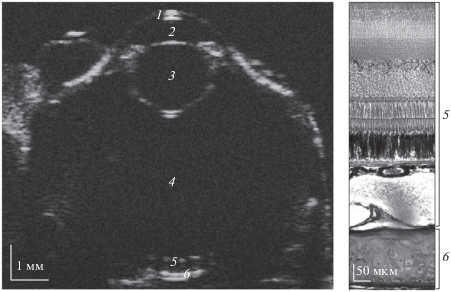
На рис. 3 представлено акустическое изображение (B/D-скан) глаза цыпленка перепела в возрасте 10 сут. В отличие от полученного in situ акустического изображения на рис. 2б, данное изображение получено in vitro (рис. 3а). На изображениях визуализируется роговица, передняя камера, хрусталик, стекловидное тело, ретинальный пигментный эпителий (РПЭ), сосудистая оболочка, склера. Для более ясной интерпретации акустического изображения на рис. 3б приведено полученное нами в более ранней работе [19] гистологическое изображение строения заднего сегмента глаза.
Рис. 3.
Акустическая микроскопия глаза перепела в возрасте 10 сут в условиях in vitro: а – B/D-скан, б – гистологическое изображение; обозначения те же, что и на рис. 2.
Уровень выработки мелатонина в организме перепела в 10 раз выше, чем у человека. В практике клинических лабораторий, специализирующихся на определении содержания мелатонина в крови, существует некая норма. В нашем случае лаборатория “АРХИМЕД”, в которой были выполнены исследования на лабораторных животных, использует следующие референсные значения для человека: 15.0–30.0 пг/мл утром, менее 4.9 пг/мл днем, 8.0–40.0 пг/мл вечером (с 22 до 24), 52.3–149.4 пг/мл ночью. У детей в возрасте 1–5 лет норма в 3–4 раза выше, у лиц пожилого возраста – ниже на 20% [20]. По нашим измерениям в глазах перепела более 85% мелатонина сконцентрировано непосредственно в сетчатке, причем у цыплят оно оказывается в 20 раз выше, чем у взрослых птиц. Результаты, полученные в ходе эксперимента, представлены в табл. 3.
Таблица 3.
Результаты измерения содержания мелатонина в тканях глаза и сыворотке крови японского перепела Coturnix japonica для двух возрастов в зависимости от освещения. Относительная ошибка измерения – не более 20%
| Образец | Содержание мелатонина, пг/мл | |
|---|---|---|
| “желтый” свет | “синий” свет | |
| 30 сут развития | ||
| Сетчатка | 31 447 | 24 780 |
| 8 мес развития | ||
| Сетчатка | 1797.3 (86%) | 1560.5 (88%) |
| РПЭ + сосудистая оболочка | 214.9 (11%) | 191.9 (11%) |
| Стекловидное тело | 69.1 (3%) | 19.6 (1%) |
| Всего в тканях глаза | 2081.3 (100%) | 1762 (100%) |
| Сыворотка крови | 774.6 | 722.8 |
Ретинальный мелатонин в детском глазу отвечает за развитие миопии. Известно, что у близоруких людей содержание мелатонина существенно выше, чем у людей с нормальными пропорциями глаз [3]. По результатам наших исследований условия “синего” повседневного освещения на начальном этапе развития незначительно снижают уровень мелатонина как в тканях глаза, так и в сыворотке крови на 7–15%, что, строго говоря, лежит в пределах погрешности измерений и свидетельствует лишь о тенденции.
Еще одним дополнительным звеном, определяющим светозависимое формирование оптической системы глаза, является толщина кровеносной сосудистой оболочки, подстилающей сетчатку и РПЭ и осуществляющей питание глаза. Толщина этой оболочки влияет на аккомодацию глаза и настройку резкости изображения. По нашим данным, полученным при помощи акустической микроскопии, толщина этого слоя увеличивается с возрастом в среднем со 150 (10-е сутки) до 200 мкм (65-е сутки). Кроме того, полученные данные говорят о некотором незначительном утолщении сосудистой оболочки в процессе роста птиц при “синем” освещении (7%). Это подтверждается ранее полученными нами данными гистологического исследования, где было показано, что у старых содержащихся на коротковолновом (“синем”) освещении птиц (52 недели) общая толщина сосудистой оболочки оказывается больше на 30% по сравнению с нормой [19].
ЗАКЛЮЧЕНИЕ
Показано, что методы акустической микроскопии (ультразвуковой биометрии) и оптической когерентной томографии могут использоваться для исследований in vivо, in situ и in vitro глаза на лабораторной животной модели перепела. Измерения in vivo являются наиболее актуальными и позволяют выполнять многократное наблюдение в течение всего онтогенеза птицы и наблюдать изменения структуры глаза с возрастом и при смене спектрального состава повседневного освещения.
Экспериментальные исследования, выполненные в рамках настоящей работы, показывают, что при нормальном развитии в первой трети жизни глаза перепелов растут пропорционально (коэффициент сферичности) и линейно. Полученные нами данные о соотношении размеров основных оптических структур глаза перепела могут использоваться в качестве сравнительной шкалы при дальнейших исследованиях с помощью этой животной модели, в частности при экспериментальном воспроизведении миопических рефракционных нарушений. В дальнейшем предполагается исследовать влияние спектрального состава повседневного освещения на формирование глаза в раннем постнатальном периоде в рамках задач по моделированию детской миопии.
Коллектив выражает благодарность сотрудникам аналитической лаборатории “АРХИМЕД” (зав. лаб. А.Н. Нижник) за помощь в определении концентрации мелатонина.
Список литературы
Rucker F. // Exp. Eye Res. 2019. V. 184. P. 172.
Nickla D.L. // Exp. Eye Res. 2013. V. 114. P. 25.
Foulds W., Bharathi V., Luu D. // Invest. Ophthalmol. Vis. Sci. 2013. V. 54. P. 8004.
Ostrin L.A. // Clin. Exp. Optom. 2019. V. 102. Issue 2. P. 99.
Kearney S., O’Donoghue L., Pourshahidi L.K. et al. // Ophthal. Physiol. Opt. 2017. V. 37. Issue 5. P. 557.
Tosini G., Iuvone P. The Retina and Circadian Rhythms. Springer, 2014.
Аветисов С.Э., Кац М.В. // Universum: медицина и фармакология. 2017. № 4(38). С. 15.
Pecora R.A., Watanabe S.S., Brito G.M. et al. // Vet Ophthalmol. 2020. V. 23. № 2. P. 358.
Lemons R.A., Quate C.F. // Science. 1975. V. 188. P. 905.
Foster F.S., Zhang M.Y., Duckett A.S. et al. // Investig. Ophthalm. Visual Science. 2003. V. 44. P. 2361.
Nakamura Y., Kusano K.F., Nakamura K. et al. // World J. Cardiovascular Diseases. 2013. V. 3. Issue 1. P. 22.
Pavlin C.J., Easterbrook M., Hurwitz J.J. et al. // Amer. J. Ophthalmol. 1993. V. 116. P. 854.
Закутайлов К.В., Левин В.М., Петронюк Ю.С. // Заводская лаборатория. Диагностика материалов. 2009. Т. 75. № 8. С. 28.
Хилл К., Тер Хаар Г., Бэмбер Дж. Ультразвук в медицине / Под ред. Сапожникова О.А. и др. М.: Физмалит, 2008.
Яковлева М.А., Радченко А.Ш., Костюков А.А. и др. // Хим. физика. 2020. Т. 39. № 6. С. 18.
Васильева А.Д., Юрина Л.В., Леонова В.Б. и др. // Хим. физика. 2020. Т. 39. № 6. С. 24.
Кононихин А.С., Захарова Н.В., Юсупов А.Э. и др. // Хим. физика. 2019. Т. 38. № 12. С. 59.
Иванов Д.Г., Пеков С.И., Бочаров К.В. и др. // Хим. физика. 2020. Т. 39. № 6. С. 41.
Сигаева А.О., Сережникова Н.Б., Погодина Л.С. и др. // Сенсорные системы. 2015. Т. 29. № 4. С. 354.
Анисимов В.Н. Мелатонин как геропротектор и антиканцероген. СПб.: ЭлПринт, 2014.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


