Химическая физика, 2022, T. 41, № 2, стр. 20-26
Сравнительный анализ физико-химических характеристик групп флуорофоров липофусциновых гранул из клеток ретинального пигментного эпителия кадаверных глаз человека в норме и при патологии
М. А. Яковлева 1, *, А. Ш. Радченко 1, А. А. Костюков 1, В. В. Чаговец 2, А. С. Кононихин 1, 3, М. Х. Хубецова 4, С. А. Борзенок 4, В. А. Кузьмин 1, Е. Н. Николаев 3, Т. Б. Фельдман 1, 5, М. А. Островский 1, 5
1 Институт биохимической физики им. Н.М. Эмануэля Российской Академии наук
Москва, Россия
2 Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии
им. акад. В.И. Кулакова Министерства здравоохранения Российской Федерации
Москва, Россия
3 Сколковский институт науки и технологий
Москва, Россия
4 Межотраслевой научно-технический комплекс “Микрохирургия глаза” им. акад. С.Н. Фёдорова
Министерства здравоохранения Российской Федерации
Москва, Россия
5 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: lina.invers@gmail.com
Поступила в редакцию 27.07.2021
После доработки 13.08.2021
Принята к публикации 20.08.2021
- EDN: MWIEGP
- DOI: 10.31857/S0207401X22020169
Аннотация
Проведено сравнительное исследование отдельных групп бисретиноидов и продуктов их окисления и деградации в хлороформных экстрактах из клеток ретинального пигментного эпителия кадаверных глаз человека без признаков патологии (“норма”) и в случае визуализированной возрастной макулярной дегенерации. Флуоресцентный анализ, высокоэффективная жидкостная хромато-масс-спектрометрия показали, что при возрастной макулярной дегенерации наблюдается повышенное содержание продуктов окисления и деградации бисретиноидов по сравнению с “нормой”. Полученные результаты позволяют сделать вывод о том, что перечисленные методы могут быть использованы в доклинической диагностике дегенеративных заболеваний сетчатки и ретинального пигментного эпителия глаза человека.
ВВЕДЕНИЕ
Дегенеративные заболевания сетчатки и ретинального пигментного эпителия (РПЭ) глаза человека являются одной из основных причин полной или частичной потери зрения. Наиболее распространенным и социально-значимым заболеванием является возрастная макулярная дегенерация (ВМД) [1, 2]. В механизмах старения и дегенерации сетчатки и РПЭ важнейшая роль принадлежит так называемому “пигменту старости” – липофусциновым гранулам (ЛГ) [3], образующимся в клетках РПЭ в результате неполной лизосомальной деградации обломков фоторецепторов [4]. Предполагается, что развитие ВМД может быть связано с прогрессирующим накоплением ЛГ. Повышенное содержание ЛГ в клетках РПЭ может считаться одним из маркеров риска развития ВМД.
Липофусциновые гранулы содержат более двух десятков флуорофоров, которые являются, в основном, производными полностью-транс-ретиналя (бисретиноиды и продукты их окисления) [5]. Наиболее изученным из них является бисретинилиденэтаноламин (А2Е) [6]. При поглощении видимого света они способны генерировать активные формы кислорода (АФК), что определяет их фототоксичность [7]. Также при действии света и в присутствии кислорода в ЛГ может происходить фотоокисление бисретиноидных флуорофоров с образованием цитотоксичных альдегидов и кетонов [5].
Одним из перспективных методов диагностики дегенеративных заболеваний сетчатки и РПЭ, в том числе и патологии, является неинвазивный метод аутофлуоресценции (АФ) глазного дна. Следует однако отметить, что метод АФ позволяет диагностировать патологию с уже проявившимися клиническими признаками. Поэтому в настоящее время для проведения доклинической диагностики стараются усовершенствовать метод АФ для извлечения дополнительной информации из суммарной аутофлуоресценции. Перспективным подходом для этого является измерение времен жизни флуоресценции (ВЖФ) при регистрации ее на определенных длинах волн – метод FLIM (Fluorescence Lifetime Imaging Microscopy) [8, 9]. Одной из главных задач при внедрении в офтальмологическую практику метода FLIM является определение состава и флуоресцентных характеристик флуорофоров ЛГ при ВМД (далее – “патологии”) по сравнению с “нормой”.
Ранее нами было показано [10, 11], что при ВМД наблюдается повышенное содержание продуктов фотоокисления и фотодеградации бисретиноидов по сравнению с “нормой”. Кроме того, получены данные анализа ВЖФ [12–14], которые показали, что численные значения ВЖФ в обоих случаях заметно не отличались, однако при “патологии” увеличивался вклад более долгоживущих окисленных бисретиноидов по сравнению с “нормой”.
Таким образом, учитывая то, что флуоресцентные характеристики окисленных и неокисленных форм флуорофоров ЛГ имеют существенные различия, а их относительное содержание заметно меняется при “патологии” по сравнению с “нормой” [10, 11], дальнейшее детальное изучение этого феномена может позволить использовать эти данные для создания доклинической диагностики ВМД и других дегенеративных заболеваний глаза.
В данной работе был проведен сравнительный анализ состава неокисленных и окисленных бисретиноидов в отдельных фракциях хлороформного экстракта, полученного из клеток РПЭ кадаверных глаз человека без признаков патологии и с визуализируемой ВМД. Для определения состава флуорофоров применен тандем методов масс-спектрометрии и ВЭЖХ-анализа [15–17]. Для анализа спектральных характеристик были использованы методы флуоресцентного анализа и регистрации кинетики затухания флуоресценции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы. В работе использованы реактивы и растворители производства “Sigma-Aldrich”, “Fluka” и “Компонент-реактив”.
Материал. Кадаверные глаза человека получены из Глазного тканевого банка МНТК “Микрохирургия глаза” им. акад. С.Н. Фёдорова на основании договора о научном сотрудничестве между ИБХФ РАН и МНТК “Микрохирургия глаза” им. акад. С.Н. Фёдорова [10]: два глаза от донора 74 лет без клинических признаков патологии РПЭ (“норма”) и два глаза от донора 75 лет с визуализированной патологией ВМД (“патология”).
Получение из клеток РПЭ хлороформных экстрактов, содержащих бисретиноиды и их производные. РПЭ извлекали из кадаверных глаз согласно методике, описанной в работе [10]. Ретиноидные флуорофоры ЛГ экстрагировали из клеток РПЭ по методу Фолча смесью хлороформ–метанол (2 : 1) [18].
ВЭЖХ-анализ. Хроматографическое разделение бисретиноидов и продуктов их фотоокисления и фотодеградации в хлороформных экстрактах РПЭ проводили на хроматографе фирмы “Knauer” (Германия) с колонкой “Диасфер 110-С18” (4 × 250 мм, размер сорбента – 5 мкм) АО “БиоХимМак СТ” (Россия), как описано ранее в работе [13]. В качестве стандарта использовали бисретиноид А2Е, синтезированный согласно методу, описанному в работе [19].
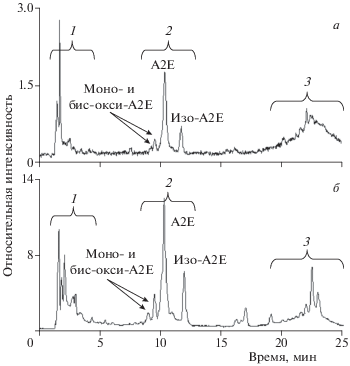
В результате ВЭЖХ-анализа хлороформных экстрактов были получены фракции, содержащие отдельные группы ретиноидов. Фракция 1 получена на временах удерживания 2–5 мин, фракция 2 – 7–16 мин, фракция 3 – 18–25 мин (см. ниже рис. 1).
Рис. 1.
ВЭЖХ-анализ хлороформных экстрактов из РПЭ двух глаз донора в возрасте 74 лет без признаков патологии (а) и двух глаз донора в возрасте 75 лет с визуализируемой ВМД (б). Группы пиков: 1 – продукты фотоокисления и фотодеградации бисретиноидов [10], 2 – А2Е, изо-А2Е, моно- и бис-окси-А2Е [20], 3 – продукты модификации полностью-транс-ретиналя и их слабоокисленные продукты [5, 21, 22]. Детектирование – по поглощению на длине волны 430 нм.
Измерение спектров флуоресценции. Спектры флуоресценции регистрировали на спектрофлуориметре RF-5301PC (“Shimadzu”, Япония).
Регистрация кинетики затухания флуоресценции. Измерения времени жизни флуоресценции (ВЖФ) хлороформного экстракта РПЭ выполняли методом подсчета коррелированных по времени фотонов с использованием спектрофлуориметра FluoTime 300 (“PicoQuant”, Германия) в Центре коллективного пользования “Новые материалы и технологии” ИБХФ РАН. Возбуждение флуоресценции образца проводили с использованием диодного лазера фирмы “PicoQuant” (Германия) LDH-P-C-485 (485 нм, длительность импульса – 107 пс). Сигнал флуоресценции регистрировали при длине волны 556 нм. Кинетические кривые затухания флуоресценции обрабатывали в рамках трехэкспоненциальной модели. ВЖФ и вклад отдельных групп флуорофоров в детектируемые кривые затухания флуоресценции рассчитывали по следующей формуле с учетом собственной функции прибора (instrument response function, IRF):
Для проведения эксперимента образцы предварительно упаривали с использованием химической вакуумной системы MZ 2C NT+AK+M+D (“Vacuubrand”, Германия), а потом растворяли в 1 мл хлороформа (D485 = 0.08–0.2). Анализ данных проведен при помощи программного обеспечения FluoFit (“PicoQuant”, Германия).
ВЭЖХ с масс-спектрометрической детекцией. Анализ хлороформных экстрактов из РПЭ был выполнен методом ВЭЖХ с масс-спектрометрической детекцией (ВЭЖХ-МС) на хроматографе Dionex UltiMate 3000 (“Thermo Fisher Scientific”, Германия) и масс-спектрометре MaXis impact (“Bruker”, Германия). Разделение проводили методом хроматографии гидрофильного взаимодействия (HILIC, hydrophilic interaction chromatography) на колонке фирмы “Waters” (США) SpherisorbSilica (1 × 250 мм, размер сорбента – 5 мкм) со следующим градиентом: 0–0.5 мин – 94% А, 6% В; 0.5–60.5 мин – 77% А, 23% В; 61–64 мин – 94% А, 6% В, где А – ацетонитрил, В – ацетат аммония, 5 ммоль/л. Скорость потока составляла 50 мкл/мин. Масс-спектрометрический анализ выполняли с ионизацией электрораспылением, масс-спектры регистрировали в режиме положительных ионов в диапазоне m/z от 400 до 1000. Параметры источника ионов: напряжение на игле составляло 4200 В, распыляющий газ подавали под давлением 0.7 бар, поток осушающего газа – 6 л/мин при температуре 200 °С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Сравнительный ВЭЖХ-анализ ретиноидов из клеток РПЭ глаз доноров без признаков патологии и с визуализируемой ВМД
На рис. 1 представлены результаты ВЭЖХ-анализа хлороформных экстрактов из РПЭ двух донорских глаз без признаков патологии (а) и двух донорских глаз с визуализируемой ВМД (б). Группа пиков 1 на хроматограммах соответствует продуктам фотоокисления и фотодеградации бисретиноидов [10]. Группа пиков 2 соответствует А2Е, изо-А2Е, а также продуктам их моно- и бис-окисления [20]. Группа пиков 3 (согласно литературным данным) может соответствовать таким бисретиноидам как: A2-DHP-PE, A2-DHP-E [5], RAL-dimer, RAL-dimer-E, A2-GPE и продуктам их слабого окисления [21], а также высокомолекулярным продуктам полимеризации бисретиноидов [22]. Сравнительный анализ показывает, что в случае ВМД в группе 1 наблюдаются пики, соответствующие разнообразным продуктам фотоокисления и фотодеградации бисретиноидов. Эти результаты хорошо согласуются с полученными ранее [10, 11].
Сравнительный флуоресцентный анализ хлороформных экстрактов из клеток РПЭ глаз доноров без признаков патологии и с визуализируемой ВМД
На рис. 2 представлены спектры флуоресценции исследуемых образцов и отдельных фракций этих хлороформных экстрактов. Отдельные фракции были получены в результате ВЭЖХ-анализа и соответствуют номерам обозначенных групп пиков на рис. 1.
Рис. 2.
Спектры флуоресценции хлороформных экстрактов из РПЭ донорских глаз и отдельных фракций этих хлороформных экстрактов (фракции 1–3), полученных в результате ВЭЖХ-анализа (рис. 1). Флуоресценцию возбуждали светом с длиной волны 488 нм. “Норма” – черная линия спектра; “патология” – красная линия спектра. Фракция 1 – продукты фотоокисления и фотодеградации бисретиноидов [10]; фракция 2 – А2Е, изо-А2Е, моно- и бис-окси-А2Е [20]; фракция 3 – продукты модификации полностью-транс-ретиналя и их слабоокисленные продукты [5, 21, 22]. Спектры хлороформных экстрактов нормированы по длине волны 592 нм.
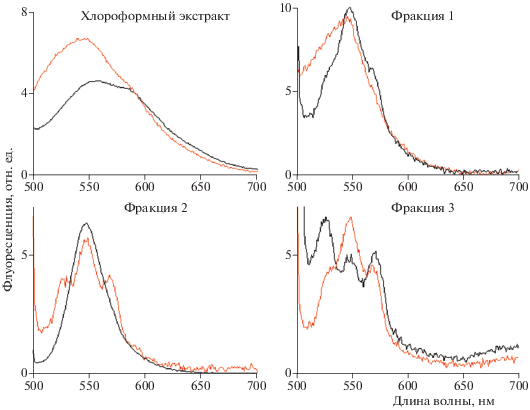
Из рис. 2 видно, что в случае хлороформного экстракта из РПЭ донорских глаз с признаками “патологии” интенсивность флуоресценции в коротковолновой части спектра (500–550 нм) заметно больше по сравнению с “нормой”. В ранее опубликованных работах [10, 11, 13] мы предположили, что такое увеличение интенсивности флуоресценции в коротковолновой части спектра происходит за счет повышенного содержания продуктов фотоокисления и фотодеградации бисретиноидов. В настоящей работе для проверки этого предположения были получены отдельные фракции хлороформных экстрактов и зарегистрированы их спектры флуоресценции (рис. 2, фракции 1–3). Из полученных данных видно, что основной вклад в увеличение интенсивности флуоресценции в коротковолновой части спектра образца из РПЭ донорских глаз с признаками ВМД происходит за счет повышенного содержания продуктов фотоокисления и фотодеградации бисретиноидов, присутствующих во фракции 1 (рис. 1, группа пиков 1).
Сравнительный анализ кривых затухания флуоресценции отдельных фракций хлороформных экстрактов из клеток РПЭ глаз доноров без признаков патологии и с визуализируемой ВМД
Для каждой полученной из хлороформного экстракта фракции (рис. 1 и 2) была зарегистрирована кинетика затухания флуоресценции на длине волны 556 нм. В рамках трехэкспоненциальной модели рассчитаны времена жизни флуоресценции и вклад отдельных групп флуорофоров (фракции 1–3) в детектируемые кривые (табл. 1).
Таблица 1.
Показатели времени жизни флуоресценции отдельных фракций хлороформных экстрактов из РПЭ глаз доноров без признаков патологии (“норма”) и с визуализируемой ВМД (“патология”); возбуждение светом с длиной волны 488 нм, детектирование – при длине волны 556 нм
| Номер фракции* | τ1, нс | А1, % | τ2, нс | А2, % | τ3, нс | А3, % | |
|---|---|---|---|---|---|---|---|
| Фракция 1 | норма | – | – | 3.2 | 67 | 7.1 | 33 |
| патология | – | – | 3.4 | 53 | 7.6 | 47 | |
| Фракция 2 | норма | 0.11 | 33 | 3.7 | 62 | 6.9 | 5 |
| патология | 0.1 | 20 | 3.0 | 55 | 6.0 | 25 | |
| Фракция 3 | норма | 0.3 | 45 | 2.7 | 45 | 6.4 | 10 |
| патология | 0.2 | 35 | 2.9 | 49 | 6.8 | 16 | |
* Номера фракций соответствуют номерам групп пиков на хроматограммах, представленных на рис. 1.
Как показано выше, флуоресценция хлороформного экстракта из РПЭ обусловлена в основном флуорофорами ЛГ. В настоящее время определено более 20 видов флуорофоров, которые являются производными полностью-транс-ретиналя. Поэтому использование трехэкспоненциальной модели дает усредненные значения при расчетах характерных времен жизни флуоресценции. В связи с этим, согласно полученным результатам (табл. 1), можно считать, что значения τ1, τ2 и τ3 для разных образцов приблизительно одинаковы и в среднем равны 0.18, 3.2 и 6.8 соответственно. Полученные величины времен хорошо согласуются с нашими предыдущими исследованиями [12, 13], а также литературными данными [23].
Можно предположить, что самые короткие времена жизни флуоресценции (τ1) соответствуют неокисленным ретиноидам из фракций 2 и 3. Во фракции 1, скорее всего, они отсутствуют, на что указывает отсутствие данной временной компоненты при детектировании флуоресценции на длине волны 556 нм. Другими словами, фракция 1 содержит практически только продукты фотоокисления и фотодеградации ретиноидов [10].
Природу соединений, характеризующихся временем τ2, в данном эксперименте было невозможно определить. Казалось бы, из данных хроматографического анализа основными продуктами должны быть А2Е и его изомерные формы. Однако, согласно нашим исследованиям [10], вклад этого бисретиноида в суммарную флуоресценцию при ее возбуждении светом с длиной волны 488 нм минимален. В то же время по данным флуоресцентного анализа вклад второй компоненты (τ2) является существенным. Можно предположить, что этими соединениями могут быть моно- и/или бис-окси-А2Е (рис. 1).
Самая долгоживущая компонента (τ3), скорее всего, соответствует продуктам фотоокисления и фотодеградации различных ретиноидов (фракция 1). Наличие этой компоненты во фракциях 2 и 3 может быть объяснено вкладом окисленных форм А2Е, а также слабоокисленных продуктов модификации полностью-транс-ретиналя [21, 22, 14 ].
Ранее нами [11, 14] было предложено определять методом FLIM [8, 9] наличие “патологии” (ВМД) не по абсолютным значениям характерных времен жизни флуоресценции, а по вкладу отдельных компонент, а именно долгоживущей компоненты τ3, в кинетику затухания флуоресценции.
Результаты данного исследования подтвердили наше предположение, что при “патологии” содержание продуктов фотоокисления и фотодеградации ретиноидов выше по сравнению с “нормой”. Анализ кривых затухания флуоресценции показал, что вклад (А3), самой долгоживущей компоненты (τ3), которая соответствует этим продуктам (фракция 1), в случае “патологии” (ВМД) увеличивается на 14% по сравнению с “нормой”. Следует отметить, что аналогичная тенденция наблюдается и для фракций 2 и 3. Таким образом, показано, что продукты фотоокисления и фотодеградации бисретиноидов имеют наибольшие времена жизни флуоресценции.
Сравнительный масс-спектрометрический анализ отдельных фракций хлороформного экстракта из клеток РПЭ глаз доноров без признаков патологии и с визуализируемой ВМД
На рис. 3 представлены масс-спектры положительных ионов, суммированные по всем временам удерживания, для каждой отдельной фракции (рис. 1 и 2). Как видно из рис. 3, наиболее заметная разница между масс-спектрами образцов “нормы” и “патологии” наблюдается в случае фракции 1. В случае “патологии” характерен больший набор интенсивных пиков (10–100% от максимального значения интенсивности) по сравнению с “нормой”. Следует отметить, что результаты масс-спектрального анализа хорошо согласуются с хроматографическими данными и флуоресцентной детекцией (рис. 1 и 2). Все три вида анализа отчетливо указывают на увеличение количественного и изменение качественного содержания продуктов окисления и деградации бисретиноидов в случае “патологии”.
Рис. 3.
Суммарные масс-спектры положительных ионов, полученные в результате анализа хлороформных экстрактов фракций 1–3. Черные линии масс-спектров – “норма”; красные линии масс-спектров – “патология”.
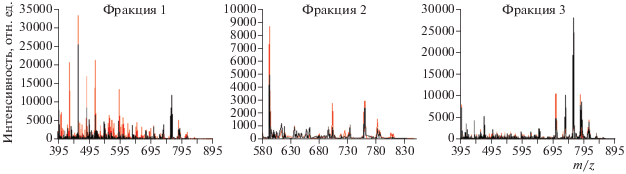
Значения m/z наиболее интенсивных пиков при масс-спектральном анализе фракций хлороформных экстрактов представлены в табл. 2. Для фракции 1 большинство масс находится в диапазоне m/z = 400–500. Согласно литературным данным, детектируемые вещества можно отнести к продуктам окислительной деградации бисретиноидов [23]. В масс-спектрах фракции 2 детектируется основной бисретиноид А2Е (m/z = 592), а также продукты его окисления (592 + n × 16) с m/z = 608, 624, 640, 656 [10, 20 ]. Профили масс-спектров фракции 3 для “нормы” и “патологии” близки (рис. 3, фракция 3), что хорошо согласуется с данными хроматографии и флуоресцентной детекции (рис. 1 и 2). Для фракции 3 характерны большие по значению массы (m/z > 700), которые могут соответствовать полимерным формам полностью-транс-ретиналя, а также димерам и тримерам бисретиноидов [22].
Таблица 2.
Значения m/z наиболее интенсивных пиков* при масс-спектральном анализе фракций хлороформных экстрактов РПЭ кадаверных глаз без признаков патологии (“норма”) и с визуализируемой ВМД (“патология”)
| Фракция 1** | Фракция 2** | Фракция 3** | |||
|---|---|---|---|---|---|
| норма | патология | норма | патология | норма | патология |
| 400.3 | 400.3 | 592.5 | 592.4 | – | 413.2 |
| 426.4 | 426.4 | 608.4 | 608.3 | 471.1 | 471.1 |
| – | 428.4 | 624.5 | 624.5 | – | 473.1 |
| 459.5 | 459.5 | 640.6 | 640.6 | 703.6 | 703.6 |
| – | 460.5 | 656.2 | 656.2 | 706.5 | 704.5 |
| 487.5 | 487.5 | 703.5 | 703.6 | 732.6 | – |
| 496.3 | – | 760.5 | 760.5 | 734.6 | 734.5 |
| – | 512.4 | 783.5 | 783.5 | 758.6 | 758.6 |
| 515.5 | 515.5 | – | – | 760.5 | 760.6 |
| – | 561.4 | – | – | 762.6 | 762.6 |
| – | 576.4 | – | – | 782.6 | 782.6 |
| – | 605.4 | – | – | – | 784.5 |
| – | 693.5 | – | – | 786.6 | 786.6 |
| 704.6 | 703.6 | – | – | 788.6 | 788.6 |
| 758.6 | – | – | – | – | 806.5 |
| 760.6 | 760.6 | – | – | – | 810.6 |
| – | 782.6 | – | – | – | – |
| 786.6 | 786.6 | – | – | – | – |
Таким образом, масс-спектрометрический анализ показал, что основное отличие “нормы” от “патологии” в качественном и количественном содержании бисретиноидов и продуктов их окисления наблюдается во фракции 1. При “патологии” содержание продуктов со значениями m/z < 600 заметно больше по сравнению с “нормой”. С учетом полученных ранее результатов [10], можно предположить, что в основном эта фракция содержит продукты окислительной деградации А2Е и других бисретиноидов, и что она является наиболее перспективной для использования в качестве диагностического признака дегенеративного заболевания сетчатки глаза.
ЗАКЛЮЧЕНИЕ
Ранее нами было показано, что при наличии признаков ВМД спектры флуоресценции как суспензии РПЭ, так и хлороформных экстрактов ЛГ из клеток РПЭ, характеризуются более интенсивной флуоресценцией в коротковолновой части спектра по сравнению с “нормой” [10, 11]. При этом ВЭЖХ-анализ показал, что в случае “патологии” наблюдаются большее разнообразие и увеличенное относительное содержание продуктов окисления и деградации бисретиноидов [10, 11]. Кроме этого, при сравнительном анализе ВЖФ хлороформных экстрактов установлено, что значения характеристических времен для “нормы” и “патологии” практически не отличаются, однако вклады долгоживущих компонент (τ3) увеличиваются в случае “патологии” [11, 13]. На основании полученных данных сделано предположение, что при ВМД относительное содержание продуктов окисления и деградации бисретиноидов в ЛГ из клеток РПЭ выше по сравнению с “нормой”.
В настоящей работе было проведено сравнительное исследование отдельных групп бисретиноидов и продуктов их окисления и деградации для “нормы” и “патологии”. Флуоресцентный анализ, ВЭЖХ, методы измерения ВЖФ и масс-спектрометрии подтвердили ранее сделанные предположения о том, что при ВМД наблюдается повышенное содержание продуктов окисления и деградации бисретиноидов по сравнению с “нормой”. Полученные результаты позволяют заключить, что этот феномен и определяет различие в флуоресцентных свойствах ЛГ в “норме” и при “патологии”, и что он может лежать в основе разработки спектрального анализа картины АФ глазного дна для доклинической диагностики дегенеративных заболеваний сетчатки и РПЭ глаза человека.
Исследование выполнено при финансовой поддержке грантом Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2020-773). В работе использовали оборудование и ресурсы ЦКП ИБХФ РАН “Новые материалы и технологии”.
Список литературы
Sparrow J.R., Boulton M.E. // Exp. Eye Res. 2005. V. 80. P. 595.
Holz F.G., Gross-Jendroska M., Eckstein F. et al. // Ger. J. Ophthalmol. 1995. V. 4. № 6. P. 336.
Kennedy C., Rakoczy P., Constable I. // Eye. 1995. V. 9. P. 763.
Holz F.G., Schutt F., Kopotz J. et al. // Investtig. Ophthalmol. Vis. Sci. 1999. V. 40. P. 737.
Sparrow J.R., Gregory-Roberts E., Yamamoto K. et al. // Prog. Retin. Eye Res. 2012. V. 31. № 2. P. 121.
Eldred G.E., Lasky M.R. // Nature. 1993. V. 361. P. 724.
Boulton M., Dontsov A., Jarvis-Evans J. et al. // J. Photochem. Photobiol. B, Biol. 1993. V. 19. P. 201.
Schweitzer D., Schenke S., Hammer M. et al. // Microsc. Res. Tech. 2007. V. 70. № 5. P. 410.
Schweitzer D., Gaillard E.R., Dillon J. et al. // Investtig. Ophthalmol. Vis. Sci. 2012. V. 53. № 7. P. 3376.
Feldman T.B., Yakovleva M.A., Arbukhanova P.M. et al. // Anal. Bioanal. Chem. 2015. V. 407. № 4. P. 1075.
Feldman T.B., Yakovleva M.A., Larichev A.V. et al. // Eye. 2018. V. 32. № 9. P. 1440.
Яковлева М.А., Фельдман Т.Б., Арбуханова П.М. и др. // ДАН. 2017. Т. 472. № 2. С. 226.
Yakovleva M.A., Radchenko A.Sh., Feldman T.B. et al. // Photochem. Photobiol. Sci. 2020. V. 19. P. 920.
Яковлева М.А., Радченко А.Ш., Костюков А.А. и др. // Хим. физика. 2020. Т. 39. № 6. С. 18.
Васильева А.Д., Юрина Л.В., Леонова В.Б. и др. // Хим. физика. 2020. Т. 39. № 6. С. 24.
Кононихин А.С., Захарова Н.В., Юсупов А.Э. и др. // Хим. физика. 2019. Т. 38. № 12. С. 59.
Иванов Д.Г., Пеков С.И., Бочаров К.В. и др. // Хим. физика. 2020. Т. 39. № 6. С. 41.
Folch J., Lees M., Stanley G.H.S. // J. Biol. Chem. 1957. V. 226. P. 497.
Parish C.A., Hashimoto M., Nakanishi K. et al. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. № 25. P. 14609.
Яковлева М.А., Сакина Н.Л., Кононихин А.С. и др. // ДАН. 2006. Т. 409. № 3. С. 411.
Kim S.R., Jang Y.P., Sparrow J.R. // Vision Res. 2010. V. 50. P. 729.
Murdaugh L.S., Avalle L.B., Mandal S. et al. // J. Mass Spectrom. 2010. V. 45. P. 1139.
Wu Y., Yanase E., Feng X. et al. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 16. P. 7275.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика


