Химическая физика, 2022, T. 41, № 6, стр. 7-14
Окислительный крекинг пропана в проточном лабораторном реакторе
А. С. Паланкоева 1, 2, *, А. А. Беляев 1, В. С. Арутюнов 1, 2, 3
1 Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Российской академии наук
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
3 Институт проблем химической физики Российской академии наук
Черноголовка, Россия
* E-mail: anitadmitruk@gmail.com
Поступила в редакцию 06.12.2021
После доработки 17.01.2022
Принята к публикации 20.01.2022
- EDN: TYLEHV
- DOI: 10.31857/S0207401X22060097
Аннотация
В работе представлены результаты экспериментов по окислительному крекингу пропана при давлении 1–2 атм и умеренных температурах (Т ≤ 1000 К) в реакторе лабораторного масштаба. В качестве газов-разбавителей использовали азот и метан. Проведен анализ кинетических моделей для описания исследуемого процесса. Показана необходимость учета гетерогенных реакций на поверхности реактора. Введение в кинетическую модель дополнительных стадий, учитывающих гетерогенные реакции на поверхности реактора, позволяет получить практически количественное согласие расчетов с экспериментальными результатами.
ВВЕДЕНИЕ
Растущий интерес к газохимическим процессам переработки природного газа и его отдельных компонентов стимулирует разработку более надежных кинетических моделей для описания этих процессов, протекающих в области умеренных температур (Т ≤ 1000 К). Пока число моделей, более менее достоверно описывающих окисление ближайших гомологов метана (в том числе пропана) в области умеренных температур, невелико. Многие представленные в литературе модели, содержащие в своем составе блок реакций окисления пропана, создавались для экспериментальных условий, существенно отличающихся от исследуемой в данной работе области. С целью анализа применимости наиболее популярных литературных моделей для описания процессов окисления и крекинга пропана в области умеренных температур в работе были проведены экспериментальные исследования окислительного крекинга (оксикрекинга) пропана в проточном лабораторном реакторе и их кинетическое моделирование на основе наиболее современных литературных механизмов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты по окислительному крекингу пропана проводили в лабораторном кварцевом реакторе проточного типа в диапазонах температур 773–1023 K и давлений 1–2 атм. Начальное соотношение пропан/кислород было в диапазоне ~1–3. Длина реактора составляла 350 мм, внутренний диаметр – 14 мм. Отношение площади внутренней поверхности реактора к его объему в рабочей части с учетом поверхности карманов для термопар составляло 5.4 см–1. Время пребывания газовой смеси в реакторе было постоянным и составляло (2.02 ± 0.05) с. Реактор нагревался тремя независимыми электронагревателями, что позволяло поддерживать постоянный профиль температуры в высокотемпературной зоне реактора, длина которой составляла 200 мм. Используемая лабораторная установка более подробно описана в работах [1–5], продолжением которых является данная работа.
В экспериментах использовали следующие газы: кислород повышенной чистоты (99.7%), азот особой чистоты первого сорта (99.999%), гелий марки “А” (99.995%), пропан чистый (99.99%). В качестве газовой среды использовали азот и метан. Анализ газовых смесей на входе и выходе реактора осуществляли с помощью газового хроматографа марки “Кристалл 5000” производства компании Хроматек (Россия), оснащенного тремя детекторами: одним пламенно-ионизационным (ПИД) и двумя детекторами по теплопроводности (ДТП). На ДТП 1 определяли наличие Н2 (газ-носитель – аргон), на ДТП 2 – наличие СО2, О2, N2 и СО (газ-носитель – гелий), наличие углеводородов определяли на ПИД (газ-носитель – гелий).
КИНЕТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ОКИСЛИТЕЛЬНОГО КРЕКИНГА ПРОПАНА
Для моделирования было отобрано несколько кинетических моделей, которые могли бы претендовать на описание процесса оксикрекинга пропана в области умеренных температур: UBC Mech 2.0 Kinetic mechanism (далее – UBC) [6], Methane/Propane oxidation mechanism (далее – Methane/Propane) [7], C1–C3 San Diego Mechanism (далее – San Diego) [8], С1–С5 Alkane oxidation mechanism (далее – С1–С5) [9], Butan NUIGALWAY (далее – Butan NUI) [10–14], HEXANE NUIGALWAY (далее – HEXANE NUI) [15], HEPTANE NUIGALWAY (далее – HEPTANE NUI) [16], Natural gas to/including C5 (2007/08) HIGH (далее – NG HIGH), Natural gas to/including C5 (2007/08) LOW (далее – NG LOW) и Natural Gas (далее – NG) [17], Natural gas to/including C5 (2010) (далее – NG3) [5–9], C1–C16 HT + LT + NOx mechanism (далее Ranzi) [18] и NUIGMech 1.1. (далее – NUIGMech) [19, 20]. Стоит отметить, что довольно известный механизм GRI-Mech 3.0 [21] нами для моделирования не использовался ввиду сильных отличий экспериментальных условий, на которых базировалась его разработка, от условий, рассматриваемых в данной работе. В табл. 1 даны краткие характеристики рассматривавшихся механизмов.
Таблица 1.
Кинетические модели окисления пропана
| Механизм | Число стадий/частиц | Условия применимости | Примечание |
|---|---|---|---|
| UBC | 55/278 | Р = 15.79–39.48 атм Т = 900–1600 К |
за основу взят механизм GRI-Mech, дополненный реакциями, связанными с образованием метилперокси, этилперокси и пропилперокси радикалов |
| Methane/Propane | 38/190 | Р = 5.3–31.4 атм Т = 1042–1585 К |
показана важность реакций CH3O•, CH3${\text{O}}_{2}^{\centerdot }$ и ${\text{CH}}_{3}^{\centerdot }$ + + O2/H${\text{O}}_{2}^{\centerdot }$ при описании кинетики процесса |
| San Diego | 40/235 | Р = 0.5–50 атм Т = 500–2500 К |
включен блок реакций для С4 |
| С1–С5 | 293/1588 | Р = 7.9–29.61 атм Т = 630–1550 К |
|
| BUTAN NUI | 289/1580 | Р = 1–30 атм Т = 630–1598 К |
|
| HEXANE NUI | 913/4150 | P = 1–29.61 атм T = 530–1365 K |
в основе – маханизм AramcoMech 1.3 [22]; рассмотрены альтернативные реакции изомеризации пероксилалкилгидропероксидных радикалов, что привело к более детальному описанию этого типа промежуточного продукта |
| HEPTANE NUI | 1268/5336 | Т = 500–1412 К Р = 1–37 атм |
подмеханизм С0–С4 из AramcoMech 2.0 [23, 24] |
| NG HIGH | 137/821 | Р = 1–30 атм Т = 1050–1600 К |
радикалы i-C4H9O2 и их последующие низкотемпературные реакции не включены в модель |
| NG LOW | 289/1580 | Р = 1–30 атм Т = 720–1050 К |
|
| NG3 | 230/1328 | P = 1–30 атм T = 630– 1598 К |
в основе – NG, NG HIGH и NG LOW |
| Ranzi | 250/8000 | Р = 1–20 атм Т = 300–2200 К |
включает блоки: C1–C4, эталонные топливные алканы (н-гептан, изооктан, н-декан, н-додекан), циклоалканы (циклогексан и метилциклогексан) и ароматические углеводороды (бензол, толуол, ксилол и этилбензол); кислородсодержащие топлива из спиртов, изомеров C3H6O, простых эфиров (диметиловый эфир и этилтретбутиловый эфир) и метиловых эфиров вплоть до метилдеканоата |
| NUIGMech | 2746/11270 | P = 1–40 атм Т = 689–2615 К |
в основе – AramcoMech 3.0 [25] |
Все представленные выше механизмы разработаны для описания процессов окисления легких углеводородов и вследствие этого имеют в своем составе блок окисления пропана. Механизмы серии AramcoMech не рассматривались, так как на них основаны другие механизмы, подробно рассмотренные в данной статье.
Кинетическое моделирование проводили с использованием моделей окисления легких углеводородов в области умеренных температур, указанных в табл. 1. Данные модели были отобраны из представленных в литературе по критерию наличия в них блока С3 и схожести условий экспериментов, в которых проводилась валидация данных моделей, с условиями данной работы. Стоит отметить, что все рассматриваемые модели разработаны исключительно для газофазных процессов и в них не учитываются реакции на поверхности реактора, важность которых была показана нами в работе [26].
Согласно изложенному в работе [27], оксикрекинг легких алканов протекает по цепному механизму с вырожденным разветвлением цепей в результате образования пероксида водорода Н2О2, образующегося в результате взаимодействия пероксидного радикала ${\text{НО}}_{2}^{\centerdot }$ с алканом, с последующим разложением пероксида водорода на гидроксильные радикалы ОН•. Необходимость учета гетерогенных процессов при оксикрекинге этана, а следовательно, и других легких алканов, была обоснована в работе [26]. Там же была дана методика такого учета, в том числе расчета коэффициентов аккомодации γi для взаимодействия соответствующих молекул с кварцевой поверхностью реактора. Поэтому механизм NUIGMech, показавший при предварительном анализе наилучшую описательную способность, был дополнен тремя гетерогенными реакциями с участием радикалов ${\text{НО}}_{2}^{\centerdot }$ и молекул H2O2, CO, которые обеспечивают превращение на поверхности реактора пероксидных радикалов и пероксида водорода в молекулы воды и кислорода, а монооксида углерода – в диоксид углерода (табл. 2). При этом полагали, что образуемые на поверхности реактора продукты H2O, O2 и CO2 в результате десорбции практически мгновенно по сравнению с характерными временами изменения газофазных концентраций ${\text{НО}}_{2}^{\centerdot },$ H2O2 и CO возвращаются в газовую фазу.
Таблица 2.
Гетерогенные реакции, включенные в механизм окисления пропана
| Реакция | А, с–1 | B | Е, кал/моль |
|---|---|---|---|
| HO2 → HO2s | 2.97 · 10–2 | 1.13 | 509.0 |
| H2O2 → H2O2s | 3.76 · 10–1 | 0.50 | 320.0 |
| СО → СОs | 2.49 · 10–4 | 0.50 | 0.0 |
Расчет соответствующих констант скорости и коэффициентов аккомодации частиц на поверхности для описания экспериментальных результатов по оксикрекингу пропана в кварцевом реакторе проводили по методике, описанной в работах [26, 28]. Моделирование проводили в программной среде российского программного комплекса CWB 4.3 [29] на модели изотермического реактора идеального вытеснения (Plug-flow Reactor). В табл. 2 приведены кинетические параметры рассматриваемых гетерогенных процессов для трехпараметрической формы уравнения Аррениуса:
Значения коэффициентов аккомодации частиц на поверхности реактора, γi, для трех указанных в табл. 2 гетерогенных реакций, были подобраны согласно методике, описанной в [26]: γ(HO2) = 2 ‧ 10–3, γ(H2O2) = 1.1 ‧ 10–4, γ(СО) = 6.7 ‧ 10–8.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные в работе экспериментальные температурные зависимости изменения концентрации реагентов и основных продуктов оксикрекинга пропана на выходе из реактора представлены на рис. 1–3. Там же представлены результаты моделирования на основании различных литературных механизмов, указанных в табл. 1.
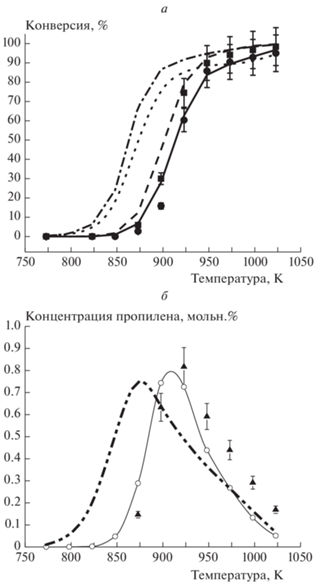
Рис. 1.
Температурная зависимость конверсии пропана (а) и кислорода (б) при Р = 1 атм, [C3H8]0 = 5.6%, [O2]0 = 1.9%, газ-разбавитель – азот;  – экспериментальные значения,
– экспериментальные значения,  – San Diego,
– San Diego,  – Methane/Propane,
– Methane/Propane,  – UBC,
– UBC,  – Ranzi,
– Ranzi,  – Butan NUI,
– Butan NUI,  – Heptane NUI,
– Heptane NUI,  – Hexane NUI,
– Hexane NUI,  – NG,
– NG,  – NG High,
– NG High,  – NG Low,
– NG Low,  – NG3.
– NG3.
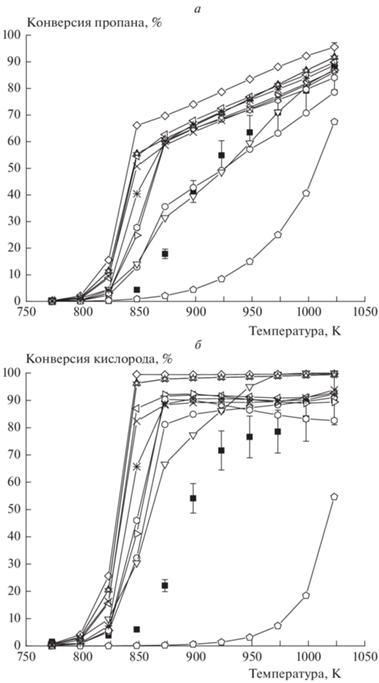
Рис. 2.
Температурная зависимость концентрации пропилена при окислительном крекинге пропана и Р = 1 атм, [C3H8]0 = 5.6%; [O2]0 = 1.9%, газ-разбавитель – азот. Обозначения те же, что и на рис. 1.

Рис. 3.
Температурная зависимость конверсии пропана (а) и кислорода (б) в среде метана при [C3H8]0= 5.02%, [O2]0 = 2.48%, P = 1 атм, газ-разбавитель – метан. Обозначения те же, что и на рис. 1.
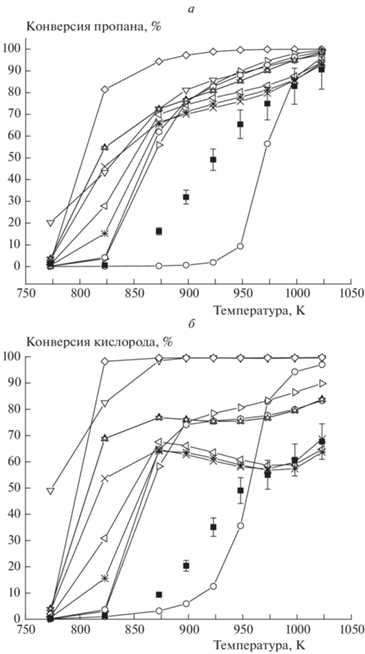
Рисунок 1а показывает, что практически все модели дают заниженное примерно на 25–50 К значение температуры начала быстрого изменения конверсии пропана при атмосферном давлении. Модели UBC и San Diego точнее других описывает данную температурную зависимость, однако при описании температурной зависимости конверсии кислорода адекватность и этих моделей низкая (рис. 1б). Модель NG HIGH заметно выбивается из общей тенденции, что еще раз указывает на необходимость учета радикалов i-C4H9O2 и их последующих низкотемпературных реакций при моделировании таких процессов.
Одним из наиболее важных параметров оксикрекинга пропана является максимально достигаемая концентрация пропилена. Практически все модели показывают, что максимум концентрации пропилена достигается в области температур 825–850 K (рис. 2). В случае моделей HEXANE NUI, HEPTANE NUI, NG LOW и San Diego температура, при которой наблюдается концентрационный максимум, соответствует ~873 К, что ниже экспериментального значения на ~50 К. Модели UBC, NG и NG3 к тому же показывают слишком низкую концентрацию пропилена. Модель NG HIGH снова выпадает из общей тенденции, в связи с чем было принято решение ее более не использовать при проведении последующих расчетов.
Большой практический интерес представляет оксикрекинг пропана в среде метана – основного компонента природного попутного газа. На рис. 3 представлены результаты моделирования данного процесса с использованием моделей из табл. 1. Расчеты по всем моделям дают более низкую температуру начала реакции по сравнению с экспериментальными значениями, как и в работе [26], что подтверждает необходимость учета процессов на поверхности реактора.
В соответствии с полученными результатами наиболее адекватная из рассмотренных нами моделей – NUIGMech была дополнена тремя указанными в табл. 2 гетерогенными стадиями с приведенными там же параметрами. На рис. 4 представлено сопоставление экспериментальных результатов с результатами моделирования оксикрекинга пропана по модели NUIGMech, дополненной гетерогенными стадиями, и без них. Результаты моделирования с учетом гетерогенных реакций достаточно хорошо, фактически количественно, описывают экспериментальные результаты, что является весомым аргументом в пользу необходимости учета гетерогенных реакций в реакторах лабораторного масштаба.
Рис. 4.
Температурная зависимость конверсии пропана и кислорода (а) и максимальной концентрации пропилена (б) при оксикрекинге пропана. Символы – экспериментальные результаты: ◼ – пропан, ⚫ – кислород, ▲ – пропилен; линии – результаты моделирования по модели NUIGMech без гетерогенных стадий: штрих-пунктирная кривая – пропан, точечная – кислород, штриховая с двумя точками – пропилен; результаты моделирования по модели NUIGMech, дополненной гетерогенными стадиями: штриховая кривая – пропан, сплошная – кислород, –⚪– – пропилен; [C3H8]0= 4.59%, [O2]0 = 2.49%, Р = 1 атм, газ-разбавитель – азот.
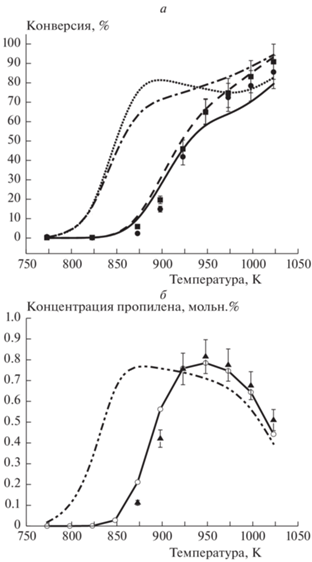
Аналогичные результаты для другого значения начального соотношения пропан/кислород представлены на рис. 5. И в этом случае результаты моделирования с использованием модифицированного путем добавления гетерогенных стадий механизма NUIGMech количественно согласуются с экспериментальными результатами.
Таким образом, при дополнении газофазного механизма NUIGMech реакциями, описывающими наиболее важные гетерогенные процессы на поверхности реактора, расчетная температура начала быстрого роста конверсии реагентов повышается на ∼50 К, что позволяет количественно согласовать расчеты с экспериментами. Учет гетерогенных процессов с участием других радикалов (Н●, ОН● и др.), играющих важную роль в газофазмом механизме оксикрекинга, так же как и при оксикрегинге этана [26], не оказывал заметного влияния на результаты, видимо, из-за значительно более высокой скорости газофазных процессов с их участием.
ЗАКЛЮЧЕНИЕ
Анализ большой группы кинетических моделей окисления пропана в области умеренных температур (Т ≤ 1000 К) показал, что наиболее современные модели, такие как NUIGMech, способны качественно описывать данный процесс. Однако количественно описание процесса в условиях лабораторных реакторов с высоким отношением площади внутренней поверхности реактора к его объему требует учета гетероенных процессов, протекающих на поверхности реактора. Учет этих процессов с кинетическими параметрами, определяемыми согласно методике, предложенной в работах [26, 28], позволяет получить количественное, с точностью до погрешности эксперимента, согласие результатов моделирования с экспериментальными результатами.
Исследование выполнено при финансовой поддержке Российским фондом фундаментальных исследований и Комитетом по науке Республики Армения в рамках научного проекта № 20-53-05001.
Список литературы
Arutyunov V.S., Magomedov R.N., Proshina A.Yu., Strekova L.N. // Chem. Eng. J. 2014. V. 238. P. 9; https://doi.org/10.1016/j.cej.2013.10.009
Арутюнов В.С., Дмитрук А.С., Никитин А.В. // Изв. АН. Сер. хим. 2016. Т. 65. № 10. С. 2405; https://doi.org/10.1007/s11172-016-1597-3
Магомедов Р.Н., Прошина А.Ю., Арутюнов В.С. // Кинетика и катализ. 2013. Т. 54. № 4. С. 401; https://doi.org/10.7868/S0453881113040114
Магомедов Р.Н., Прошина А.Ю., Пешнев Б.В., Арутюнов В.С. // Кинетика и катализ. 2013. Т. 54. № 4. С. 413; https://doi.org/10.7868/S0453881113040126
Дмитрук А.С., Никитин А.В., Стрекова Л.Н., Арутюнов В.С. // Горение и взрыв / Под ред. Фролова С.М. Вып. 9. М.: Торус Пресс, 2016. № 3. С. 21.
Huang J., Bushe W.K. // Combust. and Flame. 2006. V. 144. P. 74; https://doi.org/10.1016/j.combustflame.2005.06.013
Petersen E.L., Kalitan D.M., Simmons S. et al. // Proc. Combust. Inst. 2007. V. 31. P. 447; https://doi.org/10.1016/j.proci.2006.08.034
Prince J.C., Treviño C., Williams F.A. // Combust. and Flame. 2017. V. 175. P. 27; https://doi.org/10.1016/j.combustflame.2016.06.033
Healy D., Kalitan D.M., Aul C.J. et al. // Energy Fuels. 2010. V. 24. № 3. P. 1521; https://doi.org/10.1021/ef9011005
Healy D., Kopp M.M., Polley N.L. et al. // Ibid. № 3. P. 1617; https://doi.org/10.1021/ef901292j
Donato N., Aul C., Petersen E. et al. // J. Eng. Gas Turbine Power. 2010. V. 132. № 5. P. 051502; https://doi.org/10.1115/1.3204654
Healy D., Donato N.S., Aul C.J. et al. // Combust. and Flame. 2010. V. 157. № 8. P. 1526; https://doi.org/10.1016/j.combustflame.2010.01.016
Healy D., Donato N.S., Aul C.J. et al. // Ibid. P. 1540; https://doi.org/10.1016/j.combustflame.2010.01.011
Healy D., Kalitan D.M., Aul C.J. et al. // Energy Fuels. 2010. V. 24. № 3. P. 1521; https://doi.org/10.1021/ef9011005
Zhang K., Banyon C., Togbé C. et al. // Combust. and Flame. 2015. V. 162. № 11. P. 4194; https://doi.org/10.1016/j.combustflame.2015.08.001
Zhang K., Banyon C., Bugler J. et al. // Ibid. 2016. V. 172. P. 116; https://doi.org/10.1016/j.combustflame.2016.06.028
Bourque G., Healy D., Curran H. J. et al. // Proc. ASME Turbo Expo. 2008. V. 3. P. 1051; https://doi.org/10.1115/GT2008-51344
C1–C16 HT + LT + NOx mechanism // The CRECK Modeling Group, Politecnico di Milano. 2020; http://creckmodeling.chem.polimi.it/menu-kinetics/ menu-kinetics-detailed-mechanisms/107-category-kinetic-mechanisms/406-mechanisms-1911-tot-ht-lt-nox/
NUIGMech 1.1; https://c3.nuigalway.ie/combustionchemistrycentre/mechanismdownloads/
Martinez S., Baigmohammadi M., Patel V. et al. // Combust. and Flame. 2021. V. 228. P. 401; https://doi.org/10.1016/j.combustflame.2021.02.009
Gri-Mech 3.0; http://combustion.berkeley.edu/gri_mech/version30/ text30.html/
Metcalfe W.K., Burke S.M., Ahmed S.S., Curran H.J. // J. Chem. Kinet. 2013. V. 45. P. 638; https://doi.org/10.1002/kin.20802
Li Y., Zhou C.W., Somers K.P. et al. // Proc. Combust. Inst. 2016. V. 36. № 1. P. 403; https://doi.org/10.1016/j.proci.2016.05.052
Zhou C.-W., Li Y., O’Connor E. et al. // Combust. and Flame. 2016. V. 167. P. 353; https://doi.org/10.1016/j.combustflame.2016.01.021
Zhou C.-W., Li Y., Burke U. et al. // Ibid. 2018. V. 197. P. 423; https://doi.org/10.1016/j.combustflame.2018.08.006
Брюков М.Г., Паланкоева А.С., Беляев А.А., Арутюнов В.С. // Кинетика и катализ. 2021. Т. 62. № 6; https://doi.org/10.31857/S0453881121060022
Miller J.A., Klippenstein S.J. // Intern. J. Chem. Kinet. 2001. V. 33. P. 654; https://doi.org/10.1002/kin.1063
Паланкоева А.С., Зимин Я.С., Брюков М.Г., Беляев А.А., Арутюнов В.С. // Горение в взрыв. 2021. Т. 14. № 4. С. 42; https://doi.org/10.30826/CE
Chemical Workbench 4.3. Kintech Laboratory. 2021. http://www.kintechlab.com/products/chemical-workbench/
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика