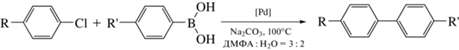Химическая физика, 2022, T. 41, № 6, стр. 15-19
Гомогенный катализ реакции Сузуки–Мияуры с использованием арилхлоридов в качестве субстратов
А. Ф. Шмидт 1, *, А. А. Курохтина 1, Е. В. Ларина 1, Н. А. Лагода 1, Т. А. Бабенко 1
1 Иркутский государственный университет
Иркутск, Россия
* E-mail: aschmidt@chem.isu.ru
Поступила в редакцию 06.12.2021
После доработки 11.01.2022
Принята к публикации 20.01.2022
- EDN: QVWTYT
- DOI: 10.31857/S0207401X22060115
Аннотация
В работе приведены результаты кинетического исследования, направленного на получение данных о вкладах гомогенного и гетерогенного механизмов катализа в реакции Сузуки–Мияуры с использованием малореакционноспособных арилхлоридов в качестве субстратов в условиях отсутствия добавок сильных органических лигандов. Закономерности изменения скорости реакции, а также частоты и числа оборотов катализатора при варьировании природы и концентрации палладиевого предшественника указывают на протекание катализа в растворе с участием истинно растворенных гомогенных форм палладия.
1. ВВЕДЕНИЕ
Катализируемые соединениями переходных металлов реакции превращения органических молекул играют важнейшую роль в современной синтетической химии [1–3]. Одной из таких реакций является катализируемое палладием сочетание арилгалогенидов с арилборными кислотами с образованием биарилов, известное под названием реакции Сузуки–Мияуры [4, 5]. На сегодняшний день реакция Сузуки–Мияуры реализована во множестве малотоннажных процессов синтеза современных полупроводниковых материалов, фармацевтических препаратов и продуктов природного происхождения [6, 7]. При этом, несмотря на значительные успехи в развитии синтетического потенциала этого процесса, многие фундаментальные аспекты механизма функционирования каталитических систем в процессе образования продуктов реакции являются предметом острой дискуссии. В частности, отсутствует единое мнение, протекает ли реакция в растворе на молекулярных комплексах палладия по механизму гомогенного катализа или на поверхности наноразмерных или более крупных частиц палладия (см., например, оригинальные работы последних лет [8–11], а также обзоры [12–14]). При этом в последние годы все более популярной становится модель функционирования каталитических систем этого процесса по так называемому “коктейльному” типу, когда каталитическую активность в зависимости от условий реакции способны одновременно проявлять несколько различных по типу субстанций (истинно растворенные молекулярные комплексы палладия, а также наноразмерные и грубодисперсные частицы этого металла) [15].
В настоящей работе нами проведено кинетическое исследование, направленное на получение данных о гомогенной или гетерогенной природе истинного катализатора реакции Сузуки–Мияуры в условиях применения наиболее привлекательной с прикладной точки зрения комбинации так называемых “безлигандных” каталитических систем, не содержащих добавок дорогостоящих, а также зачастую токсичных и требующих сложных экспериментальных процедур сильных органических лигандов (фосфиновых, аминовых, карбеновых и т.д.), и арилхлоридов, являющихся наиболее доступными в ряду арилгалогенидов субстратами.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Каталитические эксперименты проводили на воздухе, без использования инертной атмосферы. Использовали реактивы компаний Acros Organics и Sigma-Aldrich марки “ч.д.а.” без дополнительной очистки. Приготовление гетерогенного предшественника катализатора Pd(0)/C проводили согласно методике из работы [16].
Анализ проб реакционной смеси проводили на газожидкостном хроматографе “Хроматэк-Кристалл 5000.2” с детектором ионизации пламени (капиллярная колонка HP-5 длиной 15 м) и хромато-масс-спектрометре GCMS QP-2010 Ultra корпорации Shimadzu (Japan) с ионизацией электронным ударом (энергия ионизации – 70 эВ, колонка GsBP-5MS размером 0.25 мкм × 0.25 мм × 30 м, газ-носитель − гелий) с программированным нагревом от 100 до 250 °С. Полученные масс-спектры сравнивались с библиотечными масс-спектрами (библиотеки сравнения Wiley, NIST, NIST05). Количественный состав проб вычислялся методом внутреннего стандарта (внутренний стандарт – нафталин) с использованием калибровки по аутентичным образцам.
В каталитической реакции Сузуки–Мияуры при комнатной температуре смешивали 3 мл диметилформамида, 5 ммоль (1 М) 4-хлорацетофенона или хлорбензола и 1 ммоль (0.2 М) нафталина в качестве внутреннего стандарта для хроматографии. Полученный раствор помещали в круглодонный стеклянный реактор, снабженный резиновой мембраной и магнитной мешалкой, содержащий фенилборную (в реакции с 2.5 ммоль (0.5 М) 4‑хлорацетофенона, или 4-толилборную кислоту (в реакции с 0.4 ммоль (8 мМ) хлорбензола, 0.008 ммоль (1.6 мМ) палладиевого предшественника катализатора и 3.25 ммоль (0.65 М) Na2CO3 в качестве основания. Далее к реакционной смеси добавляли 2 мл воды и начинали реакцию, помещая реактор в предварительно нагретую до 100 °С масляную баню при перемешивании (480 об/мин) в течение 30–150 мин.
Пробы реакционной смеси для хроматографического анализа периодически отбирали из реактора с помощью шприца с металлической иглой. Каждый эксперимент проводили 3 раза для проверки воспроизводимости. Скорости расходования субстратов оценивали путем графического дифференцирования стационарных участков кинетических кривых. Материальный баланс по реагентам оценивали в каждой пробе методом газожидкостной хроматографии. В качестве побочных продуктов образовывались ацетофенон в результате восстановления 4-хлорацетофенона (до 0.5% от исходного количества арилхлорида), бензол и толуол из фенилборной и 4-толилборной кислот, соответственно (до 1% от исходного количества арилборной кислоты).
Значения частоты оборотов катализатора (turnover frequency (TOF), мин–1) рассчитывали путем деления максимальной скорости накопления продукта реакции – несимметричного биарила (моль/л · мин) на концентрацию загружаемого в реакционную систему палладиевого предшественника катализатора (моль/л). Значения числа оборотов катализатора (turnover number (TON)) рассчитывали путем деления концентрации продукта реакции (моль/л), достигнутой к моменту остановки реакции (30–150 мин в зависимости от условий), на концентрацию загружаемого в реакционную систему палладиевого предшественника катализатора (моль/л).
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Кинетические исследования, предполагающие изучение закономерностей развития химической реакции во времени, являются одним из наиболее эффективных инструментов исследования механизмов сложных каталитических процессов, в том числе установления природы истинного катализатора [17]. Полученные ранее данные позволяли предположить, что в условиях применения наиболее реакционноспособных в ряду арилгалогенидов арилиодидов, а также наименее реакционноспособных арилхлоридов определяющий вклад в превращение субстрата вносит гомогенный механизм катализа [16, 18], в то время как применение арилбромидов, демонстрирующих умеренную реакционную способность, сопровождается значительным увеличением вклада гетерогенного механизма катализа [16, 19].
Полученные нами результаты, базирующиеся на закономерностях дифференциальной селективности реакции Сузуки–Мияуры с арилхлоридами [18], а также результаты двух других исследовательских групп [20, 21] указывали на определяющий вклад в катализ в этих условиях именно молекулярных комплексов палладия. С другой стороны, существуют свидетельства каталитической активности гетерогенных форм палладия в активации арилхлоридов в реакции Сузуки–Мияуры [22–24]. В связи с этим в настоящей работе были проведены исследования каталитической активности “безлигандных” каталитических систем в реакции Сузуки–Мияуры с арилхлоридами с целью получения дополнительных свидетельств в пользу гипотезы гомогенного механизма катализа.
Поскольку реакционная способность арилгалогенида чрезвычайно сильно сказывается на превращениях катализатора внутри и за пределами каталитического цикла реакции кросс-сочетания [4, 16], закономерности изменения скорости реакции Сузуки–Мияуры оценивались в условиях использования двух различных арилхлоридов – неактивированного хлорбензола и активированного 4-хлорацетофенона:
где R = H, C(O)CH3; R' = H, CH3; [Pd] = PdCl2, PdBr2, Pd(OAc)2, Pd(acac)2, Pd(O)/C.Использование различных растворимых (хлорид, бис-ацетилацетонат, ацетат и бромид палладия) предшественников катализатора приводило к значительным изменениям как начальной скорости реакции, так и величины выхода продукта в обоих вариантах процесса – с использованием активированного 4-хлорацетофенона или неактивированного хлорбензола (рис. 1а). Высокие значения максимальной скорости образования продуктов в этом случае приводили и к получению наиболее высоких значений их выходов (рис. 1б). В свою очередь, переход к использованию гетерогенного предшественника катализатора (Pd(0)/C) сопровождался резким падением скорости реакции, и значимых степеней конверсии субстратов в продукты реакции не наблюдалось (рис. 1).
Рис. 1.
Скорости r образования (a) и выходы биарила (б) при варьировании природы предшественника катализатора в реакции Сузуки–Мияуры между 4-хлорацетофеноном и фенилборной кислотой (◼) и хлорбензолом и 4-толилборной кислотой (◻): 1 – PdCl2, 2 – Pd(OAc)2, 3 – Pd(0)/C, 4 – Pd(acac)2, 5 – PdBr2.

Такое принципиальное изменение каталитической активности при переходе от растворимых к нерастворимому предшественнику можно рассматривать как свидетельство сильного влияния процессов растворения палладия на протекание каталитической реакции. Безусловно, эти данные нельзя рассматривать как прямое доказательство участия в катализе исключительно гомогенной формы палладия. Это связано с тем, что растворение металлического палладия на поверхности носителя может оказывать определяющее влияние на катализ и в случае протекания последнего на поверхности формирующихся в растворе наноразмерных частиц палладия, что обусловлено сложным характером взаимопревращений растворенных и твердых форм палладия в условиях реакций кросс-сочетания [8, 14–16].
Нами также были оценены зависимости TOF и TON катализатора от концентрации растворимого предшественника в реакции Сузуки–Мияуры при сочетании неактивированного хлорбензола и 4-толилборной кислоты. Полученные зависимости имели аномальный “отрицательный” характер – частота и число оборотов катализатора падали с увеличением концентрации загружаемого предшественника катализатора (рис. 2а и б соответственно). Ранее зависимости такого типа для TOF были неоднократно зафиксированы в родственной реакции Мицороки–Хека (сочетание арилгалогенидов с алкенами) и рассматривались как свидетельство в пользу реализации катализа в растворе на молекулярных комплексах палладия [25–27]. Рост TOF катализатора при уменьшении его загрузки в рамках этой гипотезы связывается с более значительным падением скорости дезактивации растворенных молекулярных комплексов палладия вследствие образования неактивных частиц металлической фазы в сравнении со скоростью основной каталитической реакции (вследствие меньшего порядка скорости последней по концентрации палладия), а также с меньшим размером таких неактивных частиц, способствующим более эффективному их растворению [28].
Рис. 2.
Зависимости частоты (а) и числа оборотов (б) катализатора от концентрации хлорида палладия в реакции Сузуки–Мияуры между хлорбензолом и 4‑толилборной кислотой.
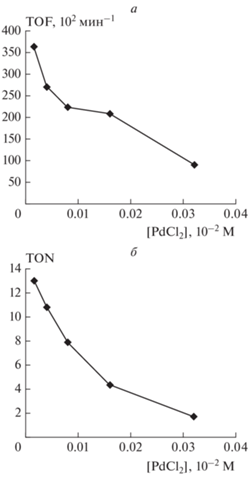
Тем не менее следует учитывать, что аналогичные зависимости могут наблюдаться и в случае гетерогенного катализа [14], поэтому их, скорее, также можно рассматривать в качестве косвенных доказательств механизма гомогенного катализа. Обнаруженное нами увеличение TON с уменьшением количества предшественника катализатора носит менее общий характер и может быть интерпретировано как падение устойчивости (времени жизни) катализатора при увеличении его загрузки. Несмотря на то, что все полученные в ходе настоящей работы экспериментальные данные не могут рассматриваться как однозначные свидетельства в пользу реализации катализа реакции Сузуки–Мияуры в растворе, большое количество взаимно непротиворечивых выводов хорошо согласуется с этой гипотезой.
4. ЗАКЛЮЧЕНИЕ
Исследования закономерностей каталитической активности изученных катализаторов были проведены для реакции Сузуки–Мияуры с арилхлоридами в условиях так называемого “безлигандного” катализа. Полученные данные о зависимостях величин скорости и выхода продукта реакции от природы предшественника катализатора, в том числе о резком падении каталитической активности при переходе от растворимых предшественников к нанесенному гетерогенному, свидетельствуют в пользу каталитической активности молекулярных комплексов палладия и, соответственно, протекания реакции в растворе по механизму истинно гомогенного катализа. Кроме того, специфические зависимости частоты и числа оборотов катализатора от его концентрации также указывают на участие в катализе растворимых форм палладия. Полученные результаты следует учитывать при определении направления создания каталитических систем для вовлечения в реакцию Сузуки–Мияуры наиболее доступных в ряду арилгалогенидов арилхлоридов.
Работа выполнена при поддержке Российским научным фондом (проект № 19-13-00051).
Список литературы
Севостьянова Н.Т., Баташев С.А., Родионова А.С. // Хим. физика. 2019. Т. 38. № 4. С. 3.
Ришина Л.А., Kissin Y.V., Гагиева С.Ч., Лалаян С.С. // Хим. физика. 2019. Т. 38. № 9. С. 14.
Гришин М.В., Гатин А.К., Сарвадий С.Ю. и др. // Хим. физика. 2020. Т. 39. № 7. С. 63.
Suzuki A. // Angew. Chem. Intern. Ed. 2011. V. 50. № 30. P. 6723.
Фатыхова Г.А., Макаров Е.Г., Миронова Д.А. и др. // Хим. физика. 2019. Т. 38. № 6. С. 15.
Ramos I.T.L., Silva R.J.M., Silva T.M.S., Camara C.A. // Synth. Commun. 2021. V. 51. № 23. P. 3520.
Choi J., Fu G.C. // Science. 2017. V. 80. № 356. P. 6334.
Ángeles Úbeda M., Amorós P., Sánchez-Royo J.F. et al. // J. Catal. 2020. V. 381. № 1. P. 26.
Costa P., Sandrin D., Scaiano J.C. // Nat. Catal. 2020. V. 3. P. 427.
Bulatov E., Lahtinen E., Kivijärvi L., Hey-Hawkins E., Haukka M. // ChemCatChem. 2020. V. 12. № 19. P. 4831.
Yang C., Zhang L., Lu C. et al. // Nat. Nanotechnol. 2021. V. 16. P. 1214.
Bourouina A., Meille V., de Bellefon C. // Catalysts. 2019. V. 9. № 1. P. 60.
Biffis A., Centomo P., Del Zotto A., Zecca M. // Chem. Rev. 2018. V. 118. № 4. P. 2249.
Шмидт А.Ф., Курохтина А.А. // Кинетика и катализ. 2012. Т. 53. № 6. С. 760.
Galushko A.S., Kashin A.S., Eremin D.B. et al. In Nanoparticles in Catalysis. Wiley: Wiley Online Books, 2021. C. 13.
Шмидт А.Ф., Курохтина А.А., Ларина Е.В. // Кинетика и катализ. 2012. Т. 53. № 1. С. 86.
Widegren J.A., Finke R.G. // J. Mol. Catal. A Chem. 2003. V. 198. № 1–2. P. 317.
Lagoda N.A., Larina E.V., Vidyaeva E.V., Kurokhtina A.A., Schmidt A.F. // Org. Process Res. Dev. 2021. V. 25. № 4. P. 916.
Kurokhtina A.A., Larina E.V., Schmidt A.F. et al. // J. Mol. Catal. A Chem. 2013. V. 379. P. 327.
Soomro S.S., Ansari F.L., Chatziapostolou K., Köhler K. // J. Catal. 2010. V. 273. № 2. P. 138.
Simeone J.P., Sowa J.R. // Tetrahedron. 2007. V. 63. № 51. P. 12646.
Duan L., Fu R., Xiao Z. et al. // ACS Catal. 2015. V. 5. № 2. P. 575.
Labattut A., Abdellah I., Buendia J. et al. // Catalysts. 2020. V. 10. № 9. P. 1.
Veisi H., Ghorbani M., Hemmati S. // Mater. Sci. Eng. C. 2019. V. 98. P. 584.
de Vries A.H.M., Mulders J.M.C.A., Mommers J.H.M., Henderickx H.J.W., de Vries J.G. // Org. Lett. 2003. V. 5. № 18. P. 3285.
Beletskaya I.P., Cheprakov A.V. // Chem. Rev. 2000. V. 100. № 8. P. 3009.
Schmidt A.F., Smirnov V.V. // Top. Catal. 2005. V. 32. № 1–2. P. 71.
Schmidt A.F., Al Halaiqa A., Smirnov V.V. // Synlett. 2006. № 18. P. 2861.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика