Химическая физика, 2022, T. 41, № 6, стр. 20-29
Синтез и исследование высокодисперсных алюминатов кальция и катализаторов на их основе
Е. И. Шуваракова 1, А. Ф. Бедило 1, *, Р. М. Кенжин 1, Е. В. Ильина 1, Ю. Ю. Герус 1, 2
1 Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова
Сибирского отделения Российской академии наук”
Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
Новосибирск, Россия
* E-mail: abedilo@bk.ru
Поступила в редакцию 06.12.2021
После доработки 10.01.2022
Принята к публикации 20.01.2022
- EDN: XNADBF
- DOI: 10.31857/S0207401X22060127
Аннотация
Образцы высокодисперсного алюмината кальция состава C12A7 (12CaO · 7Al2O3) были синтезированы в водной среде и в автоклаве с использованием сверхкритической сушки. Удельная поверхность аэрогелей достигала 330 м2/г сразу после сушки в автоклаве и 170 м2/г после прокалки при температуре 500 °С. В водной среде по реакции CaO со взвесью гидроксида алюминия были получены наноразмерные материалы с кристаллической структурой майенита и удельной поверхностью около 80 м2/г после прокалки при 600 °С. Методом пропитки по влагоемкости образца C12A7, полученного в водной среде, были синтезированы нанесенные катализаторы, содержащие Pd, V, Fe, Ni, Cu и Ag. Каталитическая активность синтезированных образцов была исследована в реакции окисления монооксида углерода CO. Наилучшую каталитическую активность продемонстрировал образец 1%Pd/C12A7. На поверхности всех синтезированных материалов на основе C12A7 были обнаружены электроноакцепторные центры, способные ионизовать молекулы фенотиазина с образованием катион-радикалов, электронодонорные центры, ионизующие тринитробензол с образованием анион-радикалов, а также центры радикальной природы, взаимодействие которых с дифениламином приводит к образованию стабильных нитроксильных радикалов. Образование нитроксильных радикалов при адсорбции дифениламина свидетельствует о существовании на поверхности майенита кислородных радикалов, которые могут проявлять высокую активность в различных реакциях каталитического окисления.
1. ВВЕДЕНИЕ
Алюминаты кальция разной стехиометрии давно известны и изучаются уже на протяжении долгого времени. Они применяются как компоненты цементных смесей и в качестве носителей катализаторов. Алюминат кальция стехиометрического состава 12CaO · 7Al2O3 (обычно обозначается как C12A7) и кристаллической структурой майенита вызывает особый интерес. Внимание к этому классу материалов вызвано обнаружением уникальных электрофизических и химических свойств, которые были детально изучены в работах группы Хосоно [1–4]. Такие материалы имеют стабильный катионный каркас [Ca24Al28O64]4+ и изменяемую анионную подрешетку 4X–. Их химические и электрофизические свойства могут быть легко изменены в широких пределах путем замены аниона X–, где X– – H–, O–, ${\text{O}}_{2}^{ - },$ O2–, OH–, Cl–, F– или e–. Возможность стабилизации радикальных форм кислорода на решетке майенита представляет значительный интерес для потенциального использования его в качестве катализатора или носителя для процессов окисления.
В большинстве работ, посвященных синтезу материалов на основе майенита, использовался твердофазный метод синтеза, включающий в себя спекание при высоких температурах. Получаемые таким способам материалы мало пригодны для использования в качестве катализаторов или носителей ввиду их низкой удельной поверхности. В недавних работах нашей группы [5, 6] для синтеза высокодисперсных электридов на основе C12A7 использовалось разложение смешанного гидроксида кальция и алюминия, покрытого углеродом. Также майенит с удельной поверхностью 74 м2/г был синтезирован методом самосгорания смеси алюминатов кальция и алюминия в присутствии щавелевой кислоты [7]. Поэтому основной целью настоящей работы была разработка методов синтеза наноразмерных кристаллов образцов майенита с высокой удельной поверхностью.
Аэрогельный метод синтеза высокодисперсных материалов представляет значительный интерес, поскольку позволяет избежать коллапса пористой структуры синтезированного геля за счет удаления растворителя в автоклаве в сверхкритических условиях [8–10]. Ранее было продемонстрировано, что нанокристаллы чистых и модифицированных оксидов щелочноземельных металлов, синтезированных по аэрогельной методике, обладают высокой активностью в разложении различных токсичных соединений [11–13] и проявляют интересные каталитические свойства [14–16].
Недавно нами были впервые синтезированы аэрогели алюмината кальция со стехиометрическим составом майенита [17]. Удельная поверхность синтезированных аэрогелей достигала 170 м2/г после прокалки при температуре 500 °С, однако алюминат кальция при этом находился преимущественно в рентгеноаморфном состоянии. До этого сообщалось только о синтезе по аэрогельной методике аморфного алюмината кальция со стехиометрией CaO–Al2O3 [18].
Высокую активность аэрогелей на основе MgO и CaO традиционно объясняли высокой концентрацией низкоординированных ионов на их поверхности [19]. Однако позже было показано, что активные центры часто формируются в ходе реакций аэрогелей на основе MgO c галогенсодержащими соединениями [20, 21]. Нами была продемонстрирована взаимосвязь между активностью аэрогелей на основе MgO в процессах деструктивной сорбции CF2Cl2 и каталитического дегидрогалогенирования 1-хлорбутана и образованием на их поверхности электроноакцепторных центров, тестируемых методом электронного парамагнитного резонанса (ЭПР) с использованием ароматических зондов [21–23].
Метод ЭПР с использованием спиновых зондов позволяет исследовать активные центры на поверхности различных материалов [24–26]. В том числе значительный интерес представляет использование ЭПР для тестирования высокоактивных центров, таких как радикальные формы кислорода [27, 28], электроноакцепторные центры, способные отрывать электрон от ароматических зондов [29, 30], и электронодонорные центры, способные отдавать электрон ароматическим нитросоединениям [30, 31], а также исследование их роли в различных химических и каталитических реакциях. Недавно было показано, что помимо электронодонорных и электроноакцепторных центров, наблюдаемых на поверхности многих высокодисперсных оксидных материалов, на поверхности майненита присутствуют также необычные центры, вероятно, радикальной природы, способные генерировать нитроксильные радикалы при адсорбции дифениламина [6].
Разработка и оптимизация катализаторов окисления монооксида углерода СО, которые работают и в области повышенных температур, и при температурах, близких к комнатной, является актуальной задачей ввиду его высокой токсичности, которая приводит к необходимости нейтрализации компонентов газовых выхлопов двигателей внутреннего сгорания и очистки воздуха в закрытых помещениях. Наиболее активными в реакции окисления СО являются катализаторы на основе благородных металлов [32–35]. В частности, высокую активность показали палладиевые катализаторы, для которых была показана возможность стабилизации палладия в наиболее активной форме на электронодорных центрах поверхности Al2O3 и ZrO2 [36, 37]. Однако катализаторы с частичной или полной заменой благородных металлов на оксиды переходных металлов также представляют колоссальный интерес ввиду их более низкой стоимости.
В настоящей работе были предложены два способа синтеза высокодисперсных алюминатов кальция состава C12A7 – по реакции CaO со взвесью гидроксида алюминия в водной среде и по аэрогельной методике. Активные центры на поверхности всех синтезированных материалов были детально охарактеризованы методом ЭПР с использованием спиновых зондов. Также были синтезированы катализаторы, содержащие различные металлы, нанесенные на поверхность майенита, и исследована их каталитическая активность в реакции окисления CO. Помимо палладия, известного как хороший катализатор окисления CO при умеренных температурах, на поверхность майенита наносили переходные металлы, обладающие различными свойствами, такие как Fe, Ni, Ag, Cu и V, с целью поиска возможной системы, где присутствие кислородных радикалов на поверхности майенита даст синергетический эффект с нанесенным металлом и приведет к заметному росту каталитической активности.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1. Методики синтеза и исследования катализаторов
Для синтеза майенита C12A7 (12CaO · 7Al2O3) в водной среде использовали смеси высокодисперсных гидроксидов алюминия и кальция в качестве прекурсоров. Гидроксид кальция в активной форме получали растворением CaO в водной суспензии, содержащей взвесь гидроксида алюминия в требуемом стехиометрическом соотношении, с последующим перемешиванием в течение 24 ч. В результате наблюдалось образование высокодисперсного смешанного гидроксида алюминия и кальция. Затем осадок сушили при температуре 110 °С и прокаливали на воздухе при 600 °С. Такая методика дает возможность получать наноразмерные материалы с кристаллической структурой майенита и удельной поверхностью около 80 м2/г.
В качестве исходных реагентов для синтеза образцов аэрогелей использовали металлический кальций и изопропилат алюминия, при этом соотношение Ca/Al соответствовало стехиометрическому составу фазы майенита. Предварительно получали взвесь метилата кальция путем растворения 0.72 г металлического кальция в 50 мл метанола. Затем в реакционную среду добавляли 4.284 г изопропилата алюминия, 100 мл толуола, 40 мл изопропанола с последующим гидролизом смеси раствором соответствующего количества воды в 10 мл изопропанола. В ходе синтеза варьировалось количество добавляемой воды, и в зависимости от этого полученные образцы обозначены как C12A7–nH2O, где n соответствует отношению добавленного количества воды к стехиометрическому. Полученный гель перемешивали в течение 16 ч и сушили в автоклаве при температуре 270 °С. Полученные аэрогельные образцы были дополнительно прокалены в атмосфере воздуха при температурах 500 и 900 °С.
Были синтезированы нанесенные катализаторы с различным содержанием металлов. Образцы, содержащие 0.5, 1 и 2% Fe, Ni, Ag, а также 0.3 и 1% Pd, были получены методом пропитки по влагоемкости образца C12A7, синтезированного в водной среде, растворами нитратов соответствующих металлов. Катализаторы, содержащие Cu в тех же концентрациях, были получены путем пропитки растворами сульфата меди. Навески майенита С12А7, прокаленного при 600 °С (С12А7-600), пропитывали рассчитанным объемом раствора соответствующей соли, тщательно перемешивали, сушили при 100 °С в течение 24 ч, а затем прокаливали при 600 °С в течение 6 ч на воздухе. Такая температура прокалки была выбрана, чтобы избежать значительной перестройки катализаторов в реакторе при проведении каталитических экспериментов.
Образцы, содержащие 5 и 10% V, готовили методом пропитки избытком раствора ванадата аммония NH4VO3. Так как NH4VO3 плохо растворим в воде, растворение проводили с добавлением аммиака при нагревании до 70 °С. Рассчитанное количество водного раствора, содержащего 1% NH4VO3 и 0.5% NH4OH, приливали к навеске С12A7 и перемешивали при 70 °С в течение 3 ч, а затем сушили при 110 °С на воздухе в течение 24 ч. Полученный образец прокаливали при 600 °С в течение 6 ч.
Концентрацию электроноакцепторных и электронодонорных центров на поверхности полученных материалов измеряли с помощью ЭПР-спектрометра ERS-221 (ГДР), работающего в X-диапазоне (ν = 9.3 ГГц). Спектры ЭПР регистрировались при ослаблении 20 дБ и мощности 3 мВт. Для проведения исследования образец помещали в ампулу для ЭПР-спектроскопии, активировали на воздухе при заданной температуре в течение 3 ч, затем остужали до комнатной температуры и проводили адсорбцию зонда. После этого регистрировали спектр ЭПР. Концентрацию активных центров рассчитывали как двойной интеграл полученного спектра с учетом нормировки на стандарт. В качестве спиновых зондов для тестирования электроноакцепторных центров использовали раствор фенотиазина (С12Н9NS) в толуоле (2 ⋅ 10–2 М) и дифениламина (C12H11N) в толуоле (2 ⋅ 10–2 М), для электронодонорных – раствор тринитробензола (C6H3N3O6) в толуоле (2 ∙ 10–2 М).
Полученные образцы катализаторов исследовали в реакции окисления CO в режиме форсированного термического старения по ранее опубликованной методике [38]. Использованная смесь содержала 0.15 об.% CO, 14 об.% O2, 0.01 об.% NO, 5 об.% воды и азот в качестве газа-носителя. В каталитических экспериментах использовали фракцию с размером гранул 0.25–0.5 мм. Загрузка образца составляла 300 мг, скорость потока – 0.3 л/мин. При этом проводили несколько испытаний с постепенным повышением температуры реакции от 50 до 320 °С (серии 1 и 2), 600 °С (серии 3 и 4) и 800 °С (серии 5 и 6).
2.2. Исследование образцов алюмината кальция физическими методами
Значения удельной поверхности аэрогелей сразу после сушки в автоклаве варьировали от 330 м2/г у образца C12A7–1H2O до 90 м2/г у C12A7–5H2O (рис. 1). Достаточно высокие ее значения сохранялись и после прокалки при температуре 500 °С. В то же время прокалка при температуре 900 °С приводила к спеканию образцов и падению величины удельной поверхности до 15–20 м2/г (рис. 1). Стоит отметить, что удельная поверхность аэрогелей C12A7–1H2O после прокалки при 500 °С примерно в 2 раза превышала наибольшие значения аналогичного параметра для образцов майенита, известные из литературы [7]. При этом у образца C12A7, полученного в водной среде, удельная поверхность после прокалки при температуре 600 °С составляла около 80 м2/г, что сопоставимо с литературными данными.
Рис. 1.
Зависимость удельной поверхности полученных аэрогелей от температуры термообработки: 1 – C12A7–1H2O, 2 – C12A7–2H2O, 3 – C12A7–5H2O.

Согласно результатам исследования синтезированных образцов методом рентгеновской дифракции во всех образцах сразу после сушки присутствовало небольшое количество кристаллического Ca(OH)2, который превращался в CaCO3 после прокалки на воздухе при 500 °С и в CaO после последующей прокалки при 900 °С. При этом в образце C12A7, синтезированном в водной среде, после прокалки при 600 °С единственной фазой, присутствовавшей в нем помимо CaO, была целевая фаза майенита, содержание которой составляло порядка 90%. Поскольку значительно более простым в исполнении методом синтеза в водной среде нам удалось получить образцы C12A7, содержащие почти чистую фазу майенита, именно такие образцы были выбраны для нанесения на них металлов в рамках поиска возможности синтеза перспективных катализаторов для окисления CO.
В образце аэрогеля C12A7–1H2O помимо Ca(OH)2 изначально присутствовал исключительно аморфный алюминат кальция, который только после прокалки при 900 °С превращался в смесь трех фаз, включая C12A7. В то же время нам удалось получить фазу майенита со средним размером кристаллитов около 20 нм наряду с аморфным алюминатом кальция сразу после сушки в автоклаве при использовании 5-кратного избытка воды. Однако удельная поверхность такого образца была существенно ниже и не превышала значения аналогичного параметра для образца, полученного в водной среде (рис. 1). Поэтому для последующего синтеза нанесенных металлических катализаторов использовали именно образец C12A7, синтезированный в воде.
Методом просвечивающей электронной микроскопии высокого разрешения было показано, что образцы аэрогеля C12A7–1H2O после прокалки при 500 °С состоят из пластинок аморфного алюмината кальция размером 10–20 нм (рис. 2a), которые увеличиваются при прокаливании до более высоких температур. На образце С12A7, синтезированном в водной среде, после прокалки при температуре 600 °С наблюдаются наночастицы майенита размером 20–40 нм. Нанесение палладия приводит к появлению наночастиц палладия размером 1–3 нм, достаточно неравномерно распределенных на поверхности частиц майенита (рис. 2б).
2.3. Характеризация активных центров майенита и катализаторов на его основе методом ЭПР
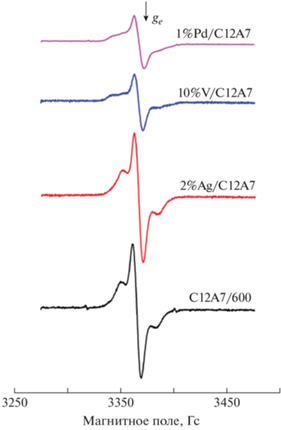
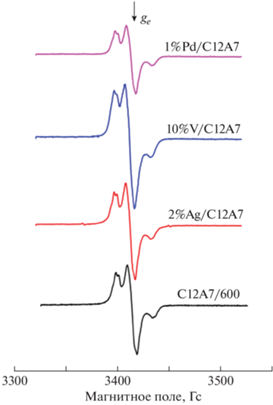
Все применяемые зонды содержат атом азота. Их спектры ЭПР представляют собой трехкомпонентные сигналы со сверхтонким расщеплением на этом атоме. Спектры, наблюдаемые после адсорбции тринитробензола на образцах C12A7, близки к спектрам анион-радикалов тринитробензола, ранее полученным для Al2O3 [31]. Наблюдается заторможенный триплетный сигнал ЭПР с g = 2.005 и константой сверхтонкого расщепления Azz = 26.5 Гс, которая практически не зависит от природы нанесенного металла (рис. 3). Это свидетельствует о том, что в исходном образце C12A7 и образцах с нанесенными металлами присутствуют электронодонорные центры такого же типа, как и на поверхности оксида алюминия.
Рис. 3.
Спектры ЭПР, наблюдаемые после адсорбции тринитробензола на образцах, активированных при 500 °С.
Результаты измерения концентрации активных центров для образцов с максимальным содержанием всех нанесенных металлов с использованием трех спиновых зондов, использованных в настоящей работе, представлены в табл. 1. Нанесение металлов не повлияло значительно на концентрацию электронодонорных центров. Их концентрация возрастала примерно в 2.5 раза при нанесении железа и падала примерно в 3 раза при нанесении меди, в то время как при введении других исследованных металлов, включая палладий, концентрация электронодонорных центров изменялась менее чем в 2 раза.
Таблица 1.
Концентрации активных центров на поверхности исследованных катализаторов, определенные методом ЭПР с использованием различных зондов
| Образец | Концентрация электроноакцепторных центров (зонд – фенотиазин), 1018 г–1 | Концентрация радикальных центров (зонд – дифениламин), 1018 г–1 | Концентрация электронодонорных центров (зонд – ТНБ), 1018 г–1 |
|---|---|---|---|
| C12A7-600 | 0.75 | 0.63 | 0.23 |
| 10% V/C12A7 | 1.12 | 0.23 | 0.23 |
| 2% Fe/C12A7 | 0.49 | 0.48 | 0.53 |
| 2% Ni/C12A7 | 0.65 | 0.51 | 0.36 |
| 2% Cu/C12A7 | 0.29 | 0.18 | 0.08 |
| 2% Ag/C12A7 | 0.76 | 0.45 | 0.32 |
| 1% Pd/C12A7 | 0.48 | 0.37 | 0.17 |
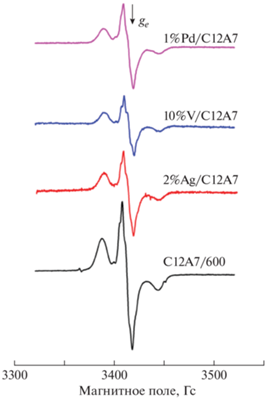
Потенциал ионизации фенотиазина составляет 6.8 эВ, что позволяет использовать его для тестирования слабых электроноакцепторных центров. На образце C12A7-600 и образцах с нанесенными на их поверхность металлами в результате адсорбции фенотиазина наблюдается триплетный сигнал ЭПР с константой сверхтонкого расщепления на атоме азота Azz = 18 Гс, соответствующий катион-радикалу фенотиазина (рис. 4).
Рис. 4.
Спектры ЭПР, наблюдаемые после адсорбции фенотиазина на образцах, активированных при 500 °С.
Концентрация электроноакцепторных центров, измеренная после адсорбции фенотиазина на поверхности исходного образца C12A7, использованного для нанесения металлов, оказалась примерно в 3 раза выше концентрации электронодорных центров на его поверхности (0.75 · 1018 и 0.23 · 1018 г–1 соответственно). Из образцов катализаторов, содержащих нанесенные металлы, снова выделяется только Cu/C12A7, концентрация электроноакцепторных центров на поверхности которого оказалась почти в 3 раза меньше, чем на образце без меди. В этом плане нанесение меди заметно снижает измеренные концентрации центров обоих типов. Вероятно, это может быть связано с наличием собственной парамагнитности у ионов Cu2+, которая может приводить к значительному уширению спектров ЭПР адсорбированных радикалов, локализованных вблизи ионов меди, или понижению их стабильности.
Потенциал ионизации дифениламина также достаточно низкий (7.2 эВ), что позволяет молекулам фенотиазина ионизоваться на слабых электроноакцепторных центрах, присутствующих на поверхности многих кислотных материалов, с образованием катион-радикалов. Однако известно, что в растворе дифениламин образует достаточно стабильные дифенилоксилнитроксильные радикалы в присутствии пероксидов, по-видимому, за счет реакции с гидроксилами, образующимися при их разложении.
Спектр, наблюдаемый после адсорбции дифениламина на поверхности С12А7-600 и образцах с нанесенными на них металлами, представляет собой триплет с константой Azz = 16 Гс, который можно отнести к дифенилоксилнитроксильным радикалам, адсорбированным на его поверхности (рис. 5). Их образование свидетельствует о существовании на поверхности высокодисперсных образцов майенита заметных концентраций радикалов, способных отрывать атом водорода от атома азота молекулы зонда. В качестве таких радикалов могут выступать радикалы O– или OH. Нанесение металлов на поверхность образца C12A7 приводит к уменьшению концентрации таких центров, особенно заметному для образцов V/C12A7 и Cu/C12A7 (табл. 1).
2.4. Исследование каталитической активности катализаторов на основе майенита в реакции окисления СО
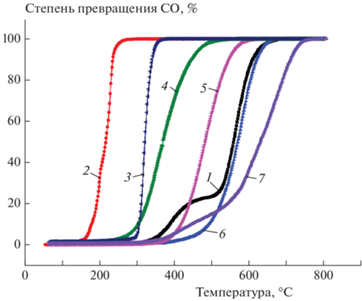
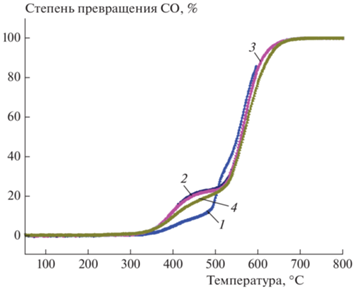
Как видно из рис. 6, образцы чистого C12A7 не проявили существенной каталитической активности в реакции окисления CO. При этом обращает на себя внимание существование плеча на кривых при температуре около 400 °С, по-видимому, связанного с каталитическим образованием кислородных радикалов на поверхности майенита.
Рис. 6.
Зависимость степени превращения CO от температуры в условиях каталитической реакции на образцах C12A7: 1 – серия 3, 50–600 °С; 2 – серия 4, 50–600 °С; 3 – серия 5, 50–800 °С; 4 – серия 6, 50–800 °С.
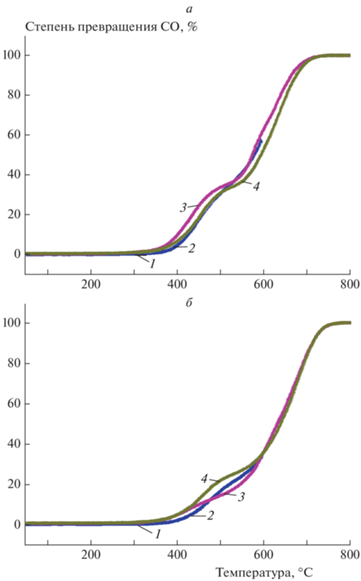
Как и ожидалось, нанесение палладия и увеличение его концентрации с 0.3 до 1 мас.% приводят к существенному росту каталитический активности (рис. 7). Вероятное наличие кислородных радикалов на поверхности майенита не приводит к более высокой активности катализаторов Pd/C12A7 по сравнению с палладием, нанесенным на другие оксиды, такие как Al2O3 и ZrO2.
Рис. 7.
Зависимость степени превращения CO от температуры в условиях каталитической реакции на образцах C12A7 с нанесенным палладием в количестве 0.3% (а) и 1% (б): 1 – серия 1, 50–320 °С; 2 – серия 2, 50–320 °С; 3 – серия 3, 50–600 °С; 4 – серия 4, 50–600 °С; 5 – серия 5, 50–800 °С; 6 – серия 6, 50–800 °С; 7 – серия 7, 50–400 °С.

Нанесение ванадия и увеличение его концентрации привели к снижению каталитической активности по сравнению с чистым майенитом (рис. 8). Вероятно, ванадий частично закрывает активные центры поверхности майенита и при этом сам не обладает заметной каталитической активностью в реакции окисления CO.
Рис. 8.
Зависимость степени превращения CO от температуры в условиях каталитической реакции на образцах C12A7 с нанесенным ванадием в количестве 5% (а) и 10% (б): 1 – серия 1, 50–320 °С; 2 – серия 3, 50–600 °С; 3 – серия 5, 50–800 °С; 4 – серия 6, 50–800 °С.
Температуры 50%-ной конверсии CO на катализаторах, содержащих различные количества разных нанесенных металлов, приведены в табл. 2. Для большинства металлов, кроме ванадия, нанесение большего количества металла приводит к росту каталитической активности. На рис. 9 приведены данные по каталитической активности образцов с нанесенными на них металлами в максимальных концентрациях. Активность в реакции окисления CO возрастает в ряду Ni–Cu–Ag–Pd по сравнению с чистым майенитом. Нанесение Fe и V приводит к снижению каталитической активности относительно исходного образца. К сожалению, ни один из изученных металлов, за исключением палладия, не показал высокой активности в реакции окисления CO. Однако активность образца 1%Pd/C12A7 оказалась ниже, чем у ранее исследованных катализаторов Pd/Al2O3 [37], активность которых была выше благодаря более высоким удельной поверхности и концентрации активных центров, способных стабилизировать палладий в высокоактивном состоянии. Также не наблюдалось существенного повышения активности нанесенных катализаторов за счет вероятного присутствия кислородных радикалов на поверхности майенита.
Таблица 2.
Температура 50%-ной конверсии CO на образцах майенита с различными нанесенными металлами
| Нанесенный металл | Концентрация, мас.% | Т50, °С | Нанесенный металл | Концентрация, мас.% | Т50, °С |
|---|---|---|---|---|---|
| Без металла | 558 | Ni | 0.5 | 555 | |
| Pd | 0.3 | 256 | 1 | 526 | |
| 1 | 216 | 2 | 484 | ||
| Ag | 0.5 | 363 | Fe | 0.5 | 563 |
| 1 | 336 | 1 | 582 | ||
| 2 | 321 | 2 | 570 | ||
| Cu | 0.5 | 519 | V | 5 | 573 |
| 1 | 467 | 10 | 630 | ||
| 2 | 370 |
3. ЗАКЛЮЧЕНИЕ
В настоящей работе были разработаны два способа синтеза высокодисперсных алюминатов кальция состава C12A7 (12CaO · 7Al2O3) – по реакции CaO со взвесью гидроксида алюминия в водной среде и по аэрогельной методике. Использование достаточно простой водной методики позволило существенно снизить температуру синтеза C12A7 по сравнению с методиками, известными в литературе, и получить наноразмерные материалы с кристаллической структурой майенита и удельной поверхностью около 80 м2/г после прокалки при 600 °С, что сопоставимо с величинами удельной поверхности лучших мировых аналогов.
В качестве исходных реагентов для синтеза образцов C12A7 по аэрогельной методике использовали металлический кальций и изопропилат алюминия, при этом соотношение Ca/Al соответствовало стехиометрическому составу фазы майенита. Удельная поверхность аэрогелей достигала 330 м2/г сразу после сушки в автоклаве и 170 м2/г после прокалки при температуре 500 °С, что примерно в 2 раза выше, чем у образцов майенита, полученных по другим методикам.
На поверхности всех синтезированных носителей и катализаторов были обнаружены электроноакцепторные центры, способные ионизовать молекулы фенотиазина с образованием катион-радикалов, электронодонорные центры, ионизующие тринитробензол с образованием анион-радикалов, а также центры радикальной природы, которые при взаимодействии с дифениламином дают стабильные нитроксильные радикалы. Образование нитроксильных радикалов при адсорбции дифениламина свидетельствует о существовании на поверхности майенита кислородных радикалов, которые могут проявлять высокую активность в различных реакциях каталитического окисления.
Методом пропитки по влагоемкости образца C12A7, полученного в водной среде, были синтезированы нанесенные катализаторы, содержащие Pd, V, Fe, Ni, Cu и Ag, и изучена их каталитическая активность в реакции окисления CO. Заметное увеличение каталитической активности образцов с нанесенными металлами наблюдалось в ряду V–Fe–Ni–Cu–Ag–Pd. Наиболее высокую каталитическую активность продемонстрировал образец с нанесенным палладием в концентрации 1%. Однако его активность оказалась ниже, чем у ранее исследованных катализаторов Pd/Al2O3, активность которых была выше благодаря более высоким значениям удельной поверхности и концентрации центров, способных стабилизировать палладий в высокоактивном состоянии.
Авторы благодарят К.В. Трегубову, С.В. Черепанову и Е.Ю. Герасимова за участие в экспериментах. Работа выполнена при финансовой поддержке Министерством науки и высшего образования РФ в рамках госзадания Института катализа СО РАН (регистрационный номер АААА-А21-121011390054-1).
Список литературы
Hayashi K., Matsuishi S., Kamiya T., Hirano M., Hosono H. // Nature. 2002. V. 419. P. 462.
Kitano M., Inoue Y., Yamazaki Y. et al. // Nature Chem. 2012. V. 4. № 11. P. 934.
Yang S.W., Kondo J.N., Hayashi K. et al. // Appl. Catal. A. 2004. V. 277. № 1–2. P. 239.
Li Q.X., Hosono H., Hirano M. et al. // Surf. Sci. 2003. V. 527. № 1–3. P. 100.
Volodin A.M., Zaikovskii V.I., Kenzhin R.M. et al. // Mater. Lett. 2017. V. 189. P. 210.
Volodin A.M., Bedilo A.F., Stoyanovskii V.O., Zaikovskii V.I. // Nanosystems: Phys., Chem., Math. 2018. V. 9. № 4. P. 558.
Meza-Trujillo I., Devred F., Gaigneaux E.M. // Mater. Res. Bull. 2019. V. 119. P. 110542.
Khaleel A.A., Klabunde K.J. // Chem. Eur. J. 2002. V. 8. № 17. P. 3991.
Ilyina E.V., Mishakov I.V., Vedyagin A.A. et al. // Micropor. Mesopor. Mater. 2012. V. 160. P. 32.
Меншутина Н.В., Лебедев А.Е., Худеев И.И. // Сверхкритич. флюиды: теория и практика. 2020. Т. 15. № 1. С. 92.
Koper O.B., Lagadic I., Volodin A., Klabunde K.J. // Chem Mater. 1997. V. 9. № 11. P. 2468.
Richards R., Li W.F., Decker S. et al. // J. Amer. Chem. Soc. 2000. V. 122. № 20. P. 4921.
Ilyina E.V., Mishakov I.V., Vedyagin A.A. et al. // Micropor. Mesopor. Mater. 2013. V. 175. P. 76.
Mishakov I.V., Heroux D.S., Chesnokov V.V. et al. // J. Catal. 2005. V. 229. № 2. P. 344.
Mishakov I.V., Vedyagin A.A., Bedilo A.F. et al. // Catal. Today 2009. V. 144. № 3–4. P. 278.
Ilyina E.V., Mishakov I.V., Vedyagin A.A. et al. // J. Sol-Gel Sci. Technol. 2013. V. 68. P. 423.
Ilyina E.V., Gerus Y.Y., Chereranova S.V., Bedilo A.F. // Mat. Lett. 2021. V. 293. P. 129699.
Medine G.M., Zaikovskii V., Klabunde K.J. // J. Mater. Chem. 2004. V. 14. № 4. P. 757.
Klabunde K.J., Stark J., Koper O. et al. // J. Phys. Chem. 1996. V. 100. № 30. P. 12142.
Mishakov I.V., Zaikovskii V.I., Heroux D.S. et al. // J. Phys. Chem. B. 2005. V. 109. № 15. P. 6982.
Bedilo A.F., Shuvarakova E.I., Volodin A.M. et al. // J. Phys. Chem. C. 2014. V. 118. № 25. P. 13715.
Vedyagin A.A., Bedilo A.F., Mishakov I.V., Shuvarakova E.I. // J. Serb. Chem. Soc. 2017. V. 82. № 5. P. 523.
Shuvarakova E.I., Bedilo A.F., Chesnokov V.V., Kenzhin R.M. // Top. Catal. 2018. V. 61. № 18–19. P. 2035.
Garcia H., Roth H.D. // Chem. Rev. 2002. V. 102. № 11. P. 3947.
Chiesa M., Giamello E., Che M. // Chem. Rev. 2010. V. 110. № 3. P. 1320.
Голубева Е.Н., Чумакова Н.А. // Сверхкритич. флюиды: теория и практика. 2018. Т. 13. № 3. С. 33.
Anpo M., Costentin G., Giamello E., Lauron-Pernot H., Sojka Z. // J. Catal. 2021. V. 393. P. 259.
Malykhin S.E., Volodin A.M., Bedilo A.F., Zhido-mirov G.M. // J. Phys. Chem. C. 2009. V. 113. № 24. P. 10350.
Бедило А.Ф., Володин А.М. // Кинетика и катализ. 2009. Т. 50. №. 2. С. 332.
Bedilo A.F., Shuvarakova E.I., Rybinskaya A.A., Medvedev D.A. // J. Phys. Chem. C. 2014. V. 118. № 29. P. 15779.
Medvedev D.A., Rybinskaya A.A., Kenzhin R.M., Volodin A.M., Bedilo A.F. // Phys. Chem. Chem. Phys. 2012. V. 14. P. 2587.
Vedyagin A.A., Gavrilov M.S., Volodin A.M. et al. // Top. Catal. 2013. V. 56. P. 1008.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др.// Хим. физика. 2020. Т. 39. № 3. С. 29.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2021. Т. 40. № 6 С. 10.
Гришин М.В., Гатин А.К., Слуцкий В.Г. и др. // Хим. физика. 2020. Т. 39. № 5. С. 84.
Vedyagin A.A., Volodin A.M., Kenzhin R.M., Chesnokov V.V., Mishakov I.V. // Molecules. 2016. V. 21. P. 1289.
Vedyagin A.A., Volodin A.M., Kenzhin R.M. et al. // Catal. Today. 2018. V. 307. P. 102.
Vedyagin A.A., Volodin A.M., Stoyanovskii V.O. et al. // Catal. Today. 2014. V. 238. P. 80.
Дополнительные материалы отсутствуют.
Инструменты
Химическая физика