Химия твердого топлива, 2021, № 2, стр. 42-46
ДИФФЕРЕНЦИАЛЬНО-СКАНИРУЮЩАЯ КАЛОРИМЕТРИЯ ГРАФИТА И АКТИВИРОВАННОГО УГЛЯ В АРГОНЕ
А. Н. Лопанов 1, *, Е. А. Фанина 1, **, Н. В. Нестерова 1
1 ФГБОУ ВО Белгородский государственный технологический университет им. В.Г. Шухова
308012 Белгород, Россия
* E-mail: alopanov@yandex.ru
** E-mail: evgenia-@mail.ru
Поступила в редакцию 30.06.2020
После доработки 29.07.2020
Принята к публикации 09.12.2020
Аннотация
Выполнены калориметрические и гравиметрические измерения дисперсий спектрального графита С-3, активированного угля ОУ-Б в атмосфере инертного газа – аргона при различных температурах. Показана актуальность проведенных исследований для технологии графита, активированного угля. Установлено, что важным параметром для физико-химических характеристик графитов, активированных углей является потеря массы в среде инертного газа при температурах до 1000°С.
ВВЕДЕНИЕ
Строение углеродных, графитовых материалов, часто являющихся компонентами твердых топлив – углей, является основой для понимания структурных и фазовых превращений, происходящих как при термической обработке топлив, так и в процессе метаморфизма. Структура углеродных материалов, графитов изучена достаточно подробно, изложена в научных статьях и монографиях, но существует проблема определения адсорбированного кислорода в графитах, активированных углях, а также ископаемых углях высокой стадии метаморфизма – антрацитах, полуантрацитах. Указанные углеродные вещества и материалы на их основе применяют в технологических процессах, где требуется не только высокая степень очистки, но и данные по структуре поверхностных соединений, дефектов кристаллической решетки, так как важными этапами получения композитов на основе углеродных матриц являются модификация поверхности и образование слоев, имеющих наноразмерные величины. Многие производители малозольных графитов особой чистоты, которые применяют в качестве оснастки при получении полупроводниковых материалов и в технологиях карбоновых изделий, не указывают наличие кислорода, которое может существенно превышать содержание других элементов, поэтому исследования, направленные на определение поверхностных свойств углеродных материалов, в частности, кислородных соединений углерода, актуальны и в настоящее время.
Цель работы состояла в установлении закономерностей потери массы, тепловых эффектов на графите и активированном угле в атмосфере инертного газа – аргона методом дифференциально-сканирующей калориметрии и на основе анализа кривых ДСК, ТГ определения кислорода, входящего в состав поверхностных функциональных групп и межплоскостных сеток углерода.
Кислородные соединения на поверхности углеродных веществ – графитов, активированных углей.
Физические и химические свойства углеродных соединений исследованы подробно и систематизированы по различным признакам [1–5]. Кислородные соединения определяют структуру поверхности, автоэмиссионные свойства углеродных материалов, а также другие физико-химические свойства, например, прочность, способность к окислению [6]. Так, производители указывают, что в образцах особо чистых графитов ГМЗ, ППГ, МГ, МГ-1 примесей содержится не более 5 ⋅ 10–3; 6 ⋅ 10–4% (классы чистоты ОСЧ-7-2, ОСЧ-7-3) [7]. В указанных образцах графита содержание углерода должно составлять 99.995−9.9994 мас. %, что может вызывать сомнение по достоверности, так как не указано содержание адсорбированного кислорода, входящего в структуру углеродных сеток. Декларируется, что в образцах графита С-3, применяемого для спектрального анализа, общее содержание примесей не превышает 1.43 ⋅ 10–3 мас. %, но содержание кислорода также не указано, табл. 1 [8].
Таблица 1.
Содержание примесей в спектральном графите С-3 [8]
| Примесь | Содержание примеси, % |
|---|---|
| Бор | 5 ⋅ 10–4 |
| Железо | 2 ⋅ 10–4 |
| Марганец | 2 ⋅ 10–5 |
| Медь | 6 ⋅ 10–5 |
| Кальций | 5 ⋅ 10–5 |
| Кремний | 4 ⋅ 10–4 |
| Алюминий | 5 ⋅ 10–5 |
| Титан | 1 ⋅ 0–4 |
| Ванадий | 2 ⋅ 10–5 |
| Никель | – |
| Серебро | – |
| Магний | 4 ⋅ 10–5 |
| Всего | 1.43 ⋅ 10–3 |
Кислородные соединения на поверхности углеродных веществ – активированных углях, ископаемых углях, графитах идентифицируются как химическими методами [9, 10], так и методами спектроскопии [11–14]. Показана роль кислородсодержащих групп при активации поверхности графита в условиях, допускающих окисление и без него.
На ископаемых углях различной стадии метаморфизма достаточно подробный обзор исследований определения функциональных групп представлен в работе [15]. В большинстве случаев на поверхности углеродных веществ можно выделить такие функциональные группы, как карбонильные, фенольные, карбоксильные, лактонные, хиноидные.
Электрохимические процессы, протекающие на поверхности углеродных электродов вследствие адсорбции кислорода, изучены в работе [16]. Показано, что уголь, обезгаженный в вакууме при повышенной температуре, при контакте с кислородом или воздухом практически мгновенно поглощает кислород, который химически адсорбируется на поверхности. Адсорбция кислорода влияет на ионный обмен, природу двойного электрического слоя в результате ионизации адсорбированного кислорода, химически связанного с поверхностью. Разность потенциалов между углем и раствором зависит от количества адсорбированного газа и рН среды. Так как в атмосфере кислорода уголь функционирует как кислородный электрод, то его поверхность заряжена положительно. Активированные угли, графиты в результате гидролиза поверхностных соединений и последующего ионного обмена посылают ионы гидроксила в раствор и адсорбируют анионы. Справедливость этих предположений подтверждается наличием линейной зависимости между количеством адсорбированных ионов и потенциалом угольного электрода [17]. Адсорбция кислорода исследовалась из различных электролитов на активированном угле, саже и графите, где были подтверждены вышеизложенные представления электрохимической теории адсорбции [18].
Строение поверхностных функциональных групп в углеродных веществах регистрируется электрохимическими методами. Обзор по применению электрохимических методов исследования поверхности ископаемых углей выполнен в работе [19]. Установлено наличие кислородных функциональных групп на ископаемых углях, графитах, других углеродных материалах. Активированные угли, графиты, природные угли поздней стадии метаморфизма – антрациты, полуантрациты вследствие наличия адсорбированного кислорода являются оксидными электродами. При контакте оксидного электрода с электролитом на поверхности реализуется электрохимический процесс с переносом заряда – электрохимическая полуреакция, которая регистрируется потенциометрическим методом. Методом моделирования на поверхности графитов идентифицированы функциональные группы различной природы, некоторые из которых представлены на рис. 1.
Рис. 1.
Функциональные группы на поверхности графита по результатам анализа потенциометрических кривых потенциал графитового электрода–кислотность среды [19].
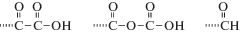
Поверхностные оксиды на углеродных веществах в зависимости от степени окисления могут занимать до 20% поверхности, но без окисления эта величина не превышает 2–5%. Таким образом, общее содержание кислорода в углеродных веществах может зависеть от их удельной поверхности. Например, при удельной поверхности активированного угля 800 м2/г содержание кислорода на поверхности в зависимости от степени окисления может достигать 0.02–0.2 г в расчете на 1 г угля (2–20 мас. %). В данном примере в расчетах предполагали, что диаметр молекулы кислорода можно оценить на уровне 1 ⋅ 10–10 м, а расчет проводили для фрагмента функциональной группы =С=О. На графите с удельной поверхностью 0.54 м2/г содержание кислорода на поверхности существенно меньше и может находиться в пределах от 1.4 ⋅ 10–5 до 1.4 ⋅ 10–4 г/г (1.4 ⋅ 10–3–1.4 ⋅ 10–2 мас. %). В действительности содержание кислорода в графите может существенно превышать указанные значения, так как основная часть кислорода может внедряться между плоскостями кристаллической решетки – для графита характерны соединения внедрения.
МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили с помощью синхронного термического анализатора ‟STA 449 F1 Jupiter”. Чувствительность прибора по гравиметрии (ТГ) составляла 0.025 мкг. Измерения проводили в атмосфере аргона в режиме дифференциально-сканирующей калориметрии при скорости нагрева образцов 10 град/мин. Проводили коррекцию полученных кривых по ДСК и ТГ. При проведении коррекции в держателе образца находился тигель без вещества. В качестве объектов исследования использовали спектральный графит высокой чистоты С-3, активированный уголь марки ОУ-Б. Для графита выделяли две фракции частиц, имеющих средние размеры частиц 5; 150 мкм. Удельную поверхность активированного угля находили по методу БЭТ при низкотемпературной адсорбции азота. Удельную поверхность фракций графита определяли по методу диффузии газа через дисперсный порошок, применяя прибор ПСХ-12. При микроскопическом исследовании установили, что активированный уголь ОУ-Б содержит частицы неправильной формы размером порядка 1 мкм, ромбоэдрические фрагменты 20–40 мкм, ситообразные структуры со сквозными отверстиями диаметром около 1 мкм. Частицы графита представляют куб или параллелепипед неправильной формы. Характеристики исследованных веществ представлены в табл. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
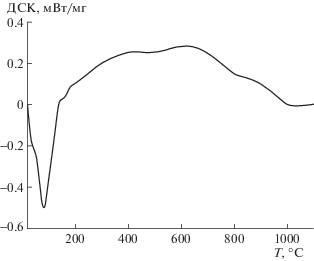
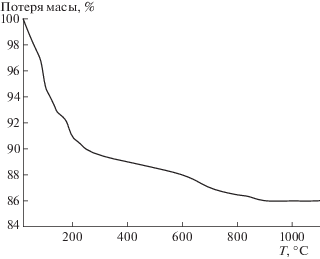
На рис. 2, 3 представлены кривые ДСК, ТГ в атмосфере аргона для частиц графита с различными размерами 5; 150 мкм. На кривой ДСК наблюдали экзотермический эффект с максимумом в области 841–842°С. Начало экзотермического эффекта зависит от дисперсности и при скорости нагрева 10 град/мин составляет для частиц 5; 150 мкм 520; 670°С соответственно. Выделение тепла заканчивается при 920; 1000°С. В исследованной области температур каких-либо фазовых превращений графита с выделением теплоты не существует, поэтому единственное объяснение полученных экспериментальных данных состоит в том, что происходит взаимодействие адсорбированного кислорода с углеродом с образованием оксидов углерода, которые десорбируются с поверхности. В указанной области температур происходит и потеря массы образцов, которая составляет около 0.6%. Отсутствие существенной разницы в общей потере массы от дисперсности графита свидетельствует о том, что основная часть кислорода находится не на поверхности частиц, а в межплоскостных сетках графита, образуя соединения внедрения. Оценим содержание кислорода в графите по кривым ТГ, ДСК, предполагая, что образуется оксид углерода (IV), стандартная энтальпия образования которого равна: ΔHo = –393.5 кДж/моль. По кривой ТГ расчетное содержание кислорода в графите составит 0.436 мас. %. Анализируя кривую ДСК, определим, что общее количество выделяемой теплоты при массе навески 9.48 мг составило около 0.5 Дж. Учитывая стандартную энтальпию образования оксида углерода (IV), расчетное значение содержания кислорода по кривой ДСК равно 0.428 мас. %. Таким образом, предположение о том, что в структуре графита С-3 находится адсорбированный кислород в количестве 0.44–0.43 мас. %, обосновано и подтверждено результатами гравиметрии и дифференциально-сканирующей калориметрии (кривые ТГ, ДСК).
Рис. 2.
Кривые ДСК графита С-3 в зависимости от температуры: 1, 2 – соответственно дисперсность 5; 150 мкм.
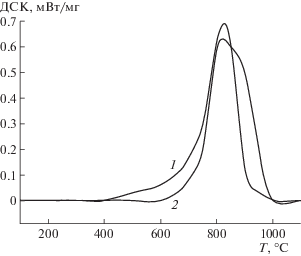
Рис. 3.
Кривые ТГ графита С-3 в зависимости от температуры: 1, 2 – соответственно дисперсность 5; 150 мкм.
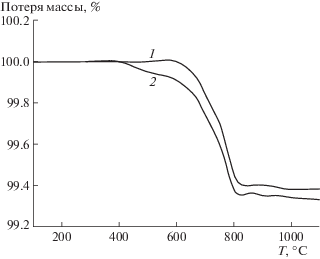
Более сложными являются зависимости потери массы и калориметрические характеристики от температуры для активированного угля ОУ-Б, рис. 4, 5. Представительные образцы активированного угля содержат до 7 мас. % влаги, которая удаляется при температурах до 180°С. Удаление влаги сопровождается эндотермическим эффектом с максимумом поглощения теплоты в области 95–96°С. Далее при термической обработке угля до 1000°С общая потеря массы достигает 14%. Наблюдали широкий пик выделения теплоты от 180 до 1000°С, имеющий несколько сглаженных максимумов при температурах 400; 650; 880°С. Предполагая, как и для графита, что потеря массы обусловлена выделением оксидов углерода, оценим содержание кислорода, адсорбированного активированным углем по кривой ТГ – 5.1 мас. %. Общее количество теплоты, выделяемое в интервале температур 180–1000оС, составляет 0.76 Дж. Если провести расчет и определить содержание кислорода по выделению теплоты, то величина составит 0.68 мас. %. Таким образом, оценки содержания кислорода в активированном угле по кривым ДСК, ТГ не совпадают – оценочные значения различаются в 7.5 раза. Следует выделить несколько причин, по которым нет совпадения расчетов на основе экспериментальных данных ТГ, ДСК. Во-первых, на кривых ДСК экзотермические эффекты занижены, так как на поверхности активированного угля присутствуют кислородные соединения углерода, которые десорбируются в других молекулярных формах, отличных от оксида углерода (IV). Например, десорбция соединений кислорода с углеродом, сходных по структуре с органическими соединениями, с поверхности активированных углей сопровождается поглощением теплоты, а образование оксидов углерода происходит с выделением теплоты, поэтому суммарный процесс выделения теплоты не соответствует реакции образования оксида углерода (IV). Потеря массы состоит из нескольких маршрутов – десорбция соединений органического характера с поверхности активированного угля, взаимодействие адсорбированного кислорода с углеродом и образованием оксидов углерода. Во-вторых, возможны эндотермические переходы и образование микроскопических фаз в турбостратной структуре активированного угля. В пользу возможности течения указанного процесса указывают пики на кривой ДСК.
Следует отметить достаточно высокую чувствительность определения адсорбированного кислорода на графите и тепловых эффектов в структуре углерода. Так, при чувствительности прибора 0.025 мкг и массе навески около 10 мг по кривой ТГ можно определить содержание кислорода вплоть до величин порядка 10–4 мас. %. По кривой ДСК, учитывая высокую энтальпию сгорания углерода, при мощности выделения теплоты 0.05 мВт/мг содержание кислорода также можно определять до величин порядка 10–4 мас. %.
ВЫВОДЫ
1. Исследование кривых ДСК, ТГ в атмосфере инертного газа – аргона на графитах, активированных углях необходимо для понимания технологии графита, активированного угля в связи с установлением количества адсорбированного кислорода, находящегося на поверхности и в межплоскостных сетках углерода. Важным параметром для физико-химических характеристик графитов, активированных углей является потеря массы в среде инертного газа при температурах до 1000°С.
2. Методом дифференциально-сканирующей калориметрии на графите с дисперсностью частиц 5; 150 мкм в среде аргона наблюдали характерный экзотермический эффект с максимумом при 841–842°С, сопровождающийся потерей массы, что вызвано взаимодействием хемосорбированного кислорода с углеродом и выделением оксида углерода (IV). По кривым ТГ, ДСК проведена оценка содержания адсорбированного кислорода. Результаты различных методов расчета совпадают, показывая, что содержание кислорода в межплоскостных сетках спектрального графита С-3 равно 0.43–0.44 мас. %.
3. Для активированного угля ОУ-Б общая потеря массы при термической обработке в среде аргона до 1000°С составляет 14%, кривые ДСК носят более сложный вид, чем для образцов графита, что обусловлено наличием на поверхности активированного угля кислородных соединений углерода, которые десорбируются в других молекулярных формах, отличных от оксида углерода (IV). Потеря массы происходит по нескольким маршрутам – в результате десорбции соединений органического характера с поверхности активированного угля, взаимодействия адсорбированного кислорода с углеродом и образованием оксидов углерода. Суммарный процесс выделения теплоты не соответствует реакции образования оксида углерода (IV).
Список литературы
Уббелоде А.Р., Льюис Ф.А. Графит и его кристаллические соединения. М.: Мир, 1965. 256 с.
Фиалков А.С. Углерод, межслоевые соединения и композиты на его основе М.: Аспект Пресс, 1997. 718 с.
Okino F., Touhara H. // Comprehensive Supramolecular Chemistry / Ed by J.L. Alwood et al. Oxford: Pergamon Press. 1996. V. 7. P. 25.
Heimann R.B., Evsykov S.E., Koga Y. // Carbon. Letters to the Editor. 1997. V. 35. № 10–11. P. 1654–1658.
Matsuo Y., Tabata T., Fukunaga T., Fukutsuka T., Sugie Y. // Carbon. 2005. V. 43. P. 2875–2882.
Шешин Е.П. Структура поверхности и автоэмиссионные свойства углеродных материалов. М: Изд-во МФТИ. Физматкнига, 2001. 287 с.
ЗАО “Графитсервис”. [Электронный ресурс] // URL. https://www.graphit-servis.ru/catalog/made/purity / (дата обращения 5.02.2020).
ООО НПО “Графит Гарант”. [Электронный ресурс] URL. http://grafit-garant.ru/grafit/us / (дата обращения 25.01.2019).
Burg P., Cagniant D. // Chemistry and physics of Carbon. 2008. V. 30. P. 129–176.
Zenga Y., Prasetyoa L., Nguyena Van T., etc. // Carbon. 2015. V. 81. P. 447–457.
Boehm H.P. // Carbon. 1994. V. 32. № 5. P.759–769.
Солдатов А.И. // Химическая технология. 2001. № 1. С. 155–163.
Collins J., Ngo T., Qu D., Foster M. // Carbon. 2013. V. 57. P. 174–183.
Смирнов Н.Н., Коновал А.В., Смирнова Д. Н., Кочетков С.П. // Экология и строительство. 2019. № 2. С. 11–17.
Хабибулина Е.Р. Исследование углей Кузбасса ряда метаморфизма физико-химическими методами: Дис. … канд. хим. наук. Кемерово: КГУ, 2018. 142 с.
Фрумкин А.Н. // Потенциалы нулевого заряда. М.: Наука, 1979. С. 57–59.
Wei W., Xu M., Chang H., Li X. // Energy Sources, Part A: Recovery, Utilization, and Environmental Effects. 2013. V. 35. P. 2181–2188.
Strobela R., Jorissena L., Schliermann T., ect. // J. Power Sources. 1999. № 84 (2). P. 221–224.
Лопанов А.Н. Коллоидно-электрохимические свойства углеродных материалов и их регулирование в гетерогенных системах: Дис. … докт. тех. наук. СПб: СПГТИ(ТУ). 2004. 319 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива