Химия твердого топлива, 2022, № 1, стр. 36-42
КАТАЛИТИЧЕСКИЕ СВОЙСТВА УЛЬТРАДИСПЕРСНОГО ПОРОШКА НИКЕЛЯ ПРИ ГИДРОГЕНИЗАЦИИ АНТРАЦЕНА И ФЕНАНТРЕНА
С. В. Ким 1, 2, *, К. С. Ибишев 1, **, М. И. Байкенов 2, ***, А. Тусипхан 2, ****, В. П. Григорьева 3, *****, А. М. Гюльмалиев 4, ******
1 РГП Химико-металлургический институт имени Ж. Абишева
100009 Караганда, Казахстан
2 НАО Карагандинский университет имени Е.А. Букетова
100028 Караганда, Казахстан
3 АО Институт топлива, катализа и электрохимии имени Д.В. Сокольского
050010 Алматы, Казахстан
4 ФГБУН Институт нефтехимического синтеза имени А.В. Топчиева РАН
119991 Москва, Россия
* E-mail: vanquishV8@mail.ru
** E-mail: ikanat2014@mail.ru
*** E-mail: murzabek_b@mail.ru
**** E-mail: almas_kz_22@mail.ru
***** E-mail: permyakova1962@inbox.ru
****** E-mail: gyulmaliev@ips.ac.ru
Поступила в редакцию 11.03.2021
После доработки 27.09.2021
Принята к публикации 13.10.2021
- EDN: OCSKBS
- DOI: 10.31857/S0023117722010029
Аннотация
Определены каталитические свойства ультрадисперсного порошка никеля с удельной поверхностью 11.7 м2/г и средним размером кристаллитов 34 нм, полученного совмещением электролиза на постоянном токе и высоковольтного разряда. Полученный порошок никеля использован в качестве наногетерогенного катализатора в процессах гидрогенизации антрацена и фенантрена. Проведено сравнение значений конверсий, полученных при использовании полученного ультрадисперсного порошка никеля, со значениями, полученными при использовании промышленного железо-хромового катализатора СТК-1 (Fe2O3 83.0%, Cr2O3 7.5%, CuO 2.0%) при тех же условиях. Установлено, что в процессе гидрогенизации антрацена в течение 60 мин, при температуре 450°C и давлении водорода 3 МПа в присутствии полученного никелевого порошка наибольшая конверсия антрацена составила 86.24%, а при использовании СТК-1 – 91.35%. При гидрогенизации фенантрена в течение 60 мин, при температуре 400°C и давлении 5 МПа с использованием полученного порошка никеля конверсия составила 32.28%, а при использовании СТК-1 – 25.9%.
Известно, что применение наноразмерных материалов в нефтехимических процессах в качестве наногетерогенных катализаторов является перспективным направлением [1], поскольку данный класс веществ благодаря наличию размерных эффектов [1, 2] способен проявлять высокую каталитическую активность [1, 3].
Благодаря своей высокой каталитической активности наногетерогенные катализаторы на основе никеля и его соединений представляют интерес для применения их в процессах гидрогенизации различных органических веществ. Так, например, при использовании катализаторов на основе никеля и его соединений при гидрировании бензола, ксилола и этилбензола наблюдается увеличение конверсий и констант скоростей реакций при меньших энергетических затратах [4, 5].
При использовании синтезированных in situ никель-молибденовых сульфидных соединений, обладающих высокой каталитической активностью из-за высокой скорости протекания реакций сульфидирования, конверсия нафталина при гидрировании в течение 60 мин достигает 60%, а при гидрировании алкилнафталинов в течение 8 ч конверсия составляет 56–100% [6].
В процессах гидрообессеривания дибензотиофена и 4,6-диметилдибензотиофена в присутствии никель-молибденовых сульфидных катализаторов, полученных гидротермальным способом, конверсия дибензотиофена составляет 67.8%, а 4,6-диметилдибензотиофена – 54% при соотношении Ni/(Mo + Ni) = 0.5, температуре 350°C, давлении водорода 2.8 МПа и продолжительности процесса 30 мин [7]. При этом в присутствии промышленного сульфидного NiMo/Al2O3 катализатора при тех же условиях конверсия дибензотиофена составляет 53.6%, а 4,6-диметилдибензотиофена – 26%.
Высокое содержание полициклических ароматических соединений в органическом сырье отрицательно влияет на качество производимой продукции, например для дизельных топлив снижается цетановое число, у топлив для реактивных двигателей также ухудшаются воспламенительные свойства и повышается нагарообразование [8]. Также следует отметить, что необходимость повышения эффективности процессов переработки органического сырья в первую очередь связана с возрастающими экологическими требованиями [9, 10].
Никель-вольфрамовые сульфидные соединения, синтезированные in situ растворением гексакарбонил вольфрама, 2-этилгексаноата никеля (II) и элементарной серы в углеводородном сырье, при гидрогенизации легкого рециклового газойля снижают содержание ароматических соединений и увеличивают степень гидродесульфуризации до 96.3% [11].
При гидроочистке дистиллятов каменноугольной смолы в присутствии MoNiWP/Al2O3 при 375°C и давлении водорода 6 МПа конверсия фенольной и нафталиновой фракций в циклоалканы достигает 60.4% и фенилциклоалканы – 83.9% [12]. А при использовании фосфида никеля, осажденного на кремниевый носитель, в процессах гидродеоксигенации фенольной фракции, выделенной из каменноугольной смолы, конверсия фенола при относительно мягких условиях (температура процесса – 370°C и давление водорода – 2 МПа) достигает 98.8% [13].
Одним из перспективных методов получения наночастиц металлов является электрический разряд в жидких средах, применение которого сопровождается протеканием ряда процессов, таких как низкотемпературная плазма, ультразвуковое и электромагнитное излучения, кавитационные процессы [14, 15].
Низкотемпературная плазма, образующаяся при электрическом разряде, способна вызвать испарение металла, пары которого перемещаются из зоны разряда в область более низких температур благодаря мощным возмущениям жидкости, возникающим из-за ударно-волнового воздействия разряда, и затем конденсируются до состояния мелких частиц [16].
Электрический разряд в жидких средах может применяться для получения ультрадисперсных порошков как индивидуальных веществ, так и соединений (карбидов и оксидов) из объемных материалов электродов, например при получении порошков Cu, WC и ZnO, когда материалами электродов являются Cu, W, Zn и графит [17]. При этом заданный химический состав может регулироваться изменением состава жидкости и материалов электродов, а при использовании дуги переменного тока с длительностью импульса 4 мс и силы тока 10 A происходит образование инкапсулированных наночастиц.
Цель данной работы – синтез ультрадисперсного порошка никеля электролизом на постоянном токе и высоковольтным разрядом и исследование каталитических свойств полученного порошка никеля при гидрогенизации антрацена и фенантрена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез никелевого катализатора проводили в реакторе, который был сконструирован таким образом, чтобы при электрохимическом растворении никелевого анода образующийся на катоде порошок никеля подвергался воздействию электроискрового разряда высокого напряжения. Для осуществления данной схемы к катоду из нержавеющей стали подведены два вольфрамовых анода, которые имеют форму острия, направлены перпендикулярно к плоскости катода по одному с каждой стороны и предназначены для высоковольтного воздействия электрического разряда. Зазор между катодом и вольфрамовыми анодами был выставлен на уровне 3 мм. Для обеспечения протекания электроискрового разряда во время процесса электролиза катод был подключен к двум источникам напряжения: постоянного и высоковольтного.
В данной работе для синтеза ультрадисперсного порошка никеля использовались многокомпонентные электролиты, а процесс электролиза проводился при различных плотностях тока и сопровождался воздействием разрядов высокого напряжения различной величины на катодную зону, поэтому для установления зависимостей выхода по току от различных факторов применялся вероятностно-детерминированный метод [18].
При составлении плана многофакторного эксперимента, согласно выбранной методике, в качестве варьируемых переменных были выбраны следующие факторы: катодная плотность тока (i, А/м2); концентрация сульфата калия в электролите (С (K2SO4)), г/л); продолжительность процесса (τ, мин); концентрация хлорида натрия в электролите (C (NaCl), г/л); величина высоковольтного разряда (U, кВ); концентрация сульфата аммония (C (NH4)2SO4, г/л). Диапазоны изменения уровней каждого фактора были установлены экспериментально.
Ввиду того что процесс проводили в водном растворе электролита при высоких плотностях тока, добавка сульфата аммония была необходима для поддержания pH раствора. Хлорид натрия предотвращает образование оксидной пленки на аноде. Сульфат калия устраняет осаждение никеля на катоде в виде компактного металла [19].
Уровни факторов представлены в табл. 1.
Таблица 1.
Уровни факторов
| Фактор | Уровень | ||||
|---|---|---|---|---|---|
| Плотность тока i, А/м2 | 11 000 | 13 000 | 15 000 | 17 000 | 19 000 |
| Концентрация сульфата калия C (K2SO4), г/л | 30 | 35 | 40 | 45 | 50 |
| Продолжительность процесса τ, мин | 30 | 40 | 50 | 60 | 70 |
| Концентрация хлорида натрия C (NaCl), г/л | 60 | 70 | 80 | 90 | 100 |
| Величина высоковольтного напряжения U, В | 12 000 | 13 000 | 14 000 | 15 000 | 16 000 |
| Концентрация сульфата аммония C((NH4)2SO4), г/л | 40 | 50 | 60 | 70 | 80 |
После группировки данных по уровням факторов были установлены частные зависимости выхода по току (q, %) от каждого выбранного фактора. Уравнения, алгебраически описывающие полученные частные зависимости плотности тока (q, %), от каждого выбранного фактора (табл. 1) в отдельности будут иметь следующий вид:
(6)
$\ln {{q}_{6}} = 3.29 + 0.23\ln C({{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{S}}{{{\text{O}}}_{4}}).$Обобщенное многофакторное уравнение, согласно выбранной методике, имеет следующий вид:
(7)
$\begin{gathered} \ln q = --5.05 + 0.35\ln i + 0.32\ln C({{{\text{K}}}_{2}}{\text{S}}{{{\text{O}}}_{4}}) + \\ + {\text{ }}0.25\ln t + 0.014\ln C({\text{NaCl}}) + \\ \, + 0.29\ln U + 0.23\ln C({{({\text{N}}{{{\text{H}}}_{4}})}_{2}}{\text{S}}{{{\text{O}}}_{4}}). \\ \end{gathered} $Для полученного обобщенного уравнения коэффициент корреляции составил R = 0.99.
Результаты экспериментальных значений выхода по току (qэ, %) и расчетов (qт, %), полученных при различных условиях, представлены в табл. 2.
Таблица 2.
Условия эксперимента, результаты опытов (qэ, %) и расчетов (qт, %)
| № опыта | q, А/м2 | С(K2SO4), г/л | τ, мин | C(NaCl), г/л | U, кВ | C(NH4)2SO4, г/л | qэ,% | qт, % |
|---|---|---|---|---|---|---|---|---|
| 1 | 11 000 | 30 | 30 | 60 | 12 000 | 40 | 44.21 | 44.14 |
| 2 | 11 000 | 40 | 50 | 80 | 14 000 | 60 | 63.36 | 63.45 |
| 3 | 11 000 | 35 | 40 | 70 | 13 000 | 50 | 53.79 | 53.84 |
| 4 | 11 000 | 50 | 70 | 100 | 16 000 | 80 | 82.77 | 82.64 |
| 5 | 11 000 | 45 | 60 | 90 | 15 000 | 70 | 73 | 73.04 |
| 6 | 15 000 | 30 | 50 | 70 | 16 000 | 70 | 69.48 | 69.37 |
| 7 | 15 000 | 40 | 40 | 100 | 15 000 | 40 | 62.32 | 62.36 |
| 8 | 15 000 | 35 | 70 | 90 | 12 000 | 60 | 70.81 | 70.71 |
| 9 | 15 000 | 50 | 60 | 60 | 14 000 | 50 | 75.89 | 76.01 |
| 10 | 15 000 | 45 | 30 | 80 | 13 000 | 80 | 67.65 | 67.71 |
| 11 | 13 000 | 30 | 40 | 90 | 14 000 | 80 | 62.05 | 62.14 |
| 12 | 13 000 | 40 | 70 | 60 | 13 000 | 70 | 73.92 | 73.99 |
| 13 | 13 000 | 35 | 60 | 80 | 16 000 | 40 | 63.93 | 63.83 |
| 14 | 13 000 | 50 | 30 | 70 | 15 000 | 60 | 64.74 | 64.78 |
| 15 | 13 000 | 45 | 50 | 100 | 12 000 | 50 | 64.41 | 64.32 |
| 16 | 19 000 | 30 | 70 | 80 | 15 000 | 50 | 74.58 | 74.63 |
| 17 | 19 000 | 40 | 60 | 70 | 12 000 | 80 | 82.35 | 82.23 |
| 18 | 19 000 | 35 | 30 | 100 | 14 000 | 70 | 67.35 | 67.45 |
| 19 | 19 000 | 50 | 50 | 90 | 13 000 | 40 | 73.74 | 73.8 |
| 20 | 19 000 | 45 | 40 | 60 | 16 000 | 60 | 78.34 | 78.22 |
| 21 | 17 000 | 30 | 60 | 100 | 13 000 | 60 | 69.28 | 69.34 |
| 22 | 17 000 | 40 | 30 | 90 | 16 000 | 50 | 65.06 | 64.96 |
| 23 | 17 000 | 35 | 50 | 60 | 15 000 | 80 | 76.93 | 76.98 |
| 24 | 17 000 | 50 | 40 | 80 | 12 000 | 70 | 74.65 | 74.54 |
| 25 | 17 000 | 45 | 70 | 70 | 14 000 | 40 | 75.85 | 75.96 |
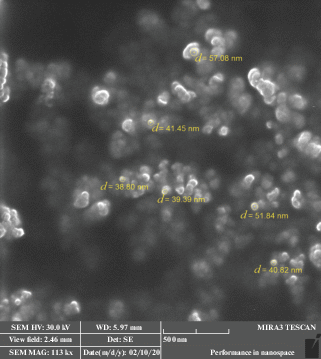
Морфология поверхности полученных частиц никеля установлена методом сканирующей электронной микроскопии с помощью электронного микроскопа MIRA 3 TESCAN.
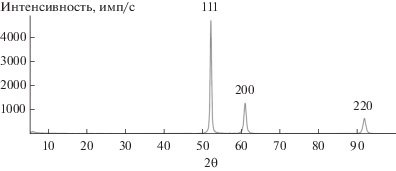
Рентгенофазовый анализ синтезированного порошка никеля был выполнен на дифрактометре ДРОН 4-07 с применением рентгеновского излучения с длиной волны λ = 0.179085 нм (CoKα-излучение).
Приблизительный размер кристаллитов синтезированного порошка никеля рассчитан по самому большому дифракционному пику (111), с помощью уравнения Шеррера для сферических частиц кубической сингонии:
где D – средний размер кристаллитов (нм); λ – длина волны рентгеновского излучения (нм); B – ширина рефлекса на полувысоте (в радианах, и в единицах 2θ); θ – угол дифракции (брэгговский угол).Величина удельной поверхности полученного порошка никеля определена с помощью низкотемпературной адсорбции азота по методу БЭТ на установке SorbiMS.
Анализ, проведенный с помощью газового хроматографа, показал, что исходный антрацен не содержал примесей, а в составе исходного фенантрена содержались флуорен в количестве 3.67% и дибензотиофен – 2.08%.
Химический состав исходных антрацена и фенантрена, а также продуктов гидрогенизации, определяли с помощью газового хроматографа Agilent 7890А с масс-селективным детектором Agilent 5975C. Анализ проводили при следующих условиях: тип колонки Rxi-5ms; длина колонки 30 м; диаметр колонки 0.25 мм; толщина адсорбента колонки 0.25 мкм; температура испарителя 250°С; температура колонки 60–300°С; скорость нагрева колонки 8°С/мин; температура источника ионов 230 °С; температура квадрупольного конденсатора 150°С; газ-носитель – гелий; давление газа в колонке 13789.51 Па; объем пробы 0.0002 см3; режим ввода – с разделением потока (split); режим регистрации масс-спектров – сканирование (scan); библиотека – NIST08; метод расчета состава фракций – относительно площади пиков (полуколичественный метод). Обработка результатов производилась автоматически при помощи программы GS-MSD Data Analysis.
Каталитическая активность катализатора, взятого в количестве 1% от массы органического соединения в течение 60 мин устанавливалась в аппарате высокого давления (автоклав) объемом 0.05 л. Поскольку при гидрировании не использовались растворители и доноры водорода, то выбор минимальных значений температуры и давления для проведения процесса гидрирования был сделан исходя из температур кипения антрацена (340.9°C), фенантрена (339.7°C) и значений критических давлений в районе 3 МПа [20]. В качестве катализатора сравнения был взят промышленный железо-хромовый катализатор СТК-1 (Fe2O3 83.0%, Cr2O3 7.5%, CuO 2.0%).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Снимок сканирующей электронной микроскопии, представленный на рис. 1, показал, что полученный порошок никеля представляет собой агрегаты, состоящие из наноразмерных частиц округлой формы.
Дифрактограмма синтезированного порошка никеля, представленная на рис. 2, содержит три пика с индексами (111), (200) и (220), что соответствует гранецентрированной кубической решетке.
Средний размер кристаллитов, рассчитанный по уравнению (8), составил 34 нм.
Величина удельной поверхности полученного порошка никеля до гидрогенизации составила 11.7 м2/г, а после процесса гидрогенизации уменьшилась до 7.1 м2/г.
В результате гидрогенизации установлено, что наибольшая конверсия антрацена в присутствии никелевого порошка в течение 60 мин достигается при давлении P = 3 МПа и температуре t = = 450°C. Продукты, полученные при каталитической гидрогенизации антрацена, представлены в табл. 3, из которой видно, что при проведении процесса гидрогенизации антрацена в течение 60 мин при давлении 3 МПа и температуре 450°C конверсия антрацена составила 86.24%, в продуктах наблюдается преобладание дигидроантрацена (27.07%) и тетрагидроантрацена (22.8%), остальная часть продуктов состояла из алкилнафталинов (13.41%), алкилдифенилов (12.47%) и алкилбензолов (8.88%), октагидроантрацена (0.66%).
Таблица 3.
Результаты гидрогенизации антрацена в присутствии ультрадисперсного порошка никеля и промышленного железо-хромового катализатора СТК-1
| Технологические параметры: t = 450°C; P = 3 МПа | ||
|---|---|---|
| Соединение | выход, мас. % | |
| полученный порошок Ni | СТК-1 | |
| О-ксилол | 0.37 | – |
| Тетрагидронафталин | – | 0.16 |
| Нафталин | 1.42 | 0.73 |
| 1-Метилнафталин | – | 0.8 |
| 2-Метилнафталин | 4.44 | – |
| 1,3-Диметилнафталин | 0.26 | – |
| 2,3-Диметилнафталин | – | 1.93 |
| 5-этил-1,2,3,4-Тетрагидронафталин | 0.15 | – |
| 1-Этилнафталин | 5.67 | 1.01 |
| 1-Пропилнафталин | 0.18 | – |
| 2-Бутилнафталин | 1.29 | 1.5 |
| 1-Метил-4-фенилметилбензол | 8.51 | – |
| Дифенилметан | 5.8 | – |
| 2-Метил-1,1-дифенил | – | 1.45 |
| 2,2'-Диметилдифенил | 0.4 | – |
| 2-Этилдифенил | – | 1.6 |
| 4-Этилдифенил | 6.27 | – |
| 9,10-Дигидроантрацен | 27.07 | 46.4 |
| 1,2,3,4,5,6,7,8-Октагидроантрацен | 0.66 | – |
| 1-Метилфлуорен | 0.21 | – |
| 1,2,3,4-Тетрагидроантрацен | 22.8 | 35.44 |
| 2-Метил-9,10-дигидроантрацен | 0.24 | – |
| 4-Гидроксистильбен | 0.14 | – |
| Неидентифицированные | 0.36 | 0.33 |
| Антрацен | 13.76 | 8.65 |
| Расход H2 | ~2.0% | ~2.9% |
Результаты гидрогенизации антрацена в присутствии промышленного катализатора СТК-1 при тех же условиях представлены в табл. 3, из результатов которой видно, что при использовании СТК-1 значительную часть продуктов составляют дигидроантрацен (46.4%) и тетрагидроантрацен (35.44%), что существенно больше, чем при использовании полученного порошка никеля.
Алкилнафталины, вероятно, образуются в результате насыщения нафтеновых колец, изомеризации и последующем крекинге тетра- и октагидроантраценов. Образование алкилдифенилов, возможно, связано с деструкцией центрального циклогексанового кольца дигидроантрацена. Алкилнафталины и алкилдифенилы расщепляются в конечном итоге до алкилбензолов [21]. При этом деструкция алкилдифенилов до алкилбензолов, возможно, происходит через разрушение метиленового мостика, поскольку ароматическая связь C–С тяжелее подвергается процессу гидрирования, чем одинарная мостиковая связь С–С [22].
Для фенантрена максимальная конверсия достигается при проведении процесса гидрогенизации в течение 60 мин при давлении P = 5 МПа и температуре t = 400°C. Продукты каталитической гидрогенизации фенантрена представлены в табл. 4, из которой видно, что в продуктах гидрогенизации фенантрена при использовании полученного никелевого порошка преобладает дигидрофенантрен (21.17%) и тетрагидрофенантрен (7.29%), а конверсия фенантрена составила 32.28%.
Таблица 4.
Результаты гидрогенизации фенантрена в присутствии ультрадисперсного порошка никеля и промышленного железо-хромового катализатора СТК-1
| Технологические параметры: t = 400°C; P = 5 МПа | ||
|---|---|---|
| Соединение | выход, мас. % | |
| полученный порошок Ni | СТК-1 | |
| 1,3-Диметилбезнол | 0.1 | – |
| Нафталин | 0.26 | 0.16 |
| Дифенил | 0.40 | 0.18 |
| 1-Метилнафталин | 0.29 | – |
| 2-Метилнафталин | – | 0.17 |
| 1-Этилнафталин | 1.60 | 1.22 |
| 2-Этилнафталин | – | – |
| 2-Этилдифенил | 0.38 | 0.17 |
| 4-Этилдифенил | 0.29 | 0.22 |
| 2-Метилдифенилметан | 0.06 | – |
| Флуорен | 3.55 | 3.15 |
| 9-Метилфлуорен | 1.60 | 1.13 |
| Бензол, 1,1'-этилиденбис | 0.16 | – |
| 9,10-Дигидрофенантрен | 21.17 | 18.34 |
| 1,2,3,4,5,6,7,8-Октагидрофенантрен | 0.12 | – |
| 1,2,3,4-Тетрагидрофенантрен | 7.29 | 5.32 |
| Неидентифицированные | 0.16 | 0.12 |
| Фенантрен | 62.57 | 69.82 |
| Расход H2 | ~1.6% | ~1.5% |
При использовании СТК-1 в продуктах также преобладают дигидрофенантрен (18.34%) и тетрагидрофенантрен (5.32%), а конверсия фенантрена составила 25.9%.
ЗАКЛЮЧЕНИЕ
Результаты проведенного исследования показали, что совмещение процесса электролиза с высоковольтным разрядом является эффективным способом получения ультрадисперсного порошка никеля, обладающего высокой каталитической активностью. В данном способе электрохимический синтез ультрадисперсного порошка никеля проводится при нормальных условиях и не требует создания вакуума или инертной среды.
При гидрогенизации антрацена в присутствии полученного порошка никеля в составе продуктов, кроме гидропроизводных общей долей 50.53%, содержится существенное количество продуктов деструкции общей долей 35.71%. В случае с применением СТК-1 в продуктах образуются преимущественно гидропроизводные в общем количестве 81.84% и продукты деструкции в количестве 9.51%. Конверсия антрацена при гидрогенизации с применением полученного порошка никеля приблизительно на 5% ниже, чем при применении СТК-1.
По значениям конверсии в процессах гидрогенизации фенантрена синтезированный порошок никеля приблизительно на 7% превосходит промышленный СТК-1. При этом продукты гидрогенизации фенантрена состоят в основном из гидропроизводных – 28.58% и продуктов деструкции – 3.7%. В случае с СТК-1 содержание в продуктах гидропроизводных составило 23.66% и продуктов деструкции – 2.24%.
Список литературы
Хаджиев С.Н. // Нефтехимия. 2011. Т. 51. № 1. С. 3. [Petrol. Chem., 2011, V. 51, Issue 1, p. 1–15. https://doi.org/ 10.1134/S0965544111010063].
Andrievski R.A., Glezer A.M. // Scripta mater. 2001. V. 44. P. 1621.
Heinz U., Landman U. Nanocatalysis. Springer-Verlag. Berlin: Heidelberg, 2007. 503 p.
Шубина Е.Г., Филимонов Н.С., Шафигулин Р.В., Буланова А.В., Шишковский И.В., Морозов Ю.Г. // Нефтехимия. 2017. Т. 57. № 3. С. 299. [Petrol. Chem., 2017, V. 57, № 5, p. 410–414. https://doi.org/10.1134/S0965544117020244].https://doi.org/10.7868/S0028242117020174
Shafigulin R.V., Filippova E.O., Shmelev A.A., Bulanova A.V. // Catal. Lett. 2019. V. 149. P. 916.
Петрухина Н.Н., Сизова И.А., Максимов А.Л. // Катализ в промышленности. 2017. № 2. С. 111. [Catal. Ind., V. 9, Issue 3, p. 247–256. https://doi.org/10.1134/S2070050417030102].https://doi.org/10.18412/1816-0387-2017-2-111-119
Yoosuk B., Song C., Kim H.J., Ngamcharussrivichai C., Prasassarakich P. // Catal. Today. 2010. V. 149. P. 52.
Cooper B.H., Donnis B.B.L. // Appl. Catalysis A: General. 1996. V. 137. P. 203.
Song C., Ma X. // Appl. Catalysis B: Environmental. 2003. V. 41. P. 207.
Houda S., Lancelot C., Blanchard P., Poinel L., Lamonier C. // Catalysts. 2018.V. 8, Issue 9 (344). P. 1.
Maximov A.L., Sizova I.A., Khadzhiev S.N. // Pure and Appl. Chem. 2017. V. 89, Issue 8. P. 1145.
Tang W., Fang M., Wang H., Yu P., Wang Q., Luo Z. // Chem. Eng. J. 2014. V. 236. P. 529.
Pan L., He Y., Niu M., Dan Y., Li W. // J. Mater. Sci. 2020. V. 55, Issue 4. P. 1614.
Ushakov V.Ya., Klimkin V.F., Korobeynikov S.M. Impulse breakdown of liquids. Springer-Verlag Berlin Heidelberg, 2007. 397 p.
Wesołowski M., Tabor S., Kielbasa P., Kurpaska S. // Appl. Sci. 2020. V. 10, Issue 11. Article number: 3900. P. 1.
Тепанов А.А., Крутяков Ю.А., Лисичкин Г.В. // Росс. хим. журн. 2012. Т. 56. № 5–6. С. 18. [Russ. J. Gen. Chem., 2014, V. 84, Issue 5, p. 986–997. https://doi.org/10.1134/S1070363214050363].
Бураков В.С., Савастенко Н.А., Тарасенко Н.В., Невар Е.А. // Журн. прикладн. спектроскопии. 2008. Т. 75. № 1. С. 111. [J. Appl. Spectrosc., 2008, V. 75, Issue 1, p. 114–124. https://doi.org/10.1007/s10812-008-9003-z].
Малышев В.П. Вероятностно-детерминированное отображение. Караганда: Гылым, 1994. 376 с.
Баймаков Ю.В., Журин А.И. Электролиз в гидрометаллургии. 2-е изд., перераб. и доп. М.: Металлургия, 1977. 336 с.
Nikitin E.D., Popov A.P. // J. Chem. Thermodynam. 2015. V. 80. P.124.
Cusumano J.A., Dalla Betta R.A., Levy R.B. Catalysis in Coal Conversion. New York: Academic Press, 1978. 272 p.
Chareonpanich M., Zhang Z-G., Tomita A. // Energy & Fuels. 1996. V. 10. P. 927.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива