Химия твердого топлива, 2022, № 2, стр. 11-20
ПОСТПИРОГЕННОЕ ИЗМЕНЕНИЕ СОСТАВА ЛИПИДОВ ТОРФА И БОЛОТНЫХ РАСТЕНИЙ
О. В. Серебренникова 1, *, Е. Б. Стрельникова 1, **, И. В. Русских 1, ***, Д. В. Федоров 1, ****
1 ФГБУН Институт химии нефти СО РАН (ИХН СО РАН)
634055 Томск, Россия
* E-mail: ovs49@yahoo.com
** E-mail: seb@ipc.tsc.ru
*** E-mail: rus@ipc.tsc.ru
**** E-mail: denilletti@gmail.com
Поступила в редакцию 26.11.2021
После доработки 02.12.2021
Принята к публикации 08.12.2021
- EDN: SCTLAW
- DOI: 10.31857/S0023117722020098
Аннотация
Методом хромато-масс-спектрометрии исследованы состав липидов болотных растений и торфа, отобранных на фоновой и выгоревшей территориях Бакчарского болота Томской области, бассейн р. Гавриловка. Идентифицированы основные группы органических соединений: ациклические – н-алканы, изопреноиды, жирные кислоты и их метиловые эфиры, н-алкан-2-оны, а также циклические соединения – токоферолы, стероиды, сескви-, ди- и тритерпеноиды, определено содержание их индивидуальных представителей. Полученные данные могут использоваться для фиксации в разрезе осадочной толщи постпирогенных слоев при палеоклиматических реконструкциях и для оценки перспектив использования растительного и торфяного сырья территорий после пожара.
Торф во многом наследует состав липидов растений, а условия торфообразования накладывают свой отпечаток на набор органических соединений в торфе [1–4]. В состав торфа входят органические соединения биогенного происхождения (н-алканы, сквален, стероиды, сескви-, ди- и тритерпеноиды и т.п.), поступающие из болотных растений [5, 6]. Состав этих соединений отражает естественные условия формирования торфа в заболоченных регионах [1, 7].
Повышенное или пониженное содержание отдельных органических соединений в торфе может быть следствием климатических условий [3, 7], геохимической обстановки залежи [8], высокой активности микрофлоры и более интенсивной трансформации присутствующего в торфах этого болота органического вещества [9].
Кроме соединений биогенного происхождения в состав липидов торфа и болотных вод могут входить органические компоненты антропогенного характера [4, 10]. К одному из антропогенных факторов воздействия на окружающую среду относятся пожары. С конца 20-го века на болотах Западной Сибири возросла пожарная активность, связанная с жизнедеятельностью человека [11].
Сразу после пожара болота превращаются в источник углерода, а изменения в растительности после пожара играют ведущую роль в управлении ходом постпирогенного баланса углерода, и восстановление мохового и кустарничкового покрова вновь возвращает болота к поглощению углерода [12]. Условием восстановления функции стока углерода является восстановление мхов, а появление вместо мхов деревьев и кустарников ведет к истощению запасов углерода [13].
Пожары, приводящие к деградации растительного покрова [14] и оказывающие жесткое термическое воздействие на подстилающие слои торфяных залежей, должны приводить к изменению содержания и состава органических соединений в них. В этом отношении при лесных пожарах наиболее изучен состав полициклоароматических углеводородов – широко распространенных канцерогенных и мутагенных загрязнителей [15, 16]. Изменение состава других органических соединений, способных зафиксировать реакцию растений на окислительный стресс, вызванное пожаром, менее изучено.
Целью работы было оценить влияние пожара на состав липидов в растениях и торфе на территории Бакчарского болота Томской области.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
После пожара августа 2016 г. на осушенном сосново-кустарничково-сфагновом верховом болоте Бакчарского района Томской области на фоновом и выгоревшем участках (табл. 1) в 2018–2020 гг. были отобраны багульник, хамедафна, Sphagnum fuscum и торф. Для горелого участка характерны гибель в основном древесного яруса, выгорание надземной части травяно-кустарничкового и полное выгорание мохового яруса на всех формах микрорельефа. Торфяные залежи на выгоревшем участке встречаются как явно горелые (Г), так и без видимых признаков горения (ТГ).
Таблица 1.
Характеристика мест отбора растений и торфа сосново-кустарничково-сфагнового болота
| Краткое описание места отбора пробы | Координаты отбора пробы |
|---|---|
| Горелое болото | 56°53′20,3″ с.ш. 82°40′35,9″ в.д. |
| Фоновый участок в 200 м от пожа-ра, рям | 56°53′25,8″ с.ш. 82°40′50,5″ в.д. |
Для определения состава органического вещества (ОВ) липидные компоненты из высушенных растений и торфа были выделены экстракцией 7%-ным раствором метанола в хлороформе при 60°С. Содержание и индивидуальный состав органических соединений определяли методом хромато-масс-спектрометрии с использованием магнитного хромато-масс-спектрометра Trace-DSQ фирмы “Thermo Scientific” (Германия). Режим работы хроматографа: кварцевая капиллярная хроматографическая колонка фирмы “Thermo Scientific” с внутренним диаметром 0.25 мм, длиной 30 м, толщина фазы 0.25 мкм, неподвижная фаза – TR-5MS; газ-носитель – гелий, температура испарителя 250°С, температура интерфейса 250°С. Индивидуальные соединения идентифицировали по масс-фрагментограммам в программе X-Calibur 10 с использованием компьютерной библиотеки масс-спектров NIST.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В образцах растений и торфа идентифицированы группы ациклических (табл. 2) и циклических (табл. 3) соединений.
Таблица 2.
Содержание отдельных групп ациклических соединений в растениях и торфе с различных участков болота
| Индекс образца | Участок | Содержание, мкг/г | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| алк | скв | ЖК | МЭ | аон | фитон | фитол | альд | сумма ациклических соединений | ||
| Багульник | ||||||||||
| БФ | Фоновый | 798.8 | 27.9 | 23.5 | 5.7 | 24.9 | 1.5 | 43.3 | 58.2 | 983.8 |
| БГ | Горелый | 710.1 | 19.5 | 28.7 | 6.1 | 7.4 | 4.6 | 39.9 | 25.0 | 841.2 |
| Хамедафна | ||||||||||
| ХФ | Фоновый | 160.3 | 3.7 | 28.1 | 35.4 | 32.4 | 2.6 | 36.9 | 21.4 | 320.8 |
| ХГ | Горелый | 113.4 | 2.3 | 14.5 | 15.9 | 8.6 | 1.0 | 21.8 | 12.4 | 189.8 |
| Sphagnum fuscum | ||||||||||
| СФ | Фоновый | 138.4 | 2.7 | 38.8 | 3.7 | 24.8 | 3.4 | 29.0 | 5.2 | 246.0 |
| СГ | Горелый | 97.7 | 2.5 | 38.2 | 3.1 | 23.3 | 3.1 | 15.6 | 5.9 | 189.6 |
| Торф | ||||||||||
| ТФ | Фоновый | 77.6 | 3.3 | 19.1 | 2.6 | 23.1 | 1.2 | 5.2 | 7.2 | 139.4 |
| ТГ | Горелый | 54.5 | 3.0 | 17.3 | 1.5 | 34.1 | 1.5 | 2.6 | 10.5 | 125.0 |
| Торф горелый | ||||||||||
| Г | Горелый | 6.6 | 5.8 | 7.9 | 0.2 | 0.7 | 0.3 | 0.9 | 1.3 | 23.8 |
Таблица 3.
Содержание отдельных групп циклических соединений в растениях и торфе с различных участков болота
| Индекс образца |
Участок | Содержание, мкг/г | |||||
|---|---|---|---|---|---|---|---|
| СТ | ДТ | ПЦТ | Стероиды | ТФ | Сумма циклических | ||
| Багульник | |||||||
| БФ | фоновый | 2269.5 | 0 | 348.3 | 22.4 | 9.3 | 2649.5 |
| БГ | горелый | 5551.3 | 0 | 436.7 | 18.9 | 5.7 | 6012.6 |
| Хамедафне | |||||||
| ХФ | фоновый | 8.0 | 0.5 | 947.7 | 38.2 | 8.0 | 1002.5 |
| ХГ | горелый | 9.8 | 0.1 | 507.5 | 17.1 | 2.4 | 536.9 |
| Sphagnum fuscum | |||||||
| СФ | фоновый | 2.2 | 1.3 | 80.4 | 34.3 | 3.5 | 121.7 |
| СГ | горелый | 1.2 | 0.6 | 27.2 | 36.4 | 3.0 | 68.5 |
| Торф | |||||||
| ТФ | фоновый | 7.9 | 6.9 | 62.1 | 53.2 | 5.0 | 135.1 |
| ТГ | горелый | 2.7 | 0.4 | 73.6 | 44.9 | 3.2 | 124.9 |
| Торф горелый | |||||||
| Г | горелый | следы | 1.1 | 3.7 | 4.7 | 0.6 | 10.1 |
Их усредненное суммарное содержание в образцах, отобранных внутри контура пожара и фоновом участке болота, находится в пределах 250–6854 мкг/г и растет в 10 и более раз в ряду торф – Sphagnum fuscum – хамедафна – багульник (табл. 4). Минимальное значение зафиксировано в образцах торфа и Sphagnum fuscum с горелого участка, максимальное – в багульнике с горелого участка. Для всех образцов торфа и растений, за исключением багульника, зафиксировано снижение суммарного содержания идентифицированных органических соединений в образцах горелого участка по сравнению с фоновым.
Таблица 4.
Усредненное содержание органических соединений в растениях и торфе с различных участков болота
| Индекс образца | БФ | БГ | ХФ | ХГ | СФ | СГ | ТФ | ТГ | Г |
|---|---|---|---|---|---|---|---|---|---|
| Участок | Фоновый | Горелый | Фоновый | Горелый | Фоновый | Горелый | Фоновый | Горелый | Горелый |
| Общее содержание, мкг/г | 3633.3 | 6853.8 | 1323.3 | 726.7 | 367.7 | 258.0 | 274.5 | 249.9 | 33.9 |
| Циклические/ациклические | 2.7 | 7.1 | 3.1 | 2.8 | 0.5 | 0.4 | 1.0 | 1.0 | 0.4 |
В образцах мха в составе идентифицированных соединений преобладают ациклические структуры, в торфяных объектах (за исключением горелого торфа) – содержание ациклических и циклических структур одинаково. В кустарничках содержание циклических структур превышает ациклические: в хамедафне и фоновом образце багульника – в 3 раза, в багульнике горелого участка болота – в 7 раз (табл. 4).
Среди идентифицированных групп ациклических органических соединений в растениях и торфе преобладают н-алканы (Алк), жирные кислоты (ЖК), н-алкан-2-оны (Аон) (табл. 2), менее распространены н-альдегиды (Альд), метиловые эфиры жирных кислот (МЭ), а также представители ациклических изопреноидов: сквален (Скв), фитол и фитон. Содержание ациклических соединений, идентифицированных в образцах растений и торфа, увеличивается в ряду торф – Sphagnum fuscum – хамедафна – багульник, причем во всех объектах оно снижено на горелом участке болота по сравнению с фоновым (табл. 2). н-Алканы преобладают в составе ациклических структур, их относительное содержание на горелом и фоновом участках составляет: в торфе – 43 и 56%, во мхе – 51 и 54%, в хамедафне – 58 и 50%, в багульнике – 85 и 82%. Зафиксировано снижение общего содержания н-алканов на 30% в торфе, мхе и хамедафне на горелом участке по сравнению с фоновым, в то время как в багульнике – только на 11% (табл. 2).
Распределение ациклических структур (н-алканов и н-алкан-2-онов) типично для верховых торфов и болотной растительности Западной Сибири [17]. Алканы в образцах растений и торфа представлены набором гомологов С14–С36 с резким преобладанием нечетных структур в кустарничках и более сглаженным – в торфе и мхе. В максимальном количестве в кустарничках присутствуют н-алканы С27–С33, причем в багульнике доминирует С31, в хамедафне – С29 (рис. 1). Несмотря на различное суммарное содержание н-алканов в кустарничках горелого и фонового участков болота, их молекулярно-массовое распределение идентично.
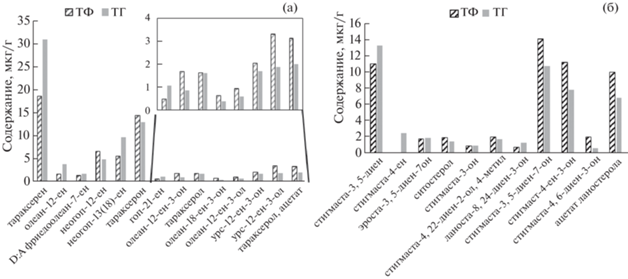
Рис. 1.
Молекулярно-массовое распределение н-алканов в багульнике (а), хамедафне (б), Sphagnum fuscum (в), торфе (г).
Состав н-алканов торфа и мха представлен в основном нечетными гомологами С21–С33, причем во мхе преобладает гомолог С25, в торфе его количество сопоставимо с С31. На горелом участке болота в составе мха и торфа зафиксировано небольшое снижение количества н-алканов С29, С31 и С33 по сравнению с образцами фонового участка, что может свидетельствовать о разрушении высокомолекулярных н-алканов при повышении температуры окружающей среды [18].
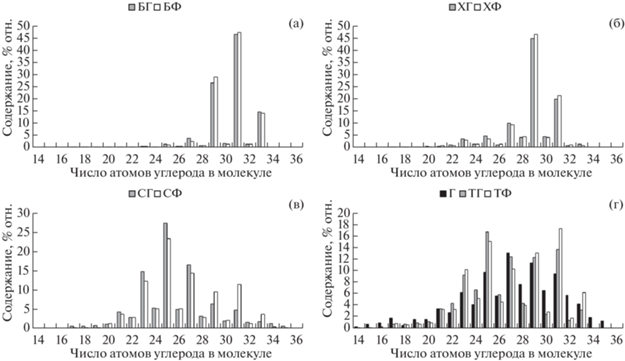
Состав н-алкан-2-онов хамедафны, Sphagnum fuscum и торфа фонового и пирогенно нарушенного участков одинаков: в ряду гомологов С19–С35 максимум приходится на С27, на втором месте по содержанию – С25 и С29 (рис. 2). В отличие от остальных растений в багульнике состав н-алкан-2-онов на фоновом и пирогенно нарушенном участке различается. На фоновом участке среди них преобладает гомолог С29, на выгоревшем – С27 и С31.
Рис. 2.
Молекулярно-массовое распределение н-алкан-2-онов в багульнике (а), хамедафне (б), Sphagnum fuscum (в), торфе (г).
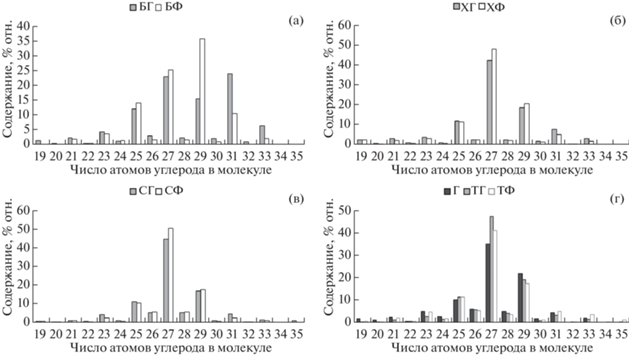
Состав жирных кислот растений и торфа пирогенного и фонового участков одинаков: доминируют четные кислоты С14–С20 с преобладанием пальмитиновой кислоты. Обнаружены также метиловые эфиры жирных кислот С15–С33 с двумя максимумами: на С17 и С23–С27 (рис. 3). В фоновом образце багульника преобладает гомолог С25, а в горелом – С17, что отличает это растение от остальных и торфа, где не зафиксирована разница в распределении метиловых эфиров жирных кислот в зависимости от пирогенной нагрузки.
Рис. 3.
Молекулярно-массовое распределение метиловых эфиров жирных кислот в багульнике (а), хамедафне (б), Sphagnum fuscum (в), торфе (г).
Таким образом, последствием пирогенного воздействия для ациклических разностей, идентифицированных в составе липидов растений и торфа, в большинстве случаев является снижение содержания всех групп соединений. Изменения в индивидуальном составе ациклических соединений, являющиеся следствием пожара, характерны только для багульника и, возможно, объясняются специфическим соотношением в нем отдельных биосинтезированных групп соединений, обусловленным отличиями в физиологии этого растения от хамедафны и сфагнового мха.
Сопоставление распределения ациклических и циклических соединений в растениях и торфе фонового и пирогенно нарушенного участков показывает значительно более выраженное различие в содержании в растениях этих участков циклических разностей, что указывает на их большую подверженность воздействию внешних факторов.
Основными среди идентифицированных циклических органических соединений в растениях и торфе являются пентациклические тритерпеноиды (ПЦТ) (табл. 3). Исключением является багульник, где количество сесквитерпеноидов (СТ) превышает содержание всех остальных групп соединений в 1.2–7.9 раза. В торфе и мхе в сопоставимом с ПЦТ количестве содержатся также стероиды. Во всех растениях и торфе в подчиненном количестве присутствуют токоферолы (ТФ) и дитерпеноиды (ДТ).
Багульник. В составе липидов багульника фонового участка в максимальном количестве присутствуют сесквитерпеноиды и н-алканы. Повышено также содержание ПЦТ. В багульнике с выгоревшего участка, отобранном через три и четыре года после пожара, незначительно понижено содержание большинства классов идентифицированных соединений, за исключением бициклических сесквитерпеноидов и ПЦТ, содержание которых после пожара возросло (в 2.5 и 1.3 раза соответственно).
Сесквитерпеноиды багульника с незатронутого пожаром участка на 88–90% представлены палустролом и ледолом, они включают также 5(1H)-азуленон, 2,4,6,7,8,8a-гексагидро-3,8-диметил-4-(1-метилэтилиден) и аромадендрен. На фоне увеличения после пожара концентрации всех этих соединений, их относительное содержание в составе сесквитерпеноидов практически не изменились. Следовательно, последствием пожара является более интенсивный биосинтез в багульнике сесквитерпеноидов, что, тем не менее, не приводит к изменению их состава.
Набор ПЦТ в багульнике фонового участка преимущественно включает Δ12 урсены (63%), а также Δ18 (12%) и Δ12 (25%) олеанены, практически не меняясь во времени. На постпирогенном участке через три и четыре года после пожара (по усредненным данным) несколько увеличилась доля урсенов (64%) и олеаненов (14%) Δ18, снизилась доля Δ12 олеаненов (22%). При этом максимальное изменение (19.8, 15.4 и 64.8%) зафиксировано через три года, а через четыре года состав приблизился к наблюдаемому в багульнике фонового участка (23.4, 13.2 и 63.4%). Все три класса ПЦТ представлены структурами, различающимися заместителем в положении 3 молекул (спиртовая или кетонная группа). На фоновом участке относительное содержание спиртов лишь незначительно превышает (65%) содержание кетонов, на постпирогенном – оно существенно выше и составляет через три года после пожара 93.7%, а через четыре года восстанавливается до 65.6%, т.е. практически совпадает с зафиксированным в багульнике фонового участка. Это указывает на существенное влияние постпирогенных условий на интенсивность, или, возможно, на пути биосинтеза в багульнике отдельных представителей ПЦТ и восстановление программы биосинтеза через четыре года после пожара.
Стероиды представлены стигмастенами (С29) и ланостенами (С30). Их набор и содержание меняются независимо от пирогенного воздействия, и связаны, видимо, с ростом багульника, поскольку и на фоновом, и на пирогенном участке в течение года изменения в составе стероидов багульника имеют однонаправленный характер.
Хамедафна. Развитие хамедафны на незатронутом пожаром участке в течение трех лет привело, при незначительном изменении концентрации, к увеличению в составе липидов доли большинства классов идентифицированных соединений за счет резкого снижения относительного содержания ПЦТ. На постпирогенном участке (проанализированы растения, собранные через два, три и четыре года после пожара) хамедафна содержит более низкие концентрации всех идентифицированных классов соединений по сравнению с фоновым участком. По мере роста растения на горелом участке, в отличие от фонового, зафиксированы снижение в составе липидов, наряду с ПЦТ, доли токоферолов, фитолов и жирных кислот и существенное увеличение доли н-алканов и сесквитерпеноидов.
Набор сесквитерпеноидов в хамедафне, в отличие от багульника, более широк (идентифицировано 11 разновидностей), но среди них, как и в багульнике на фоновом участке, преобладают палустрол и ледол (72–80 отн. %). Остальные сесквитерпеноиды не содержат функциональных групп. От фонового к горелому участку суммарное содержание сесквитерпеноидов в хамедафне снижается, затем, с увеличением времени, прошедшего после пожара, постепенно увеличивается. На второй год после пожара в хамедафне, произрастающей на горелом участке, не обнаружены палустрол и ледол, которые вновь зафиксированы через три и четыре года.
Концентрация дитерпеноидов и стероидов при переходе от фонового к горелому участку снижается без изменения соотношения содержания отдельных соединений. Дитерпеноиды представлены во всех образцах хамедафны абиета-8,11,13-триеном и склареном. В стероидах наряду со следовыми количествами С28 подавляюще преобладают производные ситостерола (С29). Среди ПЦТ, включающих преимущественно Δ12 олеанены и Δ12 урсены (86–96 отн. %), доминируют α- и β-амирины с преобладанием во всех исследованных образцах хамедафны α-амирина.
Таким образом, последствиями пожара для хамедафны явились торможение процесса биосинтеза большинства классов липидов, затем его интенсификация по мере роста растения на фоне замедления биосинтеза ПЦТ, токоферолов, фитолов и жирных кислот, не влияющее, в отличие от багульника, на избирательное образование или торможение синтеза отдельных соединений.
Sphagnum fuscum. В составе липидов Sphagnum fuscum фонового участка в максимальном количестве присутствуют н-алканы и ПЦТ. Повышено также содержание жирных кислот и стероидов. Содержание большинства классов идентифицированных липидов в Sphagnum fuscum после пожара меняется незначительно. Заметно снижается содержание н-алканов, ПЦТ.
Основными представителями стероидов на фоновом и горелом участках являются стигмаст-4-ен-3-он и стигмаста-3,5-диен-7-он. В составе стероидов горелого участка на второй год после пожара резко понижено содержание стигмастерола, появился спинастерон, возросло количество стигмастан-3,6-диона, исчез 4-метил-стигмаста-4,22-диен-3-ол, который вновь появился во мхе через три и четыре года, а количество стигмастан-3,6-диона в это время снизилось.
Известно, что образование стигмастерола из ситостерола в растениях стимулирует пониженная температура окружающей среды [19], а увеличение температуры должно тормозить такой переход. Величина отношения присутствующих во мхе стигмастерола к ситостеролу на участке, незатронутом пожаром, составляет 3.1, а на горелом участке через два, три и четыре года – 1.6, 2.0 и 2.1 соответственно. Следовательно, последствием пожара явились условия, способствующие сохранению в сфагновом мхе структуры ситостерола, угнетая процесс перехода его в стигмастерол. При увеличении времени, прошедшего после пожара, соотношение стигмастерола и ситостерола приблизилось к значению, зафиксированному на незатронутом пожаром участке.
Результатом пожара явилось исчезновение в составе ПЦТ Sphagnum fuscum углеводородов гопенового (Δ21, Δ13,18 и Δ12), а также Δ14 олеаненового рядов. Состав спиртов и кетонов Δ12 и Δ14 олеаненов, Δ12 урсенов и Δ20,29 лупенов меняется незначительно. Во всех исследованных образцах преобладают тараксерон, α- и β-амирины. В составе дитерпеноидов, представленных 18-норабиета-8,11,13-триеном и метиловым эфиром дегидроабиетиновой кислоты, при переходе от фонового к пирогенно нарушенному участку снижается доля метилового эфира дегидроабиетиновой кислоты от 85–93 до 51% на второй год после пожара, затем возрастает до 64 и 77% через три и четыре года соответственно.
Сесквитерпеноиды представлены в Sphagnum fuscum фонового участка девятью структурными формами с максимальным содержанием палустрола. На горелом участке на второй год после пожара мхи не содержат палустрола. На этом участке палустрол появляется в Sphagnum fuscum через три года, фиксируется также через четыре года и преобладает в составе сесквитерпеноидов, как и на фоновом участке.
Торф. Постпирогенные изменения в составе липидов верхнего слоя торфа первоначально связаны с термическим воздействием на торфяную залежь, контактирующую с источником огня и горением непосредственно торфа, а с течением времени – с дополнительным поступлением с болотными водами органических компонентов растений, состав липидов которых в результате пожара и впоследствии видоизменился.
Торф фонового участка, как и его основные растения-торфообразователи, – сфагновые мхи, характеризуется преобладанием в составе липидов н-алканов, ПЦТ и стероидов. В молекулярно-массовом распределении н-алканов торфа повышено содержание С25, но в отличие от Sphagnum fuscum в торфе высоко также содержание гомолога С31 – соединения, преобладающего среди н-алканов багульника (рис. 1). После пожара относительное содержание С31 снизилось, что может быть следствием отсутствия поступления в торфяную залежь н-алканов, продуцируемых частично выгоревшим кустарником.
В составе ПЦТ торфа на фоновом и горелом участках присутствуют и преобладают основные ПЦТ, присущие Sphagnum fuscum, тараксерен и тараксерон, но в отличие от Sphagnum fuscum в торфе доминирует УВ (тараксерен). Содержание после пожара тараксерена в торфе возрастает, а кетона (тараксерон) и спирта (тараксерол) – снижается (рис. 4,а).
После пожара в торфе снижается также содержание кетонов и спиртов Δ12 урсенов и Δ12 олеаненов, а также характерного для багульника кетона олеанена Δ18. Возрастает содержание УВ: Δ21 и Δ13,18 гопенов и Δ12 олеанена. Следовательно, основными изменениями в составе ПЦТ торфа после контакта с источником огня явились снижение концентрации в нем соединений, содержащих функциональные заместители, и возрастание представителей УВ. Это может являться следствием элиминирования в результате термического воздействия кетонной и спиртовой групп в молекулах олеаненов и урсенов с образованием соответствующих УВ, а увеличение содержания гопенов – с активизацией после пожара развития в торфяной залежи бактерий, продуцирующих гопеновые структуры [20].
Как и для ПЦТ, для частично ненасыщенных стероидов С29 наблюдается тенденция снижения содержания соединений с функциональными заместителями и увеличения концентрации УВ (рис. 4,б). Не подчиняются этому только представители стероидов – эргоста-3,5-диен-7-он (С28) и ланоста-8,24-ден-3-он (С30), концентрация которых в торфе выгоревшего участка незначительно возрастает, а содержание насыщенного стигмастан-3-она не меняется. Наличие стигмастерола зафиксировано только в одном образце торфа, отобранном на горелом участке на второй год после пожара. Величина отношения стигмастерола к ситостеролу в этом торфе составляет 0.5.
В составе дитерпеноидов в исследованном торфе присутствует метиловый эфир дегидроабиетиновой кислоты, представляющий на фоновом участке до 95% дитерпеноидов, а на горелом – 56–85%, возрастая с увеличением промежутка времени после пожара. Кроме него идентифицированы УВ – 18-норабиета-8,11,13-триен, абиета-8,11,13-триен и 13-метил-17-норкаур-15-ен. Сесквитерпеноиды в торфе фонового участка представлены палустролом и ледолом. В торфе горелого участка на второй год после пожара сесквитерпеноиды исчезают, через три года появляется палустрол, а через четыре года – сесквитерпеноиды, как и на фоновом участке, они представлены палустролом и ледолом.
Горелый торф (Г) отличается от остальных исследованных образцов торфа Бакчарского болота как существенно более низкой общей концентрацией липидов, так и содержанием большинства их отдельных групп (табл. 2–4). Исключение представляют ациклический тритерпен – сквален и дитерпеноиды, содержание которых, особенно сквалена, в горелом торфе выше, чем в торфе, который только контактировал с источником огня (ТГ). В составе дитерпеноидов, наряду с идентифицированными в не подвергавшемуся горению торфу фонового и горелого участков, присутствует и доминирует трахилобан (табл. 5). В то же время в горелом торфе отсутствует его изомер – 13-метил-17-норкаур-15-ен, присущий остальным торфам исследованных участков. Вполне вероятно, что в процессе горения имела место трансформация этого соединения в трахилобан за счет процессов гидрирования и циклизации, а появление в горелом торфе дегидроабиетиновой кислоты может быть обусловлено частичным деметилированием ее эфира.
Таблица 5.
Содержание (мкг/г) стероидов, ди- и пентациклических терпеноидов в горелом торфе
| Стероиды | Дитерпеноиды | ||
|---|---|---|---|
| Стигмаста 3,5-диен | 0.12 | Трахилобан | 0.84 |
| Холестерол | 0.05 | 18-Норабиета-8,11,13-триен | 0.03 |
| Эргостерол | 0.05 | Абиета-8,11,13-триен | 0.01 |
| Кампестерол | 0.36 | Метиловый эфир дегидроабиетиновой кислоты | 0.16 |
| Стигмастерол | 0.42 | Дегидроабиетиновая кислота | 0.07 |
| Стигмастан-3-ол | 0.07 | ПЦТ | |
| Ситостерол | 3.11 | Тараксерон | 0.53 |
| Эргоста-3,5-диен-7-он | 0.02 | Гоп-21-ен | 0.04 |
| Стигмастан-3-он | 0.14 | Тараксерол | 0.94 |
| Ланостa-8,24-диен-3-oн | 0.33 | Олеан-12-ен-3-ол | 0.43 |
| Эргост-4-ен-3-он | 0.06 | Урс-12-ен-3-он | 0.49 |
| Стигмаста-3,5-диен-7-oн | 0.19 | Урс-12-ен-3-ол | 0.81 |
| Стигмаст-4-ен-3-он | 0.41 | Ацетат тараксерола | 0.22 |
| Стигмастa-4,6-диен-3-oн | 0.06 | Метил-3-ацетоксилуп-20(29)-eн-28-oaт | 0.26 |
| Ацетат ланостерола | 0.26 | ||
В процессе горения в составе стероидов резко возросла доля спиртов. Их относительное содержание в составе стероидов торфа ТГ составляет 4.8–8.1%, в торфе Г – 55.1%. Видимо, горение стимулировало гидрирование кетонной группы с образованием спиртовой. Величина отношения стигмастерола к ситостеролу в торфе Г составляет 0.13, это ниже, чем в торфе ТГ (0.5), что также может быть следствием частичного гидрирования стигмастерола в процессе горения с образованием ситостерола.
Увеличение доли стероидов С28 от 3% в торфе ТГ до 9% в торфе Г, в котором, кроме того, присутствует холестерол (С27), указывает на возможное деметилирование в процессе горения алкильной цепи стероидов С29.
Аналогично стероидам в составе ПЦТ при горении возрастает доля спиртов от 12 до 59%. Соотношение кетоны/спирты в торфах горелого участка составляет 2:1, в горелом торфе – меняется на обратное. В горелом торфе исчезли УВ, за исключением Δ21 гопена, а также сесквитерпеноиды – наиболее летучие среди обнаруженных циклических соединений.
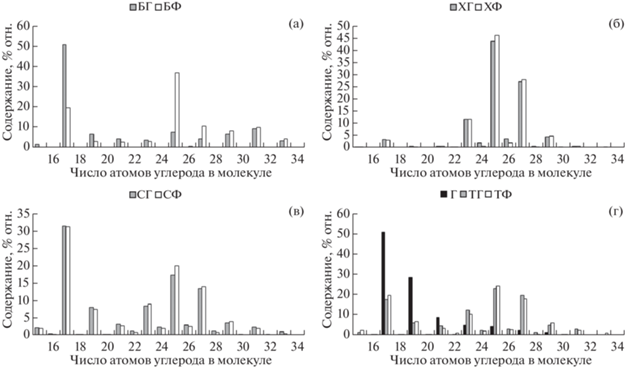
По сравнению с образцом торфа ТГ, в торфе Г существенно снизилось относительное содержание алифатических структур – н-алканов (с 43 до 28%) и н-алкан-2-онов (с 26 до 3%), в то же время доля изопреноидных соединений, таких как фитол и фитон, не изменилась.
Снижение в торфе Г общего содержания н-алканов обусловлено преимущественным разрушением как высокомолекулярных гомологов С31 и С33, так и относительно низкомолекулярных С23 и С25, в результате чего в составе н-алканов этого торфа преобладает С27 (рис. 2). Разрушение высокомолекулярных гомологов могло произойти под действием высоких температур, а низкомолекулярных – под действием бактерий, развитие которых после пожара могло активизироваться. О микробном воздействии на горелый торф может свидетельствовать также повышение, по сравнению с ТГ, доли метилового эфира пальмитиновой кислоты в составе эфиров карбоновых кислот (рис. 4), зафиксированному ранее в экспериментах по микробному окислению торфа [9].
ЗАКЛЮЧЕНИЕ
Изучен постпирогенный состав липидов в растениях и торфе на территории Бакчарского болота Томской области в течение 4-летнего периода. Термический стресс (пожар), повлиявший на особенности биосинтеза в растениях, какое-то время оказывает влияние, затем программа биосинтеза восстанавливается, растение продуцирует набор соединений, состав и соотношение которых аналогичны синтезированным без термического воздействия. Так, на второй и третий год после пожара липиды багульника, хамедафны и Sphagnum fuscum, произрастающих на постпирогенном участке, отличаются от липидов соответствующих растений фоновой территории пониженным содержанием большинства групп ациклических соединений. При этом в сфагновом мхе возрастает содержание стероидов, в багульнике и хамедафне – сесквитерпеноидов, а в багульнике, кроме того, увеличивается концентрация ПЦТ, фитона, жирных кислот и их метиловых эфиров. Перераспределение в составе ациклических структур характерно только для багульника: среди н-алкан-2-онов на фоновом участке доминирует С29, на выгоревшем – С27 и С31; в ряду метиловых эфиров жирных кислот в фоновом образце багульника преобладает гомолог С25, а в горелом – С17. На четвертый год после пожара состав липидов растений постпирогенного участка приближается к составу тех же растений фонового.
Установлено, что основными изменениями в составе липидов торфа после контакта с источником огня явилось снижение концентрации в нем большинства групп идентифицированных соединений. Увеличение концентрации отмечено для альдегидов, н-алкан-2-онов, фитона и ПЦТ. В составе ПЦТ, дитерпеноидов и стероидов торфа с постпирогенного участка, по сравнению с фоновым, возрастает содержание представителей УВ и снижается концентрация соединений, содержащих функциональные заместители. В составе н-алканов торфа фонового участка при бимодальном распределении преобладает С31, на постпирогенном – С25.
Исследование состава горелого торфа показало, что в отличие от остальных исследованных образцов торфа Бакчарского болота, он характеризуется существенно более низкой общей концентрацией липидов и содержанием большинства их отдельных групп, за исключением дитерпеноидов и сквалена. Появление в горелом торфе дегидроабиетиновой кислоты может быть обусловлено частичным деметилированием ее эфира, а исчезновение сесквитерпеноидов связано с их повышенной летучестью. В процессе горения резко возрастают содержание ситостерола и доля спиртов в составе стероидов и ПЦТ, что может быть следствием гидрирования кетонной группы с образованием спиртовой, и восстановление одной из ненасыщенных связей стигмастерола. В составе алканов горелого торфа преобладает С27, а содержание гомологов С31 и С33 и С23 и С25 снизилось, по сравнению с остальными торфами Бакчарского болота.
Таким образом, органические соединения, идентифицированные на территории, подвергшейся пожару, могут служить биомаркерами для выявления постпирогенных слоев в разрезе торфяной залежи при палеоклиматических реконструкциях. Полученные в работе результаты можно использовать и для оценки перспектив рационального применения растительного и торфяного сырья территорий после пожара, например, для медицинских, косметических целей.
Список литературы
Дучко М.А. Геохимия биомаркеров в торфах юго-восточной части Западной Сибири: Дис. … канд. геол.-минерал. наук. Томск: ИХН СО РАН, 2017. 149 с.
Серебренникова О.В., Прейс Ю.И., Кадычагов П.Б., Гулая Е.В. // ХТТ. 2010. № 5. С. 40. [Solid Fuel Chemistry, 2010, no. 5, p. 324.]
Серебренникова О.В., Стрельникова Е.Б., Русских И.В., Дучко М.А. // ХТТ. 2017. № 4. С. 3. [Solid Fuel Chemistry, 2017, no. 4, p. 195. https://doi.org/10.3103/S0361521917040097]https://doi.org/10.7868/S0023117717040016
Русских И.В., Стрельникова Е.Б., Серебренникова О.В., Воистинова Е.С., Харанжевская Ю.А. // Геохимия. 2020 Т. 65. № 4. С. 405. [Geochemistry International, 2020, v. 58, no. 4, p. 447. https://doi.org/10.1134/S0016702920040072]
Серебренникова О.В., Гулая Е.В., Стрельникова Е.Б., Кадычагов П.Б., Прейс Ю.И., Дучко М.А. // Химия растительного сырья. 2014a. № 1. С. 257.
Стрельникова Е.Б., Серебренникова О.В., Прейс Ю.И. // ХТТ. 2014. № 2. С. 12. [Solid Fuel Chemistry, 2014, v. 48, no. 2, p. 85. https://doi.org/10.3103/S0361521914020128].https://doi.org/10.7868/S0023117714020121
Серебренникова О.В., Дучко М.А., Коронатова Н.Г., Стрельникова Е.Б. // ХТТ. 2018. № 1. С. 38. [Solid Fuel Chemistry, 2018, no. 52, p. 36. https://doi.org/10.3103/S0361521918010081].https://doi.org/10.7868/S0023117718010085
Серебренникова О.В., Стрельникова Е.Б., Прейс Ю.И., Дучко М.А. // Изв. Томск. политехн. ун-та. 2014b. Т. 325. № 3. С. 80.
Сваровская Л.И., Серебренникова О.В., Дучко М.А., Стрельникова Е.Б., Русских И.В. // ХТТ. 2017. № 2. С. 2. [Solid Fuel Chemistry, 2017, v. 51, no. 2, p. 67. https://doi.org/10.3103/S0361521917020094]https://doi.org/10.7868/S0023117717020098
Серебренникова О.В., Стрельникова Е.Б., Русских И.В., Харанжевская Ю.А., Воистинова Е.С. // Химия в интересах устойчивого развития. 2019. Т. 27. № 1. С. 65. [Chemistry for Sustainable Development, 2019, v. 27, no. 1, p. 53. https://doi.org/10.15372/CSD20190110]https://doi.org/10.15372/KhUR20190110
Feurdean A., Florescu G., Tanţău I., Vannière B., Diaconu A.C., Pfeiffer M., Warren D., Hutchinson S.M., Gorina N., Gałka M., Kirpotin S. // Quaternary Sci. Rev. 2020. V. 244. https://doi.org/10.1016/j.quascirev.2020.106495
Wieder William R., Cleveland Cory, Townsend Alan R. // Ecology. 2009. V. 90. No. 12. P. 3333. https://doi.org/10.1890/08-2294.1
Kettridge Nicholas, Turetsky M.R., Sherwood J.H., Waddington J.M. // Scientific Reports. 2015. V. 5. No. 1. P. 8063. https://doi.org/10.1038/srep08063
Benscoter B.W., Vitt D.H. // Ecosystems. 2008. V. 11. No. 7. P. 1054. https://doi.org/10.1007/s10021-008-9178-4
Olivella M.A., Ribalta T.G., de Febrer A.R., Mollet J.M., de las Heras F.X.C. // Sci. Total Environment. 2006. V. 355. P. 156. https://doi.org/10.1016/j.scitotenv.2005.02.033
Sung-Deuk Choi // Sci. Total Environment. 2014. V. 470–471. P. 1441. https://doi.org/10.1016/j.scitotenv.2013.07.100
Стрельникова Е.Б., Русских И.В., Прейс Ю.И. // ХТТ. 2021. № 5. С. 56. [Solid Fuel Chemistry, 2021, v. 55, no. 5, p. 321. https://doi.org/10.3103/S0361521921050062]https://doi.org/10.31857/S0023117721050066
Kuhn Thomas K., Krull Evelyn S., Bowater Amy, Grice Kliti, Gleixner Gerd. // Org. Geochem. 2010. V. 41. P. 88. https://doi.org/10.1016/j.orggeochem.2009.08.003
Renkova A., Valitova J., Schaller H., Minibayeva F. // Biol. Plantarum. 2019. V. 63. P. 59. https://doi.org/10.32615/bp.2019.008
Sáenz J.P., Grosser D., Bradley A.S., Lagny T.J., Lavrynenko O., Broda M., Simons K. // PNAS. 2015. V. 112. No. 38. P. 11971. https://doi.org/10.1073/pnas.1515607112
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива