Химия твердого топлива, 2022, № 3, стр. 30-47
ВЛИЯНИЕ ХАРАКТЕРИСТИК ПОВЕРХНОСТИ АКТИВИРОВАННЫХ УГЛЕЙ НА ПРОЦЕСС АДСОРБЦИИ НЕКОТОРЫХ ГЕРБИЦИДОВ (ОБЗОР)
С. А. Кулайшин 1, *, М. Д. Веденяпина 1, **, А. Ю. Курмышева 1, ***
1 ФБГУН Институт органической химии имени Н.Д. Зелинского РАН (ИОХ РАН)
119991 Москва, Россия
* E-mail: s.kulaishin@mail.ru
** E-mail: mvedenyapina@yandex.ru
*** E-mail: aukurm@gmail.com
Поступила в редакцию 05.10.2021
После доработки 31.01.2022
Принята к публикации 02.02.2022
- EDN: PTTPMO
- DOI: 10.31857/S0023117722030045
Аннотация
Рассмотрены влияние методов активации на поверхностные характеристики активированных углей (АУ), взаимосвязь этих характеристик, а также параметров среды с эффективностью адсорбции молекул гербицидов на АУ. Обсуждены основные факторы, влияющие на адсорбционную эффективность АУ по отношению к данным загрязнителям.
ВВЕДЕНИЕ
В последние десятилетия растет производство биологически активных органических веществ (БАОС), в частности, гербицидов, широко используемых в сельскохозяйственной и лесохозяйственной деятельности [1]. В результате активного использования БАОС обнаруживают в природных водоемах, в которые они попадают вместе с отработанными стоками агропромышленных и сельскохозяйственных комплексов [2, 3]. В связи с большим разнообразием гербицидов, загрязняющих сточные воды, универсальной стратегии по устранению БАОС не существует [4]. К используемым в настоящее время методам извлечения и деградации БАОС относятся: фотокаталитическая деградации [5, 6]; Фентон-процесс [6]; электроокисление [7, 8]; биологическая деградация [9]; адсорбция [10–13]. Перечисленные методы достаточно эффективны, однако обладают рядом недостатков, например, биодеградация является длительным процессом и во многом зависит от условий окружающей среды [14]. Электроокисление и фотокаталитические процессы очистки энергозатратны, а также требуют внешнего источника УФ-излучения [15, 16]. Для Фентон-процесса необходима полная выработка гидроксид-радикалов [17]. Среди всех перечисленных методов адсорбция является одним из наиболее перспективных, потому что этот способ прост в конструктивном исполнении и эксплуатации [18–21]. Во многих литературных источниках отмечается высокая эффективность адсорбции по отношению к гербицидам [12, 13, 22–32]. В адсорбционном процессе применим широкий спектр адсорбентов [27]. Недостаток адсорбционного метода заключается в том, что он эффективен преимущественно при низких концентрациях загрязнителя в водной среде, поэтому его успешно применяют с целью доочистки стоков [33].
Активированные угли (АУ), применяемые в качестве адсорбентов, получают из невозобновляемого (бурые, каменные угли, антрацит) [34–39] и возобновляемого сырья (скорлупа орехов, древесина, семена растений, жмых и т.д.) [12, 13, 22–24, 40–42]. В ряде литературных источников отмечается, что АУ могут быть также получены из отработанных полимерных материалов, например полиэтилентерефталата (ПЭТ) [43] и автомобильных покрышек [44]. В работах [41, 42, 45, 46,] исследована возможность повторного использования активированных углей в качестве адсорбентов после их регенерации.
Ввиду большого разнообразия активированных углей, а также возможности их производства с заданными поверхностными свойствами [47], представляет интерес рассмотреть влияние их поверхностных характеристик на эффективность адсорбции гербицидов из водных сред. Большой вклад в эффективность адсорбции вносят условия приготовления адсорбента – карбонизация и активация исходного сырья [48]. Эффективность адсорбции также зависит от таких параметров процесса, как рН среды [10, 49–56], температура стоков [38, 48, 52], наличие примесей биологической природы [57, 58] и величина удельной поверхности АУ [11, 24, 59].
В обзоре рассматривается адсорбция следующих классов органических соединений, применяющихся в качестве гербицидов и пестицидов: арилоксилкарбоновых кислот, арилоксиалканкарбоновых кислот, парабенов, хлортриазинов, арилоксифеноксипропионатов, оксазолидинононов, хлорацетонилидов, мочевины, фосфорорганических соединений, неоникотинойдов, триазолов, бензолтиазола, бензатиадиазона, виологена, карбаматов, ароматических гетероциклических соединений.
1. ВЛИЯНИЕ УСЛОВИЙ ПРИГОТОВЛЕНИЯ АДСОРБЕНТА НА ЕГО ПОВЕРХНОСТНЫЕ ХАРАКТЕРИСТИКИ
Обязательным этапом приготовления АУ в качестве адсорбента является активация угля, способствующая улучшению его поверхностных характеристик. По данным [60, 61] развитая удельная поверхность адсорбента, а также преобладание микропор на его поверхности способствуют более эффективной адсорбции молекул гербицидов. Наличие на поверхности сорбента преимущественно мезопор способствует адсорбции более крупных молекул [59]. В данном разделе рассмотрено влияние температуры и способа активации на порометрические характеристики АУ.
1.1. Зависимость поверхностных свойств АУ от температуры и способа процесса активации. С целью улучшения характеристик поверхности сорбент может быть активирован двумя методами, физическим и химическим, либо комбинацией этих методов [62]. К физическим методам активации относятся термическая обработка и обработка паром. По данным [63] образец, активированный при температуре700°С с обработкой паром, имел большую удельную площадь поверхности и объем пор, чем тот же материал, активированный при температуре 700°С без паровой обработки (576 и 421 м2/г, 109.1 и 57.6 см3/кг соответственно). По мнению авторов, высокая температура активации способствует открытию порового пространства за счет удаления летучих органических соединений. При этом сорбционная емкость образца с наибольшей площадью поверхности и объемом пор по отношению к 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) была максимальной.
В [64] показано, что увеличение температуры может способствовать снижению площади удельной поверхности и объема пор углеродного сорбента. Для адсорбции метилпарабена (метил-4-гидроксибензоат) были использованы два образца АУ (оба на основе коммерческого микропористого сорбента из скорлупы кокосового ореха), дополнительно термически обработанных при температурах 800 и 900°С соответственно. Исходный коммерческий АУ имел значение удельной площади поверхности (SБЭТ) 864 м2/г и объем микропор 0.34 см3/г. При дополнительной обработке при 800°С наблюдался значительный рост SБЭТ и объема микропор (до 1127 м2/г и 0.42 см3/г соответственно). Значения SБЭТ и объема пор второго образца (обработанного при 900°С) уменьшились до 814 м2/г и до 0.29 см3/г соответственно. Такая зависимость, по мнению авторов, была обусловлена блокировкой микропор конденсированными продуктами карбонизации для второго образца АУ. Значение адсорбционной емкости образцов АУ по отношению к гербициду метилпарабену имеет наибольшую величину для АУ, дополнительно обработанному при температуре 800°С (1.53 ммоль/г). У образца, обработанного при 900°С, адсорбционная емкость была соизмерима с адсорбционной емкостью исходного образца (1.15 ммоль/г).
В работе [65] изучали адсорбцию 2,4-Д на синтезированных из технического углерода образцах сорбентов. Первый образец активировали паром при температуре 850–900°С в течение 8 ч, второй образец – в течение 9.5 ч. Проведение более продолжительной активации приводит к уменьшению количества мезопор размером более 10 нм, увеличивая адсорбционную емкость АУ по отношению к 2,4-Д (200 и 250 мг/г для первого и второго образца соответственно). По мнению авторов [65], изменение распределения размера мезопор после дополнительной паровой активации не повлияло на величину площади удельной поверхности (SБЭТ 560 м2/г). Для образца, активированного более продолжительное время, характерно меньшее количество поверхностных групп, определенных по ИК спектру, что так же, вероятно, обеспечивает π-π взаимодействие электрон дефицитного ароматического ядра молекул 2,4-Д и поверхности АУ [65].
Химические методы активации углеродного материала для получения АУ заключаются во введении в исходный материал химических веществ с последующей термической обработкой в инертной среде. В [66] АУ был приготовлен из отходов древесины с использованием фосфорной кислоты (H3PO4) в качестве активирующего агента. Было исследовано влияние соотношения масс активирующего агента и АУ (H3PO4/АУ:3/1, 4/1 и 5/1) и температуры активации (300, 400 и 500°C) на удельную площадь поверхности полученных после активации образцов АУ. Активированный уголь, приготовленный при соотношении пропитки 4/1 и температуре активации 300°C обладал самым высоким значением SБЭТ, которая составила 1012 м2/г. В процессе химической обработки АУ фосфорной кислотой по данным [66, 67]молекулы активирующего агента глубоко проникали в структуру углерода, что способствовало образованию новых мезопор и микропор и приводило к увеличению площади поверхности сорбента. При температуре активации 500°C площадь поверхности активированного угля резко уменьшилась до 729 м2/г при увеличении соотношения пропитки с 3/1 до 5/1. Это может быть связано с усадкой углеродной структуры в результате совместного воздействия большого количества H3PO4 и высокой температуры активации (500°C) [66], что также наблюдалось в работах [68, 69].
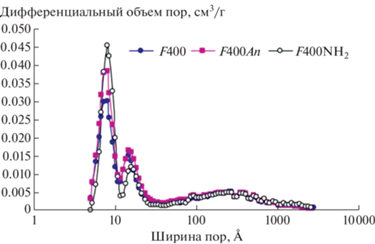
В работе [48, 70] углеродный сорбент получали путем термической активации битумного ископаемого угля (F400). Полученный образец (F400An) подвергли дополнительной химической активации в азотной кислоте (образец F400NH2). F400NH2 обладал большим количеством микропор, чем F400 и F400An без изменений в области мезо- и макропор (рис. 1). Это, по предположению авторов, связано с действием азотной кислоты в процессе активации [71]. Такое воздействие приводило к развитию поверхности, что могло быть вызвано расщеплением C-C-связей графеновых слоев образца. В случае прокаливания образца АУ F400 (F400An) (3 ч при 900°C , при скорости нагрева 10°/мин) [48], происходит снижение количества поверхностных кислородных групп, а также некоторых других групп, неустойчивых к высоким температурам, например, слабых кислотных групп (фенольных, карбоксильных, карбонильных и т.д.), присутствующих в исходном образце F400. Наличие кислотных групп определяли по степени сродства к ионам натрия [72]. На рис. 2 представлены микрофотографии исходного (рис. 2, а), а также двух образцов, подвергавшихся дополнительной обработке. На рис. 2 видно, как менялся характер поверхности АУF400 при проведении процесса аминирования и прокаливания. В [48] было показано, что при прокаливании образца F400 наблюдалось образование большей доли микропор на поверхности, что можно объяснить устранением некоторых кислородсодержащих функциональных групп, нестабильных под действием высоких температур. Микропоры, по утверждению авторов [48], являются наиболее эффективными для адсорбции низкомолекулярных соединений, таких, как используемый в работе гербицид атразин (6-хлоро-4-N-этил-2-N-пропан-2-ил-1,3,5-триазин-2,4-диамин). Преимущество микропор обусловлено перекрыванием сил потенциальной энергии в порах благодаря близкому расположению их стенок [73]. Это приводит к более прочному взаимодействию молекул адсорбата с поверхностью микропористого адсорбента. Однако наибольшей адсорбционной емкостью обладал F400An. Следовательно, распределение пор не единственный фактор, определяющий эффективность адсорбции. Химическая активация привела к образованию кислотных функциональных групп на поверхности образца F400NH2, которые оказывают существенное влияние на механизм сорбции. Данные кислотные группы взаимодействуют с молекулами воды, создавая кластерные группы на поверхности адсорбента, затрудняя транспорт молекул атразина к поверхности адсорбента. Аналогичное исследование было проведено в [62], исходное сырье для приготовления АУ пропитывали H3PO4 в разных массовых соотношениях H3PO4/АУ: 1/1; 2/1; 3/1. Каждый из полученных материалов затем подвергали термической обработке при температурах 400, 500 и 600°С. Дополнительная химическая активация полученных образцов была проведена с использованием HNO3 различной концентрации (15, 30, 45 и 69% HNO3). Наибольшую площадь поверхности (1399 м2/г) и объем микропор имел образец АУ с массовым соотношением Н3PO4/АУ 3/1 и активированный при температуре 400°С. При последующей активации образцов азотной кислотой, с увеличением ее концентрации с 15 до 69% площадь поверхности по БЭТ АУ уменьшилась с 1399 до 15 м2/г. Как показал порометрический анализ, микропоры были полностью закрыты, а объем мезопор уменьшился с 0.127 до 0.042 см3/г. По данным [62, 74] обработка азотной кислотой привела к разрушению микропор и к увеличению числа поверхностных кислородсодержащих функциональных групп.
В работе [75] показано, что термообработка образца из виноградной лозы с последующей химической активацией 3%-ной H2O2 при комнатной температуре позволила изменить состав поверхностных групп биоугля. Изменения, вызванные активацией, повысили адсорбционную емкость биоугля к цихалофопу ((2R)-2-[4-(4-циано-2-фторфенокси)фенокси]пропионовая кислота), но не кломазону (2-(2-хлорбензил)-4,4-диметил-3-изоксалидин-3-он). Это позволяет предположить, что активация H2O2 повышает адсорбционную емкость органических кислот, но не увеличивает адсорбционную емкость полярных не ионизированных соединений. Способность биоугля, приготовленного в мягких условиях, адсорбировать слабокислый гербицид возможна благодаря их анионной природе.
В качестве активирующего агента авторами работ [76–78] были использованы гидроксиды щелочных металлов при высоких температурах активации для создания развитой микропористой структуры и высоких значений SБЭТ. KOH – эффективный и экологичный активирующий агент, позволяет получать высокопористые активированные угли из широкого спектра сельскохозяйственных отходов [79]. При активации этих образцов гидроксидами щелочных металлов происходит образование карбонатов, что приводит к большему количеству кислородсодержащих поверхностных групп в конечном продукте [80].
В [81] использовали ZnCl2 в качестве активирующего агента при термообработке при 900°C для активации угля из отходов древесины. SБЭТ полученного образца составила 907 м2/г. В [82] получали активированный уголь из лигнина с использованием K2CO3 в качестве активирующего агента. По данным работы [82], удельная площадь поверхности (площадь микропор и мезопор) и объем пор (микропор и мезопор) увеличиваются по мере повышения температуры активации вплоть до 500°C. Однако при дальнейшем повышении температуры увеличение площади поверхности не является значительным. Аналогичные результаты были получены в [40], где при увеличении температуры активации биомассы карбонатом калия выше 500°C рост значения SБЭТ не наблюдался. Проведение пиролиза эндокарпа плодов макауба с последующей химической активацией K2CO3 при 400°C обеспечило образование средней ширины пор 1.7 нм (микропоры), образец при пиролизе 600°C обладал средней шириной пор 2.7 нм (мезопоры) [40]. Оба образца показали высокий процент извлечения атразина.
Для максимальных значений удельной площади поверхности и объема пор АУ температуру активации необходимо подобрать исходя из данных о наличии термически нестабильных групп в составе исходного сырья. При этом необходимо учитывать, что увеличение температуры может привести к обратному эффекту в связи с блокировкой микропор конденсированными продуктами карбонизации.
Для получения активированных углей из биомассы активацию проводят в интервале температур 300–600°C с использованием в качестве активирующих агентов щелочьи соли щелочных металлов, что является благоприятным для проведения активации растительного сырья в условиях высокотемпературной обработки по сравнению с использованием кислот.
На образование микропор в равной степени оказывает влияние как химический, так и физический метод активации. Объем микропор не всегда является ключевым фактором, влияющим на эффективность адсорбции молекул гербицидов. При выборе способа активации сорбента необходимо также учитывать наличие кислородсодержащих поверхностных функциональных групп, которые могут образоваться на АУ в результате активации и препятствовать адсорбционному процессу.
2. ВЛИЯНИЕ УДЕЛЬНОЙ ПЛОЩАДИ ПОВЕРХНОСТИ И ФУНКЦИОНАЛЬНЫХ ГРУПП АУ НА ЭФФЕКТИВНОСТЬ АДСОРБЦИИ
К основным характеристикам поверхности активированных углей относятся удельная площадь поверхности, распределение пор по размерам, а также состав и количество поверхностных функциональных групп. Представляет интерес рассмотреть влияние указанных параметров на эффективность адсорбции гербицидов на АУ из водных сред.
2.1. Удельная площадь поверхности. SБЭТ, а также распределение пор по размерам являются ключевыми характеристиками углеродного адсорбента. По данным [61] микропористые сорбенты с высокой удельной площадью поверхности эффективны для извлечения молекул гербицидов из водных сред.
В работах [50, 83] изучалась адсорбция 2,4-Дна АУ из скорлупы кокосового ореха. В обоих исследованиях отмечается высокая адсорбционная емкость образцов сорбентов по отношению к 2,4-Д, что, по мнению авторов, было обусловлено высокой удельной площадью поверхности (946 м2/г [50], 1070 м2/г [83]), а также преобладанием микропор. Сопоставимые результаты были получены в работе [60], где адсорбцию 2,4-Д проводили на микропористом образце ГАУ (SБЭТ – 1513 м2/г), величина адсорбционной емкости составила 469 мг/г.
В работе [84] 4-хлор-2-метил-феноксиуксусная кислоту (МЦПА) адсорбировали на образцах активированного угля, полученных из ПЭТ и пробкового материала при различных способах активации. Наибольшей сорбционной емкостью обладали образцы сорбентов с самыми высокими значениями SБЭТ и объема пор. Важным параметром для эффективной адсорбции гербицида МЦПА, по данным авторов, является не только большое значение удельной поверхности, но и диаметр пор: он должен превышать диаметр молекулы адсорбата примерно в 1.5 раза. Молекула МЦПА имеет диаметр 0.8 нм, что соответствует диаметрам пор наиболее эффективных образцов адсорбента(1.5 нм). Аналогичное предположение было высказано в работе [41], где для адсорбции 2,4-Д наиболее эффективным является адсорбент со средним размером пор 2.3 нм, что больше, чем размер молекулы 2,4-Д (1.1 нм). Такое соотношение по данным [85] облегчает диффузию молекулы 2,4-Д в порах.
Шесть образцов биоугля, подвергшихся термообработке при температуре 500–550°C в инертной среде азота, из смеси щелочного лигнина стружки мягких (сосна) и твердых (тополь) пород деревьев, имели по данным [86] величину удельной поверхности по БЭТ > 300 м2/г. Более высокая температура термообработки (800°C) обеспечила большую удельную поверхность (416–418 м2/г) за счет большей доли микропор. Адсорбционная емкость этих образцов для молекул атразина, метолхлора, изопротурона по данным [86] не коррелировала с величиной их удельной поверхности. Большая адсорбционная емкость была характерна для образца с большим объемом мезопор. Причина доминирующей роли мезопор в адсорбции атразина, метолхлора, изопротурона связана, по мнению авторов, с тем, что рассмотренные в работе гербициды имеют молекулярный вес >200 г/моль, что соответствует их размеру >1.0 нм. По данным [86], минимальный диаметр пор для адсорбции органических загрязнителей с молекулярной массой >200 г/моль должен составлять 1.7 нм, поэтому мезопоры наиболее эффективны для адсорбции таких молекул.
АУ возможно получить и из отходов деревообрабатывающих производств, как описано в работе [24], в которой был получен и исследован композит из отходов производства древесностружечных и древесно-волокнистых плит. Проводились карбонизацияс различной скоростью нагрева и последующая активация в токе CO2. Полученные АУ характеризовались микропористой структурой и основными свойствами. Образцы, подвергавшиеся более длительной активации (240 мин), обладали большей величиной удельной поверхности (1200 м2/г) и объемом микропор в сравнении с образцами, активированными за меньшее время (800 и 900 м2/г). При этом все образцы обладали достаточной адсорбционной активностью в отношении феноксиуксусных кислот, однако, наибольшая величина адсорбции была установлена для образца с самым высоким значением SБЭТ, что так же подтверждалось в [87] для диметоата (О,О-диметил-S-(N-метилкарбамидометил)дитиофосфат), ацетамиприда (N1-метил-N1-[(6-хлор-3-пиридил)метил]-N2-цианаце-тамидин) и атразина.
На способность к адсорбции может влиять размер частиц адсорбента. В работе [88] был использован гранулированный АУ с различным диаметром сечения гранул от 1.50 до 0.03 мм (1200 м2/г Vmic 0.480 см3/г). Отмечается рост величины адсорбции диурона (3-(3,4-дихлорфенил)-1,1-диметилмочевина) и амитрола (3-Амино-1,2,4-триазол) с уменьшением размера гранул. Такая зависимость объясняется авторами ростом частоты столкновений между адсорбтивом и адсорбентом.
2.2. Поверхностные функциональные группы АУ. Состав функциональных групп на поверхности АУ может оказывать влияние на адсорбционную емкость сорбента по отношению к молекулам гербицидов. Наиболее важными типами взаимодействия для адсорбции по данным [89] являются амфотерные группы, которые меняют свои свойства при изменении pH раствора и природы адсорбируемого вещества, диполь дипольное взаимодействие адсорбента и адсорбируемого вещества, образование водородных связей, ковалентных связей, ионный обмен.
В [11] показано, что не только уменьшение площади поверхности может отрицательно сказаться на адсорбции некоторых гербицидов (в частности, атразина), но также и увеличение количества кислотных функциональных групп (карбоксильная и фенольная) на поверхности АУ. Указанные поверхностные функциональные группы способствуют адсорбции воды на поверхности углеродного сорбента, тем самым уменьшая количество доступных адсорбционных центров для целевого адсорбата, что также подтверждалось в работе [90].
Аналогичные выводы были получены в работе [48], в которой адсорбцию атразина изучали на трех образцах АУ: исходном, термообработанном методом отжига и химически активированном методом аминирования. На термообработанном АУ было показано наименьшее содержание кислотных поверхностных групп. Снижение содержания кислотных групп на поверхности этого образца привело к росту объема микропор и к большей адсорбционной емкости по отношению к молекулам атразина по сравнению с остальными образцами. Для аминированного образца с большим количеством кислородсодержащих групп характерна самая малая адсорбционная емкость по атразину, несмотря на склонность данного соединения к образованию водородных связей [91]. В [64] также отмечается, что для фенолпроизводных молекул (2,4-Д и метилпарабена) увеличение числа кислотных групп на поверхности адсорбента приводит к снижению величины адсорбции, в связи с образованием водных кластеров за счет водородных связей. Увеличение числа основных поверхностных групп, напротив, приводит к повышению величины адсорбции за счет кислотно-основного и π-π взаимодействия. Однако при низких концентрациях гербицидов в водной среде (до 500 ppb) большую роль в эффективности адсорбции играют состав и количество поверхностных функциональных групп АУ, а не SБЭТ сорбента [92].
При изучении адсорбции 2,4-Д на модифицированном аминосиланом мезопористом АУ в работе [93] была отмечена высокая адсорбционная емкость АУ благодаря большому количеству основных групп, в частности аминогрупп, на поверхности сорбента.
В [94] для адсорбции 2,4-Д использовали АУ, приготовленный из койры финиковой пальмы путем термохимической активации с KOH в качестве активирующего агента. В [94] было показано, что активация KOH способствует образованию на поверхности сорбента множества кислородсодержащих групп, которые в свою очередь служат активными центрами для адсорбции 2,4-Д. В частности, группа С=О была отмечена в работе [94] как наиболее активная в процессе адсорбции. Результаты [94] во многом подтверждаются в [95], где АУ, полученный из крахмала путем термохимической активации с KOH, был использован в качестве сорбента для гербицида пираклостробина (Метил N-{2-[1-(4-хлорфенил)-1Н-пиразол-3-илоксиметил]фенил}(N-метокси)карбамат). Высокую эффективность сорбента по отношению к пираклостробину авторы работы [94] объясняют наличием у сорбента кислородсодержащих и азотсодержащих поверхностных функциональных групп, а именно С=О, С–N.
Для увеличения адсорбционной емкости АУ в отношении некоторых бензолпроизводных молекул [96] необходимо увеличить гидрофобность сорбентов за счет снижения содержания кислородных групп на поверхности АУ. С этой целью применяют метод снятия внешних слоев с гранул путем истирания, так как содержание кислородных групп заметно снижается от внешней поверхности к центру гранулы, как для исходных образцов, так и для образцов, активированных азотной кислотой. В обоих случаях снижение содержания кислородных групп на поверхности сорбента составляет около 20%.
Для адсорбции гидрофильных веществ желательно присутствие гидрофильных групп на поверхности, в противном случае – гидрофобных.
3. ВЛИЯНИЕ ПАРАМЕТРОВ СРЕДЫ ПРОЦЕССА АДСОРБЦИИ
Строение адсорбируемых молекул, pH и температура среды, наличие примесей химической и биологической природы в водной среде важны для процесса адсорбции. Если адсорбаты и адсорбенты характеризуются наличием функциональных групп, то от рH раствора зависит заряд функциональных групп как на адсорбентах, так и в молекулах адсорбатов за счет их депротонирования или протонирования [97].
3.1. Строение адсорбируемых молекул. Положение функциональных групп в молекуле адсорбтива и количество заместителей в ее бензольном ядре могут влиять на величину адсорбции [98]. Влияние положения галогеновых заместителей бензольного ядра описано в [98]. Сравнивая изотермы адсорбции 4-бромфеноксипропионовой кислоты и 3-бромфеноксипропионовой кислоты с 2-хлорфеноксиуксусной кислоты и 4-хлорфеноксипропионовой кислоты было определено, что молекулы с заместителями в пара-положении лучше адсорбируются по сравнению с заместителями в орто- и мета-положение. Пара-положение заместителя делает молекулу более линейной и способствует лучшему проникновению адсорбента в микропоры. Мета- и орто-положение нарушает симметрию молекул, что выражается в росте ширины молекулы в параллельной плоскости к бензольному ядру. Таким образом, доступ адсорбтива c заместителями в орто- и мета-положении в микропоры оказывается лимитированным [98].
В работе [54] описывается донорно-акцепторный механизм адсорбции молекул производных фенола на АУ. В данном случае кислород карбонильной группы на поверхности АУ действует как донор электронов, тогда как ароматическое ядро фенола – как акцептор. Данный механизм наиболее характерен для адсорбции 2,4-дихлорфенола, поскольку присутствие хлора (–Cl) способствует образованию связи между поверхностными карбонильными группами и электрон-дефицитным ароматическим ядром. Эта гипотеза подтвердилась сравнением ИК-спектров, зарегистрированных с чистого активированного АУ из кожуры Джекфрута (Artocarpus heterophyllus) и АУ с адсорбированным на нем фенолом. Наблюдалось снижение интенсивности значений волнового числа растягивающих колебаний (C=O) в аддукте по сравнению с чистым образцом АУ. Предположение о том, что карбонильная группа выступает в качестве донора электронов ароматическому ядру адсорбата, так же приводится в работах [99, 100].
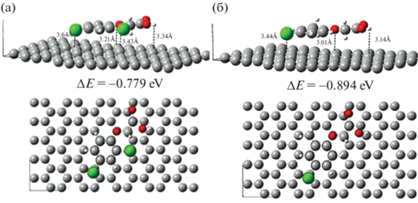
На рис. 3 изображены модели наиболее стабильного положения молекул феноксиуксусных кислот на поверхности АУ [10]. Молекулы 2,4-Д и 4-хлор-2-метил феноксиуксусной кислоты занимают квазипланарное положение на поверхности АУ (рис. 3). Энергия взаимодействия адсорбента и адсорбата при этом достаточно слабая, поэтому имеет место физический характер адсорбции. По данным [10] изменений в геометрии изученных молекул гербицидов не происходит.
Рис. 3.
Моделирование положения молекул 2,4-дихлорфеноксиуксусной кислоты (2,4-Д) (а) и 4-хлор-2-метил феноксиуксусной кислоты (б), адсорбированной на поверхности АУ [10].
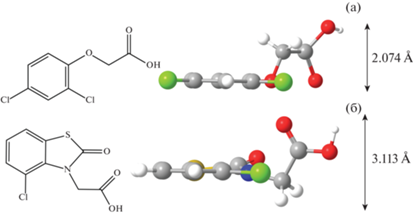
Исходя из исследований, проведенных в работе [89], стерический фактор адсорбируемых молекул может осложнять процесс адсорбции. На рис. 4 представлены структурные формулы и модели химических структур 2,4-Д и беназолина (2-(4-Хлор-2-оксо-1,3-бензотиазол-3-ил) уксусная кислота).
Для молекул 2,4-Д и беназолина функциональной группой, увеличивающей размеры молекулы в процессе адсорбции, является карбоксильная группа, расположенная вне одной плоскости с плоскостью ароматического ядра. В случае беназолина в состав молекулы входит смежное с ароматическим гетероциклическое ядро, состоящее из атомов азота и серы. Атом азот, образуя связь с соседними атомами, образует четыре пары σ-электронов, принимающих тетраэдрическое положение для минимизации отталкивания электронных пар. Одна из четырех позиций занята парой электронов, остальные три образуют σ-связи, поэтому молекула адсорбтива структурирована в виде тригональной пирамиды. Две кольцевые системы при этом не находятся в одной плоскости, что делает молекулу беназолина менее линейной и более громоздкой в сравнении с 2,4-Д [89]. Аналогичные выводы были сделаны в работе [22] при сравнении величины адсорбции бентазона (3-изопропил-(1H)-2,1,3-бенозотиадиазин-4(3H)-он-2,2-диоксид) (101 мг/г) и 2,4-Д (168 мг/г) на АУ.
В работе [98] изучено влияние на величину адсорбции различных галогеновых заместителей. При сравнении изотерм адсорбции 4-галоген-феноксипропионовой кислоты на АУ величина адсорбции уменьшается в ряду: 4-бром-феноксипропионовая >4-хлорфеноксипропионовая >4-фторфеноксипропионовая.
Такие отличия в величине адсорбции хорошо коррелируют с константой Гаммета σ. Значение константы определяет электроноакцепторные свойства заместителя. Для изучаемых молекул с пара-положением заместителей она равна σBr = 0.23, σCl = 0.23, σF = 0.06. Увеличение электроноакцепторной способности приводит к ослаблению взаимодействия между ароматическим ядром и π электронами атомов углерода адсорбента, что снижает величину адсорбции.
Карбоксильные и карбонильные группы молекул субстрата могут вступать во взаимодействие с кислородсодержащими поверхностными группами АУ. В результате образуются водородные связи, как с поверхностными группами, так и с соседними молекулами субстрата и раствора [98, 99].
Влияние строения адсорбируемых молекул на эффективность адсорбции проявляется в наличии и положении функциональных групп. Наиболее эффективным для адсорбции является пара-положение заместителя в молекуле адсорбтива, способствующее формированию линейной структуры молекулы. Рост электроотрицательности заместителя в бензольном ядре приводит к смещению электронной плотности в ароматической системе молекулы адсорбтива и, как следствие, к росту адсорбционной емкости.
3.2. pH среды. Показатель pH раствора влияет на полярность адсорбента, делая его положительным при значении pH ниже pH точки нулевого заряда (pHPZC), и отрицательным – при более высоких значениях pH [55, 101]. Величина pHPZC соответствует такому значению заряда, при котором суммарный заряд всей поверхности адсорбента равен нулю [102, 103]; pH раствора сильно влияет на состояние органических молекул в неионных, катионных и анионных формах и приводит к изменению их адсорбционных характеристик [104]. Показатель pH раствора определяет не только заряд поверхности адсорбента [105], но также степень диссоциации органической кислоты [106]. В [107] гербицид паракват(N,N'-диметил-4,4'-дипиридилия дихлорида) адсорбировали на АУ при значениях рН раствора 2, 4, 6, 8 и 10. При повышении рН с 2 до 6 адсорбционная эффективность АУ по отношению к параквату вырастала с 35 до 95%. При дальнейшем росте рН до 10 эффективность адсорбции незначительно увеличивается с 95 до 97%. По мнению авторов более низкая концентрация H+ облегчает депротонирование адсорбционных центров на поверхности адсорбента. Кроме того, уменьшается конкуренция между H+ и молекулой параквата. В результате при pH 7–10 максимальная адсорбционная способность адсорбента превышает 95%. Величинаp HPZC АУ составляла 5.4, что указывает на то, что поверхностный заряд положительный при pH < 5.4 и отрицательный при pH > 5.4, что указывает на то, что поверхность сорбента заряжена положительно при pH < 5.4 и отрицательно при pH > 5.4. Когда pH раствора больше pHPZC, электростатическое притяжение может быть доминирующим механизмом адсорбции параквата на АУ.
По данным [108], эффективность адсорбции 4-хлорфенола (4-ХФ) на активированном угле из гранатовой кожуры по мере роста pH раствора с 3 до 6 увеличивалась незначительно. При дальнейшем увеличении рН до 9 эффективность адсорбции снизилась на 10%. При pH 6.0 4-ХФ присутствует в растворе в основном в непротонированной форме, константа pKa 4-ХФ 8.96. При значениях pH раствора адсорбата выше значения pHPZC адсорбента 5.96–6.4 поверхность адсорбента становится отрицательно заряженной. При pH 9.0 соотношение недиссоциированной и диссоциированной формы молекулы 4-ХФ примерно одинаково. Следовательно, диссоциированная форма, представляющая собой анион, отталкивается от поверхности адсорбента (при pH 9), значительно снижая эффективность адсорбции.
В [109] изучено влияние рН раствора адсорбата на адсорбцию карбаматных пестицидов (производных карбаминовой кислоты) Примикарба, Метолкарба, Изопрокарба, Севина, Метиокарба, Бендиокарба на АУ. Эффективность адсорбции пестицидов увеличивалась с ростом значения pH раствора. Величина рН точки нулевого заряда (pHPZC) составила 3.8, что указывает на то, что поверхность АУ была заряжена отрицательно при pH выше 3.8 и положительно при pH ниже 3.8. Следовательно, при pH = 7, поверхность АУ была отрицательно заряжена, что способствовало адсорбции молекул пестицидов на поверхности АУ благодаря электростатическим взаимодействиям.
Аналогичные результаты были получены в работе [110], где исследовалась адсорбция гербицида флуроксипира на углеродном волокне. Наибольшая адсорбционная способность была установлена при pH 2, при котором молекулы флуроксипира были слабо диссоциированы. Высокая адсорбционная емкость при этом pH, обусловлена преобладанием дисперсионных взаимодействий между графеновыми слоями адсорбента и недиссоциированными молекулами флуроксипира. С ростом рН растворимость молекул флуроксипира увеличивается, следовательно, растет доля отрицательно заряженных ионов адсорбата в растворе, поверхность сорбента при этом приобретает отрицательный заряд. Таким образом, электростатическое отталкивание между молекулами адсорбата и адсорбента, уменьшение дисперсионных взаимодействий между недиссоциированными молекулами и поверхностью АУ приводят к снижению величины адсорбции.
В работе [12] в качестве сорбента для извлечения гербицида 2,4-Д из водной среды использовали АУ, полученный из тыквенной кожуры. Было установлено, что pHPZC поверхности сорбента равен 6.0, следовательно, в щелочной среде поверхность АУ заряжена отрицательно. При pH раствора больше 4.5 большая часть 2,4-Д находится в ионизированной форме, 2,4-дихлорфеноксиацетат-ион, что приводит к их электростатическому отталкиванию от поверхности АУ. Кроме того, в щелочной среде высокая подвижность ионов OH– может конкурировать с 2,4-дихлорфеноксиацетат-анионом за адсорбционные центры поверхности АУ [35, 111, 112]. Аналогично [12] адсорбция 2,4-Д на АУ из скорлупы кокосового ореха в [50] зависела во многом от рН раствора. По данным ИК-спектра, на поверхности АУ наблюдалось преобладание гидроксильных групп. С ростом величины pH раствора происходит депротонирование указанных групп, что, в свою очередь, приводит к отталкиванию отрицательно заряженного аниона 2,4-Д. Согласно литературным данным [10, 49–56, 113], величина адсорбции гербицида 2,4-Д снижается при росте значения pH раствора от 3 до 9.
При исследовании влияния рН на адсорбцию бентазона на АУ в [114] были получены результаты зависимости адсорбции от рН, схожие с результатами для 2,4-Д. Аналогично, по данным [64], адсорбция метилпарабена на АУ снижается при значениях pH, которые определяют отрицательный заряд адсорбента (pH > pHPZC) и высокую степень ионизации адсорбата.
В [115] изучалась адсорбция гербицидов 2,4-Д и МЦПА на АУ, произведенном из сельскохозяйственных отходов. Адсорбционная емкость 2,4-Д относительно МЦПА оказывается выше за счет меньшей растворимости молекулы 2,4-Д и ее более высокой гидрофобности. Однако для бинарных систем 2,4-Д и МЦПА в молярном соотношении 1:1 между молекулами наблюдается конкуренция за адсорбционные центры АУ. Низкая растворимость 2,4-Д обеспечивает высокое сродство с гидрофобной поверхностью АУ. Малый размер и хорошая растворимость молекулы МЦПА позволяют осуществлять диффузию в микропоры, но присутствие адсорбированного 2,4-Д способствует десорбции некоторых молекул МЦПА в объем раствора.
В [116] показано, что повышение значения pH приводит к меньшей диссоциации молекул амитрола и, следовательно, к большей величине адсорбции на АУ. Молекулы амитрола в кислой среде преобладают в протонированной форме, а поверхность АУ заряжена положительно (pHPZC 8), что приводит к снижению адсорбции амитрола на поверхности сорбента.
3.3. Температура среды. Температура среды может оказывать существенное влияние на адсорбционный процесс. Снижение эффективности адсорбции при повышении температуры можно объяснить экзотермическим характером процесса. Повышение температуры приводит к увеличению колебаний молекул на поверхности адсорбента, что приводит к десорбции молекул в объем раствора, как было показано в [23, 100, 109, 117, 118]. Например, в [117] с ростом температуры от 25 до 55°С адсорбционная емкость АУ по отношению к 2,4-Д снижается, а с повышением температуры растворимость 2,4-Д увеличивается, следовательно, уменьшается сродство молекул адсорбата и гидрофобной поверхности адсорбента, что приводит к снижению адсорбции 2,4-Д при более высоких температурах. Падение величины адсорбционной емкости АУ к 2,4-Д в [119] объясняется увеличением энергии колебаний молекул гербицида, приводящим к десорбции с поверхности сорбента в объем раствора. Аналогичные результаты показаны в работе [120], где при адсорбции 4-хлорфеноксиуксусной кислоты (4-ХФУК, парафен) на АУ с повышением температуры наблюдалось уменьшение адсорбционной емкости сорбента по отношению к 4-ХФУК. Этот температурный эффект, по данным работы, был связан с увеличением растворимости 4-ХФУК в воде с повышением температуры. Как следствие, это снижало гидрофобность молекулы гербицида и ее сродство к поверхности углерода. Кроме того, увеличение энергии колебаний адсорбированных молекул способствует их десорбции с поверхности АУ в раствор.
Обратная зависимость влияния роста температуры на повышение эффективности адсорбции можно объяснить эндотермическим характером процесса. Например, увеличение сорбционной способности активированного угля при более высокой температуре может быть связано с увеличением размера пор или с дополнительной температурной активацией поверхности адсорбента, а также с созданием некоторых новых активных центров на его поверхности. С ростом температуры также может увеличиваться подвижность молекул адсорбтива, что увеличивает скорость диффузии внутри адсорбента и приводит к повышению эффективности адсорбции [121–123].
В [94] адсорбционная емкость АУ по отношению к 2,4-Д незначительно увеличивалась при повышении температуры от 30 до 60°C, что указывает на эндотермический характер процесса [52]. Схожий результат был получен в [124], при адсорбции 2,4-Д на АУ. Эффективность адсорбции 2,4-Д незначительно увеличивалась с повышением температуры от 30 до 50°C. Вероятно, это связано с тем, что более высокая температура увеличивает подвижность и проникновение ионов 2,4-Д из раствора гербицида в структуру пор АУ.
3.4. Влияние примесей в водной среде на эффективность адсорбции. Присутствие в водной среде примесей химической либо биологической природы может повлиять на адсорбционную емкость адсорбента и растворимость адсорбтива.
Известно, что растворимость органических соединений зависит от концентрации электролита, присутствующего в водной среде [10]. Если при электростатическом взаимодействии между поверхностью АУ и адсорбируемой молекулой проявляется электростическое отталкивание, то увеличение ионной силы добавлением электролита в раствор приводит к увеличению адсорбционной емкости. При притяжении между молекулой адсорбтива и поверхностью адсорбента, а также в случае если величина поверхностной концентрации мала, увеличение ионной силы снижает адсорбционную емкость. Таким образом, при добавлении соли в раствор возникает эффект высаливания, когда происходит снижение растворимости органических молекул. Ионы в растворе формируют гидратные сферы, поэтому молекулы воды становятся недоступны для органических молекул, тем самым снижая растворимость и увеличивая диффузию органических молекул к поверхности АУ. Если соль в избытке, то возникает экранирующий эффект, снижающий взаимодействие органических молекул и поверхности АУ.
В работе [125] рассматривалась возможность адсорбции в зависимости от жесткости воды, регулируемой добавлением CaCO3. При повышении жесткости воды адсорбционная емкость АУ увеличивается, что также подтверждается в работе [126]. Снижение растворимости адсорбтива в присутствии CaCO3 обусловлено образованием нерастворимых комплексов CaCO3 и адсорбтива, так как, по данным авторов, преобладающим механизмом адсорбции является неэлектростатическое взаимодействие адсорбент – адсорбтив.
В водной среде помимо токсичных веществ химической природы могут присутствовать и биологические загрязнители, снижающие эффективность адсорбции целевого субстрата. Биологическое загрязнение водной среды авторы [127] определяют как снижение качества окружающей среды в результате изменений в биологических, химических и физических свойствах водной экосистемы.
Авторы работы [58] исследовали адсорбцию 2,4-дихлорфеноксиуксусной кислоты в присутствии загрязнителей биологической природы. Определено, что наличие биологических загрязнителей в растворе определяет полярность поверхности сорбента и приводит к сужению и закупорке пор в результате адсорбции биозагрязнителей. В результате была предложена предварительная очистка от биозагрязнителей.
Основные порометрические характеристики адсорбентов АУ (SБЭТ, pHPZC, объем пор), а также адсорбционная емкость АУ по отношению к гербицидам, рассмотренным в работе, представлены в табл. 1.
Таблица 1.
Характеристики АУ для адсорбции гербицидов
| Название соединения, константа диссоциации, растворимость, структурная формула | Название образца адсорбента | Наибольшая адсорбционная емкость*, мг/г | pHPZC адсор-бента | SБЭТ, м2/г | Vпор, см3 г–1 | Средний диаметр пор, нм | Источ-ник |
|---|---|---|---|---|---|---|---|
2,4-дихлорфеноксиуксусная
кислота (2,4-Д), 2.73, 0.31 г/л |
GAB | 400.000 | 7.5 | 1189 | Vобщ0.530 Vмикро0.270 Vмезо0.260 |
2.25 | [10] |
| CPB | 385.000 | 4.8 | 1288 | Vобщ 1.100 Vмикро 0.040 Vмезо 1.060 |
4.39 | ||
| PSHAC | 253.560 | 6.0 | 738 | Vобщ 0.370 Vмикро 0.301 Vмезо 0.069 |
2.26 | [12] | |
| MDF 5950 | 0.263 | >10.0 | 1195 | Vобщ 0.480 | 1.02 | [24] | |
| MDF 5933 | 0.157 | >10.0 | 805 | Vобщ 0.330 | 0.66 | ||
| PB 5960 | 0.303 | >10.0 | 1211 | Vобщ 0.580 | 1.15 | ||
| PB 5936 | 0.245 | >10.0 | 926 | Vобщ 0.380 | 0.80 | ||
| AC_Ar | 0.332 | 9.7 | 243 | Vобщ 0.120 | 1.05 | [115] | |
| CD_3 h | 0.332 | 11.4 | 556 | Vобщ 0.280 | 0.55 | ||
| ST_CD_3 h | 0.332 | 11.1 | 669 | Vобщ 0.520 | 1.50 | ||
| CD_MV_1.5 h | 0.332 | 11.0 | 685 | Vобщ 0.350 | 0.59 | ||
| AC | 250.000 | – | 1016 | Vобщ 0.560 Vмикро 0.290 |
н/д | [27] | |
| CSAC | 282.100 | – | 986 | Vобщ 0.540 | 2.20 | [50] | |
| CCAC | 259.400 | 3.5 | 1274 | Vобщ 0.900 Vмикро 0.101 |
3.00 | [52] | |
| F300 | 0.375 | 9.8 | 762 | Vобщ 0.460 Vмикро 0.280 Vмезо 0.180 |
0.52 | [98] | |
| TW-BCS | 55.000 | 12.0 | 576 | Vобщ 0.109 | 2.00 | [63] | |
| OW-BC | 22.000 | 10.0 | 270.7 | Vобщ 0.120 | 1.1 | ||
| BU-BC | 20.000 | 11.0 | 2.3 | Vобщ 0.109 | 2 | ||
| B-BC | 20.000 | 10.0 | 476 | Vобщ 0.209 | 1.1 | ||
| TW-BC | 8.000 | 11.0 | 421 | Vобщ 0.058 | 1.9 | ||
| QPPAC | 360.000 | 5.1 | 782 | Vобщ 0.441 | 2.26 | [41] | |
| CKIT-6 | 66.000 | – | 834 | Vобщ 1.090 | 5.50 | [93] | |
| CKIT-6-A1 | 118.000 | – | 228 | Vобщ 0.360 | 5.60 | ||
| CKIT-6-A2 | 126.000 | – | 169 | Vобщ 0.270 | 5.80 | ||
| CKIT-6-A3 | 152.000 | – | 71 | Vобщ 0.150 | 7.90 | ||
| МНУМ-1 | 185.000 | – | 557 | Vобщ 0.690 Vмикро 0.040 Vмезо 0.650 |
13.00 | [65] | |
| МНУМ-2 | 232.000 | – | 569 | Vобщ 0.640 Vмикро 0.030 Vмезо 0.610 |
9.00 | ||
| АУКО | 383.000 | – | 1070 | Vмикро 0.430 | 0.80 | [83] | |
| ГАУ | 469.000 | – | 1514 | Vмикро 0.640 | 0.80 | [60] | |
| F400 | 0.010 | 7.5 | 790 | – | – | [89] | |
| F400AN | 0.010 | 8.0 | 960 | – | – | [85] | |
| SSAC | 125.000 | – | 490 | – | 4.6 | ||
| DPC-AC | 50.250 | 5.5 | 947 | Vобщ1.646 | 2.90 | [94] | |
4-хлор-2-метил феноксиуксусная кислота (МЦПА),
3.73, 0.825 г/л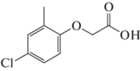 |
GAB | 590.000 | 7.46 | 1189 | Vобщ0.530 Vмикро 0.270 Vмезо 0.260 |
2.25 | [10] |
| CPB | 270.000 | 4.76 | 1288 | Vобщ 1.100 Vмикро 0.040 Vмезо 1.060 |
4.39 | ||
| MDF 5950 | 0.293 | >10.0 | 1195 | Vобщ 0.480 | 1.02 | [24] | |
| MDF 5933 | 0.147 | >10.0 | 805 | Vобщ 0.330 | 0.66 | ||
| PB 5960 | 0.375 | >10.0 | 1211 | Vобщ 0.580 | 1.15 | ||
| PB 5936 | 0.157 | >10.0 | 926 | Vобщ 0.380 | 0.80 | ||
| AC_Ar | 0.080 | 9.7 | 243 | Vобщ 0.120 | 1.05 | [115] | |
| CD_3 h | 0.302 | 11.4 | 556 | Vобщ 0.280 | 0.55 | ||
| ST_CD_3 h | 0.281 | 11.1 | 669 | Vобщ 0.520 | 1.50 | ||
| CD_MV_1.5 h | 0.211 | 11.0 | 685 | Vобщ 0.350 | 0.59 | ||
| P-K | 0.300 | 7.21 | 1255 | Vобщ 1.000 Vмикро 1.000 Vмезо0.000 |
1.07 | [84] | |
| P-UD5 | 0.748 | 7.08 | 2420 | Vобщ 1.920 Vмикро 1.770 Vмезо 0.150 |
1.54 | ||
| P-CDT-D1 | 0.792 | 6.71 | 2222 | Vобщ 1.910 Vмикро 1.530 Vмезо 0.380 |
1.71 | ||
| P-HU-D1 | 0.784 | 7.09 | 2076 | Vобщ 1.720 Vмикро 1.500 Vмезо 0.220 |
1.55 | ||
| P-PEI-D1 | 0.360 | 7.16 | 1431 | Vобщ 1.130 Vмикро 1.130 Vмезо 0.000 |
0.94 | ||
| C-K | 0.271 | 7.14 | 900 | Vобщ 1.000 Vмикро 1.000 Vмезо 0.000 |
0.82 | ||
| C-UD5 | 0.774 | 8.50 | 2339 | Vобщ 2.760 Vмикро 2.140 Vмезо 0.620 |
1.7 | ||
| C-CDT-D1 | 0.353 | 8.05 | 1142 | Vобщ 1.320 Vмикро 1.230 Vмезо 0.090 |
1.03 | ||
| C-HU-D1 | 0.546 | 8.03 | 1331 | Vобщ 1.610 Vмикро 1.320 Vмезо 0.290 |
1.38 | ||
| C-PEI-D1 | 0.423 | 8.11 | 2170 | Vобщ 2.470 Vмикро 2.320 Vмезо 0.150 |
1.09 | [84] | |
3-(3,4-дихлорфенил)-1,1-
диметилмочевина (Диурон),
не определяется, 0.035 г/л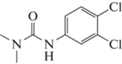 |
MDF 5950 | 0.205 | >10.0 | 1195 | Vобщ 0.480 | 1.02 | [24] |
| PB 5960 | 0.226 | >10.0 | 1211 | Vобщ 0.580 | 1.15 | ||
| PB 5936 | 0.082 | >10.0 | 926 | Vобщ 0.380 | 0.80 | ||
| AC | 60.000 | – | 1016 | Vобщ 0.560 Vмикро 0.29 |
– | [27] | |
6-хлоро-4-N-этил-2-N-пропан-
2-ил-1,3,5-триазин-2,4-диамин (Атразин), 1.7, 0.033 г/л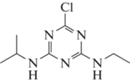 |
CTRTAC | 104.900 | Нет данных | 981 | – | 3.12 | [44] |
| F400 | 0.005 | 7.5 | 790 | – | – | [48] данные о SБЭТ из [70] | |
| F400An | 0.006 | 8.0 | 960 | – | – | ||
| F400NH2 | 0.003 | 6.5 | 836 | – | – | ||
| L800n | 0.108 | – | 416 | Vмикро 0.105 Vмезо 0.209 |
– | [86] | |
| S800n | 0.022 | – | 418 | Vмикро 0.162 Vмезо 0.037 |
– | ||
| S600n | 0.008 | – | 301 | Vмикро 0.111 Vмезо 0.013 |
– | ||
| S650 | 0.129 | – | 583 | Vмикро 0.133 Vмезо 0.209 |
– | ||
| H550 | 0.020 | – | 302 | Vмикро 0.098 Vмезо 0.040 |
– | ||
| S450 | 0.020 | – | 166 | Vмикро 0.047 Vмезо 0.031 |
– | ||
Смесь изомеров (aRS, 1S)-2-хлор-6'-этил-N-(2-метокси-метил-этил) ацето-о-толуидид
и (aRS, 1R)-2-хлор-6'-этил-N-(2-метокси-метил-этил)ацето-о-толуидид = 80–100%: 20–0%
(Метолахлор), не определяется, 0.480 г/л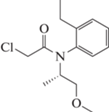 |
L800n | 0.108 | – | 416 | Vмикро 0.105 Vмезо 0.209 |
– | |
| S800n | 0.023 | – | 418 | Vмикро 0.162 Vмезо 0.037 |
– | ||
| S600n | 0.007 | – | 301 | Vмикро 0.111 Vмезо 0.013 |
– | ||
| S650 | 0.113 | – | 583 | Vмикро 0.133 Vмезо 0.209 |
– | ||
| H550 | 0.014 | – | 302 | Vмикро 0.098 Vмезо 0.040 |
– | ||
| S450 | 0.017 | – | 166 | Vмикро 0.047 Vмезо 0.031 |
– | ||
| L800n | 0.108 | – | 416 | Vмикро 0.105 Vмезо 0.209 |
– | ||
3-(4-Изопропилфенил)-1,1-диметилмочевина (Изопротурон), не диссоциирует, 0.065 г/л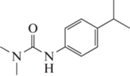 |
S800n | 0.031 | – | 418 | Vмикро 0.162 Vмезо 0.037 |
– | [86] |
| S600n | 0.007 | – | 301 | Vмикро 0.111 Vмезо 0.013 |
– | ||
| S650 | 0.124 | – | 583 | Vмикро 0.133 Vмезо 0.209 |
– | ||
| H550 | 0.015 | – | 302 | Vмикро 0.098 Vмезо 0.040 |
– | ||
| S450 | 0.015 | – | 166 | Vмикро 0.047 Vмезо 0.031 |
– | ||
2-(4,6-диметоксипиримидин-2-илкарбомоил-сульфамоил)- -N,N-диметилникотинамид (Никосульфурон),
4.78, 0.044 г/л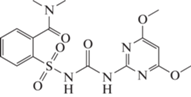 |
Ach129 | 0.070 | – | 2192 | Vмикро 1.059 | 1.79 | [87] |
Метиловый эфир пара-гидроксибензойной кислоты (Метилпарабен), 8.2, 2.5 г/л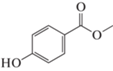 |
CB | 0.175 | 5.4 | 864 | Vобщ 0.300 Vмикро 2.100 |
– | [64] |
| CB1073 | 0.233 | 11.1 | 1127 | Vобщ 0.480 Vмикро 2.100 |
– | ||
| CB1173 | 170.000 | 8.9 | 814 | Vобщ 0.340 Vмикро 2.300 |
– | ||
4-Хлорфеноксиуксусная кислота (4-ХФУК, парафен), 8.5,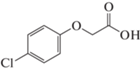 |
G0 | 0.003 | – | 800 | Vобщ 0.440 | – | [99] |
| G33 | 0.003 | – | 770 | Vобщ 0.400 | – | ||
| G66 | 0.003 | – | 740 | Vобщ 0.370 | – | ||
2-(4-Хлорфенокси)-2-метилпропановая кислота (Клофибровая кислота), 3.37, 0.582 г/л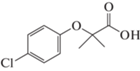 |
G0 | 0.003 | – | 800 | Vобщ 0.440 | – | |
| G33 | 0.003 | – | 770 | Vобщ 0.400 | – | ||
| G66 | 0.002 | – | 740 | Vобщ 0.370 | – | ||
1,1'-диметил-4,4'-дипиридилий дихлорид (Паракват),
не диссоциирует, 620 г/л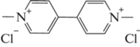 |
MCT-600 | 195.940 | – | – | н/д | 0.38 | [105] |
Метил N-{2-[1-(4-хлорфенил)-1Н-пиразол-3-илоксиметил]фенил}(N-метокси)карбамат (Пираклостробин),
не диссоциирует, 0.0019 г/л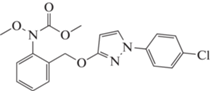 |
ACS | 70.000 | – | 161 | Vобщ 0.095 | 2.37 | [95] |
ЗАКЛЮЧЕНИЕ
В рассмотренном материале был выявлен ряд факторов, оказывающих существенное влияние на адсорбционный процесс молекул гербицидов из водных сред на активированных углях. К параметрам, которыми можно варьировать при изготовлении адсорбента, относятся: порометрические характеристики; состав и количество поверхностных функциональных групп АУ. Такие характеристики среды, как температура, рН, наличие примесей, являются факторами, от которых во многом зависит эффективность адсорбционного процесса.
Методы активации позволяют регулировать пористость поверхности образца и изменять состав и количество поверхностных групп. Величина SБЭТ и объем микропор образца АУ коррелируются с величиной адсорбционной емкости по отношению к молекулам гербицидов. Немалый вклад в процесс адсорбции вносит взаимодействие групп атомов молекул адсорбтива с поверхностными функциональными группами АУ. Их расположение и количество на поверхности АУ, положение заместителей в молекулах адсорбируемого вещества и их электроотрицательность напрямую влияют на адсорбционную емкость сорбента.
Электростатическое взаимодействие адсорбент – адсорбтив зависит от величины pH среды. Значение pH определяет заряд поверхности сорбента, который влияет на электростатическое взаимодействие адсорбент–адсорбтив.
Повышение температуры среды при адсорбции может изменить величину адсорбционной емкости АУ за счет различных термодинамических факторов процесса адсорбции. Присутствие молекул, повышающих жесткость воды и способных к формированию комплексов с адсорбируемым веществом, может снизить растворимость адсорбируемого вещества и повысить величину адсорбции.
Структура молекул адсорбтива и положение в них заместителей влияют на доступ органических молекул в микропоры. Электроотрицательность и количество заместителей бензольного ядра адсорбтива определяют адсорбционную емкость АУ.
В литературе недостаточно освещены вопросы эффективности АУ в адсорбции в многокомпонентных системах и в реальных сточных водах. Применимость рассмотренных АУ для реальных стоков, содержащих помимо гербицидов другие загрязнители, еще предстоит оценить.
Список литературы
Kanabar M., Bauer S., Ezedum Z.M., Dwyer I.P., Moore W.S., Rodriguez G., Mall A., Littleton A.T., Yudell M., Kanabar J., Tucker W.J., Daniels E.R., Iqbal M., Khan H., Mirza A., Yu J.C., O’Neal M., Volkenborn N., Pochron S.T. // Environ. Sci. Pollut. Res. 2021. V. 28. P. 32933.
Tiwari B., Sellamuthu B., Ouarda Y. // Bioresour. Technol. 2017. V. 224. P. 1.
Luo Y., Guo W., Ngo H.H. // Sci. Total Environ. 2014. V. 473–474. P. 619.
Martínez-Huitle C.A., Ferro S. // Chem. Soc. Rev. 2006. 35. P. 1324.
Lima M.S., Cruz-Filho J.F., G. Noleto L.F.G., Silva L.J., Costa T.M., Luz Jr. G.E. // Environ. Pollut. 2020. V. 8. I. 5. P. 105145.
Hassanshahi N., Karimi-Jashni A. // Ecotox Environ. Safe. 2018. V. 161. P. 683.
Ghalwa N.M.A., Zaggout F.R. // J. Environ. Sci. Heal. A. 2006. V. 41. I. 10. P. 2271.
Xiao H., Lv B., Gao J. // Environ. Sci. Pollut. Res. 2016. V. 23. P. 10050.
Cycoń M., Żmijowska A., Piotrowska-Seget Z. // Cent. Eur. J. Biol. 2011. V. 6. P. 188.
Spaltro A., Pila M., Simonetti S. // J. Contam. Hydrol. 2018. V. 218. P. 84.
Hu J., Shang R., Heijman B., Rietveld L. // J. Environ. Manage. 2015. V. 160. P. 98.
Njoku V.O., Foo K.Y., Hameed B.H. // Chem. Eng. J. 2013. V. 215–216. P. 383.
Mailler R., Gasperi J., Coquet Y. // J. Environ. Chem. Eng. 2016. V. 4. I. 1. P. 1102–1109.
Lippi M., Ley M.B.R.G., Mendez G.P., Cardoso Jr. R.A.F. // Ciência e Natura. 2018. V. 40. e78. https://doi.org/10.5902/2179460X35239
Gao J., Zhao G., Shi W., Li D. // Chemosphere. 2009. V. 75. I. 4. P. 519.
Singh P., Sharma K., Hasija V., Sharma V., Sharma S., Raizada P., Singh M., Saini A.K., Hosseini-Bandegharaei A., Thakur V.K. // Mater. Today Chem. V. 14. 2019. P. 100186.
Babuponnusami A., Muthukumar K. // J. Environ. Chem. Eng. 2014. V. 2. I. 1. P. 557.
Bhatnagar A., Sillanpää M., Witek-Krowiak A. // Chem. Eng. J. 2015. V. 270. P. 244.
Gautam R.K., Mudhoo A., Lofrano G., Chattopadhyaya M.C. // J. Environ. Chem. Eng. 2014. V. 2. № 1. P. 239.
Ali I., Asim M., Khan T.A. // J. Environ. Manag. 2012. V. 113. P. 170.
Sophia A.C., Lima E.C. // Ecotoxicology and Environmental Safety. 2018. V. 150. P. 1.
Salman J.M., Njoku V.O., Hameed B.H. // Chem. Eng. J. 2011. V. 174. I. 1. P. 41.
Salman J.M., Njoku V.O., Hameed B.H. // Chem. Eng. J. 2011. V. 174. I. 1. P. 33.
Cansado I.P.P., Mourão P.A.M., Gomes J.A.F.L. // Ciência & Tecnologia dos Materiais. 2017. V. 29. I. 1. P. 224.
Tang L., Zhang S., Zeng G.-M. // J. Colloid Interface Sci. 2015. V. 445. P. 1.
Zhong S., Zhou C., Zhang X. // J. Hazard. Mater. 2014. V. 276. P. 58.
Sarker M., Ahmed I., Jhung S.H. // Chem. Eng. J. 2017. V. 323. P. 203–211.
Jung B.K., Hasan Z., Jhung S.H. // Chem. Eng. J. 2013. V. 234. P. 99.
Gao Q., Xu J., Bu X.-H. // Coord. Chem. Rev. 2019. V. 378. P. 17.
Zhou M., Wu Y., Qiao J. // J. Colloid Interface Sci. 2013. V. 405. P. 157.
Seo Y.S., Khan N.A., Jhung S.H. // Chem. Eng. J. 2015. V. 270. P. 22.
Liu C., Wang P., Liu X., Yi X., Zhou Z., Liu D. // ACS Sustainable Chem. Eng. 2019. V. 7. I. 17. P. 14479.
Mohammad-pajooh E., Turcios A.E., Cuff G., Weichgrebe D., Rosenwinkel K.-H., Vedenyapina M.D., Sharifullina L.R. // J. Environ. Manage. 2018. V. 228. P. 189.
Bashir M.J.K., Wong J.W., Sethupathi S., Aun N.C., Wei L.J. // MATEC WebConf. 2017. V. 103. N. 06008. https://doi.org/10.1051/matecconf/201710306008
Salman J.M., Hameed B.H. // Desalination. 2010. V. 256. I. 1-3. P. 129.
Zhang W., Yang X., Wang D. // Ind. Eng. Chem. Res. 2013. V. 52. I. 16. P. 5765.
Al-Qodah Z., Shawaqfeh A.T., Lafi W.K. // Desalination. 2008. V. 208. I. 1-3. P. 294.
Aksu Z., Kabasakal E. // J Environ Sci Heal B. 2007. V. 40. I. 4. P. 545.
Li X., Zhang C., Liu J. // Min. Sci. Technol. (China). 2010. V. 20. I. 5. P. 778.
Vieira W.T., Bispo M.D., Farias S.M., Almeida A.S.V., Silva T.L., Vieira M.G.A., Soletti J.I., Balliano T.L. // J. Environ. Chem. Eng. 2021. V. 9. I. 2. 105155.
Salomón Y.L. de O., Georgin J., Franco D.S.P., Netto M.S., Piccilli D.G.A., Foletto E.L., Oliveira L.F.S., Dotto G.L. // J. Environ. Chem. Eng. 2021. V. 9. I. 1. 104911.
Orduz A.E., Acebal C., Zanini G. // J. Environ. Chem. Eng. 2021. V. 9. I. 1. 104601.
Bratek W., Świątkowski A., Pakuła M., Biniak S., Bystrzejewski M., Szmigielski R. // J. Anal. Appl. Pyrolysis. 2013. V. 100. P. 192.
Gupta V.K., Gupta B., Rastogi A., Agarwal S., Nayak A. // J. Hazard. Mater. 2011. V. 186. I. 1. P. 891.
Cazetta A.L., Junior O.P., Vargas A.M.M. // J. Anal. Appl. Pyrol. 2013. V. 101. P. 53.
Delpeux-Ouldriane S., Gineys M., Cohaut N., Béguin F. // Carbon. 2015. V. 94. P. 816.
Zhao Y., Choi J.W., Bediako J.K., Song M-H., Lin S., Cho C.W., Yun Y-S. // J. Hazard. Mater. 2018. V. 360. P. 529.
Chingombe P., Saha B., Wakeman R.J. // J. Colloid Interface Sci. 2006. V. 302. I. 2. P. 408.
Kim S.J., Shim W.G., Kim T.Y. // Korean J. Chem. Eng. 2002. V. 19. P. 967.
Njoku V.O., Asif M., Hameed B.H. // Desalin. Water. Treat. 2015. V. 55. I. 1. P. 132.
Kuśmierek K., Szala M., Świątkowski A. // J. Taiwan Inst. Chem. Eng. 2016. V. 63. P. 371.
Njoku V.O., Hameed B.H. // Chem. Eng. J. 2011. V. 173. I. 2. P. 391.
Belmouden M., Assabbane A., Ichou Y.A. // J. Environ. Monit. 2000. V. 2. I. 3. P. 257.
Jain S., Jayaram R.V. // Separ. Sci. Tech. 2007. V. 42. I. 9. P. 2019.
Moreno-Castilla C. // Carbon. 2004. V. 42. I. 1. P. 83.
Ward T.M., Getzen F.M. // Environ. Sci. Technol. 1970. V. 4. I. 1. P. 64.
Foo K.Y., Hameed B.H. // J. Hazard. Mater. 2010. V. 175. I. 1-3. P. 1.
Ova D., Ovez B. // J. Environ. Chem. Eng. 2013. V. 1. I. 4. P. 813.
Paula F.G.F., Castro M.C.M., Ortega P.F.R., Blanco C., Lavall R.L., Santamaría R. // Microporous Mesoporous Mater. 2018. V. 267. P. 181.
Кулайшин С.А., Веденяпина М.Д., Шарифуллина Л.Р., Лапидус А.Л. // ХТТ. 2020. № 1. С. 63.
Shaji A., Zachariah A.K. // Thermal and Rheological Measurement Techniques for Nanomaterials Characterization, Elsevier 2017. P. 197.
Demiral İ., Samdan C., Demiral H. // Surf. Interfaces 2021. V. 22. P. 100873.
Mandal S., Sarkar B., Igalavithana A.D., Ok Y.S., Yang X., Lombi E., Bolan N. // Bioresour. Technol. 2017. V. 246. P. 160.
Bernal V., Giraldo L., Moreno-Piraján J.C. // Molecules. 2019. V. 24. I. 3. P. 413.
Кулайшин С.А., Веденяпина М.Д., Райская Е.А., Бельская О.Б., Кряжев Ю.Г. // Физикохимия поверхности и защита материалов. 2021. Т. 57. № 3. С. 240.
Zakaria R., Jamalluddin N.A., Abu Bakar M.Z. // Results Mat. 2021. V. 10. P. 100183.
Du H., Cheng J., Wang M., Tian M., Yang X., Wang Q. // Diam. Relat. Mater. 2020 V. 102. P. 107646.
Danish M., Ahmad T. // Renew. Sustain. Energy Rev. 2018. V. 87. P. 1.
Yorgun S., Yıldız D. // J. Taiwan Inst. Chem. Eng. V. 53. 2015. P. 122.
Chingombe P., Saha B., Wakeman R.J. // Carbon. 2005. V. 43. I. 15. P. 3132.
Allwar A., Hartati R., Fatimah I. // AIP Conf. Proc. 2017. V. 1823. I. 1. https://doi.org/10.1063/1.4978202
Bernal V., Giraldo L., Moreno-Piraján J.C. // J. Carbon R. 2018. V. 4. I. 4. https://doi.org/10.3390/c4040062
Lei B., Xie H., Chen S., Liu B., Zhou G. // Environ. Sci. Pollut. Res. 2020. V. 27. P. 27072.
Li K., Jiang Y., Wang X. // Clean Techn Environ Policy 2016. V. 18. P. 797.
Gámiz B., Hall K., Spokas K.A., Cox L. // Agronomy. 2019. V. 9. 588.
Spessato L., Bedin K.C., Cazetta A.L., Souza I.P.A.F., Duarte V.A., Crespo L.H.S., Silva M.C., Pontes R.M., Almeida V.C. // J. Hazard. Mater. 2019. V. 371. P. 499.
Huang G.G., Liu Y.F., Wu X.X., Cai J.J. // New Carbon Mater. 2019. V. 34. P. 247.
Тамаркина Ю.В., Кучеренко В.А., Шендрик Т.Г. // ХТТ. 2014. № 4. С. 38. [Tamarkina Yu.V., Kucherenko V.A., Shendrik T.G. // Solid Fuel Chem. 2014. V. 48. P. 251–259.]
Oginni O., Singh K., Oporto G., Dawson-Andoh B., McDonald L., Sabolsky E. // Bioresour. Technol. Rep. 2019. V. 7. 100266.
Chen W., Gong M., Li K., Xia M., Chen Z., Xiao H., Fang Y., Chen Y., Yang H., Chen H. // Appl. Energy. 2020. V. 278. 115730.
Moura F.C.C., Rios R.D.F., Galvão B.R.L. // Environ. Sci. Pollut. Res. 2018 V. 25. P. 26482.
Sun Y., Wei J., Wang Y., Yang G., Zhang J. // Environ. Technol. 2010. V. 31. P. 53.
Веденяпина М.Д., Шарифуллина Л.Р., Кулайшин С.А., Веденяпин А.А., Лапидус А.Л. // ХТТ. 2017. № 2. С. 51.
Cansado I.P.P., Mourão P.A.M. // Environ. Technol. Innov. 2021. P. 102058.
Kırbıyık Ç., Pütün A.E., Pütün E. // Surf. Interfaces. 2017. V. 8. P. 182.
Li S., Lü J., Zhang T., Cao Y., Li J. // Water Sci Technol. 2017. V. 75. I. (2): 482.
Vukčević M.M., Kalijadis A.M., Vasiljević T.M., Babić B.M., Laušević Z. V., Laušević M.D. // Micropor. Mesoporous Mater. 2015. V. 214. P. 156.
Fontecha-Cámara M.A., López-Ramón M.V., Pastrana-Martínez L.M. // J. Hazard. Mater. 2008. V. 156. I. 1-3. P. 472.
Chingombe P., Saha B., Wakeman R.J. // J. Colloid Interface Sci. 2006. V. 297. I. 2. P. 434.
Li Q., Snoeyink V.L., J Mariñas B., Campos C. // Water Res. 2003. V. 37. I. 20. P. 4863.
Czaplicka M., Barchanska H., Jaworek K., Kaczmarczyk B. // J. Soils Sediments. 2018. V. 18. P. 827.
Vukcevic M., Kalijadis A., Kalijadis A., Babic B., Laušević M. // J. Serb. Chem. 2013. V. 78. I. 10. P. 1617.
Goscianska J., Olejnik A. // Adsorption. 2019. V. 25. P. 345.
Rambabu K., AlYammahi J., Bharath G., Thanigaivelan A., Sivarajasekar N., Banat F. // Chemosphere. 2021. V. 282. 131103.
Suo F., Liu X., Li C., Yuan M., Zhang B., Wang J., Ma Y., Lai Z., M. Ji // Int. J. Biol. Macromol. 2019. V. 121. P. 806.
Derylo-Marczewska A., Buczek B., Swiatkowski A. // Appl. Surf. Sci. 2011. V. 257. I. 22. P. 9466.
Bhadra B.N., Lee H.J., Jhung S.H. // Environ. Res. 2022. V. 204. P. A. 111991.
Derylo-Marczewska A., Blachnio M., Marczewski A.W. // Chemosphere. 2019. V. 214. P. 349.
Derylo-Marczewska A., Blachnio M., Marczewski A.W. // Chem. Eng. J. 2017. V. 308. P. 408.
Derylo-Marczewska A., Blachnio M., Marczewski A.W. // J. Therm. Anal. 2010. V. 101. P. 785.
Abdel daiem M.M., Rivera-Utrilla J., Sánchez-Polo M. // Sci. Total Environ. 2015. V. 537. P. 335.
Garrison S. // Environ. Sci. Technol. 1998. V. 32. I. 19. P. 2815.
Kruyt H.R. Colloid Science, Vol. 1, Irreversible Systems; Elsevier: Amsterdam, 1952. 389 p.
Chen K.-L., Liu L.-C., Chen W.-R. // Environ. Pollut. 2017. V. 231. P. 1163.
Li H., Qi H., Yin M., Chen Y., Deng Q., S. Wang // Chemosphere. 2021. V. 262. 127797.
Wu P., Cai Z., Jin H., Tang Y. // Sci. Total Environ. 2019. V. 650. P. 1. P. 671.
Jafari M., Rahimi M.R., Asfaram A., Ghaedi M., Javadian H. // Chemosphere. 2021. 132670.
Hadi S., Taheri E., Amin M.M., Fatehizadeh A., Lima E.C. // Environ. Sci. Pollut. Res. 2021. V. 28. P. 13919.
Wang Y., Wang S.-L., Xie T., Cao J. // Bioresour. Technol. 2020. V. 316. 123929.
Pastrana-Martínez L.M., López-Ramón M.V., Moreno-Castilla C. // Adsorption. 2013. V. 19. P. 945.
Flores P.E.D., Ramos R.L., Mendez J.R.R., Ortiz M.M., Coronado R.M.G., Barron J.M. // J. Environ. Eng. Manage. 2006. V. 16 P. 249.
Hameed B.H., Salman J.M., Ahmad A.L. // J. Hazard. Mater. 2009. V. 163. P. 121.
Kim S.J., Kim T.Y., Kim S.J. // Korean J. Chem. Eng. 2002. V. 19. P. 1050.
Ania C.O., Béguin F. // Water Res. 2007. V. 41. I. 15. P. 3372.
Blachnio M., Derylo-Marczewska A., Charmas B., Zienkiewicz-Strzalka M., Bogatyrov V., Galaburda M. // Molecules. 2020. V. 25. I. 21. 5105.
Moreno-Castilla C., Fontecha-Cámara M.A., Álvarez-Merino M.A. // Adsorption. 2011. V. 17. P. 413.
Georgin J., Franco D.S.P., Netto M.S., Allasia D., Foletto E.L., Oliveira L.F.S., Dotto G.L. // J. Environ. Chem. Eng. 2021. V. 9. I. 1. P. 104574.
Sengul M.Y., Randall C.A., Duin A.C.T. // ACS Appl. Mater. Interfaces. 2018. V. 10. I. 43. P. 37717.
Herrera-García U., Castillo J., Patiño-Ruiz D., Solano R., Herrera A. // Water. 2019. 11, 2342.
Marczewski A.W., Seczkowska M., Deryło-Marczewska A. // Adsorption. 2016. V. 22. P. 777.
Mohan D., Gupta V.K., Srivastava S.K., Chander S. // Colloid Surf. 2001. V. 177. I. 2-3. P. 169.
Chen J.P., Lin M. // Water Res. 2001. V. 35. I. 10 P. 2385.
Shukla A., Zhang Y.-H., Dobey P., Margrave J.L., Shukla S.S. // J. Hazard. Mater. 2002. V. 95. I. 1-2. P. 137.
Lam S.S., Su M.H., Nam W.L., Thoo D.S., Ng C.M., Liew R.K., Yek P.N.Y., Ma N.L., Vo D.V.N. // Ind. Eng. Chem. Res. 2018. V. 58. I. 2. P. 695.
Pastrana-Martínez L.M., López-Ramón M.V., Fontecha-Cámara M.A. // Water Res. 2010. V. 44. I. 3. P. 879.
Moreno-Castilla C., López-Ramón M.V., Pastrana-Martínez L.M. // Adsorption. 2012. V. 18. P. 173.
Olenin S., Elliott M., Bysveen I. // Mar. Pollut. Bull. 2011. V. 62. I. 12. P. 2598.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива