Химия твердого топлива, 2022, № 4, стр. 45-53
СОРБЦИЯ ИОНОВ АММОНИЯ ИЗ ВОДНЫХ РАСТВОРОВ НА ЗОЛОШЛАКАХ ТЭЦ
Т. Т. Горбачева 1, *, Д. В. Майоров 2, **
1 Институт проблем промышленной экологии Севера –
обособленное подразделение ФГБУН ФИЦ “Кольский научный центр РАН” (ИППЭС КНЦ РАН)
184209 Апатиты, Россия
2 Институт химии и технологии редких элементов и минерального сырья имени И.В. Тананаева –
обособленное подразделение ФГБУН ФИЦ “Кольский научный центр РАН” (ИХТРЭМС КНЦ РАН)
184209 Апатиты, Россия
* E-mail: t.gorbacheva@ksc.ru
** E-mail: d.maiorov@ksc.ru
Поступила в редакцию 22.02.2022
После доработки 05.03.2022
Принята к публикации 30.03.2022
- EDN: MFNUDS
- DOI: 10.31857/S0023117722040041
Аннотация
Приведен обзор применения золоотходов ТЭЦ как вторичных ресурсов в различных областях промышленности и сельского хозяйства. Исследованы физико-химические и сорбционные свойства золошлаков АТЭЦ по отношению к ${\text{NH}}_{4}^{ + }$-иону. Установлено, что процесс сорбции адекватно описывается уравнением мономолекулярной адсорбции Ленгмюра. Рассчитана емкость адсорбционного монослоя золошлаков, составляющая 20.43 мг ${\text{NH}}_{4}^{ + }$/г, что хорошо согласуется с величинами, отмеченными в международной практике, и константа адсорбционного равновесия (0.0632 л/г). Показано, что процесс сорбции наиболее точно описывается кинетической моделью псевдо-второго порядка и протекает в смешанно-диффузионном режиме с вовлечением в процесс сорбции не только внешней поверхности материала, но внутренней поверхности его частиц, обусловленной их пористостью.
Очистка природных источных вод от нежелательных примесей для обеспечения безопасности источников питьевых вод и управления качеством водоподготовки является важной составной частью комплекса мероприятий по снижению отрицательного воздействия антропогенных и техногенных факторов на водные объекты. В связи с этим разработка новых методов удаления загрязняющих веществ из сточных вод – актуальная и важная задача. На сегодняшний день для этих целей существуют различные методы: фильтрация, химическая коагуляция, ионный обмен, адсорбция и др. [1–5], их комбинация. Одним из наиболее эффективных методов очистки сточных вод от примесей является сорбционный [6, 7], который отличается относительной простотой аппаратурного оформления и эксплуатации, высокой технологичностью и возможностью автоматизации, что позволяет удалять загрязнения чрезвычайно широкой природы до концентраций, не превышающих ПДК. При этом отсутствуют какие-либо вторичные загрязнения [6–8].
Для удаления загрязняющих веществ из сточных вод используются многие традиционные сорбенты, такие как активированный уголь, цеолиты, глины, силикагель, оксид алюминия, синтетические неорганические и органические ионообменные смолы и др. [9–12].
Одним из таких сорбентов могут быть золошлаки ТЭЦ, образующиеся в огромных количествах при сжигании угля. В их состав входят уловленные зольные уносы (flyash), остаточные нелетучие золы (bottomash) и шлаки (slag). На конец прошлого столетия хранилища золошлаков в РФ занимали площадь 20 тыс. га, на которой складировалось ~1.3 млрд т отходов со средней ежегодной прибавкой~50 тыс. т [13].
В мировой практике используется в целом не более 25% золоотходов, при этом уровни их утилизации в разных странах существенно отличаются. Наиболее полное использование отходов ТЭЦ как вторичных ресурсов характерно для стран ЕЭС и Китая (90 и 67% соответственно) [14]. Традиционным направлением утилизации золоотходов, в частности золы-уноса, является их использование в строительной индустрии [15].
Поскольку применение золоотходов в строительной индустрии по миру сравнительно невелико (10–20%), их многокомпонентный состав способствует углубленным поискам других сфер применения [16]. Активно разрабатываются технологии извлечения из золы уноса алюминия [17], благородных и редкоземельных элементов [18]. Зола ТЭЦ используется в производстве цеолитов, геополимеров, керамики и мезопористого кремнезема [19]. Золоотходы признаны перспективным материалом для применения в технологиях воздухоочистки от газообразных примесей (СO2, SO2, H2S, NO) [14]. Кроме того, зола-уноса широко используется за рубежом в агротехнике в качестве мелиорирующей добавки, улучшающей структуру и питательный режим почв, повышающей их водоудерживающую способность и способствующей снижению кислотности [20, 21].
Морфология золы угля, ее относительно высокая удельная поверхность, пористость, а также многокомпонентный химический состав (наличие кремнезема, оксидов железа, алюминия, кальция и титана) способствуют активной разработке методов ее использования в водоочистке в качестве коагулянта и сорбента [22]. Применение золоотходов признается экономически выгодным альтернативным вариантом в тех областях водоочистки, где традиционно используются активированные угли и ионообменные смолы [23].
Обзор методов получения мезопористых сорбентов из золоотходов и областей их применения приведен в статье [24]. Оценка перспективности использования золы угля в водоочистке проводится по таким основным характеристикам, как гранулометрический состав, удельная поверхность, гидрофильность, пористость [25].
Анализ литературных данных показал, что в российской практике применимость золошлаков как сорбентов для очистки сточных вод относится к слабо изученным вопросам. Однако эта проблема весьма актуальна, в частности в связи с расширением вахтового метода освоения Арктической зоны РФ, где строительство крупных очистных сооружений с использованием традиционных технологий глубокой биологической очистки экономически нецелесообразно. Однако сброс в северные водоемы неочищенных коммунальных стоков способствует их эвтрофикации, чему способствует наличие в них таких биогенных элементов, как аммонийный N и фосфатная форма P.
В настоящее время активно ведутся поиски сорбентов, использование которых в процессах удаления аммония и фосфатов из сточных вод допустимо без последующей регенерации отработанного материала, с перспективой его почвенного размещения [26, 27]. Композиция золошлаков и сорбата могла бы являться мелиорантом с пролонгированным удобрительным эффектом не только по азоту и фосфору в составе сорбата, но и по кремнию, калию, кальцию, магнию, а также широкому ряду микроэлементов, присутствующих в золе каменного угля. Просматривается перспектива применения такой композиции как основы или составной части насыпного грунта при восстановлении антропогенно нарушенных территорий Крайнего Севера. Такой подход к рациональному использованию вторичных ресурсов при проведении рекультивационных мероприятий целесообразен для исключения изъятия почвенных ресурсов, медленно возобновляемых в северных широтах.
Цель данной работы – изучение физико-химических, структурно-поверхностных и сорбционных свойств золошлаков ТЭЦ и оценка эффективности их применения в качестве сорбента для извлечения аммония из модельных растворов в диапазоне концентраций, характерных для хозяйственно-бытовых стоков городов Крайнего Севера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследований являлись золошлаки, отобранные на действующем золоотвале Апатитской ТЭЦ (Мурманская область).
Согласно данным лабораторного ситового (гранулометрического) анализа, золошлаки, использованные для опытов, относятся к пылеватой песчаной фракции с бимодальным типом распределения частиц по размерам. В составе отходов доминируют фракции –64 + 40 и –200 + 400 мкм, количества которых (по данным двух параллельных определений) составляют ∼40 и 25 мас. % от общей массы проб соответственно.
Рентгенофазовый анализ (РФА) образца золошлака проводили на приборе SHIMADZUXRD-6000 в диапазоне углов 2Θ от 6 до 70° с шагом 0.02°. Фазовый состав идентифицировали с использованием Международной базы дифракционных данных JCPDC-ICDD 2002.
Структурно-поверхностные характеристики исследовали на анализаторе удельной поверхности и пористости TriStar 3020 методами BET и BJH.
Для определения валового содержания макроэлементов (Si, Al, Fe, Na, Ca, Mg, K, P и пр.) образец текущих золошлаков массой 200 мг подвергали открытому кислотному разложению смесью HNO3, HF, HCl в стеклоуглеродных тиглях. Для удаления плавиковой кислоты добавляли серную кислоту и отгоняли полученную смесь до густых белых паров. Кислоты квалификации “о.с.ч.” (кроме серной) предварительно подвергали изотермической перегонке на установке Berghof (Германия). Растворы после разложения переводили в полипропиленовые пробирки вместимостью 50 либо 100 мл, доводили до метки 2%-ным раствором HNO3. Для разбавления растворов также использовали 2%-ный раствор HNO3. Деионизованную воду получали с помощью системы очистки воды “MilliporeElement” (Millipore, США).
Измерения проводили на масс-спектрометре с индуктивно связанной плазмой ELAN 9000 DRC-e (Perkin Elmer, США). Для настройки прибора использовали стандартный образец Multi-element ICP-MS Calibration Standard STD 1 (PerkinElmer), для градуировки прибора применяли стандартные растворы ICP-MS CalibrationStandard IV-STOCK-21 и IV-STOCK-29 (InorganicVentures, США) с массовой концентрацией определяемых элементов 10 мг/дм3. Погрешность измерений не превышала 0.5% при доверительной вероятности Р = 0.95.
Величину pH водной вытяжки золошлаков определяли, согласно [28], при соотношении массы пробы грунта и воды 1:5.
Кислотно-основные свойства поверхности золошлаков исследовали методом прерывного титрования суспензии по определению значения pH изоионной точки (рНиит) [29]. Для определения величины рНиит определяли значения рН дистиллированной воды со значениями рНо от 1 до 10, до и после контакта с исследуемыми образцами. Различная кислотность дистиллированной воды создавалась путем прибавления к ней определенных количеств 0.1 М раствора HCl или KOH. Навески образцов массой 0.4 г помещались в колбы, куда добавлялось по 30 мл дистиллированной воды. После этого суспензия выдерживалась при перемешивании на лабораторном встряхивателе в течение 2 ч для установления адсорбционно-десорбционного равновесия. Затем суспензию фильтровали и замеряли рН фильтрата (рНк).
По разнице значений кислотности раствора до адсорбции (рНо) и после адсорбции (рНк) находили изменение (ΔрН) в результате гидролитической адсорбции:
Точка пересечения графика зависимости ΔрН ∼ f(рНо) для исследуемого образца с осью абсцисс дает значение изоионной точки поверхности (рНиит).
Изучение сорбционной способности образца золошлака проводили на модельных растворах, содержащих ${\text{NH}}_{4}^{ + }$-ион с концентрациями от 5 до 50 мг ${\text{NH}}_{4}^{ + }$/л, которые готовили растворяяNH4Cl (квалификации “ч.д.а.”) в воде.
Определение равновесных характеристик (сорбционной емкости и константы сорбционного равновесия) образца золошлака проводили статическим методом. Для этого в 50 мл раствора NH4Cl соответствующей концентрации вводили 0.1 или 0.2 г исследуемого образца и выдерживали при перемешивании 24 ч в закрытой колбе. По завершении процесса суспензию фильтровали, раствор анализировали на содержание ${\text{NH}}_{4}^{ + }$-иона фотоколориметрическим методом с применением реактива Несслера.
Расчет сорбционной емкости aр осуществляли по уравнению
где ${{C}_{{\text{н}}}}$ и ${{C}_{{\text{р}}}}$ – начальная и равновесная концентрации ионов ${\text{NH}}_{4}^{ + }$, ммоль/л; $V$ – объем раствора, л; $m$ – масса навески образца золошлака, г.Обработку экспериментальных данных осуществляли по уравнениям сорбции Фрейндлиха (2) и Ленгмюра (3) в координатах их линейных уравнений (уравнения (4) и (5) соответственно):
(3)
${{a}_{{\text{р}}}} = {{a}_{\infty }}\frac{{{{k}_{{\text{р}}}}{{C}_{{\text{р}}}}}}{{1 + {{k}_{{\text{р}}}}{{C}_{{\text{р}}}}}}~,$(4)
${\text{ln}}{{a}_{{\text{р}}}} = {\text{ln}}{{k}_{{\text{р}}}} + (1{\text{/}}n){{C}_{{{\text{р\;}},}}}$(5)
$\frac{{{{C}_{{\text{р}}}}}}{{{{a}_{{\text{р}}}}}} = \frac{1}{{{{a}_{\infty }}{{k}_{{\text{р}}}}}} + \frac{{{{C}_{{\text{р}}}}}}{{{{a}_{\infty }}}}~.$Для изучения кинетики сорбции ${\text{NH}}_{4}^{ + }$-иона на образце золошлака в 50 мл раствора NH4Cl с концентрацией 30 мг/л по ${\text{NH}}_{4}^{ + }$-иону вводили 0.1 и 0.2 г исследуемого образца, при перемешивании выдерживали определенные промежутки временив закрытой колбе, после чего суспензии фильтровали, растворы анализировали на содержание ${\text{NH}}_{4}^{ + }$-иона.
Обработку экспериментальных данных осуществляли по уравнениям химической кинетики псевдо-первого (уравнение Лагергрена (6) [30]) и псевдо-второго (уравнение Хо и Маккея (7) [31]) порядков по уравнениям в координатах их линейных форм (уравнения (8) и (9) соответственно):
где k – константа скорости реакции; t – время от начала процесса сорбции.Расчет сорбционной емкости (at) в момент времени t от начала процесса сорбции емкости образца золошлака осуществляли по уравнению:
где Сн и Сt – начальная и в момент времени t концентрация ионов ${\text{NH}}_{4}^{ + }$ в растворе соответственно, ммоль/л; V – объем раствора, л; m – масса навески образца, г.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По данным РФА (рис. 1), в анализируемом образце четко идентифицируются две минеральные составляющие – кварц (SiO2) (номер карточки Международной базы дифракционных данных JCPDC-ICDD 2002 – 33-1161) и феррит кальция (CaFe2O4) (номер карточки – 32-0168). Наличие других фаз (Al2O3, CaO, MgO и др., или их соединений) не обнаружено, что можно объяснить их присутствием в образце в рентгеноаморфном состоянии [32].
По данным химического анализа, в составе золошлаков преобладают оксиды кремния и алюминия, а также высокое содержание оксидов железа, кальция и магния (табл. 1).
Таблица 1.
Химический состав золошлаков Апатитской ТЭЦ, мас. %
| Na2О | MgО | Al2О3 | SiО2 | P2О5 | SO3 | K2O | CaО | TiO2 | MnО | Fe2О3 |
|---|---|---|---|---|---|---|---|---|---|---|
| 0.6 | 2.9 | 23.3 | 47.9 | 0.8 | 1.0 | 1.0 | 2.1 | 1.2 | 0.1 | 5.8 |
Согласно классификации золоотходов ASTMC 618 [33], основанной на оценке содержания основных оксидов, исследованный образец можно отнести к F-типу (Σ(SiO2, Al2O3 и Fe2O3) более 70%), наиболее пригодному для использования в водоочистке.
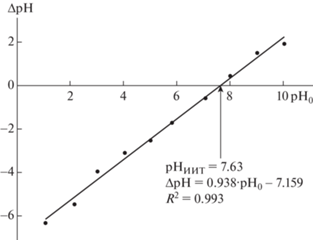
На рис. 2 представлен вид зависимости ΔрН от рНо фильтрата суспензии образца золошлаков. Такой вид характерен для полифункциональной поверхности, на которой нет адсорбированных примесей, степень диссоциации которых превышала бы диссоциацию активных центров самого твердого тела, тем самым изменяя химическое равновесие на поверхности [29].
По значению pHиит можно прогнозировать преимущественное направление извлечения ионов из раствора при применении золошлаков в качестве сорбента. Если pH водной вытяжки выше pHиит, происходит преимущественное извлечение катионов из раствора, а если ниже, то поверхность заряжена положительно, и материал работает как анионообменник [34]. Как следует из рис. 2, pHиит исследуемого образца составляет 7.63. При этом pH водной вытяжки образца варьирует в диапазоне 7.73–7.93. Отсюда можно предполагать преимущественную сорбцию катионов золошлаками ТЭЦ, поэтому в данной работе акцент сделан на сорбцию ионов ${\text{NH}}_{4}^{ + }$.
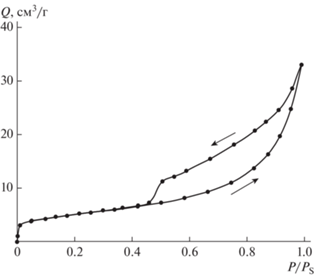
На рис. 3 представлена изотерма сорбции-десорбции азота образцом золошлака. Вид изотермы может быть отнесен, по классификации, предложенной в [35], к изотерме IV(a) типа, которая ассоциируется с капиллярной конденсацией в мезопорах, о чем свидетельствует ярко выраженная петля гистерезиса, основной причиной которого является капиллярная конденсация азота (абсорбата) в мезопорах (2 < dпор < 50 нм). Начальный участок этой изотермы аналогичен изотерме типа II. Характерное смыкание петли гистерезиса на изотерме в процессе десорбции ранее, чем относительное давление, достигнет величины 0.3, а также отсутствие значительного увеличения количества адсорбированного азота в области давлений P/PS < 0.1, свидетельствует об отсутствии (или незначительном количестве) в образцах микропор (dпор < 2 нм).
Рис. 3.
Изотерма сорбции-десорбции образца золошлака (зависимость количества адсорбированного N2 (Q) от относительного давления (P/PS).
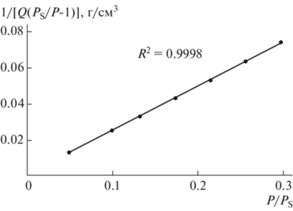
Для подтверждения мезопористого характера образца и проверки применимости теории (уравнения) БЭТ, лежащей в основе алгоритма вычисления удельной поверхности, была построена зависимость (1/[Q(PS/P – 1)]) от относительного давления азота P/PS для исследованного образца (рис. 4). Известно, что уравнение БЭТ может быть применено к расчету поверхности мезопористых веществ в случае, если хотя бы на небольшом участке изотермы зависимость (1/[Q(PS/P – 1)]) от P/PS будет линейной [36]. Для большинства твердых веществ линейная зависимость на небольшом участке изотермы в пределах значений относительного давления от 0.05 до 0.35. Как видно из рис. 4, для представленного образца график зависимости (1/[Q(PS/P – 1)]) от P/PS имеет линейный вид (коэффициент корреляции составляет ∼0.999), что говорит о хорошей применимости метода BET для расчета удельной поверхности образца золошлака.
В табл. 2 приведены некоторые структурно-поверхностные свойства исследованного образца золошлака. Удельная поверхность образца Sуд составляет 17.8 м2/г, что хорошо согласуется с исследованиями золы ТЭЦ европейских стран (1.3–12.4 м2/г [37]).
Таблица 2.
Структурно-поверхностные свойства золошлака
| Показатель | Значение |
|---|---|
| Удельная поверхность по методу БЭТ, м2/г | 17.81 |
| Удельная поверхность микропор (d < 1.7 нм), м2/г | 1.15 |
| Удельная внешняя поверхность, м2/г | 16.66 |
| Удельный объем микропор (d < 1.7 нм), см3/г | 0.0005 |
| Удельный объем пор (1.7 нм ≤ d ≤ 300 нм), (BJH, десорбция), см3/г | 0.0513 |
| Ширина пор по методу БЭТ, нм | 8.63 |
| Ср. диаметр пор по методу BJH (адсорбция), нм | 11.09 |
| Ср. диаметр пор по методу BJH (десорбция), нм | 7.28 |
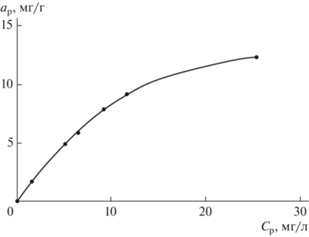
На рис. 5 представлены полученные экспериментальные данные по изучению равновесных сорбционных характеристик образца золошлака.
Обработка результатов экспериментов по линейным формам уравнений Фрейндлиха (4) и Ленгмюра (5) (рис. 6) показала, что коэффициент детерминации R2 для уравнения Ленгмюра, описывающего процесс сорбции, составляет 0.983, в то время как для уравнения Фрейндлиха он равен 0.967. Таким образом, уравнение Ленгмюра более точно описывает процесс сорбции ${\text{NH}}_{4}^{ + }$-иона на образце золошлака.
Рис. 6.
Изотерма сорбции ${\text{NH}}_{4}^{ + }$-иона на золошлаке в координатах линейных форм уравнений Фрейндлиха (а) и Ленгмюра (б).

Сопоставление уравнения (5) и уравнения прямой зависимости Ср/ар– f(Ср) (рис. 6, б) дает tgα = 1/а∞, а отрезок, отсекаемый на оси y, равен 1/(а∞ ⋅ kр). Откуда а∞ = 20.43 мг/г; kр = 0.0632 л/г.
Сорбционная емкость золошлаков Апатитской ТЭЦ в отношении ионов аммония (20.43 мг/г) значительно превышает содержание общего азота в целинных и окультуренных почвах Кольского полуострова (0.070 и 0.161 мг/г соответственно) [38]. Это позволяет рекомендовать отработанный сорбент как мелиорирующую добавку с пролонгированным удобрительным эффектом при формировании насыпных грунтов при рекультивации нарушенных территорий региона. Экспериментальные результаты по изучению кинетики сорбции представлены в табл. 3.
Таблица 3.
Изменение содержания ${\text{NH}}_{4}^{ + }$-иона в растворе в процессе сорбции (начальная концентрация ${\text{NH}}_{4}^{ + }$ – 30 мг/л)
| Расход золошлака, 2 г/л | Расход золошлака, 4 г/л | ||
|---|---|---|---|
| время сорбции, ч | содержание ${\text{NH}}_{4}^{ + }$-иона, мг/л | время сорбции, ч | содержание ${\text{NH}}_{4}^{ + }$-иона, мг/л |
| 1 | 13.54 | 1 | 11.03 |
| 2 | 13.12 | 2 | 9.80 |
| 3 | 12.69 | 3 | 8.49 |
| 4 | 12.03 | 4 | 7.42 |
| 6 | 11.70 | 6 | 7.13 |
| 24 | 11.64 (ap = 9.18 мг/л) | 24 | 6.52 (ap = 11.74 мг/л) |
На рис. 7 представлены экспериментальные результаты в координатах линейных форм уравнений химической кинетики псевдо-первого (8) и псевдо-второго (9) порядков.
Рис. 7.
Кинетические кривые уравнений псевдо-первого (а) и псевдо-второго (б) порядка в линейной форме. Расход золошлака, г/л: 1 – 2; 2 – 4.
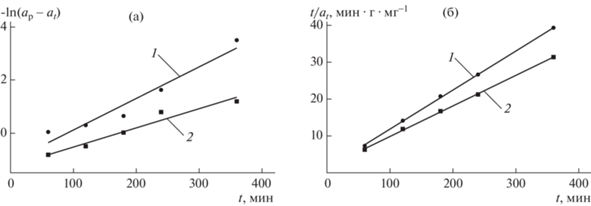
Математической обработкой экспериментальных данных (рис. 7) были получены уравнения химической кинетики псевдо-первого и псевдо-второго порядка (табл. 4) и рассчитаны значения кинетических параметров: равновесной сорбционной емкости образца золошлака (ap) и константы скорости реакции (k) (табл. 4).
Таблица 4.
Результаты математической обработки экспериментальных данных
| Порядок реакции | Расход золошлака, г/л | Уравнение | R2 | ap, мг/г | k, г (мг ⋅ мин)–1 |
|---|---|---|---|---|---|
| 1 | 2 | –ln(ap – at)= –1.0477 + 0.01185t | 0.942 | 0.35 | 1.012 |
| 4 | –ln(ap – at)= –1.2329 + 0.00714t | 0.951 | 0.29 | 1.007 | |
| 2 | 2 | t/at= 1.2889 + 0.10616t | >0.999 | 9.42 | 8.74 ⋅ 10–3 |
| 4 | t/at= 1.6156 + 0.08292t | >0.999 | 12.06 | 4.26 ⋅ 10–3 |
Из данных табл. 4 можно сделать вывод, что кинетическая модель псевдо-второго порядка более точно описывает экспериментальные данные по сорбции ${\text{NH}}_{4}^{ + }$-иона на образце золошлака (коэффициент детерминации $R_{1}^{2}$ < $R_{2}^{2}$). Это же подтверждает и то, что ошибка между расчетными значениями равновесных концентраций ap и полученными экспериментальным путем не превышает 3%. Некоторое расхождение значений констант скорости реакции можно объяснить погрешностью аналитического определения ${\text{NH}}_{4}^{ + }$-иона в растворе, особенно в области малых концентраций, а также тем, что, вероятно, формальный порядок реакции имеет дробное значение, близкое к двум.
Для выявления лимитирующей стадии кинетики сорбционного процесса были использованы модели диффузионной кинетики Бойда [39] и Морриса–Вебера [40], предполагающие анализ полученных кинетических данных (табл. 3) в координатах –ln(1 – F) – t, и F – t1/2 соответственно, где F = at/ap. В случае преобладания внешне-диффузионного лимитирования процесса сорбции линейной является первая из приведенных зависимостей. Если лимитирующая стадия– внутренняя диффузия, то наблюдается линейная корреляция во втором случае. Полученные результаты представлены на рис. 8 и в табл. 5.
Рис. 8.
Интегральные кинетические кривые сорбции ${\text{NH}}_{4}^{ + }$-иона из водного раствора в координатах –ln(1 – F) – t (а) и F – t1/2 (б) на образце золошлака. Расход золошлака, г/л: 1 – 2; 2 – 4.
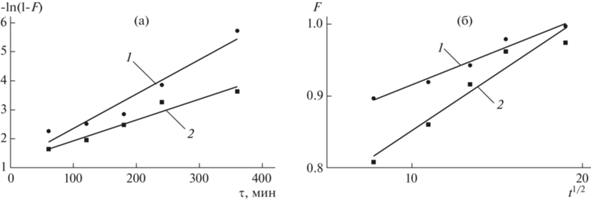
Таблица 5.
Результаты математической обработки внешне- и внутренне-диффузионной кинетики процесса сорбции ${\text{NH}}_{4}^{ + }$-иона из водного раствора на образце золошлака (рис. 8)
| Лимитирующая стадия | Расход золошлака | Уравнение прямой | R2 |
|---|---|---|---|
| Внешняя диффузия | 2 | –ln(1 – F) = 1.1694 + 0.01185t | 0.942 |
| 4 | –ln(1 – F) = 1.2301 + 0.00714t | 0.951 | |
| Внутренняя диффузия | 2 | F = 0.8204 + 0.00949t1/2 | 0.971 |
| 4 | F = 0.6932 + 0.01583t1/2 | 0.942 |
Значения коэффициентов детерминации (R2) для внешне- и внутренне-диффузионных моделей (0.942–0.951 и 0.942–0.971 соответственно) свидетельствуют, что обе модели адекватно описывают процесс ($R_{{{\text{внутр}}.}}^{2}$ ≈ $R_{{{\text{внешн}}.}}^{2}$ > 0.8), т.е. процесс сорбции протекает в смешанно-диффузионном режиме. При этом, вероятно, в первые 1–2 ч (табл. 3) происходит относительно быстрое заполнение внешней поверхности и легкодоступного приповерхностого объема (слоя) частиц (at составляет 75–85% от aр), а для полного заполнения поверхности (объема) и достижения сорбционного равновесия требуется значительное время (более 5–10 ч).
Основываясь на полученных данных, можно предположить, что механизм сорбции заключается в образовании донорно-акцепторной и/или водородной связи между ионами ${\text{NH}}_{4}^{ + }$ и активными центрами (О– и ОН–) на поверхности золошлаков.
ВЫВОДЫ
1. Сорбционная емкость золошлаков достигает 20.43 мг ${\text{NH}}_{4}^{ + }$/г, что значительно превышает содержание общего азота в целинных и окультуренных почвах региона.
2. Процесс сорбции ${\text{NH}}_{4}^{ + }$-иона протекает в смешанно-диффузионном режиме, в процесс сорбции вовлекается не только внешняя поверхность материала, но внутренняя поверхность зерен, обусловленная их пористостью. При этом в первые 1–2 ч сорбции сорбционная емкость золошлака достигает 75–85% от максимально возможной (равновесной).
3. По структурно-поверхностным и физико-химическим характеристикам золошлаки ТЭЦ соответствуют F-типу международной классификации ASTMC 618, что позволяет рекомендовать их к использованию в качестве сорбента при очистке хозяйственно-бытовых стоков.
4. Золошлаки ТЭЦ с сорбированными аммонийными соединениями перспективны при восстановлении антропогенно нарушенных территорий для формирования насыпных грунтов как мелиорант с пролонгированным удобрительным эффектом.
Список литературы
Перлов А.Г. Технологии очистки природных вод. М.: Изд. АСВ. 2016. 600 с.
O’Shea K.E., Dionysiou D.D. // Phys. Chem. Lett. 2012. V. 3. № 15. P. 2112.
Chee Yang Teh, Pretty Mori Budiman, Katrina Pui, Yee Shak, Ta Yeong Wu. // Ind. Eng. Chem. Res. 2016. V. 55. № 16. P. 4363.
Miller D.J., Dreyer D.R., Bielawski Ch.W., Paul D.R., Freeman B.D. // Angew. Chem. Inter. Ed. 2017. V. 56. № 17. P. 4662.
Mohammed Boshir Ahmed, Zhou J.L., Huu Hao Ngo, Wenshan Guo, Thomaidis N.S., Jiang Xu. // J. Haz. Mat. 2017. V. 323. Part A. P. 274.
Arami M., Limaee N.Y., Mahmoodia N.M. // Chem. Eng. J. 2008. № 139. P. 2.
Lee S.M., Tiwar D. // Appl. Clay Sci. 2012. № 59–60. P. 84.
Considine R., Denoyel R., Pendleton P., Schumann R., Wong S.H. // Colloids Surf. A: Physicochem. Eng. Aspects. 2001. № 179. P. 271.
Su F., Lu C., Hu S. // Colloids Surf. A: Physicochem. Eng. Aspects. 2010. № 353. P. 83.
Hao R., Xiao X., Zuo X.X., Nan J.M., Zhang W.D. // J. Hazard. Mater. 2012. № 209–210. P. 137.
Hou M.F., Ma C.X., Zhang W.D., Tang X.Y., Fan Y.N., Wan H.F. // J. Hazard. Mater. 2011. № 186. P. 1118.
Jafari S., Aziziana S., Jalehb B. // Colloids Surf. A: Physicochem. Eng. Aspects. 2011. № 384. P. 618.
Юдович Я.Э., Кетрис М.П. Токсичные элементы-примеси в ископаемых углях. Екатеринбург: Изд-во. УрОРАН. 2005. 648 с.
Asl S.M.H., Javadian H., Khavarpour M., Belviso C., Taghavi M., Maghsudi M. // Journal of Cleaner Production. 2019. № 208. P. 1131. https://doi.org/10.1016/j.jclepro.2018.10.186
Xu G., Shi X. // Resour. Conserv. Recycling. 2018. № 136. P. 95. https://doi.org/10.1016/j.resconrec.2018.04.010
Iyer R.S., Scott J.A. // Resour. Conserv. Recycling. 2001. № 31(3). P. 217.https://doi.org/10.1016/S0921-3449(00)00084-7
Ding J., Ma S., Shen S., Xie Z., Zheng S., Zhang Y. // Waste Management. 2017. № 60. P. 375.https://doi.org/10.1016/j.wasman.2016.06.009
Sahoo P.K., Kim K., Powell M.A., Equeenuddin S.M. // Intern. J. of Coal Sci. Technol. 2016. № 3 (10–11). P. 1958.https://doi.org/10.1007/s40789-016-0141-2
Li C., Qiao X. // Chem. Eng. J. 2016. № 302. P. 388.https://doi.org/10.1016/j.cej.2016.05.029
Ram L.C., Masto R.E. // Earth-Science Rev. 2014. № 128. P. 52.https://doi.org/10.1016/j.earscirev.2013.10.003
Sabry M.S., Peter S.H., Tsadilas C.D. // J. Environ. Management. 2014. № 145. P. 249.https://doi.org/10.1016/j.jenvman.2014.07.005
Mushtaq F., Zahid M., Bhatti I. A., Nasir S., Hussain T. // J. Environ. Management. 2019. № 240. P. 27. https://doi.org/10.1016/j.jenvman.2019.03.054
Hower J.C., Groppo J.G., Graham U.M., Ward C.R., Kostova I.J., Maroto-Valer M.M., Dai S. // Intern. J. Coal Geology. 2017. № 179. P.11. https://doi.org/10.1016/j.coal.2017.05.007
Vassilev S.V., Vassileva C.G. // Energy Fuel. 2005. № 19. P. 1084.
Visa M., Isac L., Duta A. // Appl. Surface Sci. 2012. № 258 (17). P. 6345.
Hermassi M., Valderrama C., Moreno N., Font O., Querol X., Batis N.H., Cortina J.L. // J. Environ. Chem. Eng. 2017. № 5 (1). P. 160.https://doi.org/10.1016/j.jece.2016.11.027
Wang X., Lü S., Gao C., Xu X., Zhang X., Bai X., Liu M., Wu L. // Chem. Eng. J. 2014. № 252. P. 404. https://doi.org/10.1016/j.cej.2014.04.097
ГОСТ 27753.3-88. Грунты тепличные. Метод определения рН водной суспензии.
Иконникова К.В., Иконникова Л.Ф., Минакова Т.С., Саркисов Ю.С. Теория и практика определения кислотно-основных свойств поверхности твердых тел методом рН-метрии: учебное пособие. Томск: Изд-во Томск. политехн. ун-та. 2014. 99 с.
Lagergren S. About the theory of so-called adsorption of soluble substances // Kung Sven Veten Hand. 1898. V. 24:1. P. 39.
Ho Y.S., Ng J.C.Y., McKay G. // Separation and Purification Methods. 2000. № 29(2). P. 189.
Wendling L.A., Douglas G.B., Coleman S., Yuan Z. // Sci. Total Environ. 2013. № 442. P. 63. https://doi.org/10.1016/j.scitotenv.2012.10.008
ASTM. Standard C618-08 Standard Specification for Coal Fly Ash and Raw or Calcined Natural Pozzolan for Use in Concrete. 2008. ASTM International, West Conshohocken, PA, USA. P. 1–3.
Taleb K., Markovski J., Veličković Z., Rusmirović J., Rančić M., Pavlović V., Marinković A. // Arabian J. Chem. 2016. № 12. P. 4675.
Thommes M., Kaneko K., Neimark A.V., Olivier J.P., Rodriguez-Reinoso F., Rouquerol J., Sing K.S.W. // Pure Appl. Chem. 2015. V. 87. № 9–10. P. 1051. https://doi.org/10.1515/pac-2014-1117
Яковлева Н. В. // Вопросы материаловедения. 2013. № 1(73). С. 95.
Moreno N., Querol X., Andrés J.M., Stanton K., Towler M., Nugteren H., Janssen-Jurkovicová M., Jones R. // Fuel. 2005. № 84 (11). P. 1351.https://doi.org/10.1016/j.fuel.2004.06.038
Переверзев В.Н., Коробейникова Н.М., Баскова Л.А. // Агрохимия. 2009. № 2. С. 35.
Бойд Г.Е., Адамсон А.В., Майерс Л.С. Хроматографический метод разделения ионов. М.: Химия, 1949. 333 с.
Weber Jr. W.J., Morris J.C., Sanit J. // J. Sanitary Eng. Division. 1963. № 89. P. 31–38.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива