Химия твердого топлива, 2022, № 4, стр. 20-25
АНТИОКСИДАНТЫ В ГУМИНОВЫХ КИСЛОТАХ РАЗЛИЧНОГО ПРОИСХОЖДЕНИЯ
Н. В. Юдина 1, *, А. В. Савельева 1, **, Е. В. Линкевич 1, ***
1 ФГБУН Институт химии нефти СО РАН (ИХН СО РАН)
634055 Томск, Россия
* E-mail: natal@ipc.tsc.ru
** E-mail: anna@ipc.tsc.ru
*** E-mail: maltseva2@gmail.ru
Поступила в редакцию 14.02.2022
После доработки 17.02.2022
Принята к публикации 30.03.2022
- EDN: QCPFZJ
- DOI: 10.31857/S0023117722040090
Аннотация
Вольтамперометрическим методом показано, что гуминовые кислоты (ГК) разного происхождения, извлеченные из почв, сапропелей, торфов и бурых углей, проявляют выраженные антиоксидантные свойства. По результатам корреляционного анализа показано, что антиоксидантная активность ГК зависит от содержания фенольных гидроксилов и карбоксильных групп в области рН 10–5.5. Максимальной антиоксидантной активностью характеризуются ГК торфов.
ВВЕДЕНИЕ
Природные антиоксиданты (АО) широко распространены в биосфере и оказывают влияние на процессы биохимической трансформации органического вещества, обеспечивая устойчивость к окислению. К наиболее эффективным ингибиторам окисления относятся соединения с функциональной группой, имеющей подвижный атом водорода (фенолы, ароматические амины, аминофенолы, пигменты и другие вещества), способные переводить свободные радикалы в неактивную форму [1–4]. Соединения, имеющие сравнительно слабые –OH- и –NH-связи вступают во взаимодействие с пероксидными радикалами, обрывая основную цепь окисления [5].
Гуминовые кислоты (ГК), представляющие собой гетерогенные редокс-активные органические макромолекулы, способны регулировать окислительно-восстановительные процессы. Особой характеристикой ГК является их антиоксидантная способность, влияющая на концентрацию и продолжительность жизни активных форм кислорода в почвах и водных системах [6]. Гуминовые кислоты могут также выполнять защитные функции в экосистемах, прерывая радикальные реакции и предотвращая повреждение клеточных мембран и биологических макромолекул [7, 8].
Было установлено, что при заданных значениях рН и Еh электронодонорная способность ГК в окислительных условиях хорошо коррелирует с содержанием фенольных фрагментов [6]. Фенольные фрагменты, образующиеся из более сложных молекул-предшественников, таких как лигнин и дубильные вещества, были предложены в качестве основных электронодонорных фрагментов ГК, обеспечивающих их антиоксидантную способность.
По результатам сравнительного анализа индексов реакционной способности модельной структуры ГК разработаны критерии оценки антиоксидантной способности по величине энергии адсорбции молекулярного кислорода гидроксильной группой [9].
Значения рН оказывают важное влияние на восстановительную способность АО. В кислых условиях восстановительная способность может быть ограничена за счет протонирования антиоксидантных соединений, тогда как в основных условиях протонная диссоциация фенольных соединений увеличила бы восстановительную способность образца [10]. Антиоксидантная активность ГК в кислой области рН в основном связана с присутствием азотсодержащих групп, таких как пептиды и аминокислотные остатки [11–13].
При определении антиоксидантной активности широко применяют различные методы: хемилюминесценцию [14], спектрофотометрию [15], электрохимические [16, 17], газометрические [18] и т.д. Достаточно удобным для определения АО и их активности является вольтамперометрический метод, весьма чувствительный к наличию в среде кислорода и его активных радикалов.
Цель данной работы – исследование антиоксидантной активности ГК различного происхождения в зависимости от молекулярной структуры и рН среды.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе исследовались гуминовые кислоты, выделенные из чернозема (ЧП), дерновоподзолистой (ДП), подзолистой (ПЗ) почвы, сапропелей органического (ОР), органожелезистого (ОЖ) и карбонатного (КР) типа, верхового торфа фускум (ТВФ), верхового древесно-травяного (ТДТ) и низинного древесного (ТД) из района Васюганской природной провинции. Источником ГК более преобразованных каустобиолитов служили окисленные угли месторождений Чуй-Кэнул (ОУ, Китай), Баганур (ОУ1, Монголия) и бурые угли месторождений Чинг-Чай (БУ, Китай) и Барандатского месторождения Канско-Ачинского угольного бассейна (БУ1). В качестве стандартов использовали ГК фирмы “Merk” (Германия) и нефракционированную смесь гуминовых и фульвокислот ГФК фирмы “Sigma Aldrich” (США).
Каустобиолиты предварительно измельчались в дезинтеграторе Nossen 8255 до размера частиц 1–3 мм.
Гуминовые кислоты выделяли из каустобиолитов 0.1 н NaОН при температуре 20°С и перемешивании в течение 1 ч. Щелочную экстракцию повторяли трижды. Гуминовые кислоты в щелочном растворе осаждали 4%-ной НCl до значения рН 2. Бурый аморфный осадок ГК отделяли центрифугированием, затем отмывали дистиллированной водой до значения рН 7 и высушивали в чашке Петри в вакуумном шкафу до постоянной массы.
Методом потенциометрического титрования определяли содержание кислых ионогенных групп. Во время титрования ГК ионную силу раствора поддерживали на постоянном уровне насыщенным раствором хлорида натрия. На полученных кривых титрования выделяли три четких перегиба в области рН 10–11 (фенольные гидроксилы CArOH), рН 5.5–8.5 (карбоксильные группы при ароматическом кольце CArСOOH), рН 2.5–5.0 (карбоксильные группы при углеводородных цепочках CAlkCOOH). Расчет точки эквивалентности проводили с помощью численной интерполяции.
Элементный состав ГК определяли на элементном анализаторе Vario El Cube (Германия).
Регистрацию ИК-спектров ГК проводили на ИК-Фурье-спектрометре Nikolet 5700 c Raman-модулем (корпорация “Thermo Electron”, США) в таблетках с KBr при соотношении 1:300 соответственно в интервале значений частоты от 400 до 4000 см–1 c компенсацией сигналов адсорбированной воды. Для количественной оценки интенсивности полос поглощения применен метод базовых линий и относительных оптических плотностей (D) с использованием компьютерной программы. Содержание структурных групп рассчитывали в виде отношения значений оптической плотности в максимуме характеристической полосы поглощения (п.п.) и реперной п.п. 1465 см–1.
Фрагментный состав ГК анализировали методом 13С-ЯМР-спектроскопии на радиоспектрометре фирмы Bruker 300 (Германия), имеющем рабочую частоту по углероду 125 МГц, с использованием Фурье-преобразования с накоплением. Время накопления изменялось от нескольких часов до суток. Обработку спектров проводили с использованием программы WINNMR фирмы Bruker. Кроме регистрации спектров ЯМР осуществляли запись интеграла, что позволило определить относительное содержание магнитных ядер углерода, принадлежащих к той или иной группе атомов.
Вольтамперометрическим методом катодного восстановления кислорода с использованием ртутного пленочного электрода (“Антиоксидант АОА”) определяли антиоксидантные свойства ГК [17]. Ошибка измерений не превышает 10%. Фоновым электролитом являлся фосфатный буфер (рН 6.8) и боратный буфер (рН 9.18). Концентрация ГК в ячейке изменялась от 0.5 ⋅ 10–5 г/мл до 2.0 ⋅ 10–5 г/мл. По результатам определений строился график зависимости функции (1 – I/I0) от времени (t). Данный график обрабатывался методом наименьших квадратов. По линейной части кривой d(1 – I/I0)/dt определяли тангенс угла наклона и рассчитывали кинетический критерий К, мкмоль/л·мин:
где I – ток электровосстановления (ЭВ О2) в присутствии ГК в растворе, мкА; I0 – ток ЭВ О2 в отсутствие ГК в растворе, мкА; $C_{{{{{\text{O}}}_{2}}}}^{0}$– исходная концентрация кислорода в растворе, мкмоль/л; t – время протекания процесса, мин.Используемые материалы: NaOH (х.ч., “Реахимприбор”), НCl (х.ч., ООО “ХИМТОРГ”), NaCl (х.ч., ООО “ХИМТОРГ”), фосфатный буфер (100-кратный концентрат, рН 6.8, “Абрис+”), боратный буфер (рН 9.18, “ЛенРеактив”).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Гуминовые кислоты относятся к ароматическим оксиполикарбоновым кислотам, периферическая часть макромолекулы которых обогащена кислородсодержащими группами. Как показано в [8], количество функциональных групп в пересчете на одну макромолекулу ГК составляет: –СООН – 50, –ОН – 25.
В табл. 1 и 2 приведены физико-химические характеристики ГК, выделенных из почв, сапропелей, торфов и углей. Исследованные ГК существенно различались по своим структурно-молекулярным характеристикам. Самые высокие значения атомного отношения H/C характерны для ГК из сапропелей и торфов, что свидетельствует о большей насыщенности молекулярной структуры водородом и преобладанием алифатических и ациклических фрагментов. Низкими значениями H/C отличаются ГК из почв и углей. Последние характеризуются более конденсированными структурами с меньшей долей в них водорода. Преобразование органического вещества (ОВ) в процессе гумификации в системе “торф–уголь” сопровождается конденсацией молекул и приводит к снижению атомного отношения H/C в ГК.
Таблица 1.
Физико-химическая характеристика гуминовых кислот
| Образец ГК | Атомное отношение | Содержание функциональных групп, мг-экв/г | ||||
|---|---|---|---|---|---|---|
| Н/С | О/C | C/N | СAlkCООН | СArCOOH | СArOH | |
| Чернозем ЧП | 0.86 | 0.51 | 14.8 | Не определено | Не определено | Не определено |
| ДП | 1.01 | 0.50 | 16.4 | – | – | – |
| Подзолистая | 1.08 | 0.56 | 11.9 | – | – | – |
| Сапропель ОР | 1.36 | 0.62 | 21.5 | – | – | – |
| Сапропель ОЖ | 1.61 | 0.57 | 13.6 | – | – | – |
| Сапропель КБ | 1.89 | 0.77 | 17.0 | – | – | – |
| Торф ТВФ | 1.24 | 0.66 | 29.7 | 3.2 ± 0.1 | 7.5 ± 0.1 | 10.2 ± 0.3 |
| Торф ТДТ | 1.22 | 0.48 | 35.4 | 3.1 ± 0.2 | 6.5 ± 0.1 | 9.2 ± 0.2 |
| Торф ТД | 1.21 | 0.50 | 28.1 | 3.1 ± 0.1 | 6.8 ± 0.1 | 8.5 ± 0.2 |
| ОУ Чуй-Кэнул | 1.20 | 0.46 | 37.3 | 1.6 ± 0.1 | 6.1 ± 0.2 | 8.4 ± 0.1 |
| ОУ1 Баганур | 1.19 | 0.45 | 41.3 | 2.0 ± 0.1 | 5.8 ± 0.2 | 8.3 ± 0.1 |
| БУ Чинг-Чай | 1.10 | 0.39 | 72.3 | 2.4 ± 0.1 | 5.1 ± 0.2 | 8.1 ± 0.1 |
| БУ1 Барандатское | 1.13 | 0.38 | 71.9 | 0.8 ± 0.1 | 4.7 ± 0.2 | 8.0 ± 0.2 |
| ГФК “Aldrich” | 1.15 | 0.71 | 39.7 | 2.3 ± 0.1 | 6.1 ± 0.3 | 8.7 ± 0.2 |
Таблица 2.
Структурно-групповой состав ГК по данным ИК-Фурье-спектроскопии
| Образец ГК | Содержание струк- турных групп, о. е. | |||
|---|---|---|---|---|
| D3350/ D1465 | D2910/ D1465 | D1720/ D1465 | D1270/ D1465 | |
| Сапропель ОР | 0.88 | 0.91 | 0.86 | 0.83 |
| Сапропель ОЖ | 0.87 | 0.89 | 0.89 | 0.85 |
| Сапропель КР | 0.86 | 0.90 | 0.82 | 0.82 |
| Торф ТВФ | 0.89 | 0.82 | 1.02 | 0.85 |
| Торф ТДТ | 1.05 | 0.88 | 0.93 | 0.82 |
| Торф ТД | 0.85 | 0.86 | 0.89 | 0.82 |
| ОУ Чуй-Кэнул | 0.83 | 0.75 | 0.88 | 0.78 |
| ОУ1 Баганур | 0.80 | 0.71 | 0.82 | 0.72 |
| БУ Чинг-Чай | 0.76 | 0.69 | 0.84 | 0.78 |
| БУ1 Барандатское | 0.72 | 0.63 | 0.81 | 0.75 |
В процессе трансформации ОВ в структуре ГК уменьшается не только доля водорода, но и азота. Содержание азота в молекулах ГК изученных объектов снижается в ряду: почвы > сапропели > > торф > окисленный уголь > бурый уголь. Вторым по количеству элементом в молекулах ГК после углерода является кислород, что определяет содержание кислых функциональных групп. Максимальные значения атомных отношений О/С характерны для ГК из сапропелей, почв и торфов, снижающихся для ГК окисленных и бурых углей. В ГФК “Aldrich” отношение О/С достигает значений 0.71.
По результатам потенциометрического титрования содержание фенольных CArOH и карбоксильных групп CArCOOH в ГК торфов и ГФК “Aldrich” выше по сравнению с ГК углей (табл. 1).
Данные ИК-спектроскопии свидетельствуют о более высокой доле алкильных заместителей D2910/D1465, гидроксильных групп D3350/D1465 и карбонильных групп D1720/D1465 и D1270/D1465 в макромолекулах ГК из торфов и сапропелей, чем в ГК из углей (табл. 2).
Структурно-молекулярная характеристика ГК дана на основании показателей, рассчитанных по результатам ЯМР 13С-спектрометрии (табл. 3) [19]. Отношение СalkО/Calk, характеризующее количество атомов гетероалкильного углерода к алкильному, снижается в ГК почв в ряду: чернозем > дерновоподзолистая > подзолистая. Наибольшая степень окисленности алкильных фрагментов отмечается в молекулах ГК из сапропелей и торфов. Степень окисленности алкильных фрагментов заметно уменьшается в ГК в процессе трансформации органического вещества при переходе от торфов к окисленным и бурым углям.
Таблица 3.
Структурно-молекулярная характеристика гуминовых кислот
| Образец ГК | САlkO/CАlk | ƩCArO + CArCH | CArO/CArO + CArCH | К, мкмоль/л · мин |
|---|---|---|---|---|
| Почва ЧП | 0.67 | 43.9 | 0.27 | 0.32 |
| Почва ДП | 0.56 | 39.6 | 0.17 | 0.24 |
| Почва ПЗ | 0.38 | 35.5 | 0.35 | 0.25 |
| Сапропель ОР | 1.0 | 33.5 | 0.32 | 0.77 |
| Сапропель ОЖ | 0.95 | 32.4 | 0.22 | 0.59 |
| Сапропель КР | 0.91 | 28.4 | 0.20 | 0.89 |
| Торф ТВФ | 0.91 | 20.8 | 0.11 | 0.91 |
| Торф ТДТ | 0.89 | 32.7 | 0.17 | 0.73 |
| Торф ТД | 0.88 | 28.4 | 0.56 | 0.62 |
| ОУ Чуй-Кэнул | 0.57 | 44.5 | 0.29 | 0.41 |
| ОУ1 Баганур | 0.67 | 50.0 | 0.25 | 0.39 |
| БУ Чинг-Чай | 0.47 | 50.0 | 0.35 | 0.32 |
| БУ1 Барандатское | 0.38 | 45.6 | 0.28 | 0.27 |
| ГК “Merk” | 0.67 | 35.8 | 0.11 | 0.43 |
| ГФК “Aldrich” | 0.68 | 43.8 | 0.24 | 0.49 |
Существенные отличия в ГК наблюдаются в количестве ароматических фрагментов ΣCArO+CArCH (табл. 3). В макромолекулах ГК, выделенных из чернозема и углей, от 43.9 до 50 отн. % углерода принадлежит ароматическим фрагментам. Торфяные, сапропелевые и ГК “Merk” характеризуются близкими значениями степени ароматичности. В ГК торфов ТВФ и ТДТ, дерновоподзолистой почве отмечается низкая степень окисленности ароматических фрагментов, рассчитанная как CArO/(СArH,C + CArO), сравнимая со степенью окисленности данных фрагментов в ГК “Merk”.
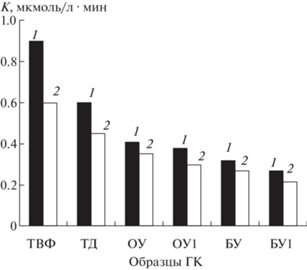
В табл. 3 приведены значения кинетического критерия К антиоксидантной активности гуминовых кислот, отражающего количество кислорода и активных кислородных радикалов, прореагировавших с антиоксидантом за 1 мин при рН 10. Как полагают в работах [5–8], антиоксидантную активность ГК определяют фенольные фрагменты, образованные из более сложных молекул-предшественников растений, таких как лигнин и дубильные вещества. Для ГК из торфов и сапропелей отмечаются максимальные значения К и минимальные – для ГК из почв ДП и ПЗ и ГФК “Aldrich”.
Благодаря присутствию в ГК широкого спектра функциональных групп разной природы их антиоксидантные свойства могут проявляться во всем диапазоне рН. На рис. 1 показано влияние рН в области 10–5.5 на величину критерия К для гуминовых кислот, выделенных из торфов и углей. В основных условиях протонная диссоциация фенольных соединений увеличивает восстановительную способность ГК, а в кислых условиях восстановительная способность может быть ограничена из-за протонирования антиоксидантных фрагментов [10]. При рН 10 максимальной антиоксидантной способностью характеризуются ГК из верхового торфа ТВФ. Для ГК из бурых углей отмечается наименьшее значение К. Снижение рН до 6.5 приводит к уменьшению критерия К для всех образцов ГК. В этой области рН диссоциируют карбоксильные группы.
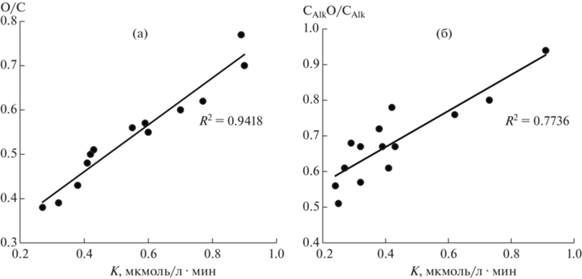
Для понимания взаимосвязи антиоксидантных свойств и структурных особенностей ГК был проведен корреляционный анализ данных элементного состава, ЯМР 13C, потенциометрического титрования с содержания АО. На рис. 2, а приведена зависимость критерия К от атомного отношения О/С в макромолекулах ГК, характеризующаяся положительной линейной связью с высокой степенью аппроксимации, что объясняется наличием в структуре ГК кислых функциональных групп. На основании анализа данных ЯМР 13С-спектроскопии ГК установлена взаимосвязь показателя степени окисленности алкильных фрагментов СAlO/CAl в ГК с критерием К (рис. 2, б).
На рис. 3, а показана взаимосвязь между содержанием фенольных групп СArOH в ГК, определяемых потенциометрическим титрованием, и кинетическим критерием К при рН 10. Наибольшее содержание фенольных групп установлено в ГК торфа ТВФ, наименьшее – в ГК из бурого угля, что отразилось на значении их антиоксидантной активности. Величина достоверности аппроксимации удовлетворительная.
Рис. 3.
Зависимость критерия К в ГК торфов и углей от содержания CArOH при рН 10 (а); содержания CArCОOH при рН 5.0–7.5 (б).
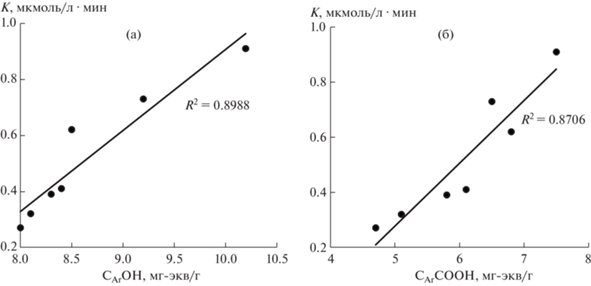
Зависимость критерия К при рН 6.5 от содержания СArCOOH-групп в ГК торфов и углей приведена на рис. 3, б. При снижении содержания карбоксильных групп в ряду “ГК торф > ГК окисленный уголь > ГК бурый уголь” уменьшается их антиоксидантная активность с достаточно высокой степенью достоверности.
Реакционная способность однотипных групп в макромолекуле ГК зависит от их пространственного расположения. В зависимости от расположения карбоксильных групп антиоксидантная активность фенольных гидроксилов может снижаться за счет удаления электронной плотности из фенольного кольца, а при их депротонировании при рН 6.5 повышает антиоксидантную активность фенольных гидроксилов [20].
ЗАКЛЮЧЕНИЕ
Антиоксидантная активность ГК зависит от их молекулярной структуры, определяемой происхождением. Макромолекулы ГК, выделенные из почв, характеризуются низкой насыщенностью водородом и высоким содержанием азота. В составе ГК торфов и сапропелей, обогащенных водородом и кислородом, преобладают алифатические и ациклические фрагменты и кислые функциональные группы.
Антиоксидантную активность ГК в зависимости от рН среды определяют соединения, включающие –OH- и –NH-связи. Значения критерия антиоксидантной активности К для торфяных и угольных ГК снижаются с уменьшением основности с рН 10 до рН 5.5. Установлена положительная линейная зависимость критерия антиоксидантной активности ГК от содержания фенольных гидроксилов при рН 10 и от содержания карбоксильных групп при рН 6.5.
Список литературы
Miliauskas G., Venskutonis P.R., Van Beek T.A. // Food Chem. 2004. V. 85. № 2. P. 231. https://doi.org/10.1016/j.foodchem.2003.05.007
Silva B.A., Ferreres F., Malva J.O., Dias A.C.P. // Food Chem. 2005. V. 90. № 1. P. 157. https://doi.org/10.1016/j.foodchem.2004.03.049
Варданян Л.Р., Атабекян Л.В., Айрапетян С.А., Варданян Р.Л. // ХРС. 2018. № 3. С. 61. https://doi.org/10.14258/jcprm.2018033697
Luximon-Ramma A., Bahorun T., Soobrattee M.A., Aruoma O.I. // J. Agric. Food Chem. 2002. V. 50. № 18. P. 5042. https://doi.org/10.1021/jf0201172
Смирнова О.В., Ефимова И.В., Хилько С.Л., Опейда И.А., Рыбаченко В.И. // Наносистемы, наноматериалы, нанотехнологии. 2010. Т. 8. № 4. С. 835.
Aeschbacher M., Graf C., Schwarzenbach R.P., Sander M. // Environ Sci Technol. 2012. V. 46. № 9. P. 4916. https://doi.org/10.1021/es300039h
Tarasova A.S., Stom D.I., Kudryasheva N.S. // Environ Monit Assess. 2015. V. 187. № 3. P. 4304. https://doi.org/10.1007/s10661-015-4304-1
KhiI'ko S.L., Efimova I.V., Smirnova O.V. // Solid Fuel Chemistry. 2011. V. 45. № 6. Р. 367. [Хилько С.П., Ефимова И.В., Смирнова О.В. // ХТТ. 2011. № 6. С. 3.https://doi.org/10.3103/S036152191106005X
Яркова Т.А., Гюльмалиев А.М. // ХТТ. 2020. № 1. С. 49. [Solid Fuel Chemistry, 2020, vol. 54, no. 1, p. 42. https://doi.org/10.3103/S0361521920010103]https://doi.org/10.31857/S0023117720010119
Huang D., Ou B., Prior R.L. // J. Agric Food Chem. 2005. V. 53. P. 1841. https://doi.org/10.1021/jf030723c
Klein O.I., Kulikova N.A., Filimonov I.S., Koroleva O.V., Konstantinov A.I. // J. Soils Sediments. 2018. V. 18. № 4. P. 1355. https://doi.org/10.1007/s11368-016-1538-7
Nimalaratne C., Lopez-Lutz D., Schieber A., Wu J. // Food Chem. 2011. V. 129. P. 155. https://doi.org/10.1016/j.foodchem.2011.04.058
Schlichting A., Rammer D.L., Eckhardt K.-U., Heumann S., Abbott G.D., Leinweber P. // Soil Biol. Biochem. 2013. V. 58. P. 16. https://doi.org/10.1016/j.soilbio.2012.10.040
Юдина Н.В., Чайковская О.Н., Соколова И.В., Мальцева Е.В., Нечаев Л.В. // ЖПХ. 2011. Т. 84. № 5. С. 790. [Russ. J. Appl. Chem., 2011, vol. 84, no. 5, p. 820. https://doi.org/10.1134/S1070427211050144]
Moyer R.A., Hummer K.E., Finn C.E., Frei B., Wrolstad R.E. // J. Agric. Food Chem. 2002. V. 50. № 3. P. 519.
Korotkova E.I., Karbainov Y.A., Avramchik O.A. // Anal. Bioanal. Chem. 2003. V. 375. № 3. P. 465.
Romera-Castillo C., Jaffé R. // Marine Chemistry. 2015. V. 177. № 4. P. 668. https://doi.org/10.1016/j.marchem.2015.10.008
Ермилова Е.В., Кадырова Т.В., Краснов Е.А., Писарева С.И., Пынченков В.И. // Химико-фармацевтический журнал. 2000. Т. 34. № 11. С. 28.
Бямбагар Б., Кушнарев Д.Ф., Федорова Т.Е., Новикова Л.Н., Яковлева Ю.Н., Островская P.M., Пройдаков А.Г., Калабин Г.А. // ХТТ. 2003. № 1. 83.
Al-Sehemi A.G., Irfan A. // Arab. J. Chem. 2017. V. 10. P. 1703.https://doi.org/10.1016/j.arabjc.2013.06.019
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива