Химия твердого топлива, 2022, № 5, стр. 32-37
КВАНТОВОХИМИЧЕСКАЯ ОЦЕНКА ЭНЕРГИИ СОЛЬВАТАЦИИ ГУМИНОВЫХ ВЕЩЕСТВ В РАЗЛИЧНЫХ РАСТВОРИТЕЛЯХ
А. Л. Лапидус 1, *, А. М. Гюльмалиев 2, **, Ф. Г. Жагфаров 1, ***, Т. А. Яркова 3, ****
1 ФГБОУ ВОРГУ нефти и газа (НИУ) им. И.М. Губкина
119991 Москва, Россия
2 ФГБУН Институт нефтехимического синтеза им. А.В. Топчиева РАН
11907 Москва, Россия
3 ФГБОУ ВО МИРЭА – Российский технологический университет
(Институт тонких химических технологий им. М.В. Ломоносова)
119571 Москва, Россия
* E-mail: albert@ioc.ac.ru
** E-mail: gyulmaliev@ips.ac.ru
*** E-mail: firdaus_jak@mail.ru
**** E-mail: tat772003@list.ru
Поступила в редакцию 27.04.2022
После доработки 25.05.2022
Принята к публикации 08.06.2022
- EDN: ARATPA
- DOI: 10.31857/S0023117722050061
Аннотация
Приведены результаты квантовохимических расчетов методом ДФТ b3lyp/sto-3g*энергий сольватации гуминовых веществ в органических растворителях и воде, проведенных с использованием структурной модели гуминовых кислот. Показано, что сольватация гуминовых веществ зависит от их количественного функционального состава. Предложено использование полученных результатов для фракционирования этих природных соединений и направленного изменения их свойств.
Гуминовые вещества используются в различных отраслях хозяйства, в основном, как стимуляторы роста растений, микроудобрения и вещества, нейтрализующие экотоксины. Наличие ярко выраженных поверхностно-активных свойств обусловливает применение этих природных соединений в составе буровых растворов, а также для промывания водоносных горизонтов, загрязненных ароматическими веществами. Для указанных целей используют также синтетические стимуляторы и поверхностно-активные вещества, но, в отличие от них, гуминовые препараты совершенно безопасны для природы [1, 2]. Все это ставит перед исследователями задачу создания гуминовых веществ направленного действия, решение которой невозможно без фундаментального представления об их структуре и свойствах.
Гуминовые вещества – малоизученные органические соединения, состоят из продуктов разложения растительных организмов и образуют набор хаотических структур. Общего научного подхода к исследованию структуры и свойств гуминовых веществ пока не выработано. Согласно классификации, основанной на различной растворимости гуминовых веществ [3–5], их подразделяют на следующие группы: гуминовые кислоты – фракция гуминовых веществ, растворимая в щелочах и нерастворимая в кислотах (при рН < 2); фульвокислоты – фракция гуминовых веществ, растворимая в воде, щелочных и кислых растворах; гумин – практически нерастворимое и неизвлекаемое из природных тел органическое вещество. Иногда выделяют гиматомелановые кислоты, являющиеся растворимой в этаноле частью гуминовых веществ.
Для гуминовых кислот различного происхождения общим является наличие ароматического ядра, как наиболее зрелой и химически устойчивой части молекулы, замещенного алкильными радикалами и функциональными группами: карбоксильными –СООН, гидроксильными –ОН, хиноидными >С=О, метоксильными –ОСН3 и аминогруппами –NH2 [2, 3, 7]. По данным рентгеноструктурного анализа, молекулы гуминовых кислот характеризуются упорядоченным сетчатым строением, хотя и не имеют кристаллической структуры. Таким образом, гуминовые вещества – это смесь хаотически сложенных, сложных по строению природных органических соединений.
Для систематизации научных представлений при исследованиях структуры и свойств сложных природных соединений часто исходят из обобщенной структурной модели. На рис. 1 из работы [6] представлена структурная модель гуминовых кислот, основанная на данных элементного и количественного функционального анализов, полученных современными методами физико-химического исследования, такими как газовая хромато-масс-спектрометрия, твердофазная ЯМР-спектроскопия, ионизационная масс-спектроскопия. Предлагаемая макромолекулярная структура почвенной гуминовой кислоты основана на следующих общих характеристиках: элементный анализ (мас. % на daf): C 53.6; N 5.0; H 5.8; O 35.1; S 0.5; C/N 10.7; функциональные группы (смоль/г): карбоксильные – 376; фенольные – 188; общая кислотность – 564. Распределение углерода в гуминовых кислотах (в % от общего содержания углерода) по данным ЯМР-анализа в структурных фрагментах происходит следующим образом: алифатический 18.1, ароматический 20.9, углеводного характера 23.7, содержащийся в метоксигруппах 4.9, карбоксильный 8.4, кетоновый 4.5, фенольный 4.2, в остальных группах 15.3 [4].
В настоящее время ведутся научные исследования по изучению вещественного и функционального состава гуминовых веществ для направленного изменения их свойств [2]. О структуре и свойствах гуминовых веществ можно судить только по усредненным значениям, которые приводятся в литературных данных [3, 5]. Однако современные спектроскопические методы позволяют с хорошей точностью установить количество различных функциональных групп на единицу массы гуминовых веществ [7]. Тип и количество функциональных групп определяют растворимость гуминовых веществ. Следовательно, одним из путей направленного изменения их свойств является химическая модификация, изменяющая количество функциональных групп заданного типа.
Цель данной работы – вычисление энергии сольватации гуминовых кислот в среде различных органических растворителей и воде, проведенное с помощью современных квантовохимических методов. Основу расчета составляет модель структуры гуминовых кислот. Полученные результаты позволяют оценить эффективность применения различных органических веществ и воды в качестве растворителей для этих природных соединений.
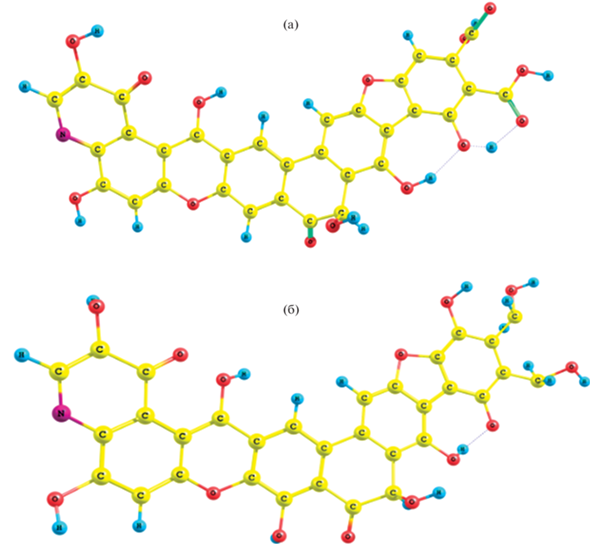
На рис. 2 приведены модельные структуры гуминовых веществ, приятых для расчета. Расчеты сольватации модельных структур в различных растворителях проводились квантовохимическим методом ДФТ b3lyp/sto-3g* по программе [9].
Рис. 2.
Структурный фрагмент гуминовых веществ [8]: (a) – брутто-формула С32NH15O14, функциональные группы –СООН (2), –ОН (6), –О–(2), >C=O (2);(б) – брутто-формула С32NH15O14, функциональные группы –ОН (8), –О– (3), >C=O (3). В скобках приведено количество функциональных групп определенного типа, присутствующее в рассматриваемой структурной модели.
Энергия сольватации представляет собой выигрыш в энергии, который получается при перенесении моля исследуемых веществ из вакуума в данный растворитель.
Модель поляризуемой непрерывной среды является одним из наиболее часто используемых методов сольватации непрерывной среды. В модели поляризованного континуума PCM (Polarizable Continuum Model) расчеты выполнены как для вакуума, так и для растворителя. В этой модели растворитель представляется как континуум, обладающий определенными значениями диэлектрической проницаемости и поляризуемости. В модели РСМ энергию сольватации рассчитывают как сумму трех вкладов:
Эти составляющие представляют собой электростатический (es) и дисперсионно-отталкивающий (dr) вклады в свободную энергию и энергию кавитации (cav). Все три члена рассчитываются с использованием полости, определяемой взаимосвязанными ван-дер-ваальсовыми сферами с центрами в атомных позициях. Электростатическая энергия по определению равна работе, произведенной при сближении двух зарядов с большего расстояния на заданное.
Органические растворители отличаются диэлектрической проницаемостью. Диэлектрическая проницаемость ε показывает, во сколько раз напряженность электрического поля в однородном диэлектрике Е меньше напряженности в вакууме.
Квантовохимические расчеты проводились по методу ДФТ b3lyp/sto-3g* с учетом диэлектрической проницаемости
Вычисляются следующие энергии:
где Ψ – волновая функция системы; H – гамильтониан системы; V – возмущение гамильтониана; E1 – энергия невозмущенной системы, которая используется в качестве эталонной энергии для всех последующих этапов расчета; E2 – включает взаимодействие неполяризованного растворенного вещества с неполяризованным растворителем; E3 – энергия взаимодействия, которая составляет разницу между взаимодействием в растворителе и в газовой фазе, принятой за эталон сравнения; E4 – энергия взаимодействия неполяризованного растворенного вещества с поляризованным растворителем; E5 – энергия поляризации растворителя при взаимодействии с поляризованным растворенным веществом.Энергия Гиббса раствора (∆G (раствор)) складывается из полной электростатической энергии и энергии неэлектростатического происхождения.
Результаты расчетов сольватации гуминового вещества с брутто-формулой С32NH15O14 в различных органических веществах приведены в табл. 1 и 2.
Таблица 1.
Энергетические характеристики сольватации модельной структуры гуминовых веществ с брутто-формулой С32NH15O14 и функциональными группами –СООН (2), –ОН (6), –О– (2), >C=O (2) в различных средах
| Растворитель | Энергия | Величина, ккал/моль |
|---|---|---|
| Вода | Полная электростатическая энергия | –38.58 |
| Энергия кавитации | 69.70 | |
| Дисперсионная энергия | –61.89 | |
| Энергия отталкивания | 8.10 | |
| Неэлектростатическая энергия | 15.91 | |
| ∆G (раствор) | –22.67 | |
| Толуол | Полная электростатическая энергия | –7.87 |
| Энергия кавитации | 57.60 | |
| Дисперсионная энергия | –59.85 | |
| Энергия отталкивания | 10.90 | |
| Неэлектростатическая энергия | 8.65 | |
| ∆G (раствор) | 0.78 | |
| Метанол | Неэлектростатическая энергия | 11.69 |
| ∆G (раствор) | –25.72 | |
| Гексан | Полная электростатическая энергия | –6.11 |
| Энергия кавитации | 48.56 | |
| Дисперсионная энергия | –52.76 | |
| Энергия отталкивания | 6.38 | |
| Неэлектростатическая энергия | 2.18 | |
| ∆G (раствор) | 3.92 | |
| Циклогексан | Полная электростатическая энергия | –6.56 |
| Энергия кавитации | 54.42 | |
| Дисперсионная энергия | –56.82 | |
| Энергия отталкивания | 6.82 | |
| Неэлектростатическая энергия | 4.42 | |
| ∆G (раствор) | –2.14 | |
| Бензол | Полная электростатическая энергия | –7.52 |
| Энергия кавитации | 58.36 | |
| Дисперсионная энергия | –58.60 | |
| Общая неэлектростатическая энергия | 10.82 | |
| Неэлектростатическая энергия | 10.57 | |
| ∆G (раствор) | 3.05 | |
| Этанол | Полная электростатическая энергия | –33.85 |
| Энергия кавитации | 52.79 | |
| Дисперсионная энергия | –54.16 | |
| Энергия отталкивания | 6.71 | |
| Электростатическая энергия | 5.34 | |
| ∆G (раствор) | –28.50 | |
| Муравьиная кислота | Неэлектростатическая энергия | 35.39 |
| ∆G (раствор) | –2.74 | |
| Уксусная кислота | Неэлектростатическая энергия | 23.63 |
| ∆G (раствор) | –6.17 |
Таблица 2.
Энергетические характеристики сольватации модельной структуры гуминовых веществ с брутто- формулой С32NH18O14 и функциональными группами –ОН (8), –О– (2), >C=O (2) в различных средах
| Растворитель | Энергия | Величина, ккал/моль |
|---|---|---|
| Вода | Полная электростатическая энергия | –42.84 |
| Энергия кавитации | 71.27 | |
| Дисперсионная энергия | –63.17 | |
| Энергия отталкивания | 8.18 | |
| Полная неэлектростатическая энергия | 16.28 | |
| ∆G (раствор) | –26.57 | |
| Толуол | Полная электростатическая энергия | –8.43 |
| Энергия кавитации | 57.58 | |
| Дисперсионная энергия | –59.28 | |
| Энергия отталкивания | 10.79 | |
| Полная неэлектростатическая энергия | 9.09 | |
| ∆G (раствор) | 0.66 | |
| Метанол | Полная электростатическая энергия | –41.16 |
| Энергия кавитации | 51.42 | |
| Дисперсионная энергия | –52.53 | |
| Энергия отталкивания | 6.60 | |
| Полая неэлектростатическая энергия | 5.49 | |
| ∆G (раствор) | –35.66 | |
| Гексан | Полная электростатическая энергия | –6.54 |
| Энергия кавитации | 48.54 | |
| Дисперсионная энергия | –52.22 | |
| Энергия отталкивания | 3.31 | |
| Полная неэлектростатическая энергия | 2.63 | |
| ∆G (раствор) | –3.91 | |
| Циклогексан | Полная электростатическая энергия | –7.03 |
| Энергия кавитации | 54.4 | |
| Дисперсионная энергия | –56.24 | |
| Энергия отталкивания | 6.75 | |
| Полная неэлектростатическая энергия | 4.92 | |
| ∆G (раствор) | –2.11 | |
| Бензол | Полная электростатическая энергия | –8.06 |
| Энергия кавитации | 58.34 | |
| Дисперсионная энергия | –58.04 | |
| Энергия отталкивания | 10.70 | |
| Полная электростатическая энергия | 11.00 | |
| ∆G (раствор) | 2.94 | |
| Этанол | Полная электростатическая энергия | –37.67 |
| Энергия кавитации | 54.03 | |
| Дисперсионная энергия | –55.24 | |
| Энергия отталкивания | 6.77 | |
| Полная неэлектростатическая энергия | 5.56 | |
| ∆G (раствор) | –32.11 |
Результаты исследования сольватационной способности воды и органических соединений при растворении модельной структуры гуминовых кислот по величине энергии Гиббса ∆G сольватации, вычисленной квантовохимическим методом ДФТ b3lyp/sto-3g*, показывают: сольватации модельной структуры гуминовых веществ с брутто-формулой С32NH15O14, содержанием функциональных групп –СООН (2), –ОН (6), –О–(2), >C=O (2) лучше проходит в воде и спиртах (∆Gвода = –22.67 ккал/моль, ∆Gметанол = = –25.72 ккал/моль и ∆Gэтанол = –28.50 ккал/моль). При сольватации той же модельной структуры, отличающейся содержанием функциональных групп –ОН (8), –О–(3), >C=O (3) результаты следующие: (∆Gвода = –26.57 ккал/моль, ∆Gметанол = = –35.66 ккал/моль и ∆Gэтанол = –32.11 ккал/моль).
Таким образом, проведенное исследование показывает, что сольватация гуминовых веществ, даже одинакового элементного состава, зависит от количественного содержания функциональных групп. Выяснено, что увеличение содержания фенольных и спиртовых гидроксилов в составе гуминовых веществ увеличивает их растворимость в воде и низших спиртах. Этот результат в различных модификациях может быть использован на практике, в частности для фракционирования гуминовых веществ или при подборе растворителя для проведения направленной химической модификации этих природных соединений.
Список литературы
ГОСТ Р 54221-2010. Гуминовые препараты из бурых и окисленных каменных углей. Методы испытаний // М.: Стандартинформ, 2012. 10 с.
Перминова И.В. // Химия и жизнь. 2008. № 1. С. 50.
Орлов Д.С. Гумусовые кислоты почв и общая теория гумификации. // М.: Изд-во МГУ, 1990. 325 с.
Stevenson F.J. // New York: John Wiley & Sons, 1982. 443 p.
Орлов Д.С. Химия почв. // М.: Изд-во МГУ, 1992.259 с.
Grinhut T., Hadar Y., Chen Y. Degradation and transformation of humic substances by saprotrophic fungi: processes and mechanisms fungal biology reviews, 2007. № 21 (4). P. 179. https://doi.org/10.1016/J.FBR.2007.09.003
Перминова И.В. Анализ, классификация и прогноз свойств гумусовых кислот. Дис. … д-ра хим. наук. М.: МГУ, 2000. 360 с.
Яркова Т.А., Гюльмалиев А.М.// ХТТ. 2020. № 1. С. 49. [Solid Fuel Chemistry, 2020, vol. 54, no. 1, p. 42. https://doi.org/10.3103/S0361521920010103]https://doi.org/10.31857/S0023117720010119
Granovsky A.A. PCGAMES Sversion 7.0. http://classic.chem.msu.su/gran/gamess/index.Html.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива