Химия твердого топлива, 2022, № 6, стр. 10-17
СТРУКТУРНО-ГРУППОВОЙ СОСТАВ И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ФУЛЬВОКИСЛОТ БУРЫХ УГЛЕЙ
К. С. Вотолин 1, *, С. И. Жеребцов 1, **, Н. В. Малышенко 1, ***, К. М. Шпакодраев 1, ****, З. Р. Исмагилов 1, *****
1 ФИЦ угля и углехимии СО РАН
650000 Кемерово, Россия
* E-mail: votolin_ks@mail.ru
** E-mail: sizh@yandex.ru
*** E-mail: profkemsc@yandex.ru
**** E-mail: shpakodraevkm@mail.ru
***** E-mail: zinfer1@mail.ru
Поступила в редакцию 17.06.2022
После доработки 07.07.2022
Принята к публикации 03.08.2022
- EDN: WBDNUL
- DOI: 10.31857/S002311772206010X
Аннотация
Гуминовые (ГК) и фульвокислоты (ФК), выделенные из бурых углей Тисульского и Тюльганского месторождений, охарактеризованы с применением элементного и технического анализов. При помощи ИК-Фурье- и 13С ЯМР (CPMAS)-спектроскопии показано существенное различие в структурно-групповом составе ГК и ФК. Представлены результаты тестирования биологической активности буроугольных ФК на примере семян пшеницы сорта “Ирень”. Показано, что максимальный эффект ФК проявляется на высоту проростков и длину корней семян пшеницы в сравнении с контролем. ФК естественно-окисленной формы бурого угля Тисульского месторождения проявили наибольшую биологическую активность.
ВВЕДЕНИЕ
Химическая переработка твердых горючих ископаемых c целью получения экологически чистых, эффективных и недорогих продуктов является в настоящее время актуальной задачей и отвечает современным требованиям рационального и безопасного использования природных ресурсов. Наиболее перспективное направление – получение гуминовых веществ (ГВ), которые представляют собой сложную смесь природных высокомолекулярных органических соединений, обладающих биологической активностью [1–3]. ГВ состоят из нескольких фракций: гуминовые кислоты (ГК) – фракция, растворимая в щелочах; фульвокислоты (ФК) – фракция, растворимая в щелочах и в кислотах; гиматомелановые кислоты (ГмК) – растворимая в этаноле часть ГК [4, 5]. Благодаря наличию в структуре различных кислородосодержащих групп (карбоксильные, карбонильные, фенольные, гидроксильные, метоксильные, хиноидные) ГВ обладают уникальными специфическими свойствами, что обусловливает их широкое и эффективное применение в различных областях промышленности, сельского хозяйства, медицины и экологии. Интенсификация производства продуктов питания без ущерба для окружающей среды стала одной из самых серьезных задач, стоящих перед сельскохозяйственными науками. Для их решения необходимы новые технологии, способствующие устойчивому и интенсивному сельскохозяйственному производству. Многочисленными исследованиями установлено стимулирующее действие гуминовых веществ, полученных из торфа, на рост и развитие растений, повышение их устойчивости к неблагоприятным факторам окружающей среды, стимулирование прорастания семян, повышение продуктивности крупного рогатого скота и птицы [6]. Одним из способов повышения эффективноcти производства продуктов растениеводства и животноводства является использование природных биостимуляторов, таких как гуминовые и фульвокислоты, бактериальные и грибковые препараты [7, 8]. Благодаря своей низкой молекулярной массе ФК способны транспортировать вещества из почвы через поверхности органов растений в клетки, улучшая усвоение растениями питательных веществ. Их физиологическое воздействие на растения аналогично действию ауксинов и антитранспирантов [9]. Всхожесть семян и характер роста проростков являются чрезвычайно важными факторами, определяющими урожайность. Использование ФК для замачивания или протравливания семян улучшает всхожесть семян и снижает повреждаемость проростков [10]. Кроме того, применение ФК способствует уменьшению средних сроков прорастания семян сельскохозяйственных культур (яровая пшеница, яровой ячмень, сахарная свекла), значительно снижает количество всходов, пораженных фузариозом [11]. Фульвокислоты оказывают положительное влияние на рост боковых корней и побегов, увеличивают их длину и воздушно-сухую массу, повышают урожайность и улучшают качественные показатели урожая растений [9, 11, 12]. ФК могут оставаться биологически активными в почвенном растворе даже при высокой концентрации солей и в широком диапазоне рН из-за своей низкой молекулярной массы. Положительное действие фульвокислот особенно проявляется в условиях засухи [13]. Имеются данные о том, что повышение концентрации фульвокислот при обработке семян приводит к снижению их всхожести [14].
Главным источником гуминовых и фульвокислот является органическое вещество почвы, торфа, угля, донных осадков. Самая представительная фракция ГВ – гуминовые кислоты – достаточно изучена. В то же время данные о природе биологической активности гуминовых кислот, ее взаимосвязи со структурными параметрами макромолекул ГК, природой и содержанием функциональных групп весьма противоречивы и неоднозначны. Исследований по изучению биологической активности ФК значительно меньше, они относятся в основном к ФК, выделенным из торфа и почвы. Состав и соответственно свойства ФК существенно зависят не только от источника, но и от методики их выделения [15]. Очевидно, что состав и свойства ФК, выделенных из почвы и торфа, в полной мере нельзя проецировать на буроугольные ФК. Изучение буроугольных ФК необходимо для определения перспективных направлений их использования в различных отраслях промышленности с учетом особенностей химического и структурно-группового состава.
Цель данной работы – изучение структурно-группового состава и биологической активности фульвокислот, выделенных из бурых углей.
МЕТОДИЧЕСКАЯ ЧАСТЬ
Для исследования был выбран бурый уголь Тисульского месторождения Канско-Ачинского бассейна (БУТС), его естественно-окисленная форма (БУТСО) и бурые угли с различных участков Тюльганского месторождения Южно-Уральского бассейна (БУТ30 и БУТ31).
ГВ выделяли согласно [16] обработкой измельченного бурого угля (помол менее 0.2 мм) 1%-ным водным раствором NaOH на кипящей водяной бане в течение 2 ч с последующим отделением твердого остатка непрореагировавшего угля. ГК отделяли от ФК осаждением путем подкисления раствора ГВ соляной кислотой до pH 1–2. Отфильтрованный осадок ГК промывали дистиллированной водой до нейтральной среды и высушивали при 90°С до постоянного веса. Фульвокислоты выделяли в виде порошка путем экстрагирования из водного солянокислого раствора н-бутанолом с последующей отгонкой экстрагента и сушкой ФК в вакуум-сушильном шкафу в соответствии со схемой (рис. 1) [17]. О завершении процесса экстракции судили по достижению постоянства показателя преломления (п.п.) водной фазы на значении n = 1.343 при 20°С (дистиллированной воды – 1.333, н-бутанола – 1.399). Показатель преломления контролировался на рефрактометре ИРФ-454. Спектры 13С ЯМР (CPMAS) высокого разрешения в твердом теле регистрировались на приборе “BrukerAvanceIII 300 WB” при частоте 75 МГц и с частотой вращения образца 5 кГц. Использовалась методика кросс-поляризации с вращением под “магическим” углом (CPMAS).
Запись ИК-спектров проводилась в сухом KBr на ИК-Фурье -спектрофотометрах “ИНФРАЛЮМ ФТ-801” при разрешении 4 см–1 с накоплением 64 сканов в диапазоне 4000–500 см–1. С целью снижения влияния молекулярной воды на интенсивность полосы поглощения в этой области исследуемые образцы предварительно высушивались до постоянной массы, KBr прокаливался (соотношение KBr : образец = 200:1). Интерпретация спектров проводилась, согласно литературным источникам [18, 19].
Оценку биологической активности ФК проводили по ГОСТ 12038-84 и 54221-2010 [20, 21].
Обработку семян пшеницы сорта “Ирень” проводили водными растворами ФК концентрации 0.00038 и 0.00025%, которые готовили путем разбавления дистиллированной водой раствора ФК (концентрации 0.6–1.4%). Выбор концентраций ФК основан на результатах предварительных экспериментов. Семена пшеницы проращивали при постоянной температуре 20°С в темноте в специальных растильнях-лотках. Биологическую активность ФК оценивали по величине интегрального индекса фитоактивности (ИФ) с учетом трех тест-функций [22]: энергии прорастания семян (ЭП), длины корня (ДК) и высоты проростка (ВП). Величина ИФ – обобщающий индекс, отражает отклонения от контроля и вычисляется как средняя величина суммы показателей ЭП, ДК и ВП, выраженная в долях единицы:
где ЭП, ДК и ВП – средние величины по трем лоткам.Повторность эксперимента трехкратная: 3 лотка по 50 семян пшеницы для каждого вида ФК и столько же при смачивании дистиллированной водой (контроль, ИФ = 1.0). ЭП, ВП и ДК, а также количество корней (КК) замеряли на 7-е сутки. Относительная ошибка во всех экспериментах составляла 3–5% для уровня значимости α = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В табл. 1 представлены данные технического и элементного анализа образцов исходных углей, гуминовых и фульвокислот, выделенных из гуматов натрия. Наименьший выход гуминовых веществ характерен для бурого угля Тисульского месторождения (БУТС): ГК – 22%, ФК – ~0.1%. Наибольший выход ГВ характерен для этого же угля в окисленной форме (БУТCО): ГК – 61%, ФК – 9% на daf угля. ФК, выделенные из всех образцов углей, отличаются от ГК более низким содержанием углерода и более высоким суммарным содержанием гетероатомов (кислорода, азота и серы). Полученные данные элементного анализаобразцов ФК и ГК, выделенных из бурых углей, согласуются с результатами исследования стандартных образцов ФК и ГК торфа (PahokeePeat) и почвы (ElliottSoil) международного гуминового общества IHSS [23] и с усредненными результатами более двухсот образцов этих кислот торфа, почвы, природных вод и донных отложений [24]. Увеличение содержание гетероатомов (О, N и S) в ФК обеспечивается преимущественно за счет высокого содержания кислорода [23].
Таблица 1.
Технический и элементный анализ исходного угля, ГК и ФК, %
| Образец | W a | Ad | V daf | С daf | Нdaf | (О + N + S)daf | Выход, % |
|---|---|---|---|---|---|---|---|
| БУТС | |||||||
| Уголь | 8.3 | 10.3 | 48.3 | 61.4 | 5.1 | 33.5 | |
| ГК | 6.1 | 1.1 | – | 56.3 | 5.1 | 38.6 | 22.1 |
| ФК | 1.48 | 12.35 | – | 43.15 | 6.03 | 50.82 | ~0.1 |
| БУТСО | |||||||
| Уголь | 10.0 | 43.5 | – | 69.3 | 6.0 | 24.7 | |
| ГК | 10.6 | 10.9 | – | 59.7 | 6.2 | 34.1 | 60.9 |
| ФК | 1.85 | 6.56 | – | 40.64 | 5.22 | 54.14 | 9.6 |
| БУТ 30 | |||||||
| Уголь | 21.5 | 26.7 | 71.5 | 66.7 | 8.5 | 24.8 | |
| ГК | 0.6 | 20.5 | – | 61.6 | 8.6 | 29.8 | 38.0 |
| ФК | 1.4 | 3.4 | – | 48.0 | 4.8 | 47.2 | 2.3 |
| БУТ 31 | |||||||
| Уголь | 9.1 | 21.5 | 64.4 | 63.7 | 5.9 | 30.4 | |
| ГК | 0.7 | 13.4 | – | 53.2 | 10.5 | 36.3 | 38.5 |
| ФК | 1.3 | 4.0 | – | 50.0 | 5.4 | 44.6 | 4.4 |
Примечание. Показатель daf – сухое беззольное состояние образца; W a – влага аналитическая по ГОСТ Р 52917-2008; Ad – зольность на сухую пробу по ГОСТ 11022-95; V daf – содержание летучих веществ по ГОСТ 6382-2001; C daf, Hdaf – содержание элементов по ГОСТ 2408.1-95; (О + N + S)daf – по разности; выход свободных кислот по ГОСТ 9517-94. Погрешность измерений – не более 2%.
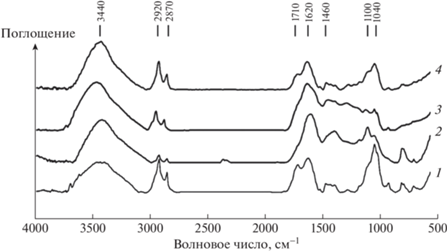
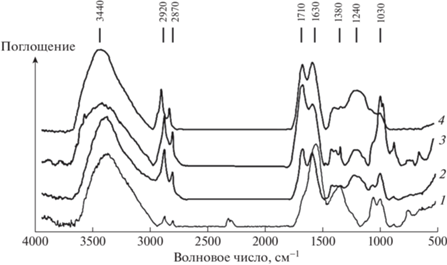
Для ИК-спектров поглощения исходных углей, ГК и ФК (рис. 2–4) характерно наличие интенсивной полосы поглощения в интервале частот 3500–3400 см–1 – валентные колебания водородосвязанных O–H-групп; 2920–2960 и 2870 см–1 – валентные колебания CH3- и CH2- групп; 1700–1740 см–1 – валентные колебания C=O кислот; 1100–1040 см–1 – С–О спиртов, эфиров. Полоса поглощения 1620 см–1 относится к колебаниям ароматических С=С-связей. В этой области могут поглощать связи С=С, образующие линейную систему сопряжения, но нельзя полностью исключить колебания карбонильной группы С=С=О, включенной в систему сопряжения. На наличие ароматических структур указывает полоса поглощения в области 1460 см–1, которая может перекрываться полосой поглощения деформационных колебаний CH2-группы.
В отличие от ИК-спектров исходных углей для спектров ГК и ФК свойственно присутствие более интенсивных полос при частоте 1710 см–1 – валентные колебания С=О-связи карбоновых кислот и 1240 см–1 – валентные колебания С–О-связи карбоновых кислот, сложных эфиров и О–Н-связи фенолов (рис. 2–4). Более интенсивные полосы в спектрах фульвокислот в области 2960 и 2870 см–1, 1730 и 1240 см–1 свидетельствуют о преобладании в структуре ФК алифатических фрагментов с преобладанием карбоновых кислот, спиртов и эфиров.
В табл. 2 приведены данные 13С ЯМР-спектроскопии (CP/MAS) исследуемых образцов углей и выделенных из них ГК и ФК. Параметр far/al (ароматичность/алифатичность) вычислен по интегральным интенсивностям в соответствующих спектральных областях [25, 26]:
Таблица 2.
Интегральные интенсивности спектральных областей в 13С ЯМР-спектрах образцов углей, ГК и ФК, %
| Образец | 220-187 | 187–165 | 165–145 | 145–108 | 108–90 | 90–48 | 48–5 | far/al |
|---|---|---|---|---|---|---|---|---|
| С=О | СООН (R) | Сar-O | Car | CO-alk-O | Calk-O | Calk | ||
| БУТС | ||||||||
| Уголь | 0.4 | 3.2 | 7.0 | 54.9 | 3.3 | 10.1 | 21.1 | 1.79 |
| ГК | 1.0 | 8.2 | 6.7 | 51.1 | 3.4 | 7.3 | 22.4 | 1.75 |
| ФК | 4.7 | 10.0 | 5.6 | 14.3 | 4.5 | 20.8 | 40.1 | 0.30 |
| БУТСО | ||||||||
| Уголь | 2.6 | 6 | 8.9 | 31.9 | 5.4 | 12.7 | 30.3 | 0.84 |
| ГК | 3.5 | 7.4 | 8.2 | 31.7 | 6.3 | 14.8 | 26.8 | 0.83 |
| ФК | 5,0 | 8,6 | 5,6 | 16,6 | 3,5 | 18,7 | 42,0 | 0.34 |
| БУТ 30 | ||||||||
| Уголь | 1.3 | 3.9 | 6.3 | 20.4 | 2.4 | 12.1 | 53.7 | 0.39 |
| ГК | 1.5 | 6.4 | 8.5 | 26.0 | 5.2 | 15.2 | 37.3 | 0.59 |
| ФК | 4.2 | 8.6 | 5.7 | 13.9 | 3.8 | 21.2 | 42.6 | 0.28 |
| БУТ 31 | ||||||||
| Уголь | 1.2 | 3.4 | 6.6 | 24.6 | 5.5 | 20.4 | 38.3 | 0.48 |
| ГК | 2.4 | 7.6 | 8.5 | 25.2 | 4.2 | 12.2 | 39.9 | 0.60 |
| ФК | 4.1 | 9.4 | 5.9 | 14.7 | 3.8 | 20.6 | 41.5 | 0.31 |
По результатам ЯМР-спектроскопии в твердом теле можно заключить, что для ФК свойственно более высокое содержание углерода карбонильных групп C=O (220–187 м.д.), карбоксильных и сложноэфирных групп COOH(R) (187–165 м.д.), алифатического углерода Calk (48–5 м.д.) в сравнении с исходным углем и ГК. Для ГК характерно более высокое содержание ароматического углерода Car (145–108 м.д.) и Сar-O (165–145 м.д.). Для всех образцов ФК характерно более низкое соотношение содержания ароматических фрагментов и алифатических (far/al) по сравнению с ГК (табл. 2).
В настоящее время накоплен большой экспериментальный материал, свидетельствующий о положительном влиянии биологической активности гуминовых веществ на урожайность и качество сельскохозяйственных культур. Однако взгляды на природу биологической активности ГВ неоднозначны и противоречивы, нет четкого понимания, какие структурные параметры являются определяющими. Поскольку фульвокислоты отличаются от гуминовых структурно-групповым составом и молекулярной массой, можно предположить, что ФК и ГК будут проявлять биологическую активность неодинаково.
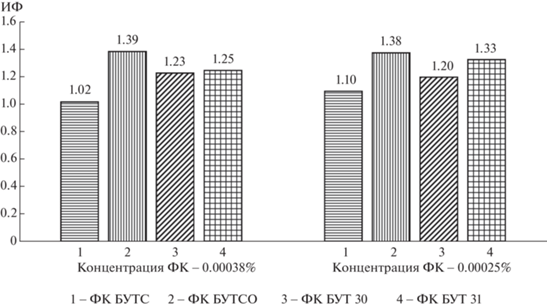
Данные исследования биологической активности ФК, выделенных из бурых углей, приведены в табл. 3. Все исследуемые образцы показали положительное влияние по отношению к семенам пшеницы “Ирень”. Для ФК, выделенных из естественно-окисленной формы бурого угля (БУТСО), наблюдается не только максимальный количественный выход (9.6%), но и индекс фитоактивности (1.39). ИФ для выбранных концентраций ФК изменяется в ряду углей: БУТСО > > БУТ31 > БУТ30 >БУТС (рис. 5).
Таблица 3.
Биологическая активность ФК из бурых углей
| Концентрация раствора ФК, % | ДК, % | ВП, % | ЭП, % | ИФ | КК, % |
|---|---|---|---|---|---|
| ФК ГумNa БУТС | |||||
| 0.00038 | 94.4 | 138.6 | 73.6 | 1.02 | 102.1 |
| 0.00025 | 111.1 | 131.0 | 89.9 | 1.10 | 102.9 |
| ФК ГумNa БУТСО | |||||
| 0.00038 | 137.7 | 189.8 | 89.9 | 1.39 | 102.8 |
| 0.00025 | 151.3 | 168.6 | 95.8 | 1.38 | 101.8 |
| ФК ГумNa БУТ 30 | |||||
| 0.00038 | 109.4 | 157.0 | 104.2 | 1.23 | 111.0 |
| 0.00025 | 113.9 | 145.0 | 101.7 | 1.20 | 110.2 |
| ФК ГумNa БУТ 31 | |||||
| 0.00038 | 108.3 | 147.8 | 120.7 | 1.25 | 99.2 |
| 0.00025 | 133.6 | 158.9 | 107.8 | 1.33 | 102.4 |
Основное увеличение ИФ обеспечивается за счет существенного роста показателей ВП (max = = 189.8% для ФК БУТСО, min =131.0% для ФК БУТС) и ДК (max = 151.3% также для ФК БУТСО) (табл. 3). Показатель КК во всех случаях увеличился незначительно. Наибольший прирост показателя КК относительно контроля характерен для ФК БУТ 30 (110.2–111.0%). Среднее количество корней для всех ФК составило 5.1, для контроля 4.9. Следует отметить, что влияние ФК на показатель ЭП (количество проросших семян) проявилось неоднозначно. Угнетающее действие на энергию прорастания семян (ЭП < 95.8%) проявили ФК, выделенные из углей БУТС и БУТСО. Положительное влияние (ЭП = 101.7–120.7%) оказали ФК из углей БУТ 30 и БУТ 31. Фульвокислоты стимулируют прорастание семян, но интенсифицируют поражение их плесневыми грибами, снижая тем самым долю жизнеспособных проростков и приводя к гибели растений [27]. Обработка семян битумными препаратами подавляет развитие гнилей. Наибольший фунгицидный эффект проявляет фракция смол [27]. Показано [28], что обработка семян пшеницы смолами, выделенными из битума (уголь БУТ), способствует увеличению показателя ЭП до 22%. В данной работе при выделении ГК и ФК не было проведено предварительное дебитуминирование углей БУТ 30 и БУТ 31 (содержание битумов до 16%), поэтому положительное влияние ФК на энергию прорастания семян может быть связано с присутствием примесей битумов, обладающих фунгицидными свойствами.
В работах [29, 30] была исследована биологическая активность гуматов натрия, выделенных из образцов исследуемых углей. Наиболее положительное действие на семена пшеницы оказывают гуматы концентрации 0.005%. Индексы фитоактивности ГумNa (1.14–1.27) сопоставимы с полученными в данной работе ИФ фульвокислот, выделенных из этих же углей, но при более низких концентрациях.
ЗАКЛЮЧЕНИЕ
Результаты технического и элементного анализа, ИК-Фурье и 13С ЯМР (CPMAS)-спектроскопии показали, что буроугольные ФК и ГК имеют значимые отличия в химическом и структурно-групповом составе. ФК отличаются высоким содержанием кислородсодержащих алифатических групп, карбоновых кислот и сложных эфиров. Для них характерно более низкое содержание углерода и водорода, ароматических фрагментов и соотношения ароматичность/алифа-тичность far/al.
Методом фитотестирования показано, что ФК, выделенные из всех исследуемых образцов бурых углей, проявляют биологическую активность по отношению к семенам пшеницы сорта “Ирень”. Во всех случаях ИФ превышал контроль в среднем от 2 до 40%. Наиболее выраженное стимулирующее влияние ФК проявляют на длину корней и высоту проростков. Присутствие в растворе ФК примесей битумов (для углей БУТ 30 и БУТ 31) оказывает фунгицидный эффект, что обеспечивает превышение показателя ЭП (энергия прорастания семян) над контролем. Это необходимо учитывать при практическом применении фракций буроугольных ГВ.
Полученные данные свидетельствуют о необходимости дальнейшего изучения влияния концентрации, структурно-группового состава фульвокислот, а также механизмов воздействия ФК на биометрические показатели роста растений. Это позволит создать эффективные препараты для повышения урожайности сельскохозяйственных культур.
Список литературы
Жеребцов С.И., Малышенко Н.В., Вотолин К.С., Андроханов В.А., Соколов Д.А., Дугаржав Ж., Исмагилов З.Р. // ХТТ. 2019. № 3. С. 19. [Solid fuel chemistry, 2019. V. 53. № 3. P. 145. https://doi.org/10.3103/S0361521919030121].
Dobbs L.B., Canallas L.P., Olivares F.L., Aguiar N.O., Peres L.E.P., Azevedo M., Spaccini R., Piccolo A., Facanha A.R. // Agriculture and Food Chemistry. 2010. V. 58. P. 3681.
Conselvan G.B., Pizzeghello D., Francioso O., Foggia M., Nardi S., Carletti P. // Plant Soil. 2017. V. 420. P. 119.
Орлов Д.С. Химия почв. М.: Изд-во МГУ, 1992. 259 с.
Stevenson F.J. Humus Chemistry, Genesis, Composition, Reactions. N.Y.: John Wiley&Sons, 1982. 443 p.
Юшкова Е.И. Физико-химическая характеристика и биологическая активность биогумуса. Орел: Изд-во ОРАГС, 2007. 140 с.
Berbara R.L.L., García A.C. // Physiological Mechanisms and Adaptation Strategies in Plants under Changing Enviornoment. N. Y.: Springer Science+Business Media, 2014. V. 1. P. 297.
Steinberg C.E.W., Meinelt T., Timofeyev M.A., Bittner M., Menzel R. //Environ. Sci. Pollut. Control Ser. 2008. V. 15. P. 28.
Canellas L.P., Olivares F.L., Aguiar N.O., Jones D.L., Nebbioso A., Mazzei P., Piccolo A. // Sci. Hortic. 2015. V.196. P. 15.
Kamel S.M., Afifi M.M.I., El-shoraky F., El-Sawy M.M. // Intern. J. Phytopathology. 2014. V. 3. № 2. P. 101.
Braziene Z., Paltanavicius V., Avizienyte D. // Environment Res. 2021. V.195. P .110824.
Eyheraguibel B., Silvestre J., Morard P. // Bioresour. Technol. 2008. V. 99. P. 4206.
Anjum S.A., Wang L., Farooq M., Xue L., Ali S. // J. Agron. Crop Sci. 2011. V. 197. P. 409.
Qin Y., Zhu H., Zhang M., Zhang H., Xiang C., Li B. // Molecules. 2016. V. 21. P. 1363.
Уланкина А.В. // Почвоведение. 2001. №12. С. 1443.
Тайц Е.М., Андреева И.А. Методы анализа и испытания углей. М.: Недра, 1984. 301 с.
Вотолин К.С., Жеребцов С.И., Шпакодраев К.М., Малышенко Н.В., Исмагилов З.Р. // Кокс и химия. 2022. №. 5. С. 33.
Беллами Л.Дж. Инфракрасные спектры сложных молекул. М.: Изд-во иностр. лит., 1963. 592 с.
Наканиси К. Инфракрасные спектры и строение органических соединений. Пер. с англ. М.: Мир, 1965. 216 с.
ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. М.: Изд-во стандартов, 1984. 30 с.
ГОСТ Р 54221-2010. Гуминовые препараты из бурых и окисленных каменных углей. Методы испытания. М.: Стандартинформ, 2012. 10 с.
Воронина Л.П., Якименко О.С., Терехова В.А. // Агрохимия. 2012. № 6. С. 50.
International Humic Substances Society (https://humic-substances.org/)
Rice J.A., Maccarthy P. // Org. Geochem. 1991. V. 17. № 5. P. 635.
Kalaitzidis S., Georgakopoulos A., Christanis K., Iorda-nidis A. // Geochimicaet Cosmochimica Acta. 2006. V. 70. P. 947.
Votolin K.S., Zherebtsov S.I., Smotrina O.V. // Chem. Sustainable Development. 2019. V. 7. № 6. P. 576.
Селянина С.Б., Понаморева Т.И., Ярыгина О.Н., Труфанова М.В., Зубов И.Н. // Химия растительного сырья. 2020. № 1. С. 293.
Шпакодраев К.М., Жеребцов С.И., Малышенко Н.В., Вотолин К.С., Исмагилов З.Р. // ХТТ. 2022. № 4. С. 11.
Жеребцов С.И., Малышенко Н.В., Вотолин К.С., Шпакодраев К.М., Исмагилов З.Р. // ХТТ. 2020. № 4. С. 3. [Solid fuel chemistry, 2020. V. 54. № 4. P. 191. https://doi.org/10.3103/S0361521920040096]
Жеребцов С.И., Вотолин К.С., Малышенко Н.В., Исмагилов З.Р. // ХИУР. 2020. Т. 28. № 6. С. 544.
Дополнительные материалы отсутствуют.
Инструменты
Химия твердого топлива