Кинетика и катализ, 2019, T. 60, № 1, стр. 75-80
Синтез 1,4-диметил-9,10-антрахинона из 1,4-нафтохинона и 2,4-гексадиена в присутствии гетерополикислот
Л. Л. Гогин 1, *, Е. Г. Жижина 1, З. П. Пай 1
1 ФГБУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Академика Лаврентьева, 5, Россия
* E-mail: gogin@catalysis.ru
Поступила в редакцию 27.06.2018
После доработки 13.08.2018
Принята к публикации 27.06.2018
Аннотация
Изучена возможность синтеза 1,4-диметил-9,10-антрахинона (ДМАХ) из 1,4-нафтохинона и 2,4-гексадиена на основе разработанного авторами нового одностадийного метода синтеза замещенных антрахинонов. Раствор высокованадиевой гетерополикислоты брутто-состава H17P3Mo16V10O89 (ГПК-10) был использован как бифункциональный (кислотный и окислительный) катализатор. Показано, что реакция с участием 2,4-гексадиена, в отличие от других метилбутадиенов, протекает не так гладко и приводит к образованию смеси ДМАХ и его дигидропроизводного, а также продуктов осмоления. Обсуждены возможные причины полученных результатов.
9,10-Антрахинон (АХ) и его производные (в частности, алкил-АХ) являются важными продуктами органического синтеза [1–6]. Помимо традиционных областей – производства органических красителей [1, 2] и пероксида водорода [1, 3] – они находят применение также в качестве катализаторов делигнификации древесины [1], их используют для приготовления лекарственных препаратов [1, 4, 5], в электронике [6] и т.д.
Ранее [7, 8] нами были разработаны одностадийные процессы получения АХ и его производных из 1,4-нафтохинона (НХ) и 1,3-диенов в присутствии водных растворов высокованадиевых модифицированных (некеггиновских) гетерополикислот (ГПК) брутто-составов H15P4Mo18V7O89 (ГПК-7) и H17P3Mo16V10O89 (ГПК-10). В этих процессах реакция диенового синтеза технологически совмещена с окислением образующихся аддуктов, а растворы ГПК, которые одновременно являются сильными бренстедовскими кислотами и довольно сильными окислителями с редокс-потенциалом около 1.0 В [9], играют роль бифункциональных катализаторов: кислотных катализаторов в реакции диенового синтеза и катализаторов окисления получаемых аддуктов. В новых процессах при полной конверсии НХ удалось добиться выхода целевых продуктов 70–90% при содержании основного вещества до 97% [7, 8].
Как правило, реакции проводили в избытке диена при 80°С (ниже 50°С диеновый синтез идет очень медленно [7]) и мольном соотношении ГПК : НХ = 2 : 1. Были использованы смешивающиеся с водой органические растворители (ацетон и 1,4-диоксан) при их объемном соотношении с водным раствором ГПК, равном 1 : 2. Важно отметить, что растворы модифицированных ГПК обладают высокой стабильностью, поэтому после регенерации катализаторов кислородом при 150–160°С [8] их можно вновь многократно использовать в целевых реакциях.
В настоящей работе исследована возможность расширения круга субстратов для получения новых производных АХ. В частности, изучена применимость разработанного нами ранее способа для получения 1,4-диметил-9,10-антрахинона (ДМАХ) из НХ и 2,4-гексадиена, представляющего собой смесь геометрических изомеров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
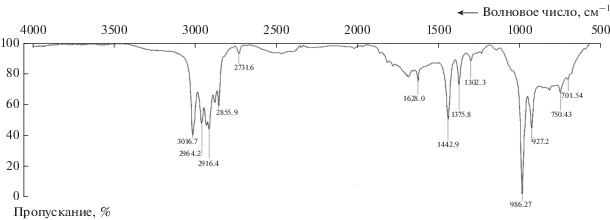
Для синтеза ДМАХ использовали 1,4-нафтохинон (97% основного вещества, “Alfa Aesar”) и 2,4-гексадиен (содержащий, согласно паспортным данным “Acros Organics”, 90% транс–транс-изомера). Результаты анализа методами ПМР и ИК-спектроскопии подтвердили, что в смеси изомеров 2,4-гексадиена действительно преобладает транс–транс-изомер. Присутствует также цис–транс-изомер (полоса поглощения в ИК-спектре 701 см–1 (рис. 1), а в спектре ПМР имеется мультиплет протонов при 6.3–6.4 м. д.).
В качестве бифункционального катализатора использовали 0.2 М раствор ГПК (массовая концентрация 40%) брутто-состава H17P3Mo16V10O89 (ГПК-10, М = 3580), синтезированной по методике [9].
Анализ продуктов реакции
Продукты реакции анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ) на жидкостном хроматографе Pro Star 410 (“Varian”, США), снабженном УФ-детектором Photodiode Pro Star 335 (длина волны 247 нм). Продукты разделяли на колонке Pursuit 3C18 (247 × 4.6 мм) при скорости подачи элюента 1 мл/мин. В качестве растворителей в хроматографических операциях использовали метанол (99%, “J.T. Baker”) и трифторуксусную кислоту (99%, “Acros Organics”), а также деионизованную воду. Состав элюента: 70% CH3OH + 30% CF3COOH (растворитель для образцов – хлороформ). Градуировку производили, используя коммерческие образцы замещенных антрахинонов производства “Alfa Aesar” и “Sigma-Aldrich” с содержанием основного вещества не менее 97%, а внутренним стандартом служил дурохинон (2,3,5,6-тетраметилбензохинон) такой же чистоты (“Alfa Aesar”).
Полученный продукт дополнительно анализировали методами хромато-масс-спектрометрии (ХМС) и ИК-спектроскопии.
Состав реакционной смеси в ходе процесса контролировали методом тонкослойной хроматографии (ТСХ) на пластинках Sorbfil (элюент – смесь бензола с хлороформом в соотношении 1 : 1).
Методика экспериментов
Синтез ДМАХ проводили в термостатированном стеклянном реакторе объемом 100 мл, снабженном рубашкой для обогрева и обратным холодильником. В реактор вводили 0.2 г НХ, затем при перемешивании добавляли органический растворитель и после растворения субстрата вводили расчетные количества 0.2 М раствора ГПК-10 и 2,4-гексадиена. После этого рубашку реактора подсоединяли к термостату (модель LT-205A, “ЗАО ЛОИП”, Россия), предварительно нагретому до 80°С. Все опыты проводили при интенсивном перемешивании реакционной смеси магнитной мешалкой (650 об/мин) в течение заданного времени. В ходе синтеза цвет раствора ГПК в результате восстановления изменялся от темно-красного до зеленого.
По окончании опыта реакционную смесь охлаждали до комнатной температуры, продукты экстрагировали хлороформом (3 × 30 мл), экстракт сушили над хлористым кальцием, а хлороформ отгоняли на роторном испарителе. Полученный темно-коричневый смолистый остаток высушивали в вакууме над P2O5, взвешивали и анализировали методами ВЭЖХ и ХМС.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
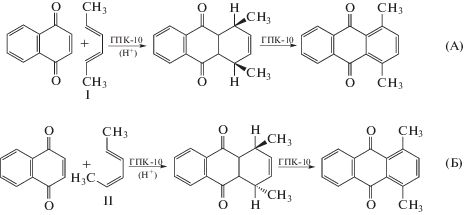
Была исследована возможность синтеза ДМАХ из НХ и смеси изомеров 2,4-гексадиена в присутствии раствора ГПК-10 по следующей схеме:
В данном случае в реакцию Дильса−Альдера с НХ могут вступать два геометрических изомера 2,4-гексадиена: транс–транс (вариант А) и цис–транс (вариант Б). Однако наиболее благоприятной является транс–транс-конфигурация, поскольку в конфигурации цис–транс существуют пространственные препятствия для сближения реагентов, обусловленные положением одной из метильных групп. Поэтому цис–транс-изомер, скорее всего, должен реагировать намного медленнее, и для осуществления синтеза потребуются значительно более жесткие условия (температура выше 100°С [10]). Но при высоких температурах может происходить осмоление реакционной смеси, а выше температуры кипения реакционного раствора (~100°С) процесс придется вести под давлением. Теоретически возможно существование также третьего геометрического изомера – цис–цис-2,4-гексадиена, который в условиях реакции Дильса–Альдера был бы нереакционноспособным по той же причине, что и цис–транс-изомер (пространственные затруднения). Однако в исходном образце 2,4-гексадиена этот изомер, согласно данным ПМР и ИК-спектроскопии, отсутствовал. Кроме того, необходимо учитывать, что в кислой среде (в том числе в растворах ГПК) возможна трансформация геометрических изомеров друг в друга [11].
Реакцию 2,4-гексадиена с НХ в присутствии раствора ГПК-10 проводили в соответствии с методикой [8], разработанной ранее для других 1,3-диенов (80°С, время реакции 7 ч, растворитель 1,4-диоксан), используя, однако, более значительный избыток диена (2 : 1), чем в работе [8], поскольку исходным соединением был не чистый 2,4-гексадиен. Согласно данным ВЭЖХ, в результате реакции образовывалась смесь четырех компонентов, содержащая как целевой продукт ДМАХ (29%), так и дигидро-ДМАХ (28%), а также 25% исходного НХ и продукты конденсации в виде смол.
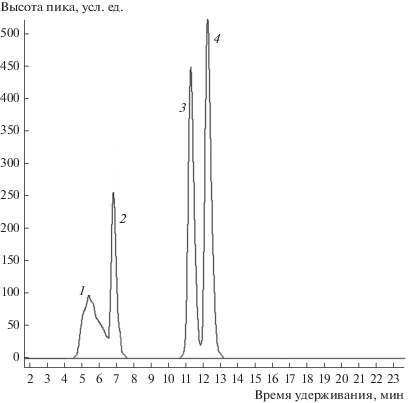
Таким образом, оказалось, что синтез соответствующего антрахинона из 2,4-гексадиена протекает не столь эффективно, как из других 1,3-диенов [8]. Поэтому возникла необходимость изменить условия процесса. С целью ускорения реакции диенового синтеза (для достижения полной конверсии НХ) избыток диена по отношению к НХ был увеличен до 5 : 1 при сохранении неизменными прочих условий. Через 6 ч после начала реакции к смеси был дополнительно добавлен 1 мл исходной ГПК-10, поскольку раствор приобрел темно-зеленый цвет и стало понятно, что окисление аддуктов уже практически не происходит, так как, по нашим данным, окислительный потенциал раствора ГПК-10 такого цвета, как правило, не превышает 0.7 В (относительно НВЭ). Анализ методом ТСХ показал, что и через 7 ч в реакционной смеси все еще остается НХ. Поэтому для завершения диенового синтеза к смеси добавили еще 0.1 мл 2,4-гексадиена и 3.5 мл ГПК-10 и продолжили процесс при тех же 80°С в течение еще 5.5 ч. В итоге через 12.5 ч получили смесь 28.5% ДМАХ и 35% дигидро-ДМАХ (по данным ВЭЖХ). В выделенном продукте осталось также 16% НХ (см. рис. 2).
Рис. 2.
Типичная ВЭЖХ-хроматограмма продукта: 1 – смолистые продукты конденсации, 2 – НХ, 3 – ДМАХ, 4 – дигидро-ДМАХ.
Была предпринята попытка улучшить показатели процесса путем повышения температуры. Эксперимент, проведенный при тех же условиях, что и в исходном опыте, но при температуре 90°С, позволил увеличить конверсию НХ, однако при этом заметно снижалось содержание антрахинонов вследствие образования большего количества смол. Таким образом, повышение температуры процесса выше 80°С является неоправданным.
Добиться полной конверсии НХ мы попытались в следующем опыте, объединив синтезированные продукты из предыдущих двух опытов (0.56 г) и продолжив процесс в течение 9 ч при 80°С, используя 15 мл 0.2 М ГПК-10, 15 мл диоксана и 0.6 мл 2,4-гексадиена. В результате была получена смесь, содержащая (по данным ВЭЖХ) 7% НХ, 25% ДМАХ и 42% дигидро-ДМАХ. Анализ методом ХМС показал, что соотношение дигидро-ДМАХ : ДМАХ = 68 : 32 (т.е. 2.125 : 1). Результаты проведенных экспериментов представлены в табл. 1.
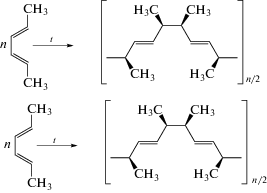
Таким образом, даже применение многократного избытка 2,4-гексадиена и ГПК-10 и увеличение времени процесса не позволяет осуществить полное превращение дигидро-ДМАХ в ДМАХ. Поскольку в аналогичных условиях в реакциях с участием других метилбутадиенов наблюдается практически полная конверсия НХ [8] (нижняя строка в табл. 1), можно предположить, что в данном случае в условиях реакции происходит изомеризация преобладающего в исходной смеси транс–транс-изомера 2,4-гексадиена в цис–транс-изомер, который значительно менее реакционноспособен в реакции Дильса−Альдера. Кроме того, наблюдаемое осмоление продукта, вероятнее всего, обусловлено полимеризацией как цис–транс-, так и, частично, транс–транс-изомера 2,4-гексадиена:
Таблица 1.
Зависимость выхода ДМАХ от условий проведения процесса
| Время реакции, ч | T, °С | Мольное отношение диен : НХ | Мольное отношение ГПК : НХ | Конверсия НХ, % | Суммарное содержание ДМАХ и дигидро-ДМАХ в твердом продукте, % | Содержание ДМАХ, % |
|---|---|---|---|---|---|---|
| 7* | 80 | 2 : 1 | 0.75 : 1 | 75 | 57 | 29 |
| 7* | 90 | 2 : 1 | 0.75 : 1 | 85 | 52 | 27 |
| 12.5* | 80 | 1.5 : 1 | 1.3 : 1 | 84 | 63.5 | 29 |
| 24** | 80 | – | – | 93 | 67 | 25 |
| 7*** | 80 | 1.2 : 1 | 1 : 1 | 100 | 99 | 99 |
* Содержание НХ 1.9 × 10–3 моль (0.2 г), 0.20 М раствор ГПК-10, объемное отношение ГПК : диоксан = 1 : 1. ** 0.56 г смеси продуктов из двух предыдущих опытов, 15 мл ГПК-10, 15 мл диоксана, 0.6 мл диена. *** Результаты синтеза 1-метил-АХ из НХ и транс-пиперилена [8].
Следовательно, при использовании 2,4-гексадиена не удается реализовать одностадийный процесс синтеза ДМАХ из НХ со столь же высокой эффективностью, как в реакциях с участием монометильных производных 1,3-бутадиена.
ЗАКЛЮЧЕНИЕ
Итак, исследование возможности реализации одностадийного синтеза 1,4-диметил-9,10-антрахинона (ДМАХ) по реакции 1,4-нафтохинона с 2,4-гексадиеном (90% транс–транс-изомера) в присутствии раствора модифицированной высокованадиевой ГПК-10 показало, что в ходе процесса образуется смесь ДМАХ и дигидро-ДМАХ, а также продукты осмоления. Образование смол обусловлено, вероятно, полимеризацией как цис–транс-изомера 2,4-гексадиена, обладающего низкой реакционной способностью в реакции Дильса−Альдера, так частично и транс–транс-изомера. Таким образом, синтез соответствующего антрахинона (ДМАХ) из 2,4-гексадиена протекает не так эффективно, как из монометильных производных 1,3-бутадиена.
БЛАГОДАРНОСТИ
Работа выполнена в рамках бюджетного проекта Института катализа СО РАН № АААА-А17-117041710081-1.
Список литературы
Anthraquinone. Kirk-Othmer Encyclopedia of Chemical Technology. 5th ed., 2006. V. 2.
Chang J.B., Yuk S.B., Park J.S., Kim J.P. // Dyes and Pigments. 2012. V. 98. № 1. P. 737.
Valim R.B., Reis R.M., Castro P.S., Lima A.S., Rocha R.S., Bertotti M., Lanza M.R.V. // Carbon. 2013. V. 61. P. 236.
Abdel-Yamid A.M., Solbiati J.O., Cann I.R.O. // Adv. Appl. Microbiol. 2013. V. 82. P. 1.
Zhang C., Kim S.K. // Adv. Food and Nutrition Res. 2012. V. 65. P. 415.
Caldiran Z., Deniz A.R., Coskun M., Ayudogan S., Yesildaz A., Ekinei D. // J. Alloys Compd. 2014. V. 584. P. 652.
Zhizhina E.G., Odyakov V.F. // ChemCatChem. 2012. V. 4. P. 1405.
Гогин Л.Л., Жижина Е.Г., Пай З.П., Пармон В.Н. // Изв. РАН. Сер. хим. 2015. № 9. С. 2069.
Odyakov V.F., Zhizhina E.G., Maksimovskaya R.I. // Appl. Catal. A. General. 2008. V. 342. P. 126.
Физер Л., Физер М. Органическая химия. Т. 1. М.: Химия, 1970. С. 242.
Pat. US 3642885, 1972.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ