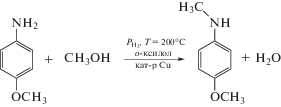Кинетика и катализ, 2019, T. 60, № 3, стр. 364-376
N-метилирование пара-анизидина на катализаторах на основе Cu-содержащих слоистых двойных гидроксидов
М. В. Бухтиярова 1, *, А. Л. Нуждин 1, Т. Ю. Кардаш 1, А. В. Бухтияров 1, Е. Ю. Герасимов 1, А. В. Романенко 1
1 ФБГУН Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 5, Россия
* E-mail: mvb@catalysis.ru
Поступила в редакцию 04.09.2018
После доработки 29.11.2018
Принята к публикации 15.01.2019
Аннотация
Cu-содержащие слоистые двойные гидроксиды с различным соотношением Cu : Al синтезированы методом соосаждения с использованием в качестве осадителя смеси гидроксида и карбоната натрия. Методами термического анализа и рентгеновского фазового анализа исследовано влияние концентрации осадителя на формирование фазы гидроталькита. Поверхность полученных образцов после прокаливания при 450°С, а также последующего их восстановления при 300°С в водороде охарактеризована методами рентгеновской фотоэлектронной спектроскопии и просвечивающей электронной микроскопии. Синтезированные катализаторы испытаны в реакции N-метилирования пара-анизидина с метанолом в автоклавном реакторе с получением N-метил-п-анизидина и изучено влияние отношения Cu : Al в них на каталитическую активность и селективность.
N-метил-пара-анизидин (H3C–NH–C6H4–OCH3) является перспективным для использования в качестве присадок к бензинам, поскольку его добавление приводит к повышению октанового числа. Наличие кислорода в молекуле N-метил-п-анизидина позволяет повысить полноту сгорания топлива и снизить содержание выбросов CO и несгоревших углеводородов в выхлопных газах. Согласно патенту [1], синтез N-метил-п-анизидина может быть проведен N-алкилированием п-анизидина метанолом (схема 1 ) в газовой фазе при температуре 180–260°C и атмосферном давлении в присутствии медьсодержащих катализаторов.
Схема 1 . N-метилирование п-анизидина метанолом.
В работах [2–5] было исследовано влияние природы катализатора и условий проведения реакции N-метилирования аминов на каталитическую активность и было показано, что в качестве гомогенных катализаторов могут быть использованы RuCl3 ⋅ nH2O–P(OBu)3 [2] или марганцевый комплекс [3]. В работе [2] проводили N-метилирование п-анизидина, п-толуидина и п-хлоранилина в присутствии метанола при температуре 180°С в течение 15 ч в реакторе периодического действия. В качестве основного продукта образовывался N,N-диметиламин, и его выход составлял 60–80% в зависимости от исходного субстрата, тогда как целевым продуктом был N-метиламин. В работе [3] использовали марганцевый комплекс в качестве катализатора в реакции N-метилирования различных ароматических аминов метанолом при температуре 120°С в течение 24 ч. Достигнутая конверсия соответствующих аминов, как и в случае п-анизидина, составила 93%. Однако поскольку выходы продукта не были приведены, сложно судить о селективности катализатора. В работе [4] в качестве катализатора использовали гетерогенную систему Al2O3–морденит. N-метилирование различных аминов проводили в проточном реакторе при температуре 270°С, давлении 10 бар и соотношении метанол : амин, равном 4 : 1. Однако в этой работе не изучали п-анизидин. Тем не менее из полученных данных, согласно которым более высокая селективность была получена по N,N-диметиламину, можно сделать вывод, что катализатор Al2O3–морденит не является селективным для получения N-метил-п-анизидина. В работе [5] в реакции N-метилирования ароматических аминов (анилина, о-, м- и п-толуидинов и п-анизидина) в проточном реакторе при температуре 300°С в течение 10 ч был исследован катализатор Cu0.5Zn0.5Fe2O4, полученный методом соосаждения. В реактор подавали смесь метанол : амин : вода = 3 : 1 : 1. Каталитические свойства зависели от используемого субстрата. В случае п-анизидина конверсия и селективность составляли 32–35 и 94–96% соответственно (в зависимости от времени реакции). Повышение концентрации метанола в реакционной смеси (метанол : амин : вода = 6 : 1 : 1) приводило к возрастанию конверсии до 60%, однако с течением времени она постепенно уменьшалась и после 5 ч эксперимента составила ~40% [5]. Таким образом, на основании литературных данных можно предположить, что медьсодержащие катализаторы являются перспективными в реакции N-метилирования п-анизидина для получения N-метил-п-анизидина.
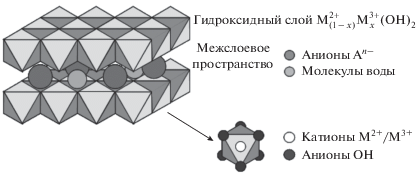
В качестве катализаторов в реакции N-алкилирования могут быть использованы и слоистые двойные гидроксиды (СДГ) [6], которые имеют общую формулу ${{\left[ {{\text{M}}_{{1 - x}}^{{2 + }}{\text{M}}_{{1 - x}}^{{3 + }}{{{({\text{OH}})}}_{2}}} \right]}^{{x + }}}{{[{{{\text{A}}}^{{n - }}}]}_{{{x \mathord{\left/ {\vphantom {x n}} \right. \kern-0em} n}}}} \cdot m{{{\text{H}}}_{2}}{\text{O}}.$ СДГ известны как соединения типа гидроталькита. Структура гидроталькита Mg6Al2(OH)16CO3 · · 4H2O представляет собой укладку бруситовых слоев Mg(OH)2, содержащих положительный заряд из-за частичного замещения ионов магния ионами алюминия. Положительный заряд компенсируется анионами (OH– или ${\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}$), находящимися в межслоевом пространстве (рис. 1). Чистая фаза двойного слоистого гидроксида получается при 0.2 < x < 0.33, где x – соотношение M3+/(M2+ + M3+), тогда как соотношение катионов M2+/M3+ находится в диапазоне (2 : 1)–(4 : 1) [7]. Такие системы являются перспективными катализаторами, поскольку в качестве двухвалентного металла может служить Cu, а в качестве трехвалентного – Al. Традиционный метод синтеза двойных слоистых гидроксидов состоит в соосаждении нитратов металлов смесью гидроксида натрия и карбоната натрия [8]. Однако работы, посвященные изучению СДГ-систем в реакции N-метилирования п-анизидина, в литературе практически отсутствуют.
В представленной работе было исследовано влияние условий синтеза СuAl-слоистых двойных гидроксидов (таких как соотношение Сu2+/Al3+ и концентрация осадителя) на фазовый состав полученных образцов, их активность и селективность в реакции N-алкилирования п-анизидина метанолом в N-метил-п-анизидин в процессе его однореакторного (one-pot) синтеза, а также изучено влияние условий проведения целевой реакции на каталитические свойства синтезированных на основе СuAl-СДГ-катализаторов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез CuAl-слоистых двойных гидроксидов
Слоистые двойные гидроксиды различного состава получали с соотношением Cu : Al, равным 1 : 1, 2 : 1 и 3 : 1. Кроме них, был получен образец с добавлением цинка (Cu : Al : Zn = 1 : 1 : 1). Эти образцы обозначены как CuAl-СДГ-2, CuAl-СДГ-3, CuAl-СДГ-4 и CuAl-СДГ-5 соответственно. Синтез проводили методом соосаждения при постоянных значениях pH 9.0 ± 0.1 и температуры 70°C.
В качестве осаждающего агента использовали смесь NaOH и Na2CO3. По поводу концентрации осадителя существуют разные мнения. Так, в работе [9] в растворе осаждающего агента соотношение ${{\left[ {{\text{CO}}_{3}^{{2 - }}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{CO}}_{3}^{{2 - }}} \right]} {\left[ {{\text{A}}{{{\text{l}}}^{{3 + }}}} \right]}}} \right. \kern-0em} {\left[ {{\text{A}}{{{\text{l}}}^{{3 + }}}} \right]}}$ было близко к стехиометрическому и составляло 0.7, тогда как в большинстве работ [10, 11] использовали более высокую концентрацию карбонат-ионов, равную 2.0. Их концентрация должна быть достаточной для формирования чистой карбонатной фазы СДГ [12]. В нашей работе мы выбрали промежуточные значения концентрации карбонат-ионов. Для образцов CuAl-СДГ-2–CuAl-СДГ-5 соотношение ${{\left[ {{\text{CO}}_{3}^{{2 - }}} \right]} \mathord{\left/ {\vphantom {{\left[ {{\text{CO}}_{3}^{{2 - }}} \right]} {\left[ {{\text{A}}{{{\text{l}}}^{{3 + }}}} \right]}}} \right. \kern-0em} {\left[ {{\text{A}}{{{\text{l}}}^{{3 + }}}} \right]}}$ составляло 1.73. Дополнительно мы получили образец, обозначенный как CuAl-СДГ-1, с соотношением Cu : Al = 1 : 1, при синтезе которого концентрация карбонат-ионов в осаждающем агенте была уменьшена в два раза ($\left[ {{\text{CO}}_{3}^{{2 - }}} \right]$ = = 0.86[Al3+]). Концентрация гидроксид-ионов для синтеза всех образцов была одинаковой и составляла [OH–] = 1.6([Al3+] + [Cu2+]), что достаточно для формирования слоистого двойного гидроксида [13].
Старение образцов проводили при 70°C в течение 4 ч. Состаренный осадок фильтровали, промывали горячей водой для удаления избытка ионов натрия, высушивали при 110°C в течение 14 ч с последующими прокаливанием при 450°C в течение 4 ч и восстановлением при 300°С в токе водорода в течение 2 ч. Прокаленные образцы, обозначенные как CuAl-1–CuAl-5, далее исследовали в реакции N-метилирования п-анизидина.
Каталитические эксперименты
Исследование каталитической активности проводили в автоклавном реакторе Tinyclave Steel (“Buchiglasuster”, Швейцария) объемом 15 мл. Реакционная смесь состояла из раствора п-анизидина (0.1 моль/л) и метанола (0.1–0.9 моль/л) в о-ксилоле (10 мл), содержащем н-декан в качестве внутреннего стандарта. В экспериментах массу катализатора подбирали таким образом, чтобы отношение п-анизидин : Cu находилось в интервале 1.33–5.0. После загрузки катализатора в реактор с реакционной смесью проводили опрессовку под давлением водорода (или азота) 5 бар. Процедуру набора и сброса давления повторяли 8 раз. Реакцию продолжали в течение 5–20 ч при 180–200°C и давлении H2 (или N2) 2–6 бар.
Конверсию реагентов определяли методом внутреннего стандарта (н-декан). Продукты реакции анализировали методом хромато-масс-спектрометрии (ГХ-МС) на приборе Agilent 7000B Triple Quad System (“Agilent”, США). Анализ газовой фазы проводили методом газовой хроматографии (ГХ) на хроматографе Хромос ГХ-1000 (Россия), cнабженном пламенно-ионизационным детектором.
Химический анализ
Полученные образцы анализировали на содержание основных компонентов (алюминия, меди и цинка) атомно-абсорбционным методом [14].
Термический анализ
Термогравиметрический анализ (ТГА) образцов катализаторов выполняли в атмосфере гелия в температурном диапазоне 20–700°C на термогравиметре Netzsch STA 449 (“Netzsch”, Германия) со скоростью нагрева 10 град/мин (количество образца 70 мг).
Рентгенофазовый анализ (РФА)
Рентгенограммы катализаторов получали на приборе Bruker D8 (“Bruker”, Германия) с CuKα-излучением и фокусирующей геометрией θ–θ, оснащенном высокоскоростным многоканальным детектором LynxEye. Съемку проводили в сканирующем режиме в диапазоне углов 2θ = 5°–70° с шагом 0.05° и временем накопления в точке 3 с. Для фазового анализа использовали порошковую базу данных ICDD PDF-2.
Параметры ячейки a и c слоистых двойных гидроксидов уточняли по пикам (002), (004) и (101) или (003), (006) и (011) для 2H1- и 3R1-политипов соответственно. Для расчетов использовали программный пакет Topas V. 4.3 (“Bruker”). Значения областей когерентного рассеяния (ОКР) рассчитывали по значению Lvol-IB в изотропном приближении для формы частиц. Инструментальный вклад учитывали методом фундаментальных параметров.
Рентгеновская фотоэлектронная спектроскопия (РФЭС)
Образцы CuAl-1 и CuAl-2 исследовали на фотоэлектронном спектрометре SPECS (Германия) с использованием AlKα-излучения (hν = 1486.6 эВ, 150 Вт). Шкалу энергий связи (Есв) предварительно калибровали по положению пиков остόвных уровней золота и меди – Au4f7/2 (Есв = 84.0 эВ) и Cu2p3/2 (Есв = 932.67 эВ). Давление остаточных газов в ходе съемки не превышало 8 × 10–9 мбар. Образцы наносили на двухсторонний проводящий медный скотч (Scotch 3M®), помещенный на стандартный держатель. Для определения химического (зарядового) состояния и соотношения атомных концентраций элементов на поверхности образцов измеряли регионы Al2p, Al2s, C1s, O1s, Cu2p и Na1s. Для калибровки измеренных спектров в качестве внутреннего стандарта использовали линию Al2p (Есв = 74.5 эВ) от алюминия в составе слоистого гидроксида [15]. Интегральные интенсивности линий измеряли по площадям соответствующих регионов (Al2p, C1s, O1s, Cu2p и Na1s). Относительное содержание элементов на поверхности образцов и соотношение их атомных концентраций определяли по интегральным интенсивностям фотоэлектронных линий, откорректированным на соответствующие коэффициенты атомной чувствительности [15]. Полученную спектральную информацию обрабатывали с использованием программы XPSPeak 4.1. Спектры образцов CuAl-1 и CuAl-2 снимали сначала после прокаливания, а затем после их восстановления в водороде при 300°С. Восстановление выполняли непосредственно в камере фотоэлектронного спектрометра SPECS, оснащенной ячейкой высокого давления, позволяющей обрабатывать образцы в различных газовых средах при давлениях вплоть до 1 атм в диапазоне температур 50–450°С. Для этого образцы втирали в сетку из нержавеющей стали, приваренную точечной сваркой на стандартный держатель. Восстановление выполняли при давлении водорода в ячейке ~500 мбар (0.5 атм) и температуре 300°С в течении 2 ч. Затем образцу давали остыть в водороде, после чего водород откачивали из ячейки и перемещали образец в камеру анализатора без промежуточного контакта с атмосферой.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Каталитические свойства образцов CuAl-1–CuAl-5 на основе СДГ, прокаленных при 450°C, исследовали в реакции N-метилирования п-анизидина в автоклавном реакторе с использованием о-ксилола в качестве растворителя.
Выбор оптимальных условий
На первом этапе работы подбирали оптимальные условия для получения наиболее высоких значений конверсии п-анизидина и селективности по N-метил-п-анизидину, для чего в качестве катализатора использовали образец CuAl-1. Ранее в работе [16] была показана возможность N-алкилирования анилина различными спиртами на медном катализаторе Cu/Al2O3 (в котором медь находится в состоянии Cu0) с селективностью по целевому продукту 60–95% в зависимости от использованного спирта. Поэтому в настоящей работе были исследованы как свежепрокаленный катализатор, так и восстановленный в токе водорода. Результаты жидкофазного синтеза N-метил-п-анизидина на образце CuAl-1 представлены в табл. 1.
Таблица 1.
Жидкофазный синтез N-метил-п-анизидина на катализаторе CuAl-1
| № п/п | [CH3OH], моль/л | п-Анизидин : Cu | P, бар | T, °C | Конверсия MeOH, % | Конверсия, % | Селектив-ность, % |
|---|---|---|---|---|---|---|---|
| 1 | 0.10 | 1.33 | 4 (N2) | 200 | –* | 0 | н/о |
| 2** | 0.10 | 1.33 | 4 (N2) | 200 | –* | 0 | н/о |
| 3** | 0.10 | 1.33 | 4 (H2) | 180 | –* | 6 | 100 |
| 4** | 0.10 | 1.33 | 4 (H2) | 200 | 84 | 16 | 99.9 |
| 5** | 0.15 | 1.33 | 4 (H2) | 200 | 90 | 32 | 99.9 |
| 6 | 0.15 | 1.33 | 4 (H2) | 200 | 88 | 33 | 99.9 |
| 7 | 0.40 | 1.33 | 4 (H2) | 200 | 90 | 69 | 99.8 |
| 8 | 0.65 | 1.33 | 4 (H2) | 200 | 85 | 99.8 | 97.5 |
| 9 | 0.65 | 2.66 | 4 (H2) | 200 | 76 | 84 | 99.5 |
| 10 | 0.65 | 5 | 4 (H2) | 200 | 68 | 34 | 99.8 |
| 11 | 0.90 | 5 | 4 (H2) | 200 | 54 | 50 | 99.7 |
| 12*** | 0.90 | 5 | 4 (H2) | 200 | 60 | 75 | 99.3 |
| 13 | 0.90 | 5 | 2 (H2) | 200 | 73 | 31 | 99.9 |
| 14 | 0.90 | 5 | 6 (H2) | 200 | 66 | 40 | 99.8 |
При проведении реакции в атмосфере азота при давлении 4 бар и концентрации метанола 0.1 моль/л N-метил-п-анизидин при температуре 200°C не образуется (табл. 1, строки 1 и 2). В атмосфере же водорода при давлении 4 бар и температуре 180°С наблюдается расходование п-анизидина (табл. 1, строка 3), хотя конверсия составляет всего 6%. Повышение температуры до 200°С приводит к существенному росту конверсии п-анизидина (табл. 1, строки 3 и 4). При этом скорость превращения метанола в ходе реакции заметно превышает скорость превращения п-анизидина, что, возможно, связано с одновременным протеканием побочных реакций метанола с образованием метана, CO2 и CO. Такое предположение подтверждается присутствием угарного газа, диоксида углерода и метана в газовой фазе, отобранной из реактора после окончания реакции и исследованной методом ГХ (рис. 2).
Рис. 2.
Анализ газовой фазы после окончания реакции (метанол : п-анизидин = 9, п-анизидин : Cu = 5, 200°C, 4 бар, время реакции 20 ч).
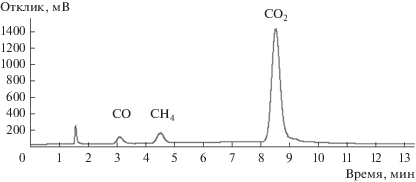
Хорошо известно, что на медьсодержащих катализаторах могут протекать реакции парового риформинга метанола с образованием CO2 [17, 18], а также разложение метанола до CO и воды [17]. Паровой риформинг метанола происходит при его взаимодействии с водой, образующейся в ходе протекания целевой реакции. К тому же взаимодействие оксида углерода с водородом приводит к образованию небольших количеств метана [17].
Использование избытка метанола по отношению к п-анизидину позволяет значительно увеличить выход N-метил-п-анизидина (табл. 1, строки 4–8). Свежепрокаленный катализатор проявляет такую же активность, как и образец, предварительно восстановленный в токе водорода при 300°C (табл. 1, строки 5 и 6). В обоих случаях конверсия п-анизидина достигает ∼32%. Следовательно, можно предположить, что в условиях протекания реакции происходит восстановление Cu2+ в составе прокаленного катализатора до металлической меди, которая, в свою очередь, выступает в качестве активного компонента в реакции. Стоит отметить, что восстановление катализатора проводили в проточном реакторе, после чего его переносили в автоклав для проведения реакции N-метилирования п-анизидина, т.е. катализатор подвергался воздействию кислорода воздуха. В результате могло происходить частичное окисление меди на поверхности катализатора, что приводило к потере активности восстановленного катализатора при проведении реакции в атмосфере азота (табл. 1, строки 1 и 2). (Ниже это соображение будет подтверждено методом ПЭМ.)
Повышение концентрации метанола от 0.15 до 0.65 моль/л (табл. 1, строки 6–8) способствует росту конверсии п-анизидина от 33 до 99.8%, тогда как селективность по N-метил-п-анизидину остается практически неизменной.
При изучении влияния загрузки катализатора на протекание реакции обнаружено, что для достижения ∼100%-ной конверсии п-анизидина необходимо высокое содержание катализатора при проведении реакции с метанолом (0.65 M) в течение 5 ч (табл. 1, строка 8). Снижение загрузки катализатора сопровождается падением конверсии п-анизидина (табл. 1, строки 8–10) до 34% при соотношении п-анизидин : Cu = 5. Увеличение используемой концентрации метанола до 0.9 М также способствует повышению степени превращения п-анизидина (табл. 1, строка 11), тогда как увеличение времени реакции до 10 ч позволяет повысить конверсию до 75% (табл. 1, строка 12). При этом селективность по N-метил-п-анизидину остается на уровне 99.0–99.8%. Таким образом, можно сделать вывод, что уменьшение загрузки катализатора приводит к снижению конверсии.
Оптимальное давление водорода для реакции N-метилирования п-анизидина определено как 4 бар. Его уменьшение до 2 бар приводит к снижению активности, что, возможно, связано с тем, что ионы Cu2+ только частично восстанавливаются до металлической меди, которая является активным компонентом (табл. 1, строки 11 и 13). Повышение же давления водорода до 6 бар снижает конверсию п-анизидина (табл. 1, строка 14), что объясняется смещением равновесия реакции в сторону метанола на стадии дегидрирования метанола в формальдегид (схема 2 ) [19].
Схема 2 . Металл-каталитическое алкилирование нуклеофила (:NuH2) спиртом (R1R2СНOH) [19].
Таким образом, в ходе испытаний каталитической активности смешанного оксида CuAl-1 было показано, что данный образец обеспечивает получение N-метил-п-анизидина с высокой селективностью при проведении реакции с большим избытком метанола. Оптимальными были выбраны следующие условия проведения реакции: температура 200°С, давление водорода 4 бар, концентрация метанола 0.9 моль/л, концентрация п-анизидина 0.1 моль/л и соотношение п-анизидин : Cu = 5.
Влияние природы катализатора
Пять образцов катализатора CuAl-1–CuAl-5, отличающихся условиями синтеза, были испытаны в оптимизированных условиях проведения реакции (табл. 2). Наименьшую конверсию п-анизидина 8% наблюдали на образце CuAl-3 с соотношением Cu : Al = 2 : 1, тогда как конверсии на образцах CuAl-2 (Cu : Al = 1 : 1) и CuAl-4 (Cu : Al = = 3 : 1) практически совпали и составили 16 и 18% соответственно. При этом конверсии метанола на этих образцах соответствовали 47 и 68% соответственно. Можно предположить, что на образце CuAl-4 с высоким содержанием меди предпочтительно протекание побочных реакций, таких как риформинг метанола и разложение метанола. Таким образом, существует предельное содержание меди, выше которого метанол расходуется не на целевую реакцию, а на побочные. Следует отметить, что частичное замещение ионов Cu на ионы Zn в образце CuAl-5 приводит к повышению конверсии п-анизидина до 27%. Этот факт может служить свидетельством проявления синергетического эффекта, связанного с добавлением цинка в катализатор, что согласуется с данными работы [20]. В ней на примере алкилирования этилендиамина было показано, что образец CuO–ZnO/Al2O3 является более активным катализатором по сравнению с CuO/Al2O3, тогда как не содержащий медь образец ZnO/Al2O3 проявляет нулевую каталитическую активность.
Таблица 2.
Жидкофазный синтез N-метил-п-анизидина на образцах на основе СДГ, прокаленных при 450°С
| № п/п | Катализатор | Cu : Zn : Al | $\left[ {{\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}} \right]$/[Al3+] | Конверсия MeOH, % | Конверсия п-анизидина, % |
Селектив-ность, % |
|---|---|---|---|---|---|---|
| 1 | CuAl-1 | 1 : 0 : 1 | 0.86 | 54 | 50 | 99.7 |
| 2 | CuAl-2 | 1 : 0 : 1 | 1.73 | 47 | 16 | 99.9 |
| 3 | CuAl-3 | 2 : 0 : 1 | 1.73 | – | 8 | 99.9 |
| 4 | CuAl-4 | 3 : 0 : 1 | 1.73 | 68 | 18 | 99.9 |
| 5 | CuAl-5 | 1 : 1 : 1 | 1.73 | 52 | 27 | 99.9 |
Согласно полученным нами данным, наиболее активным катализатором является CuAl-1, хотя селективность по N-метил-п-анизидину достигает практически 100% на всех катализаторах. Таким образом, на каталитическую активность может влиять отношение Cu : Al в приготовленных образцах, концентрация осадителя, а также введение промотирующей добавки в виде цинка. В работах, посвященных N-алкилированию аминов [5, 16], не проводилось исследования физико-химических свойств образцов для выявления факторов, влияющих на каталитическую активность. В нашей же работе были изучены фазовый состав образцов и поверхностное состояние меди, что может позволить обнаружить связь природы катализаторов с их активностью в реакции N-метилирования п-анизидина.
Физико-химические свойства образцов
По данным химического анализа, содержание основных компонентов в синтезированных образцах, определенное экспериментально, отличается от расчетных значений. На основании результатов анализа было получено соотношение Cu : Al и Zn : Al в образцах (табл. 3), согласно которым в образцах CuAl-СДГ-2, CuAl-СДГ-3 и CuAl-СДГ-5 экспериментальные соотношения Cu : Al незначительно превышают расчетные значения. Кроме того, в образце CuAl-2 присутствуют ионы натрия несмотря на одинаковые условия промывки образцов после фильтрации. Возможно, низкая каталитическая активность образца CuAl-3 в реакции N-метилирования п-анизидина обусловлена повышенным содержанием Cu по сравнению с расчетным значением.
Таблица 3.
Данные химического анализа образцов на основе СДГ
| Образец | $\left[ {{\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}} \right]$/[Al3+] | Cu : Al | Zn : Al | Na, мас. % | ||
|---|---|---|---|---|---|---|
| расчет | эксперимент | расчет | эксперимент | |||
| CuAl-СДГ-1 | 0.86 | 1.00 | 1.01 | – | – | – |
| CuAl-СДГ-2 | 1.73 | 1.00 | 1.11 | – | – | 5.74 |
| CuAl-СДГ-3 | 1.73 | 2.00 | 2.18 | – | – | – |
| CuAl-СДГ-4 | 1.73 | 3.00 | 3.03 | – | – | – |
| CuAl-СДГ-5 | 1.73 | 1.00 | 1.10 | 1.00 | 1.20 | – |
Температурно-программированная обработка образцов в температурном диапазоне 25–700°С сопровождалась появлением на ДТА-кривых эндо-эффектов. В процессе нагревания воздушно-сухих образцов происходит их разложение в три стадии (рис. 3). Потери массы для образцов составляют 33.2–38.2 мас. % в зависимости от соотношения Cu : Al.
Рис. 3.
Термический анализ воздушно-сухих образцов: а – CuAl-СДГ-1, б – CuAl-СДГ-2, в – CuAl-СДГ-3, г – CuAl-СДГ-5; д – сравнительный термический анализ образцов.
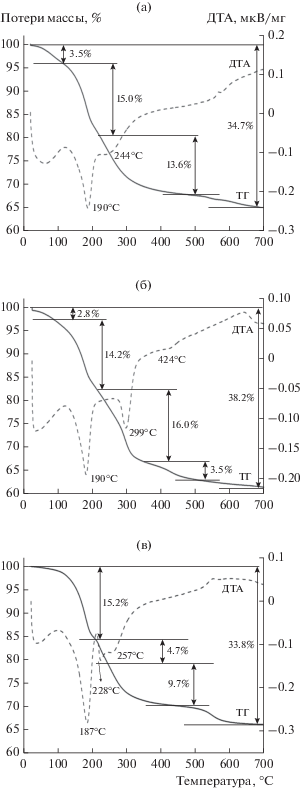
Рис. 3.
Окончание.
На первой стадии (в температурном диапазоне 60–200°С) удаляются физически адсорбированная вода и вода, находящаяся в межслоевом пространстве СДГ. При этом потеря воды составляет 15.2–18.5 мас. %. Дегидроксилирование и декарбонизация фазы гидроталькита происходят на второй стадии в диапазоне температур 200–300°C [21], и потеря массы не превышает 16 мас. %. Таким образом, согласно данным ТГА, дегидроксилирование и декарбонизация происходят до 500°С (рис. 3). При дальнейшем нагревании образца на ТГ-кривых наблюдается незначительная потеря массы при температурах 400–600°С в зависимости от природы образца. Третья стадия может соответствовать разложению прочносвязанного высокотемпературного карбоната в межслоевом пространстве [22, 23]. Более высокая температура разложения этого карбоната является индикатором сильного взаимодействия на границах раздела и границ зерен, которые были образованы на первой стадии разложения. Кроме того, карбонат-ион может вести себя как монодентатный или бидентатный лиганд в межслоевом пространстве. При этом монодентантый карбонат разлагается при более низкой температуре, тогда как бидентатный карбонат стабилен при высоких температурах [24]. Следует отметить, что образцы CuAl-СДГ-3 и CuAl-СДГ-5 ведут себя практически одинаково при нагревании, следовательно, можно заключить, что введение цинка не влияет на термическое разложение образцов.
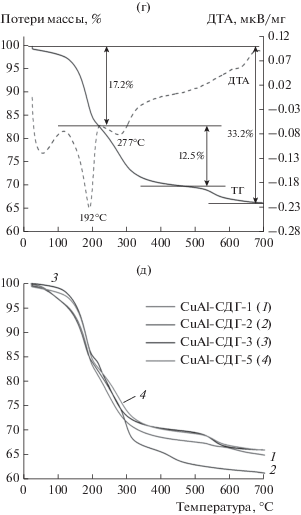
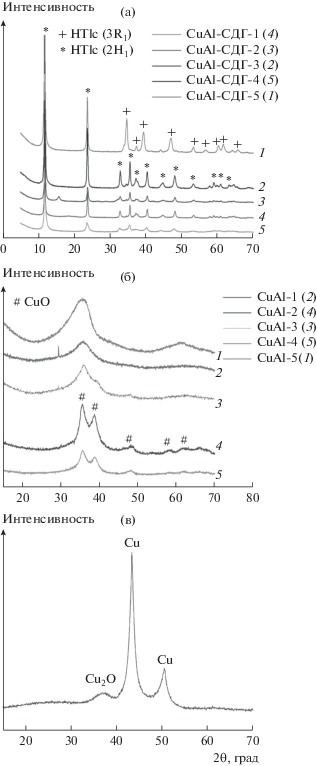
Выводы, сделанные на основании термического анализа, подтверждаются результатами, полученными при исследовании образцов методом РФА. На рис. 4 представлены рентгенограммы для образцов, высушенных при 110°С и прокаленных при 450°С. Как было показано выше, разрушение структуры гидроталькита происходит при температурах выше 300°С. На дифрактограммах всех образцов, высушенных при 110°С, видны характерные пики структуры гидроталькита. При этом во всех образцах присутствует только фаза гидроталькита. В случае CuAl-СДГ-2 обнаружен дополнительный пик при 2θ = 15.75°. В публикациях [25, 26] сообщалось, что этот сверхструктурный пик связан с упорядочением в катионной подрешетке. Кроме того, известно, что бруситовые слои могут быть упакованы различным образом, поэтому возможно формирование различных политипов структуры [27]. Так, СuAl-гидроталькиты образуют тригональную призматическую структуру двухслойного 2H1-политипа, который имеет гексагональную упаковку слоев (рис. 4а). Введение же цинка приводит к формированию структуры трехслойного 3R1-политипа с ромбоэдрической симметрией (образец CuAl-СДГ-5).
Рис. 4.
РФА образцов, высушенных при 110°С (а), прокаленных при 450°С (б) и восстановленного при 300°С образца CuAl-1 (в).
Для всех полученных образцов слоистых двойных гидроксидов были рассчитаны параметры ячейки в гексагональной упаковке, где параметр a является характеристикой ячейки внутри бруситового слоя, а параметр c – характеристикой межслойного расстояния. Видно, что в образце CuAl-СДГ-4 параметр a выше, чем в остальных образцах (табл. 4). Это различие связано с бόльшим содержанием катионов Cu2+ (0.073 нм) в структуре, имеющих бόльший ионный радиус, чем Al3+ (0.051 нм) [28]. Параметры решетки образца CuAl-СДГ-5 существенно отличаются от остальных образцов из-за различия в политипах фаз СДГ.
Таблица 4.
Структурные параметры образцов СДГ и размеры ОКР, рассчитанные для направления [00l]
| Образец | Политип | Пространст-венная группа | Параметры решетки, Å | ОКР, нм | |
|---|---|---|---|---|---|
| a | c | ||||
| CuAl-СДГ-1 | 2H1 | P63/mmc | 3.204 ± 0.002 | 15.032 ± 0.002 | _ |
| CuAl-СДГ-2 | 2H1 | P63/mmc | 3.204 ± 0.003 | 15.010 ± 0.006 | 5.74 |
| CuAl-СДГ-3 | 2H1 | P63/mmc | 3.201 ± 0.002 | 15.048 ± 0.003 | _ _ _ |
| CuAl-СДГ-4 | 2H1 | P63/mmc | 3.214 ± 0.006 | 15.000 ± 0.010 | |
| CuAl-СДГ-5 | 3R1 | R-3M | 3.073 ± 0.001 | 22.529 ± 0.004 | |
Прокаливание образцов при 450°С приводит к разрушению фазы гидроталькита и формированию оксидных фаз (рис. 4б). На образовавшуюся фазу влияет как соотношение Cu : Al в образцах, так и концентрация осадителя на стадии синтеза двойных слоистых гидроксидов. В образцах CuAl-2 и CuAl-4 с отношениями Cu : Al, равными 1 и 3 соответственно, происходит образование фазы CuO. Следует отметить, что фаза алюмината меди, по литературным данным [24], начинает формироваться при температурах прокаливания слоистого двойного гидроксида выше 700°С, что существенно выше использованной нами в данной работе. На дифрактограммах образцов CuAl-1 (приготовлен с использованием осадителя с пониженной концентрацией карбонат-ионов), CuAl-5 (часть ионов меди заменена ионами цинка) и CuAl-3 (с отношением Cu : Al = 2) присутствуют два широких пика (∼36° и ∼62°). Они могут быть отнесены к плохо окристаллизованному оксиду меди, что согласуется с литературными данными [23, 29]. Восстановление водородом при 300°С должно приводить к восстановлению CuO до металлической меди, что подтверждается рентгенофазовым анализом образца CuAl-2. На его дифрактограмме (рис. 4в) видны пики, относящиеся к Cu и Cu2O. Образование оксида меди Cu2O, возможно, обусловлено контактом образца с кислородом воздуха при переносе в измерительную камеру.
Характеризацию поверхности полученных образцов после прокаливания при 450°С, а также последующего их восстановления при 300°С в водороде проводили методом РФЭС. Как описано в разделе Экспериментальная часть, восстановление катализаторов проводили непосредственно в камере фотоэлектронного спектрометра SPECS, оснащенной ячейкой высокого давления. Это позволяло перемещать восстановленный образец в камеру анализатора без промежуточного контакта с атмосферой. В обзорных спектрах образца CuAl-1 присутствуют линии, характерные для алюминия, углерода, кислорода и меди. В спектрах образца CuAl-2 дополнительно видны линии, характерные для натрия. Пиков других элементов в рамках чувствительности метода РФЭС не обнаружено.
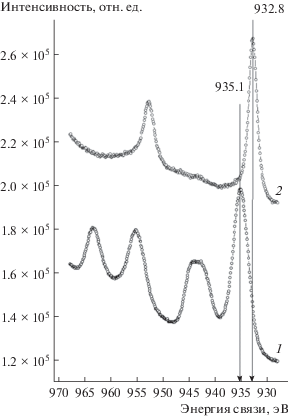
Анализ формы и положения линии Cu2p в спектрах всех исходных образцов (до восстановления) позволяет сделать вывод, что вся медь находится в состоянии Cu2+ (Есв = 935.1 эВ). В РФЭ-спектрах образцов CuAl-1 и CuAl-2, снятых после восстановления, форма и положение линии Cu2p соответствует только меди в металлическом состоянии (Есв = 932.8 эВ) [15, 30] (рис. 5). Так как восстановление образцов проводилось в тех же условиях, что и в проточном реакторе, можно сделать вывод, что на поверхности восстановленных в проточном реакторе образцов вся медь находится в металлическом состоянии, а образование ее окисленных форм (см. данные РФА) происходит при переносе образца через атмосферу в результате контакта с кислородом воздуха.
Рис. 5.
РФЭ-спектры линии Cu2p, снятые для только прокаленного образца CuAl-1 (1) и восстановленного после прокаливания CuAl-1 (2).
Следует отметить, что в образце CuAl-2 на поверхности присутствуют ионы натрия, которые не удаляются при отмывке образца, несмотря на использование одинакового количества воды для промывки образцов. Это может влиять на каталитическую активность образца в реакции N-метилирования п-анизидина (табл. 3). На поверхности образца CuAl-2 обнаружено пониженное соотношение поверхностных концентраций меди к алюминию (0.37) по сравнению с образцом CuAl-1 (0.73) (табл. 5).
Таблица 5.
Соотношения атомных концентраций элементов Cu, Al и Na на поверхности прокаленных и прокаленно-восстановленных образцов
| Образец | Cu : Al | Na : Al |
|---|---|---|
| CuAl-1 | 0.73 | – |
| CuAl-1 (восстановленный) | 0.13 | – |
| CuAl-2 | 0.37 | 0.54 |
| CuAl-2 (восстановленный) | 0.20 | 0.49 |
После восстановления образца CuAl-1 соотношение Cu : Al на поверхности резко падает до 0.13, тогда как для образца CuAl-2 уменьшение концентрации меди не так существенно (Cu : Al = = 0.20). Падение отношения атомных концентраций может быть связано с агломерацией меди в ходе восстановительной обработки. При этом появляются эффекты самоэкранирования (ослабления) интенсивности сигналов Cu2p от атомов меди, находящихся в объеме частиц, ее атомами на поверхности. Образование на поверхности катализаторов частиц металлической меди после их восстановления подтверждается данными ПЭМ. Так как на поверхности восстановленных образцов медь находится в металлическом состоянии, то катализатор CuAl-2 с большим соотношением Cu : Al должен быть более активным в реакции N-метилирования п-анизидина. Однако в действительности наблюдается обратная картина, и наиболее активным образцом является CuAl-1 (табл. 2). Это может быть связано с различием в размерах частиц меди, присутствующих на поверхности образцов.
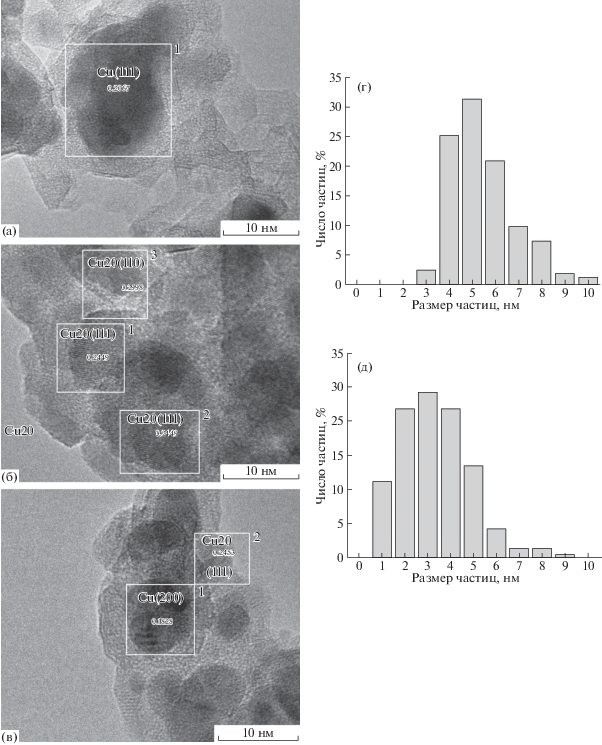
Морфология образцов CuAl-1, CuAl-2 и CuAl-4, восстановленных при 300°С в токе водорода, была исследована методом ПЭМ. На ПЭМ-снимках образца CuAl-4 видны как мелкие частицы размером 7–10 нм, так и большие кластеры меди величиной до 200 нм (рис. 6а), что может отрицательно сказываться на каталитической активности образца в целевой реакции. Возможно, большие частицы меди более активно проводят реакцию парового риформинга метанола, поэтому его конверсия составляет 68% (табл. 2), что выше по сравнению с другими катализаторами. В образцах CuAl-1 и CuAl-2 присутствуют частицы, которые имеют средний размер 5.5 и 3.3 нм соответственно (рис. 6г и 6д). Однако в образце CuAl-1 обнаружено более узкое распределение частиц по размерам по сравнению с образцом CuAl-2. Можно предположить, что основным фактором в определении каталитической активности этих двух образцов является наличие ионов натрия на поверхности, поскольку при практически одинаковом размере частиц конверсия п-анизидина отличается в 3 раза. При этом измеренные межплоскостные расстояния свидетельствуют о присутствии в образцах CuAl-1, CuAl-2 и CuAl-4 следующих фаз: Cu2O (111), Cu2O (110); Cu(200), Cu2O (111); и Cu(111) соответственно (рис. 6). Присутствие оксида меди Cu2O на поверхности образца, по-видимому, вызвано взаимодействием образца с кислородом воздуха при переносе образца в камеру измерения ПЭМ, так как ранее методом РФЭС было показано, что в восстановленных образцах медь находится только в металлическом состоянии. Конверсия п-анизидина в реакции N-метилирования на образце CuAl-2 составляет всего 16%, тогда как на CuAl-1 эта величина достигает 50%. На данном этапе работы сложно сказать, с чем связано такое различие в каталитической активности двух образцов с одинаковым соотношением Cu : Al. Видимо, основными причинами могут служить присутствие натрия на поверхности CuAl-2, разный размер частиц, а также разная концентрация осадителя при синтезе образцов, которая может влиять на степень осаждения слоистых двойных гидроксидов.
ЗАКЛЮЧЕНИЕ
Таким образом, исследованы каталитические свойства образцов на основе Cu-содержащих двойных слоистых гидроксидов в реакции N-метилирования п-анизидина. Как было показано, конверсия п-анизидина изменяется нелинейно при уменьшении соотношения Cu : Al. При этом частичное замещение ионов меди ионами цинка способствует повышению каталитической активности синтезированных образцов. Кроме того, исследование влияния концентрации осаждающего агента на каталитическую активность образцов в реакции N-метилирования п-анизидина показало, что повышенное содержание карбонатных ионов в осадителе приводит к более прочному связыванию ионов натрия со слоистым двойным гидроксидом. Судя по результатам РФЭС, на поверхности образца CuAl-2, синтезированного с концентрацией карбоната $\left[ {{\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}} \right]$ = 1.73[Al3+], присутствуют ионы натрия, что влияет на его каталитическую активность. В случае образца CuAl-1, который был получен с соотношением $\left[ {{\text{CO}}_{{\text{3}}}^{{{\text{2}} - }}} \right]$ = = 0.86[Al3+], ионы натрия на поверхности не обнаружены. Конверсия п-анизидина на образце CuAl-1 составила 50%, что существенно выше конверсии на образце CuAl-2 (16%). Таким образом, необходимо более детально исследовать влияние концентрации осадителя, используемого в синтезе слоистых двойных гидроксидов, на реакцию N-метилирования п-анизидина.
Также было исследовано влияние условий реакции на протекание N-метилирования п-анизидина. В качестве катализатора был выбран CuAl-1, поскольку он является более активным при температуре 200°С, давлении 4 бар и концентрации метанола 0.9 моль/л. Как было показано, снижение температуры приводит к снижению конверсии п-анизидина. Варьирование давления также способствует уменьшению конверсии, что может быть связано с протеканием побочных реакций, в которых расходуется метанол. Уменьшение количества катализатора снижает конверсию п-анизидина, тогда как увеличение времени реакции способствует ее повышению, при этом селективность по N-метил-п-анизидину остается практически неизменной. Таким образом, в дальнейшем возможно варьирование условий синтеза образца CuAl-СДГ-1 с соотношением Cu : Al, равным 1 : 1, для получения более активного катализатора при меньшей его загрузке в реакции N-метилирования п-анизидина при оптимальной температуре 200°С и давлении 4 бар. Также возможно промотирование этого образца ионами цинка для повышения конверсии п-анизидина. Кроме того, возможно применение медьсодержащих слоистых двойных гидроксидов в реакциях N-метилирования других производных анилина.
Список литературы
Пaт. 2472774 PФ, 2011.
Huh K.-T., Tsuji Y., Kobayashi M., Okuda F., Watanabe Y. // Chem. Lett. 1988. V. 17. P. 449.
Bruneau-Voisine A., Wang D., Dorcet V., Roisnel T., Darcel C., Sortais J.-B. // J. Catal. 2017. V. 347. P. 57.
Su J., Li X., Chen Y., Cui Y., Xu J., Qian C., Chen X. // RSC Adv. 2016. V. 6. P. 55643.
Vijayaraj M., Gopinath C.S. // Appl. Catal. A. 2007. V. 320. P. 64.
Likhar P.R., Arundhathi R., Kantam M.L., Prathima P.S. // Eur. J. Org. Chem. 2009. V. 2009. P. 5383.
De Roy A., Forano C., Besse J.-P. // Layered Double Hydroxides: Present and Future. N.Y.: Nova Sci. Pub. Inc., 2001.
Panda H.S., Srivastava R., Bahadur D. // Bull. Mater. Sci. 2011. V. 34. P. 1599.
Miyata S. // Clays Clay Miner. 1980. V. 28. P. 50.
Reichle W.T. // Solid State Ionics. 1986. V. 22. P. 135.
Zhang S., Liu Q., Fan G., Li F. // Catal. Lett. 2012. V. 142. P. 1121.
Bukhtiyarova M.V. // J. Solid State Chem. 2019. V. 269. P. 494.
Zhao Y., Li F., Zhang R., Evans D.G., Duan X. // Chem. Mater. 2002. V. 12. P. 4286.
Прайс В. Аналитическая атомно-абсорбционная спектроскопия. М.: Мир, 1976. 358 с.
Meher L.C., Gopinath R., Naik S.N., Dala A.K. // Ind. Eng. Chem. Res. 2009. V. 48. P. 1840.
Santoro F., Psaro R., Ravasio N., Zaccheria F. // RSC Adv. 2014. V. 4. P. 2596.
Fornari A.C., Neto R.M., Lenzi G.G., dos Santos O.A.A., Jorge L.M.D. // Can. J. Chem. Eng. 2017. V. 95. P. 2258.
Bukhtiyarova M.V., Lunkenbein T., Kähler K., Schlögl R. // Catal. Lett. 2017. V. 147. P. 416.
Shimizu K. // Catal. Sci. Technol. 2015. V. 5. P. 1412.
Yamakawa T., Tsuchiya I., Mitsuzuka D., Ogawa T. // Catal. Commun. 2004. V. 5. P. 291.
Lwin Y., Yarmo M.A., Yaakob Z., Mohamad A.B., Daud W.R.W. // Mater. Res. Bull. 2001. V. 36. P. 193.
Li D., Cai Y., Ding Y., Li R., Lu M., Jiang L. // Int. J. Hydrogen Energy. 2015. V. 40. P. 10016.
Kühl S., Friedrich M., Armbrüster M., Behrens M. // J. Mater. Chem. 2012. V. 22. P. 9632.
Alejandre A., Medina F., Salagre P., Correig X., Sueiras J.E. // Chem. Mater. 1999. V. 11. P. 939.
Bellotto M.R.B., Clause O., Lynch J., Bazin D., Elkam E. // J. Phys. Chem. 1996. V. 100. P. 8527.
Solin S.A., Hines D.R., Seidler G.T., Treacy M.M.J. // J. Phys. Chem. Solids. 1996. V. 57. P. 1043.
Bookin A.S., Drits V.A. // Clay Clays Miner. 1993. V. 41. P. 551.
Shannon R.D. // Acta Cryst. 1976. V. A32. P. 751.
Moulder J.F., Stickle W.F., Sobol P.E., Bomben K.D. // Handbook of X-Ray Photoelectron Spectroscopy. Eden Prairie: Perkin-Elmer Corp., 1992. P. 261.
Biesinger M.C., Lau L.W.M., Gerson A.R., Smart R.St.C. // Appl. Surf. Sci. 2010. V. 257. P. 887.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ