Кинетика и катализ, 2019, T. 60, № 4, стр. 526-531
Изучение механизмов агрегации частиц кремнезема при золь–гель-синтезе промотированных серебряных катализаторов
Ю. В. Ларичев a, b, *, О. В. Водянкина c
a “Федеральный исследовательский центр “ФГБУН Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. Лаврентьева, 5, Россия
b ФГАОУ ВО Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
c ФГАОУ ВО Томский национальный исследовательский государственный университет
634050 Томск, просп. Ленина, 36, Россия
* E-mail: ylarichev@gmail.com
Поступила в редакцию 30.12.2018
После доработки 12.03.2019
Принята к публикации 19.03.2019
Аннотация
Методом малоуглового рентгеновского рассеяния в условиях in situ показано, что в результате золь–гель-синтеза силикатных, силикатно-фосфатных и силикатно-фосфатно-серебряных гелей из тетраэтоксисилана образуется пористая структура, состоящая из компактных частиц с размерами от 2 до 8 нм. Установлено, что процесс агрегации частиц кремнезема в присутствии азотной кислоты протекает по механизму коалесценции. Присутствие в системе фосфорной кислоты меняет механизм агрегации на созревание по Оствальду. Введение в систему нитрата серебра не оказывает существенного влияния на размеры частиц кремнезема и на механизм их агрегации.
Серебряные катализаторы, промотированные соединениями фосфора, находят применение для важного промышленного процесса окисления этиленгликоля в глиоксаль [1]. Ранее для этого процесса изучали серебряные катализаторы, приготовленные разными способами [2, 3], и было показано, что для создания высокоэффективного катализатора необходимо предотвратить спекание наночастиц серебра при высоких температурах, а также модифицировать поверхность самого серебра для снижения доли реакций полного окисления в процессе парциального окисления этиленгликоля [4]. Соединения фосфора являются одними из наиболее эффективных промоторов при использовании кремнеземной матрицы в качестве носителя. При взаимодействии силикагеля с фосфатами образуется модифицированная матрица, препятствующая спеканию наноразмерных частиц серебра в процессе селективного окисления этиленгликоля [5]. При этом остаточная часть фосфорного промотора покрывает тонкой пленкой частицы серебра, модифицируя их каталитические свойства [2].
Основные способы приготовления таких катализаторов представляют собой последовательную пропитку пористого силикагеля соединениями серебра и фосфора и золь–гель-синтез [2–6]. Последний способ удобен тем, что одновременно осуществляется одностадийный синтез пористой матрицы и введение промотора и активного компонента. Также при этом обеспечивается более эффективное взаимодействие частиц кремнезема с соединениями фосфора по сравнению со стандартной процедурой пропитки силикагеля.
Поскольку при взаимодействии силикагеля и оксидов фосфора могут образовываться смешанные соединения [5, 7–9], то возникает вопрос, может ли введение соединений фосфора и серебра повлиять на механизм золь–гель-синтеза и изменить пористую структуру приготовленного таким образом катализатора. В литературе существует достаточно большое количество работ, посвященных системам P2O5–SiO2 [7–11], но в основном они направлены на изучение структуры образующегося материала после его высокотемпературной термообработки. Так, например, в зависимости от способов синтеза и термообработки в системах P2O5–SiO2 были идентифицированы фосфаты кремния, обладающие различной структурой [7, 8]. Однако вопрос о том, как соединения фосфора могут повлиять на процессы агрегации частиц кремнезема в золях при приготовлении таких систем, не обсуждался.
Поэтому целью данной работы являлось изучение кинетических закономерностей формирования силикатных материалов с добавками соединений фосфора и серебра с помощью метода малоуглового рентгеновского рассеяния (МУРР) in situ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
В качестве исходных реагентов для получения силикатных, силикатно-фосфатных и силикатно-фосфатно-серебряных материалов использовали тетраэтоксилан (ТЭОС, ”ос. ч.”), фосфорную кислоту (“ос. ч.”) и нитрат серебра (”х. ч.”). Растворителем служил этанол (”х. ч.”), а катализатором гидролиза выступала либо азотная кислота (68%, ”х. ч.”), либо фосфорная кислота (74%), либо их смесь.
Синтез образцов
Золь получали последовательным смешением реагентов. Образец 1 получали путем смешения ТЭОС, водно-спиртовой смеси и азотной кислоты, образец 2 – смешением ТЭОС, водно-спиртовой смеси и фосфорной кислоты. При синтезе образца 3 в реакционную смесь добавляли обе кислоты – фосфорную и азотную. Получение образца 4 отличалось от образца 3 добавлением нитрата серебра. Соотношения реагентов, использованных при синтезе образцов, указаны табл. 1. После процедуры перемешивания при 25°С в течение 180 мин проводили процесс гелеобразования в режиме термостатирования золя при температуре 50°С до образования геля. Механизм и кинетику формирования силикатно-фосфатных материалов исследовали, отбирая через определенные временные интервалы из приготовленной смеси небольшие порции золя (0.3 мл) для анализа методом МУРР.
Таблица 1.
Составы исходных реагентов для синтеза образцов 1–4
| Образец | VТЭОС, мл |
${{V}_{{{{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{5}}}}{\text{OH}}}}},$ мл |
${{V}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}},$ мл |
${{V}_{{{\text{HN}}{{{\text{O}}}_{{\text{3}}}}}}},$ мл |
${{V}_{{{{{\text{H}}}_{{\text{3}}}}{\text{P}}{{{\text{O}}}_{{\text{4}}}}}}},$ мл |
${{m}_{{{\text{AgN}}{{{\text{O}}}_{{\text{3}}}}}}},$ г |
|---|---|---|---|---|---|---|
| 1 | 113 | 101 | 26 | 20 | – | – |
| 2 | 79 | 71 | 16 | – | 9 | – |
| 3 | 262 | 235 | 45 | 47 | 35 | – |
| 4 | 122 | 110 | 21 | 22 | 18 | 3.5 |
Контроль за образованием частиц и характеризация образцов
Контроль за образованием и ростом наночастиц в золях проводили путем измерения интенсивности рентгеновского излучения при малых углах в течение всего синтеза. Первая точка отсчета соответствовала 15-й мин от момента смешения реагентов. Последующие измерения проводили через каждые 15 мин до начала потери текучести реакционной смеси.
Рентгенограммы МУРР анализируемых образцов получали на малоугловом рентгеновском дифрактометре Kristalloflex-805 (“Siemens”, Германия), в котором использовалась рентгеновская трубка, снабженная молибденовым анодом, с MoKα-излучением (λ = 0.71 Å) и линейной коллимацией по схеме Кратки. Образцы золей помещали в плоскостенные полимерные кюветы со стенками толщиной 0.1 мм. В качестве фонового рассеяния измеряли рассеяние от кюветы с водно-спиртовым растворителем. Измерения рентгенограмм МУРР проводили в интервале волновых векторов q = 0.03–0.3 Å–1 (q = 4πsin(θ)/λ, где 2θ – угол рассеяния, λ – длина волны излучения). В полученные рентгенограммы МУРР образцов вносили поправки на поглощение рентгеновского излучения, на коллимацию рентгеновского пучка [12] и на фоновое рассеяние. Радиус инерции частиц (RG) определяли по наклону малоугловой кривой в координатах ln(I(q)–q2) [13]. Также для обработки экспериментальных данных и расчета по ним распределений частиц по размерам использовали пакет программ ATSAS [14].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
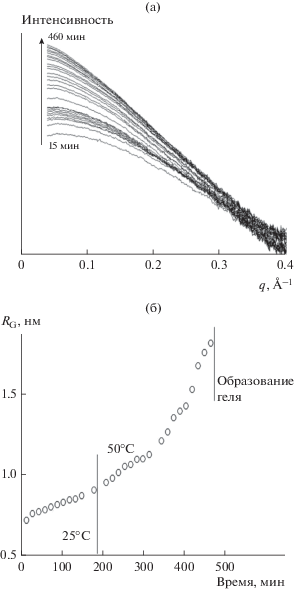
На рис. 1а в качестве примера приведены типичные кривые малоуглового рассеяния в зависимости от времени гидролиза тетраэтоксисилана (ТЭОС) в водно-этанольной среде под действием азотной кислоты. Как известно, малоугловое рассеяние происходит на неоднородностях электронной плотности нанометрового размера в гомогенной среде [13]. В нашем случае такими неоднородностями являются частицы кремнийсодержащего золя, поскольку они имеют более высокую плотность по сравнению с ТЭОС. В исходных растворах реагентов малоугловое рассеяние отсутствует, поскольку данные растворы гомогенны. Но при смешении реагентов наблюдается практически одномоментное малоугловое рассеяние, что свидетельствует о том, что наночастицы золя в системе образуются сразу после смешения реагентов. Процесс гидролиза ТЭОС в кислой среде происходит достаточно быстро [15], поэтому отследить его начало затруднительно. С помощью формулы Гинье [13] на основании полученных данных МУРР были определены величины радиусов инерции дисперсных частиц кремнезема в золе в зависимости от времени (рис. 1б). Как видно из полученных данных, частицы кремнезема даже после потери текучести обладают достаточно малыми размерами, что, впрочем, вполне согласуется с известными ранее представлениями о гелировании частиц кремнезема в кислой среде [16].
Рис. 1.
а – Спектры МУРР, полученные при различных временах гидролиза ТЭОС в водно-спиртовой среде в присутствии азотной кислоты. б – Значения радиусов инерции (RG), определенные из спектров МУРР.
Аналогичным образом были получены серии кривых МУРР при гидролизе ТЭОС в присутствии добавок H3PO4, смеси HNO3 + H3PO4 и смеси AgNO3 + HNO3 + + H3PO4 (табл. 1). Из этих данных также были определены соответствующие радиусы инерции и построены зависимости этих величин от времени синтеза (рис. 2).
Рис. 2.
Значения радиусов инерции (RG) частиц кремнезема в зависимости от продолжительности синтеза образцов 1–4 (1 – ⚫, 2 – ⚪, 3 – ◻, 4 – △) в логарифмических координатах (табл. 1).
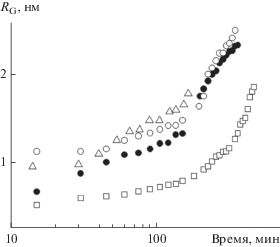
Как было установлено ранее, из временной зависимости размера частиц, наблюдаемой при укрупнении частиц, можно определить механизм, по которому и происходит этот процесс [17–19]. Обычно при этом данные описываются степенным уравнением вида R(t) ~ t1/n , где R(t) – размер частиц в зависимости от времени, t – время, за которое происходит процесс агрегации, а n – показатель, из величины которого можно определить тип механизма агрегации. Согласно [17], если n = 3–4, то это характерно для процесса оствальдовского созревания, или переконденсации. Если же n = 5–11, то это означает, что процесс старения в золе происходит по механизму коалесценции частиц. Таким образом, можно понять, каким образом происходит старение золей. Как видно из данных на рис. 2, приведенных в логарифмических координатах, в зависимости от времени наблюдается нелинейный рост величин радиусов инерции. По всей вероятности, это обусловлено некоторой полидисперсностью смесей, а также тем фактом, что радиус инерции очень чувствителен именно к крупным частицам. Поэтому для подобного анализа, вероятно, следует использовать средние размеры более узких фракций. Для этих целей из серий кривых МУРР были рассчитаны распределения частиц по размерам. Поскольку во всех случаях степень спада малоугловых кривых в дальних углах после введения коллимационной поправки соответствует I ~ q–4, то был использован сферический форм-фактор, и кривые МУРР моделировались наборами полидисперсных сфер [14].
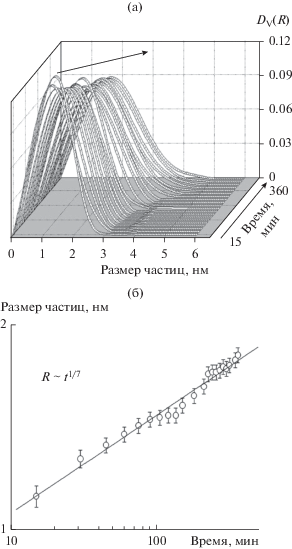
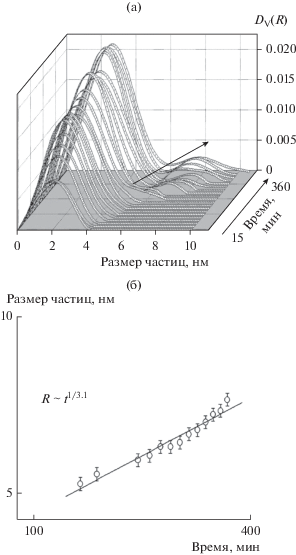
На рис. 3а приведены распределения частиц по размерам для образца 1. Видно, что гидролиз ТЭОС в присутствии азотной кислоты приводит к появлению мономодального распределения частиц по размерам, которое несколько уширяется и сдвигается в сторону бóльших размеров частиц с течением времени. На рис. 3б показана зависимость среднего размера частиц от времени и аппроксимация этих данных степенной функцией. Как видно из полученной функции R ~ t1/7.0, показатель n равен 7.0, что соответствует механизму коалесценции частиц. Вообще, при низких pH для кремнеземных золей характерна именно коалесценция частиц, приводящая к образованию трехмерной сетки из мелких частиц, тогда как в щелочной среде наблюдается более быстрый механизм агрегации частиц (оствальдовское созревание), когда мелкие частицы кремнезема растворяются и осаждаются на более крупных, укрупняя их таким образом [16].
Рис. 3.
а – Объемные распределения (DV(R)) частиц по размерам при гидролизе ТЭОС под действием азотной кислоты (образец 1). Стрелкой показан рост размеров частиц. б – Зависимость средних размеров частиц от времени в логарифмических координатах и их описание степенной функцией R ~ t1/7.0.
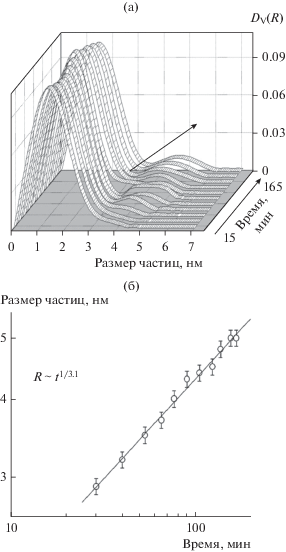
Ситуация существенно меняется при замене азотной кислоты на фосфорную. На рис. 4а показано распределение частиц по размерам для образца 2 (табл. 1). Как видно, замена кислоты не только сильно ускоряет процесс гелеобразования, но и приводит к образованию бимодального распределения частиц по размерам. При этом был проанализирован рост фракции более крупных частиц в зависимости от времени. На рис. 4б показана зависимость средних размеров частиц крупной фракции от времени с соответствующей интерполяцией данных степенной функцией. Как видно из полученной функции R ~ t1/3.1, показатель n равен 3.1, что свидетельствует о том, что рост частиц крупной фракции в данной системе обусловлен механизмом освальдовского созревания.
Рис. 4.
а – Объемные распределения (DV(R)) частиц по размерам при гидролизе ТЭОС под действием фосфорной кислоты (образец 2). Стрелкой показан рост размеров частиц более крупной фракции. б – Зависимость средних размеров частиц крупной фракции от времени в логарифмических координатах и их описание степенной функцией R ~ t1/3.1.
Этот результат несколько необычен, поскольку оствальдовское созревание для частиц кремнезема обычно наблюдается в щелочных условиях, так как для этого требуется обеспечить некоторую растворимость частиц кремнезема в среде [16]. По-видимому, изменение механизма агрегации зависит от типа используемой кислоты. Ранее было показано, что оксиды фосфора могут реагировать с кремнеземом с образованием фосфатов кремния [5, 7–9]. Поэтому можно предположить, что в присутствии фосфорной кислоты происходит растворение мелких частиц кремнезема с последующим образованием и осаждением фосфатов кремния на поверхности более крупных частиц, что и обуславливает появление более быстрого механизма агрегации (оствальдовское созревание).
В случае образца 3, когда в реакционной смеси присутствует смесь азотной и фосфорной кислот, принципиально ситуация не меняется. В полученных распределениях частиц по размерам также присутствуют две фракции частиц, но количество частиц крупной фракции существенно меньше, чем в образце 2, и сам процесс гелеобразования протекает гораздо дольше, чем для образца 2 (рис. 5а). Анализ роста фракции крупных частиц также показывает (R ~ t1/3.0), что в данном случае происходит оствальдовское созревание (рис. 5б). Вероятно, более тонкий подбор соотношения кислот H3PO4/HNO3 в системе позволит более точно регулировать соотношение между мелкими и крупными частицами (а значит, и размером пор) и механизмами их агрегации.
Рис. 5.
а – Объемные распределения (DV(R)) частиц по размерам при гидролизе ТЭОС под действием смеси азотной и фосфорной кислоты (образец 3). Стрелкой показан рост размеров частиц более крупной фракции. б – Зависимость средних размеров частиц крупной фракции от времени в логарифмических координатах и их описание степенной функцией R ~ t1/3.0.
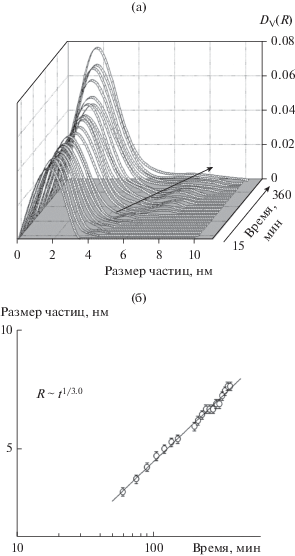
Добавление нитрата серебра в реакционную смесь, как оказалось, практически никак не влияет на механизм агрегации частиц кремнезема. Хотя введение различных солей при гелировании кремнеземных золей в некоторых случаях может ускорять агрегацию [16]. На рис. 6а показаны распределения частиц по размерам для образца 4, полученного с добавкой нитрата серебра. Время гелирования смеси для образцов 3 и 4 практически одинаково, но для образца 4 характерно несколько большее количество крупных частиц в распределениях. Рост размеров фракции крупных частиц в данном случае также описывается (R ~ t1/3.1) механизмом оствальдовского созревания (рис. 6б).
Рис. 6.
а – Объемные распределения (DV(R)) частиц по размерам при гидролизе ТЭОС под действием смеси азотной кислоты, фосфорной кислоты и нитрата серебра (образец 4). Стрелкой показан рост размеров частиц более крупной фракции. б – Зависимость средних размеров частиц крупной фракции от времени в логарифмических координатах и их описание степенной функцией R ~ t1/3.1.
Таким образом, показана ключевая роль фосфорной кислоты при регулировании механизмами агрегации кремнеземных золей. За счет образования фосфатов кремния можно управлять скоростью и механизмом агрегации частиц, а следовательно, и пористой структурой материала, получаемого после просушки и прокаливания гелей. Вероятно, похожих результатов можно достичь также введением в смесь плавиковой кислоты или фторидов, поскольку для смены механизма агрегации необходимо обеспечить возможность растворения частиц кремнезема в кислой среде.
ЗАКЛЮЧЕНИЕ
Методом МУРР in situ проведено исследование кинетики формирования силикатных, силикатно-фосфатных и силикатно-фосфатно-серебряных золь–гель-материалов. В зависимости от условий синтеза формируются структуры гелей, состоящие из частиц кремнезема с размерами от 2 до 8 нм. В присутствии азотной кислоты образуется золь с мономодальным распределением наночастиц кремнезема с размерами 2–3 нм. Добавка фосфорной кислоты вместо азотной приводит к появлению дополнительной фракции более крупных частиц с размерами от 4 до 8 нм. Введение нитрата серебра в систему не влияет ни на размеры полученных частиц кремнезема, ни на механизм агрегации частиц в процессе золь–гель-синтеза. Показано, что при проведении золь–гель-синтеза в присутствии азотной кислоты происходит агрегация частиц кремнезема по механизму кластер-кластерной агрегации, тогда как введение в состав смеси фосфорной кислоты приводит к смене механизма агрегации на оствальдовское созревание. Выдвинуто предположение о роли фосфорной кислоты при смене механизма агрегации кремнеземных золей за счет возможного перерастворения мелких частиц кремнезема с образованием фосфатов кремния.
Список литературы
Salaev M.A., Krejker A.A., Magaev O.V., Malkov V.S., Knyazev A.S., Borisova E.S., Khanaev V.M., Vodyankina O.V., Kurina L.N. // Chem. Eng. J. 2011. V. 172. P. 399.
Magaev O.V., Knyazev A.S., Vodyankina O.V., Dorofeeva N.V., Salanov A.N., Boronin A.I. // Appl. Catal. A. 2008. V. 344. P. 142.
Мамонтов Г.В., Изаак Т.И., Магаев О.В., Князев А.С., Водянкина О.В. // Журн. физ. химии 2011. Т. 85. № 9. С. 1657.
Mamontov G.V., Magaev O.V., Knyazev A.S., Vodyankina O.V. // Catal. Today. 2013. V. 203. P. 122.
Epiphanova A.A., Magaev O.V., Vodyankina O.V. // J. Sol–Gel Sci. Technol. 2012. V. 61. P. 509.
Мамонтов Г.В., Князев А.С., Паукштис Е.А., Водянкина О.В. // Кинетика и катализ 2013. Т. 54. № 6. С. 776.
Elisa M., Sava B.A., Volceanov A., Monteiro R.C.C., Alves E., Franco N., Costa Oliveira F.A., Fernandes H., Ferro M.C. // J. Non-Cryst. Solids. 2010. V. 356. P. 495.
Boigelot R., Graz Y., Bourgel C., Defoort F., Poirier J. // Ceram. Int. 2015. V. 41. P. 2353.
Li W., Xie F., Hua D., Zhang C., Dai C., Yu Z., Qi M., Yu S. // Front. Chem. Sci. Eng. 2011. V. 5. P. 314.
Sava B.A., Elisa M., Vasiliu I.C., Nastase F., Simon S. // J. Non-Cryst. Solids. 2012. V. 358. P. 2877.
Kamimura Y., Kurumada K. // J. Non-Cryst. Solids. 2009. V. 355. P. 1693.
Svergun D.I. // J. Appl. Cryst. 1992. V. 25. P. 495.
Свергун Д.И., Фейгин Л.А. Рентгеновское и нейтронное малоугловое рассеяние. М.: Наука, 1986. С. 280.
Konarev P.V., Petoukhov M.V., Volkov V.V., Svergun D.I. // J. Appl. Cryst. 2006. V. 39. P. 277.
Boukari H., Lin J.S., Harris M.T. // J. Colloid Interf. Sci. 1997. V. 194. P. 311.
Айлер Р. Химия кремнезема М.: Мир, 1982. Ч. 1 и 2.
Zhdanov V.P. // Surf. Rev. Lett. 2008. V. 15. № 3. P. 217.
Lifshitz I.M., Slyozov V.V. // J. Phys. Chem. Solids. 1961. V. 19. P. 35.
Wynblatt P., Gjostein N.A. // Prog. Solid State Chem. 1975. V. 9. P. 21.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ


