Кинетика и катализ, 2019, T. 60, № 4, стр. 509-519
Разработка, синтез и исследование наноматериалов оксида титана, допированного цирконием, для селективного гидрирования 2-метил-3-бутин-2-ола в микрокапиллярном реакторе
Л. Б. Охлопкова a, *, М. А. Керженцев a, З. Р. Исмагилов a, b
a ФГБУН “Федеральный исследовательский центр “Институт катализа им. Г.К. Борескова СО РАН”
630090 Новосибирск, просп. акад. Лаврентьева, 5, Россия
b Федеральный исследовательский центр угля и углехимии СО РАН
650000 Кемерово, просп. Советский, 18, Россия
* E-mail: mila65@catalysis.ru
Поступила в редакцию 19.11.2018
После доработки 05.02.2019
Принята к публикации 14.03.2019
Аннотация
Упорядоченная мезопористая титано-циркониевая матрица TixZr1–xO2 для введения каталитических наночастиц была синтезирована методом самосборки с использованием изопропоксида титана и оксихлорида циркония в качестве предшественников и амфильного триблок-сополимера F127 в качестве темплата. Процесс самосборки протекает без добавления кислоты, что необходимо для сохранения морфологии и структуры каталитических наночастиц. При регулировании начальных молярных соотношений сополимера к прекурсорам металлов нанокомпозиты титана-циркония с контролируемой текстурой и составом были получены в широком диапазоне: от 15 до 80 мол. % TiO2. Структурные и фазовые свойства композитов исследованы методами рентгеновской дифракции, низкотемпературной адсорбции азота и просвечивающей электронной микроскопии. Композиты обладают упорядоченной мезопористой структурой пор, высокой удельной поверхностью, большим объемом пор и равномерным распределением пор по размерам. Каталитические покрытия 1 вес. % Pd–Zn/TixZr1 – xO2 (x = 1.0, 0.8, 0.5) на внутренней поверхности капиллярного реактора были приготовлены методом погружения с использованием коллоидного раствора наночастиц Pd–Zn. Разработанные каталитические покрытия на основе титано-циркониевых композитов проявляют высокую активность и селективность (>96%) в гидрировании 2-метил-3-бутин-2-ола.
ВВЕДЕНИЕ
Мировой технический прогресс привел к появлению серьезных глобальных проблем в области охраны природы в виде ухудшения экологической обстановки. Для их решения в настоящее время ведутся работы по разработке экологически безопасных и эффективных процессов. В этом контексте ключевой технологией являются процессы с использованием микроструктурированных реакторов. Микрореактор, в котором катализатор находится на его стенках, обеспечивает отношение поверхности к объему на несколько порядков больше, чем периодические реакторы, что способствует лучшей передаче тепла и массы [1, 2]. В микрореакторах реакции протекают в кинетическом режиме, что приводит к росту селективности образования продукта, в то время как ламинарный поток позволяет точно контролировать время контакта [3, 4]. Кроме того, непрерывная работа микрореакторов позволяет проводить простую и быструю оптимизацию процесса, что способствует снижению затрат [5]. Для создания высокоэффективных капиллярных реакторов разрабатываются воспроизводимые методы осаждения каталитического пористого покрытия [6, 7]. Мультикристаллические оксидные покрытия обладают повышенной механической прочностью и термической устойчивостью по сравнению с покрытиями на основе диоксида титана [8]. Смешанные оксиды TiO2–ZrO2 широко используются в качестве катализаторов и носителей с металлами, неметаллами и оксидами металлов для различных каталитических реакций, а именно: дегидрирование, окисление, гидрирование, гидропереработка, удаление NOx и фотокаталитическое окисление летучих органических соединений [9]. Такие усовершенствованные смешанные оксиды титана и циркония не только сочетают в себе преимущества TiO2 (активный катализатор и носитель) и кислотно-оснóвные свойства ZrO2, но также расширяют их применение посредством создания новых каталитических центров благодаря сильному взаимодействию металл–носитель. Наиболее часто используемые методы получения смешанных оксидов TiO2–ZrO2 – соосаждение и золь–гель-метод. Одним из существенных достоинств золь–гель-метода является тот факт, что многокомпонентные однофазные оксиды металлов могут образовываться при относительно низких температурах по сравнению с твердофазной реакцией [10]. Композиты TiO2–ZrO2 обладают большой удельной поверхностью, сильно выраженными кислотно-оснóвными свойствами поверхности, высокими термостойкостью и механической прочностью [11–13]. В последние годы был получен ряд структурированных материалов путем сочетания золь–гель-метода с поверхностно-активными веществами (ПАВ). Молекулы амфифильного поверхностно-активного вещества самоорганизуются в различные структуры. Процесс самосборки (EISA) включает в себя естественную и самопроизвольную способность поверхностно-активных веществ организовывать себя в различные формы за счет водородных связей и π–π-взаимодействий, а также электростатических и Ван-дер-Ваальсовых сил. Кооперативное зародышеобразование и агрегация приводят к формированию органическо-неорганической гибридной структуры. Удаление молекул ПАВ ведет к образованию мезопористого материала. Процесс EISA был разработан для получения тонких пленок структурированного диоксида кремния и впервые предложен в работах Brinker [14, 15] и Stucky [16]. За последнее десятилетие основные усилия были сосредоточены на синтезе упорядоченных мезопористых композитов TiO2–ZrO2 для применения в фотокатализе [17–21]. В настоящее время актуальной остается задача получения каталитических мезопористых покрытий на основе смешанных TiO2–ZrO2-оксидов со встроенным активным компонентом для селективного гидрирования ацетиленового спирта. Такая мезопористая структура с большой удельной поверхностью и связанными порами улучшает свойства катализатора, так как обеспечивает доступ реагентов и продуктов реакции к активному компоненту. Введение оксида циркония в матрицу диоксида титана способствует сохранению упорядоченной мезопористой структуры диоксида титана [22]. В этом случае частицы активного компонента заключены в мезопористом пространстве наноструктурированного носителя, что ограничивает их рост в ходе каталитической реакции и, следовательно, повышает стабильность работы катализатора. Чтобы предотвратить растворение наночастиц металла, синтез таких покрытий должен быть осуществлен при низкой кислотности золя.
Настоящая работа посвящена синтезу и изучению физико-химических свойств мезопористых титано-циркониевых композитов, а также каталитических покрытий на их основе. Титано-циркониевые композиты с различными соотношениями Ti : Zr были получены методом EISA без добавления кислоты c использованием амфифильного триблок-сополимера Плуроник F127 в качестве структурообразующей добавки. Каталитические свойства покрытий на основе TixZr1 – xO2 (x = 1.0, 0.8, 0.5) с внедренными Pd–Zn-наночастицами были исследованы в селективном гидрировании 2-метил-3-бутин-2-ола (МБИ).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез TixZr1-xO2-композитов
Для синтеза были использованы Pluronic F127 (Mср = 12600, EO106PO70EO106) (“Sigma-Aldrich Chemical Inc.”), оксихлорид циркония (ZrOCl2 ⋅ 8H2O) (“Вектон”), тетраизопропоксид титана (Ti[CH3(CH2)3O]4) (“Acros”), метанол (99.8%) и этанол (99.9%) (“Baker”). Мезопористые композиты TiO2–ZrO2 были синтезированы золь–гель-методом в присутствии темплата. Молярное отношение реагентов составило Pluronic F127 : [(CH3)2O]4Ti : ZrOCl2 ⋅ 8H2O : спирт = = 0.0112 : 0–1 : 1–0 : 34. Pluronic F127 массой 0.85 г растворяли в 12 мл смеси этанола и метанола (объемное отношение 1 : 1) при комнатной температуре. Ti[CH3(CH2)3O]4 и ZrOCl2 ⋅ 8H2O добавляли в раствор (общее количество Ti + Zr составляло 6 ммоль) при интенсивном перемешивании. После перемешивания в течение 2 ч при комнатной температуре однородный золь переносили в печь для испарения растворителя. После двух дней старения при 303 K и относительной влажности (RH) 50% гель сушили при 373 K в течение 1 дня. Затем медленно повышали температуру от комнатной до 673 К (скорость нагрева 1 К/мин) и прокаливали при 673 К в течение 2 ч на воздухе. Высокотемпературную обработку (873, 1073 К) проводили на воздухе в течение 1 ч при скорости нагрева 5 К/мин.
Синтез Pd–Zn/TixZr1–xO2-покрытий
Мезопористые пленки, допированные наночастицами, получали одностадийным синтезом с использованием раствора предшественника согласно методике, описанной в работе [23]. Коллоидный раствор Pd–Zn-наночастиц (мольное отношение Pd : Zn = 1 : 1), стабилизированых поливинилпирролидоном (Mср = 58 000, “Acros”), был приготовлен восстановлением солей Pd(CH3COO)2 (46.5% Pd, “Аурат”) и ZnCl2 (98%) в растворе этиленгликоля [24]. Катализаторы Pd–Zn/TiO2, Pd–Zn/Ti0.8Zr0.2O2 и Pd–Zn/Ti0.5Zr0.5O2 синтезировали в виде порошка и пленок на внутренней поверхности капилляра. Вес каталитических пленок Pd–Zn/TiO2, Pd–Zn/Ti0.8Zr0.2O2 и Pd–Zn/Ti0.5Zr0.5O2 составлял 1.95, 3.85 и 6.50 мг соответственно.
Исследование физико-химических свойств TixZr1 – xO2-композитов и Pd–Zn/TixZr1 – xO2-катализаторов
Фазовый состав образцов изучали методом рентгеновского фазового анализа (РФА). Порошковые рентгенограммы регистрировали на дифрактометре HZG-4C (“Freiberger Prazisionmechanik”, Германия) с применением излучения CoKα в диапазоне 4° < 2θ < 50° с скоростью счетчика 1°/мин. Микрофотографии просвечивающей электронной микроскопии (ПЭМ) получали на приборе JEM-2010 (“JEOL ”, Япония), работающем при 200 кВ с разрешением 0.14 нм. Изотермы адсорбции и десорбции азота при 78 K измеряли с помощью анализатора ASAP 2400 (“Micromeritics”, США). Удельную поверхность рассчитывали методом Брунауэра–Эммета–Теллера (БЭТ). Значения объема пор и распределение пор по размерам были получены с использованием модели Барретта–Джойнера–Халенды (BJH) из десорбционной ветви изотерм. Содержание Pd, Zn, Ti и Zr в порошковых катализаторах находили методом рентгеновской флуоресцентной спектроскопии (РФС) на анализаторе VRA-30 (“ThermoFisher Scientific”, Швейцария) с Cr-анодом рентгеновской трубки. Содержание катализатора в микрокапиллярном реакторе определяли методом атомно-эмиссионной спектроскопии с индуктивно связанной плазмой (АЭС-ИСП) на приборе OPTIMA 4300 DV (“Perkin Elmer”, США). Термогравиметрический анализ (ТГ) и дифференциальный термический анализ (ДТА) осуществляли на дериватографе Q-1500 (“MOM Budapest”, Венгрия). Измерения проводили со скоростью нагрева 10 К/мин от 293 до 873 К в атмосфере воздуха.
Каталитические испытания
Катализатор в микрокапиллярном реакторе предварительно восстанавливали in situ в токе водорода (2 мл/мин) при температуре 573 К в течение 2 ч. Описание оборудования для проведения реакции в микрокапиллярном реакторе и методика эксперимента приведены в работе [25]. Капилляр помещали в термостатированную печь при температуре 313 К. Водород и раствор МБИ или 2-метил-3-бутен-2-ол (МБЕ) в метаноле подавали в Т-образный смеситель, внутренние диаметры входной и выходной трубок были равны 250 мкм до капилляра. Скорость потока изменяли от 5 до 100 мкл/мин, поток газа составлял 6 мл/мин. Пробы (3–5 шт.) отбирали после достижения системой устойчивого состояния в течение 20 мин, разбавляли метанолом (5 : 1) и анализировали с использованием газового хроматографа Кристалл 2000М (“Хроматэк”, Россия), снабженного капиллярной колонкой с неподвижной фазой СКТФТ – 50Х, диаметром 0.22 мм, длиной 30 м (ИК СО РАН, Россия) и пламенно-ионизационным детектором. Углеродный баланс для этих систем составлял 100 ± 2%, т.е. основными продуктами были 2-метил-3-бутин-2-ол (МБИ), 2-метил-3-бутен-2-ол (МБЕ) и 2-метил-2-бутанол (МБА). Конверсию (x), селективность по МБЕ реакции (SМБЕ), выход продукта (Y), производительность реактора (Q), производительность катализатора (А) рассчитывали следующим образом:
Для расчета кинетических параметров применяли программное обеспечение Матлаб. Систему дифференциальных уравнений решали с помощью функции ode45, минимизацию суммы квадратов между экспериментальными и расчетными концентрациями на выходе из реактора выполняли при использовании функции fminsearch.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
TixZr1–xO2-композиты
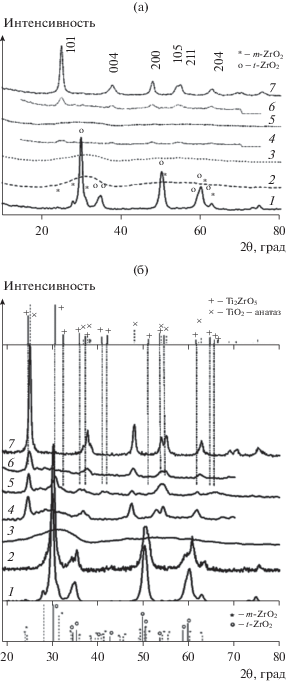
При варьировании мольного отношения TixZr1 – xO2 (x = 0, 0.15, 0.30, 0.50, 0.70, 0.8, 1) был приготовлен ряд образцов. Согласно данным РФА для образцов TixZr1 – xO2 (x = 0, 0.15, 0.30, 0.70) в области малых углов наблюдается пик в районе 1.63°, что указывает на упорядоченную структуру пор с небольшой протяженностью (рис. 1). В области больших углов в спектрах чистого TiO2 и Ti0.80Zr0.20O2 присутствуют пики фазы анатаза (JCPDS 21−1272) (рис. 2). В работе [26] было предположено, что ZrO2 может диффундировать в матрицу TiO2, и в таком случае дифракция диоксида циркония не наблюдается. Увеличение содержания Zr ингибирует кристаллизацию, так как образцы Ti0.15Zr0.85O2, Ti0.30Zr0.70O2, Ti0.50Zr0.50O2, Ti0.70Zr0.30O2 находятся в аморфном состоянии. Это явление, вероятно, связано с наличием Ti−O−Zr-связей в межблочных границах, которые препятствуют росту кристаллов оксида [27]. Орторомбическая фаза ZrO2 (JCPDS 34–1084) и моноклинная фаза ZrO2 в следовых количествах (JCPDS 37–1484) образуются после прокаливания образца Ti0.15Zr0.85O2 при 873 К. Кристаллизация бинарных оксидов протекает при более высоких температурах. На рентгенограммах в области больших углов образцы Ti0.70Zr0.30O2 и Ti0.50Zr0.50O2 после обработки при 873 К имеются рефлексы, относящиеся к фазе анатаза (JCPDS 21−1272) и Ti2Zr2O6 (JCPDS 46–1265). После прокаливания образца Ti0.30Zr0.70O2 при 1073 К стенки пор кристаллизуются до ZrTiO4 (JCPDS 34−0415), что согласуется с литературными данными [28].
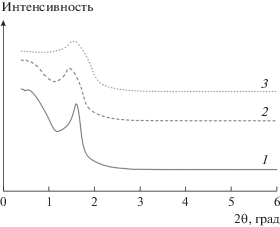
Рис. 1.
Дифрактограммы в области малых углов композитов TiO2–ZrO2 с различными отношениями Ti : Zr, прокаленных при 673 (a) и 873 К (б): 1 – Ti0.15Zr0.85O2; 2 – Ti0.30Zr0.70O2; 3 – Ti0.70Zr0.30O2.
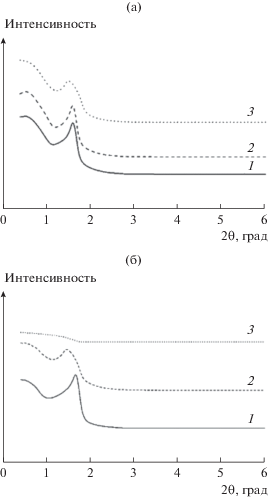
Рис. 2.
Дифрактограммы композитов TiO2–ZrO2 с различными отношениями Ti : Zr, прокаленных при 673 (a) и 873 К (б): 1 – ZrO2; 2 – Ti0.15Zr0.85O2; 3 – Ti0.30Zr0.70O2; 4 – Ti0.50Zr0.50O2; 5 – Ti0.70Zr0.30O2; 6 – Ti0.80Zr0.20O2; 7 – TiO2.
После обработки при 873 К мезопористая структура образца Ti0.70Zr0.30O2 разрушается, в то время как мезопористые структуры образцов с повышенным содержанием Zr сохраняются (Ti0.30Zr0.70O2 и Ti0.15Zr0.85O2) (рис. 1б). С ростом температуры до 873 К пики в спектрах в области больших углов становятся ýже и интенсивнее (рис. 2б). Размер кристаллитов образца Ti0.8Zr0.2O2 незначительно увеличивается от 9 до 15 нм. Для Ti0.15Zr0.85O2, Ti0.50Zr0.50O2 и Ti0.70Zr0.30O2 диаметр кристаллитов возрастает от 1.4 до 17 нм, от 1.2 до 15 нм и от 1.2 до 17 нм соответственно. В случае Ti0.30Zr0.70O2 это изменение проявляется в меньшей степени − размер частиц, рассчитанный по уравнению Шеррера, повышается от 1.3 до 1.5 нм. После прокаливания при 1073 К стенки пор Ti0.30Zr0.70O2 кристаллизуются до ZrTiO4, диаметр кристаллитов увеличивается до 25 нм. Очевидно, что рост кристаллитов приводит к разрушению мезопористой структуры (рис. 3).
Рис. 3.
Дифрактограммы в области малых углов композита Ti0.30Zr0.70O2, прокаленного при 673 (1), 873 (2) и 1073 К (3).
На электронномикрографических снимках образца Ti0.30Zr0.70O2 в виде пленки, прокаленного при 673 К, наблюдаются участки с упорядоченной структурой пор (рис. 4). Открытая и регулярная структура пор обеспечивает доступ реагентов к активному компоненту. Параметр ячейки равен 9 нм. Стенки ячейки находятся в аморфном состоянии и их толщина составляет около 5 нм.
Рис. 4.
Электронно-микрографический снимок Ti0.30Zr0.70O2, прокаленного при 673 К. На вставке – снимок высокого разрешения.

Изотермы низкотемпературной адсорбции азота смешанного композита TiO2–ZrO2 с различными соотношениями Ti : Zr имеют форму IV типа по классификции Брунауэра с резким подъемом в области Р/Р0 = 0.4–0.8, что свидетельствует об узком распределении пор по размерам (рис. 5а). Наблюдаются гистерезисные петли типа H1, что предполагает однородную цилиндрическую геометрию пор. Смешанные композиты обладают высокой удельной поверхностью − 116−185 м2/г (табл. 1). Размеры пор, рассчитанные по данным десорбции азота с использованием BJH-модели, находятся в диапазоне 3.6−3.8 нм (табл. 1) и не зависят от отношения Ti : Zr. Однако при увеличении Ti : Zr распределение пор по размерам становится шире (рис. 5б), что указывает на снижение степени их упорядоченности. Рассчитанная толщина стенки пор составляет ~5.3 нм, что согласуется с данными ПЭМ.
Рис. 5.
Изотермы низкотемпературной адсорбции азота (а) и распределение пор по размерам, вычисленное из десорбционной ветви изотермы (б): 1 – ZrO2; 2 – Ti0.15Zr0.85O2; 3 – Ti0.30Zr0.70O2; 4 – Ti0.50Zr0.50O2; 5 – Ti0.70Zr0.30O2; 6 – Ti0.80Zr0.20O2; 7 – TiO2.
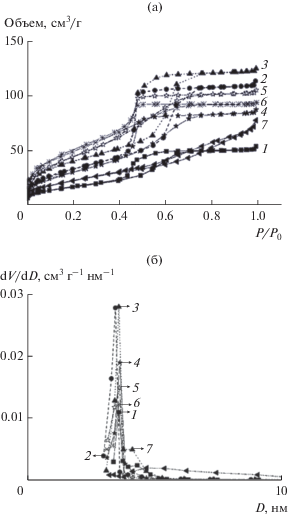
Таблица 1.
Физико-химические свойства мезопористых композиций TiO2–ZrO2, полученных при варьировании соотношения Ti : Zr и температуры прокаливания
| Образец | Температура прокаливания, К | Удельная поверхность, м2/г | Размер пор, нм | Объем пор, см3/г |
|---|---|---|---|---|
| TiO2 | 673 | 81.6 | 7.3 | 0.098 |
| Ti0.80Zr0.20O2 | 673 | 185.5 | 3.6 | 0.084 |
| Ti0.70Zr0.30O2 | 673 | 156.9 | 3.7 | 0.132 |
| Ti0.50Zr0.5O2 | 673 | 116.2 | 3.8 | 0.136 |
| Ti0.30Zr0.70O2 | 673 | 150.4 | 3.8 | 0.208 |
| Ti0.30Zr0.70O2 | 873 | 103.2 | 3.7 | 0.162 |
| Ti0.30Zr0.70O2 | 1073 | 79.5 | 5.1 | 0.152 |
| Ti0.15Zr0.85O2 | 673 | 126.0 | 3.6 | 0.187 |
| ZrO2 | 673 | 65.2 | 4.9 | 0.094 |
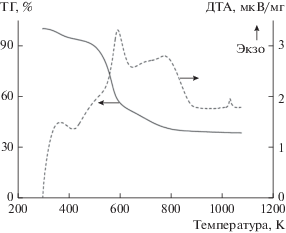
Кривые термического анализа (ТГ-ДТА) образца Ti0.30Zr0.70O2 при разложении в атмосфере воздуха приведены на рис. 6. Максимум на кривой ТГ наблюдается при 567 К, потеря веса составляет около 50 мас. %. В области температур от 473 до 673 К протекает разложение амфифильного триблоксополимера Pluronic F127 и удаляется вода − как адсорбированная, так и из гидроксида Ti–Zr. Экзотермический эффект при 573 К на кривой ДТА относится к разложению F127 и обезвоживанию гидроксида Ti–Zr. Экзотермический эффект при 993 К соответствует кристаллизации фазы ZrTiO4, что приводит к разрушению мезопористой структуры образца Ti0.30Zr0.70O2.
Pd–Zn/TixZr1 – xO2-покрытия
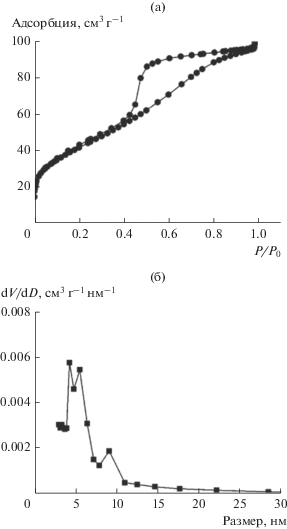
Микрофотографии образца Pd–Zn/Ti0.8Zr0.2O2 в виде порошка, восстановленного при 573, представлены на рис. 7. Образец имеет однородную аморфную “червеобразную” структуру с размером пор 5−6 нм, что согласуется с данными низкотемпературной адсорбции азота (рис. 8). На снимках высокого разрешения (рис. 8а) видны Pd–Zn-наночастицы (НЧ), повторяющие структуру пор носителя (рис. 4), со средним диаметром 3.7 нм. Полученное значение соответствует диаметру пор исходной матрицы. При введении активного компонента в матрицу Ti0.8Zr0.2O2 формируется пористая система с бóльшим размером пор (5.2 вместо 3.6 нм для носителя). Поэтому можно предположить, что наночастицы активного компонента расположены внутри пор носителя. Для образцов на основе чистого оксида титана размер частиц TiO2 после восстановления при 573 К составляет 6.5 нм по данным ПЭМ [20]. При добавлении оксида циркония в матрицу носителя удельная поверхность и объем пор увеличиваются с 85 до 143 м2/г и от 0.10 до 0.18 см3/г соответственно. Стенки пор носителя удерживают внедренные НЧ, уменьшая их миграцию по поверхности носителя. Частичное разрушение мезопористой структуры недопированной матрицы приводит к спеканию и агломерации НЧ. Таким образом, в образцах на основе смешанного оксида наночастицы активного компонента спекаются в меньшей степени.
Рис. 7.
Микроснимки ПЭМ (а, б) и гистограммы распределения частиц по размеру (в) порошкообразного катализатора Pd–Zn/Ti0.8Zr0.2O2, восстановленного при 573 К.

Рис. 8.
Изотермы адсорбции азота (а) и распределение пор по размерам (б) порошкообразного катализатора Pd–Zn/Ti0.8Zr0.2O2, восстановленного при 573 К.
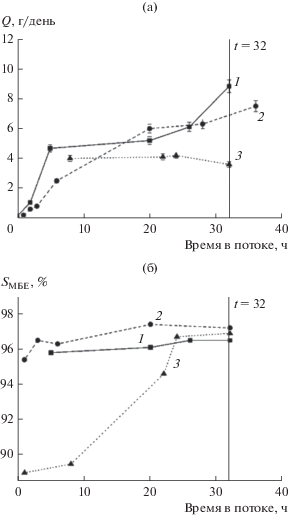
Было проведено сравнительное исследование каталитических свойств покрытий Pd–Zn/TixZr1 – xO2 (x = 1.0, 0.8 и 0.5) в реакции гидрирования МБИ. В опубликованных ранее работах [23, 25] нами было показано, что активность и селективность реакции гидрирования МБИ на покрытиях Pd–Zn/TiO2 возрастают с увеличением времени реакции в результате удаления углеродистых отложений. Аналогичные закономерности получены и для титан-циркониевых покрытий (рис. 9). При увеличении времени реакции от 1 до 32 ч производительность реактора повышается от 0.8 до 8.6 г/день для катализаторов Pd–Zn/Ti0.8Zr0.2O2 и от 1.6 до 4.5 г/день для Pd–Zn/TiO2. Селективность образования МБЕ также растет от 95.4 до 97.2% для Pd–Zn/Ti0.8Zr0.2O2 и от 89.0 до 96.9% для Pd–Zn/TiO2.
Рис. 9.
Влияние времени нахождения в потоке на производительность реактора (а) и селективность (б) в реакции гидрирования МБИ на пленках Pd–Zn/ Ti0.5Zr0.5O2 (1), Pd–Zn/Ti0.8Zr0.2O2 (2) и Pd–Zn/TiO2 (3). Условия реакции: СМБИ, 0 = 1.0–2.0 моль/л, скорость потока газа 6.0 мл/мин, ${{P}_{{{{{\text{H}}}_{2}}}}}$ = 1 атм, Т = 313 К.
Производительность реактора после 32 ч непрерывного потока раствора МБИ в метаноле и водорода возрастает в ряду Pd–Zn/TiO2 < < Pd–Zn/Ti0.8Zr0.2O2 < Pd–Zn/Ti0.5Zr0.5O2, а селективность и производительность катализаторов практически не зависят от их состава (табл. 2). Вес каталитического покрытия на внутренней поверхности капилляра увеличивается в том же ряду при повышении мольного отношения Zr : Ti, что обусловлено образованием более вязкого золя и утолщением каталитического слоя. Таким образом, высокая производительность реактора обусловлена большей загрузкой катализатора.
Таблица 2.
Влияние состава катализатора и времени непрерывного потока на производительность реактора и селективность в гидрировании 2-метил-3-бутин-2-ола
| Образец | Qt= 32, гМБЕ/день |
At= 32, гМБЕ с–1${\text{г }}_{{{\text{Pd}}}}^{{ - 1}}$ |
Sx =97, % |
|---|---|---|---|
| Pd–Zn/TiO2 | 4.51 | 1.5 | 96.9 |
| Pd–Zn/Ti0.8Zr0.2O2 | 8.62 | 1.9 | 97.2 |
| Pd–Zn/Ti0.5Zr0.5O2 | 11.02 | 1.6 | 96.5 |
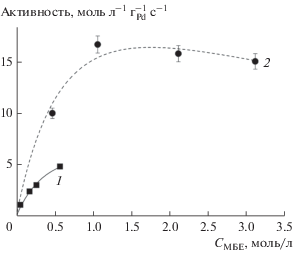
На рис. 10 для сравнения представлены кинетические зависимости концентраций исходного реагента и продуктов реакции гидрирования МБИ от времени контакта на покрытиях Pd–Zn/TiO2 и Pd–Zn/Ti0.8Zr0.2O2 после 32 и 20 ч нахождения в потоке соответственно. При этих условиях селективность по МБЕ была максимальной (рис. 9). Времена контакта рассчитаны из значений скорости потока жидкости с применением уравнения Локхарда–Мартинелли–Чисхолма в предположении, что в условиях эксперимента был реализован кольцевой двухфазный поток [29]. При добавлении Zr в матрицу носителя скорость реакции гидрирования МБЕ увеличивается (рис. 10в и 10г). В табл. 3 приведены кинетические параметры реакции, вычисленные из кинетических зависимостей, приведенных на рис. 10а и 10в и на рис. 11. Для нахождения константы адсорбции KМБЕ было изучено влияние концентрации МБЕ в диапазоне 0.1–3.1 моль/л на начальную скорость реакции. Кинетические параметры рассчитывали по модели Лэнгмюра–Хиншельвуда согласно методологии, описанной ранее в работе [18]. Наблюдаемое повышение скорости гидрирования МБЕ для катализаторов на основе смешанных оксидов можно объяснить снижением отношения констант адсорбции KМБА/KМБИ и увеличением констант скорости гидрирования МБЕ $k_{2}^{'}.$ Хотя константа адсорбции алкина и уменьшалась при добавлении циркония, ее значение в 60 раз превышало значение константы адсорбции алкена. Константа скорости прямого гидрирования МБИ до МБА $k_{3}^{'}$ была меньше для титан-циркониевого катализатора. Низкие значения KМБЕ/KМБИ и $k_{3}^{'}$ обусловили высокую селективность покрытия Pd–Zn/Ti0.8Zr0.8O2 при конверсии 97%.
Рис. 10.
Зависимости концентраций МБИ (1, ◼), продуктов МБЕ (2, ⚫) и МБА (3, ▲) от времени контакта на пленках Pd–Zn/TiO2 после 32 ч потока (а) и Pd–Zn/Ti0.8Zr0.2O2 после 20 ч потока (в); зависимости скорости реакций от времени контакта на пленках на пленках Pd–Zn/TiO2 после 32 ч потока (б) и Pd–Zn/Ti0.8Zr0.2O2 после 20 ч потока (г). Условия реакции: ${{\text{v}}_{{\text{r}}}}$ = 6.0 мл/мин, ${{P}_{{{{{\text{H}}}_{2}}}}}$ = 1 атм, Т = 313 К.
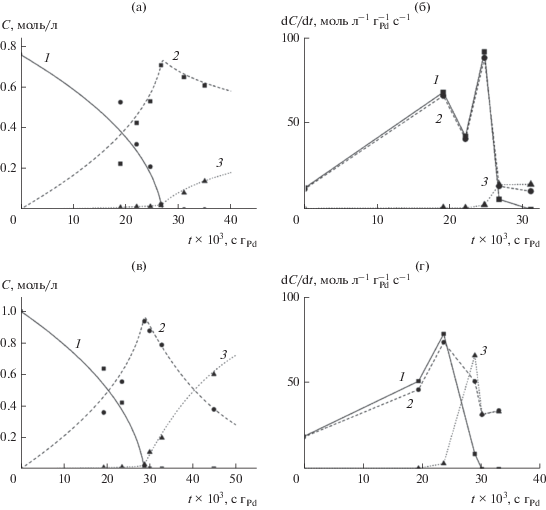
Таблица 3.
Кинетические параметры реакции гидрирования МБИ на покрытиях Pd–Zn/TixZr1 – xO2
| Параметр | Pd–Zn/TiO21 | Pd–Zn/Ti0.8Zr0.2O22 |
|---|---|---|
| $k_{1}^{'},$ моль ${\text{г }}_{{{\text{Pd}}}}^{{ - 1}}$ c–1 | 714 | 750 |
| $k_{2}^{'},$ моль ${\text{г }}_{{{\text{Pd}}}}^{{ - 1}}$ c–1 | 132 | 230 |
| $k_{3}^{'},$ моль ${\text{г }}_{{{\text{Pd}}}}^{{ - 1}}$ c–1 | 20 | 10 |
| KМБИ, л/моль | 61 | 38 |
| KМБЕ3 | 0.84 | 0.62 |
| KМБА | 8 | 0.5 |
| KМБЕ/KМБИ | 0.013 | 0.016 |
| KМБА/KМБЕ | 10 | 0.8 |
| KМБА/KМБИ | 0.13 | 1.3 × 10–2 |
| Макс. отклонение, % | 20 | 14 |
1 Условия реакции: ${{\text{v}}_{{\text{r}}}}$ = 6.0 мл/мин, ${{P}_{{{{{\text{H}}}_{2}}}}}$ = 1 атм, Т = 313 К, Pd–Zn/TiO2 после 32 ч потока. 2Условия реакции: ${{\text{v}}_{{\text{r}}}}$ = 6.0 мл/мин, ${{P}_{{{{{\text{H}}}_{2}}}}}$ = 1 атм, Т = 313 К, Pd–Zn/Ti0.8Zr0.2O2 после 20 ч потока. 3Фиксированное значение. 4Вычислено из зависимости активности Pd–Zn/TixZr1 – xO2 от концентрации МБЕ.
ЗАКЛЮЧЕНИЕ
В настоящей работе было показано, что упорядоченные мезопористые титано-циркониевые композиты с использованием изопропоксида титана и оксихлорида циркония в качестве предшественников оксида титана и оксида циркония и триблок-сополимера F127 в качестве темплата могут быть получены методом самосборки. В большинстве случаев для процесса EISA при синтезе мезопористых оксидных материалов необходимо добавление кислоты для замедления реакции гидролиза–конденсации предшественников металлов. В нашем случае для регулирования скорости гидролиза кислота не добавляется, что важно при производстве каталитических покрытий для микрореакторов. Была приготовлена серия нанокомпозитов титана–циркония с контролируемыми свойствами при варьировании содержания TiO2 в смеси оксидов от 15 до 80 мол. %. Композиты обладают упорядоченной мезопористой структурой, высокой удельной поверхностью (до 185 м2/г), большим объемом пор (0.08–0.21 см3/г) и равномерным их распределением по размерам (3.6–3.8 нм). Были синтезированы каталитические покрытия 1 вес. % Pd–Zn/TixZr1 – xO2 (x = 1.0, 0.8, 0.5) на внутренней поверхности капиллярного реактора диаметром 0.53 мм, длиной 10 м. Покрытия испытаны в селективном гидрировании 2-метил-3-бутин-2-ола при 333 К и 1 атм H2. Производительность реактора после 32 ч непрерывного потока раствора МБИ в метаноле и водорода возрастает в ряду Pd–Zn/TiO2 < < Pd–Zn/Ti0.8Zr0.2O2 < Pd–Zn/Ti0.5Zr0.5O2 за счет увеличения загрузки катализатора, а высокая селективность (>96%) и производительность катализаторов практически не зависят от состава покрытия.
Список литературы
Ehrfeld W., Hessel V., Löwe H. // Microreactors. New Technology for Modern Chemistry. Wiley-Vch, Verlag GmbH & Co. KGaA, Weinheim, FRG, 2000. P. 288.
Irfan M., Glasnov T.N., Kappe C.O. // ChemSusChem. 2011. V. 4. P. 300.
Hessel V., Cravotto G., Fitzpatrick P., Patil B.S., Lang J., Bonrath W. // Chem. Eng. Process. Process Intensif. 2013. V. 71. P. 19.
Hessel V., Kralisch D., Kockmann N., Noël T., Wang Q. // ChemSusChem. 2013. V. 6. P. 746.
Roberge D.M., Ducry L., Bieler N., Cretton P., Zimmermann B. // Chem. Eng. Technol. 2005. V. 28. P. 318.
Rebrov E.V., Berenguer-Murcia A., Skelton H.E., Johnson B.F.G., Wheatley A.E.H., Schouten J.C. // Lab. Chip. 2009. V. 9. P. 503.
Rebrov E.V., Klinger E.A., Berenguer-Murcia A., Sulman E.M., Schouten J.C. // Org. Process Res. Dev. 2009. V. 13. P. 991.
Okhlopkova L.B., Kerzhentsev M.A., Ismagilov Z.R. // Surf. Eng. 2015. V. 31. P. 78.
Reddy B.M., Khan A. // Catal. Rev. 2005. V. 47. P. 257.
Tsodikov M.V., Bukhtenko O.V., Ellert O.G., Shcherbakov V.M., Kochubey D.I. // J. Mater. Sci. 1995. V. 30. P. 1087.
Wang I., Chang W.F., Shiau R.J., Wu J.C., Chung C.C. // J. Catal. 1983. V. 83. P. 428.
Wu J.C., Chung C.C., Ay C.L., Wang I. // J. Catal. 1984. V. 87. P. 98.
Wang I., Wu J.C., Chung C.C. // Appl. Catal. 1985. V. 16. P. 89.
Brinker C.J, Lu Y., Sellinger A., Fan H. // Adv. Mater. 1999. V. 11. P. 579.
Lu Y., Fan H., Stump A., Ward T.L., Rieker T., Brinker C.J. // Nature. 1999. V. 398. P. 223.
Yang P.D., Zhao D.Y., Margolese D.I., Chmelka B.F., Stucky G.D. // Nature. 1998. V. 396. P. 152.
Schattka J.H., Shchukin D.G., Jia J.G., Antonietti M., Caruso R.A. // Chem. Mater. 2002. V. 14. P. 5103.
Zhou W., Liu K.S., Fu H.G., Pan K., Zhang L.L., Wang L., Sun C.-C. // Nanotechnol. 2008. V. 19. P. 035610.
Sekulic J., Magraso A., ten Elshof J.E., Blank D.H.A. // Micropor. Mesopor. Mater. 2004. V. 72. P. 49.
Das D., Mishra H.K., Pradhan N.C., Dalai A.K., Parida K.M // Micropor. Mesopor. Mater. 2005. V. 80. P. 327.
Zorn M.E., Tompkins D.T., Zeltner W.A., Anderson M.A. // Appl. Catal. B: Env. 1999. V. 23. P. 1.
Yuan Q., Liu Y., Li L., Li Z.-X., Fang C.-J., Duan W.-T., Li X.-G., Yan.-H.C. // Micropor. Mesopor. Mater. 2009. V. 124. P. 169.
Охлопкова Л.Б., Керженцев М.А., Исмагилов З.Р. // Кинетика и катализ. 2018. Т. 59. № 3. С. 355.
Dominguez-Dominguez S., Berenguer-Murcia A., Cazorla-Amoros D., Linares-Solano A. // J. Catal. 2006. V. 243. P. 74.
Okhlopkova L.B. Cherepanova S.V., Prosvirin I.P., Kerzhentsev M.A., Ismagilov Z.R. // Appl. Catal. A: Gen. 2018. V. 549. P. 245.
Li M., Li X., Jiang G., He G. // Ceramics International. 2015. V. 41. № 4. P. 5749.
Yu J.C., Lin J., Kwok R.W.M. // J. Phys. Chem. B. 1998. V. 102. P. 5094.
Macan J., Gajovi A., Ivankovi H.J. // Europ. Cer. Soc. 2009. V. 29. P. 691.
Chisholm D.J. // Heat Mass Transfer. 1967. V. 10. P. 1767.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ