Кинетика и катализ, 2020, T. 61, № 4, стр. 520-525
Кинетика терполимеризации диоксида углерода с пропиленоксидом и гексеноксидом
О. М. Чуканова a, *, К. О. Коренков b, Н. О. Гарифуллин a, О. Г. Шеверденкина a, И. В. Седов a, b
a ФГБУН Институт проблем химической физики РАН
142432 Черноголовка, просп. Акад. Семенова, 1, Россия
b ФГБОУ ВПО Московский государственный университет им. М.В. Ломоносова, Факультет фундаментальной физико-химической инженерии
119991 Москва, ГСП-1, Ленинские горы, 1, стр. 51, Россия
* E-mail: olchukan@icp.ac.ru
Поступила в редакцию 30.12.2019
После доработки 17.01.2020
Принята к публикации 17.01.2020
Аннотация
Впервые изучена кинетика терполимеризации СО2 с пропиленоксидом и гексеноксидом в присутствии бинарной каталитической системы salenCoDNP/PPNCl. Значение скорости реакции рассчитывали, измеряя поглощение СО2 со временем в процессе терполимеризации. Представлены зависимости скорости реакции и состава терполимера от состава эпоксидов в реакционной среде. Измерено соотношение констант сополимеризации при внедрении различных эпоксидов в терполимер. Температура стеклования алифатического поликарбоната определялась его составом и изменялась в диапазоне от 26.3 до –9.8°С.
ВВЕДЕНИЕ
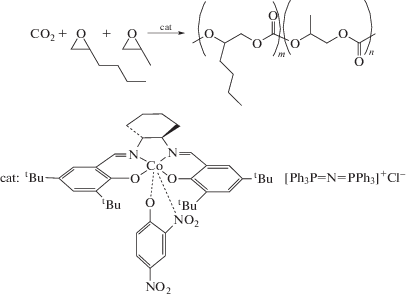
Использование диоксида углерода в органическом синтезе представляет большой интерес для современной химии, так как позволяет уменьшить зависимость химической промышленности от нефтяного сырья. Реакция СО2 с эпоксидами, протекающая в присутствии катализаторов, дает возможность получать алифатические поликарбонаты, содержащие в полимерной цепи одинаковое количество молекул эпоксида и диоксида углерода. Природа эпоксида оказывает влияние на физико-химические или механические свойства полимерного продукта. Так, сополимер СО2 с пропиленоксидом имеет довольно низкую температуру стеклования (25–45°С [1]), что не позволяет применять этот материал как конструкционный пластик. При введении в сополимер эпоксидов циклического строения температура стеклования повышается, однако ухудшаются его физико-механические свойства [2, 3]. Один из подходов, позволяющих в широких пределах изменять свойства алифатических поликарбонатов, заключается в проведении реакции СО2 одновременно с двумя разными эпоксидами (терполимеризация). Используя смеси эпоксидов различного состава, можно получать сополимеры как с низкой температурой стеклования (менее 0°С), так и с высокой (более 150°С) [2, 3], регулируя одновременно их физико-механические свойства. Одна из проблем в осуществлении процессов терполимеризации – различная реакционная способность сомономеров (эпоксидов). Известно, что сополимеризация СО2 с пропиленоксидом (PO) протекает с высокой скоростью [1–3]. Однако терполимеризация PO с некоторыми эпоксидами (например, стиролоксидом) проходит с трудом из-за малой реакционной способности стиролоксида [2].
В литературе нет данных о кинетических закономерностях процессов терполимеризации эпоксидов с СО2. Выводы о средней скорости реакции делают, как правило, на основании измерения выхода сополимера. Ранее [4] нами была исследована кинетика терполимеризации PO с бутеноксидом (BO) или циклогексеноксидом. Показано, что скорость терполимеризации постепенно снижается по мере увеличения содержания менее реакционноспособного эпоксида в смеси. Состав терполимеров определялся составом смеси. В присутствии двухкомпонентной каталитической системы salenCoDNP/PPNCl (salen – (R,R)-N,N'-бис-(3,5-ди-трет-бутилсалицилиден)-1,2-диаминоциклогексан, DNP – 2,4-динитрофеноксид, PPNCl – бис-(трифенилфосфин)иминия хлорид) в мягких условиях реакции (45°С, 0.6 МПа) скорость сополимеризации СО2 с BO была всего в 2 раза ниже, чем сополимеризации СО2 с PO. Используя гексеноксид (HO) в качестве второго сомономера, можно получать полимеры с температурой стеклования менее 0°С, сохраняющие эластичность в условиях низких температур [5]. Синтез тройных сополимеров CO2/PO/HO с применением кобальтого катализатора нового поколения с лигандом сложного строения был описан в работе [6]. Процесс терполимеризации проводили в довольно жестких условиях (70–75°С, 2 МПа). Температура стеклования сополимера CO2/HO составляла –15°С по данным этой работы и –18°С по данным [5]. В цитируемой работе синтез сополимера осуществляли в присутствии биядерного цинк–кобальт цианидного комплекса при 50°С, давлении 4 МПа в течение 15 ч.
Задача представленной работы заключалась в исследовании кинетики процесса терполимеризации CO2/PO/HO в мягких условиях проведения реакции с использованием каталитической системы salenCoDNP/PPNCl для сравнения кинетических особенностей протекания этого процесса с изученной ранее терполимеризацией CO2/PO/BO в тех же условиях. Необходимо было получить новые данные о влиянии состава эпоксидов на скорость процесса и состав терполимера, а также определить соотношение констант сополимеризации СО2 с эпоксидами PO и HO.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и методы исследования
Катализатор (salen)Co(DNP) синтезировали по методике [7], используя (salen)Co(II) (“Strem Chemicals”) и 2,4-динитрофенол (≥97%, “Sigma-Aldrich”). Сокатализатор PPNCl получен от “Strem Chemicals”. CO2 (99.8%) предоставлен фирмой “Линде Газ”. Пропиленоксид и гексеноксид (“Sigma-Aldrich”) осушали перегонкой над CaH2.
1H ЯМР-спектры регистрировали на приборе AVANCE III 500-MHz (“Bruker”, Германия), растворяя образцы в CDCl3. Сополимеры анализировали методом гель-проникающей хроматографии (ГПХ) на приборе GPCV 2000 (“Waters”, США) с двумя колонками PLgel 5 мкл MIXED-C (“Agilent Technologies”, США) в тетрагидрофуране (ТГФ) (35°C) при скорости элюента 1 мл/мин. Значения молекулярных масс (ММ) рассчитывали по калибровочной кривой, полученной с помощью полистирольных стандартов. Данные о температуре стеклования получали из анализа второго цикла нагревания при скорости 20°С/мин методом дифференциальной сканирующей калориметрии (ДСК) на приборе 822e (“Mettler-Toledo GmbH”, Швейцария).
Реакция СО2 с эпоксидами
Катализатор salenCoDNP и сокатализатор PPNCl при эквимолярном мольном соотношении растворяли в смеси эпоксидов (3.5–4.5 мл) в атмосфере аргона и перемешивали в течение 15 мин. Концентрацию катализатора варьировали в диапазоне (7.5–9.5) × 10–3 моль/л. Раствор переливали в предварительно откачанный металлический реактор объемом 0.1 л, снабженный магнитной мешалкой, в атмосфере СО2. В реакторе поднимали давление подачей СО2, термостатировали при 45°С. В ходе реакции поддерживали давление 0.6 МПа. Кинетику расхода СО2 регистрировали, измеряя давление СО2 в калиброванной мерной емкости, соединенной с реактором. Количество СО2 рассчитывали по градуировочной кривой, выражающей зависимость массы СО2 от давления в мерной емкости. Реакцию заканчивали, охлаждая реактор до комнатной температуры и сбрасывая давление. Продукт растворяли в CH2Cl2 (5 мл), сополимер высаживали МеОН (30 мл) с добавлением 5% раствора HCl в МеОН (5 мл). Процедуру повторяли до получения бесцветного сополимера. После очистки сополимер высушивали в вакууме при температуре 100–140°С и взвешивали. Выход сополимера соответствовал количеству поглощенного СО2 с точностью ±10%. Продукты анализировали, применяя методы ГПХ и ЯМР. Относительное содержание звеньев различных эпоксидов в тройном сополимере рассчитывали по спектрам ЯМР 1Н [4, 6]. 1H ЯМР (CDCl3, 500 МГц) м. д.: (–СО2–PO–)n 1.33, 1.35 (д, 3H, CH3), 4.11–4.30 (м, 2H, CH2), 5.01 (м, 1H, CH); (–СО2–HO–)n 0.87–0.89 (м, 3H, CH3), 1.30–1.32 (м, 4H, CH2), 1.63 (м, 2H, CH2), 4.08–4.34 (м, 2H, CH2), 4.88 (м, 1H, CH).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Процесс терполимеризации CO2/PO/HO проводили в условиях, которые были использованы ранее для исследования кинетики терполимеризации СО2 с пропиленоксидом, бутеноксидом или циклогексеноксидом [4]: температура 45°С, давление 0.6 МПа. Общая схема процесса терполимеризации СО2/PO/НО представлена ниже (схема 1 ):
Схема 1 . Общая схема процесса терполимеризации СО2/PO/НО.
Выбор условий определялся следующими факторами: при 45°С реакция протекала с селективностью по поликарбонату более 96%, в качестве побочных продуктов наблюдалось образование лишь небольшого количества циклических карбонатов. Повышение температуры процесса приводит, с одной стороны, к ускорению реакции, а с другой – к снижению селективности по полимерному продукту. С увеличением давления до 0.6 МПа наблюдался линейный рост скорости реакции, а в диапазоне 0.6–1 МПа скорость реакции возрастала всего на 20%, поэтому для исследования процессов терполимеризации были выбраны наиболее мягкие условия.
Кинетика сополимеризации СО2 с эпоксидами часто характеризуется наличием индукционных периодов, длительность которых повышается с уменьшением концентрации катализатора [8]. В данной работе для уменьшения величины индукционных периодов в процессах терполимеризации использовали концентрации катализатора в интервале (7.5–9.5) × 10–3 моль/л. Мольное соотношение катализатор/сокатализатор составляло 1 и было оптимальным для достижения максимальной скорости и селективности по поликарбонату [8]. В описанных выше условиях терполимеризация CO2/PO/HO шла длительное время с постоянной скоростью при различных соотношениях эпоксидов в реакционной смеси. Типичные зависимости поглощения СО2 со временем в ходе реакции представлены на рис. 1.
Рис. 1.
Поглощение СО2 со временем в терполимеризации СО2/PO/HO при различном составе эпоксидов: fHO равно 0.21 (1), 0.33 (2), 0.63 (3), 1 (4). T = 45°C, давление 0.6 МПа, [salenCoDNP]/[PPNCl] = 1.
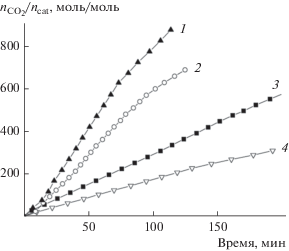
До значения конверсии эпоксидов 40% реакция протекала при постоянной скорости. Дальнейшее уменьшение скорости может быть связано с накоплением продуктов, снижением растворимости СО2, увеличением вязкости реакционной среды. Далее скорость реакции рассчитывали на стационарном участке кинетической кривой в параметрах TOF (ч–1) как количество молей СО2 в расчете на моль катализатора за час.
Повышение содержания HO в среде приводит к довольно резкому падению скорости терполимеризации. На рис. 2 показано изменение скорости в единицах TOF от относительного мольного содержания HO в смеси эпоксидов (fHO).
Рис. 2.
Зависимость скорости реакции от состава эпоксидов в терполимеризации: 1 – СО2/PO/НО, f = = nHO/(nPO + nHO); 2 – CO2/PO/BO, f = nBO/(nPO + nBO).
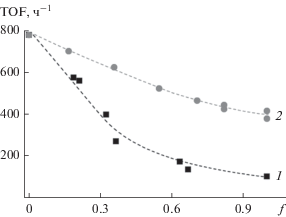
Более плавная зависимость была получена ранее при исследовании процесса терполимеризации CO2/PO/BO [4], для сравнения она также приведена на рис. 2. Эти данные показывают, что с ростом содержания атомов углерода в углеводородной цепи эпоксида происходит резкое снижение скорости сополимеризации. Так, сополимеризация СО2/НО протекает в 3.5 раза медленнее, чем сополимеризация CO2/BO. При одинаковом количестве атомов углерода циклогексеноксид по сравнению с гексеноксидом имеет циклическое строение и меньший размер молекулы. Сополимеризация СО2 с циклогексеноксидом также идет с более высокой скоростью, чем с гексеноксидом [4]. Этo свидетельствует, что увеличение размера молекулы эпоксида сопровождается снижением скорости сополимеризации при проведении реакции в одинаковых условиях. Большие различия в скоростях внедрения двух эпоксидов могут приводить к затруднениям при формировании терполимера. Однако, несмотря на то, что скорости сополимеризации для РО и НО отличаются почти в 8 раз, были получены тройные сополимеры с различным содержанием звеньев –(CO2–HO)–.
Значения скорости терполимеризации, данные о составе терполимера для ряда опытов с разным составом эпоксидов представлены в табл. 1.
Таблица 1.
Терполимеризация СО2 с пропиленоксидом и гексеноксидом при разном составе эпоксидов в среде
| № | fHO | FHO | TOF, ч–1 | Mn, кг/моль | Mw/Mn* | Тс, °С | Тд**, °С |
|---|---|---|---|---|---|---|---|
| 1 | 0.21 | 0.16 | 560 | 23.4 7.1 |
1.0 1.4 |
26.3 | 254 |
| 2 | 0.33 | 0.32 | 398 | 20.1 6.2 |
1.0 1.5 |
10.8 | 263 |
| 4 | 0.67 | 0.59 | 134 | 12.1 3.8 |
1.0 1.4 |
–0.9 | 281 |
| 5 | 1 | 1 | 101 | 17.7 5.5 |
1.0 1.3 |
–9.8 | 293 |
С увеличением содержания гексеноксида в реакционной смеси растет мольная доля звеньев ‒(CO2–HO)– в терполимере (FHO = m/(m + n), см. схема 1 ), скорость процесса при этом уменьшается.
Изменение относительного мольного количества звеньев –(СО2–НО)– в терполимере с содержанием НО в среде показано на рис. 3.
Рис. 3.
Зависимость относительного мольного количества звеньев –(СО2–НО)– в терполимере от содержания HO в среде.
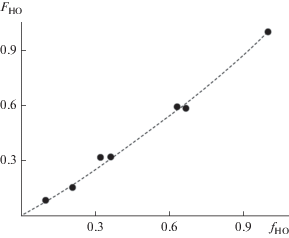
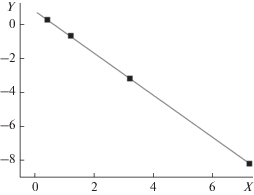
Зависимость носит нелинейный характер, количество звеньев –(СО2–НО)– в терполимере растет с повышением содержания НО в среде. Полученные экспериментальные результаты позволяют провести расчет соотношения констант сополимеризации при внедрении PO и HO в терполимер с использованием соотношения Файнмана–Росса (Fineman–Ross) [4, 6]. Зависимость, рассчитанная в координатах Файнмана–Росса (X = [fРО2/(1 – fPO)2] × [(1 – FPO)/FPO]; Y = [fPO/(1 – – fPO)] × [(1 – 2FPO)/FPO]) для процесса терполимеризации CO2/PO/HO, представлена на рис. 4 (FPO = n/(m + n), см. схема 1 ).
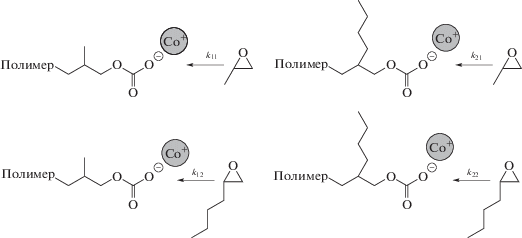
В процессе роста цепи терполимера внедрение эпоксидов может происходить в разной последовательности, варианты представлены на схеме 2 .
Схема 2 . Константы сополимеризации при внедрении эпоксидов в разной последовательности.
Анализ данных в координатах Файнмана–Росса позволяет определить соотношение констант при формировании разных последовательностей звеньев в полимерной цепи. Согласно полученным результатам соотношение констант k11/k12 (rPO) равно 1.24, а k22/k21 (rHO) – 0.77. В процессе терполимеризации CO2/PO/BO значение rPO составляло 1.15, rBO было 0.66 [4]. Рассчитанные соотношения констант показывают, что скорость внедрения HO в последовательность звеньев с PO ниже, чем скорость внедрения BO в ту же последовательность. С другой стороны, внедрение HO в последовательность –(CO2–HO)– протекает с более высокой скоростью, чем внедрение BO в последовательность –(CO2–BO)–. В данном случае скорость внедрения PO служит реперным значением, позволяющим сравнивать скорости внедрения для второго эпоксида.
Рассчитанные значения rPO и rHO можно сопоставить с результатами для терполимеризации CO2/PO/HO с использованием однокомпонентного катализатора нового поколения [6]. По данным работы [6] значение rPO было 1.9, rHO составляло 0.46. Различия с полученными нами величинами довольно существенны и указывают на то, что при применении однокомпонентного катализатора PO более успешно конкурирует с HO, чем в случае двухкомпонентной каталитической системы salenCoDNP/PPNCl.
Сополимер СО2 с PO имеет температуру стеклования в пределах 25–45°С в зависимости от ММ, региорегулярности и других параметров. Модификация свойств алифатических поликарбонатов, повышение или понижение температуры стеклования возможно при введении в сополимеры других эпоксидов. При использовании эпоксидов циклического строения, например, в терполимеризации СО2/циклогексеноксид/лимоненоксид [9], температура стеклования продуктов возрастает до 100°С и выше. Для применения полимерных материалов в условиях низких температур необходимо формирование терполимеров с возможно более низкой температурой стеклования. Увеличение содержания звеньев с HO в терполимере CO2/PO/HO от 0.16 до 0.59 сопровождается снижением температуры стеклования от 26.3°С практически до 0°С (см. табл. 1). Одновременно наблюдается повышение температуры деструкции терполимеров от 254 до 281°С. Изменение термических характеристик с составом терполимера представлено на рис. 5.
Рис. 5.
Изменение температуры стеклования тройных сополимеров CO2/PO/HO с ростом содержания звеньев с HO в терполимере.
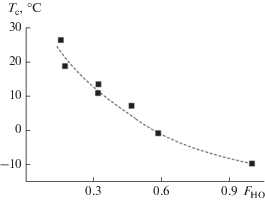
Минимальная температура стеклования была близка к –10°С (сополимер СО2/HO), а введение до 40% пропиленоксда позволяет варьировать этот показатель в диапазоне от 0 до –10°С. Температура стеклования сополимера CO2/BO была выше и составляла 9.3°С [4].
ЗАКЛЮЧЕНИЕ
В присутствии двухкомпонентной каталитической системы salenCoDNP/PPNCl в мягких условиях реакции (45°С, 0.6 МПа) процесс терполимеризации CO2/PO/HO протекает длительное время с постоянной скоростью при различном составе эпоксидов в реакционной среде. Данные о стационарной скорости реакции получены на основании результатов измерения поглощения СО2 со временем. Повышение содержания HO в смеси сопровождается снижением скорости процесса и постепенным увеличением содержания звеньев –(СО2–НО)– в терполимере. Анализ соотношения констант сополимеризации при внедрении эпоксидов в различной последовательности по соотношению Файнмана–Росса показывает, что с наибольшей скоростью протекает внедрение PO в терполимер. С другой стороны, скорость внедрения PО в последовательность звеньев –(СО2–НО)– в терполимере лишь в 1.3 раза выше, чем скорость внедрения НО в ту же последовательность. В процессе терполимеризации CO2/PO/BO наблюдалось меньшее различие в скоростях внедрения PO или BO, и скорость реакции плавно изменялась с ростом содержания BO. Полученные результаты свидетельствуют, что небольшое увеличение длины углеводородной цепи в эпоксиде приводит к довольно значительному падению скорости внедрения эпоксида в терполимер.
Синтезированные тройные сополимеры CO2/PO/HO характеризуются низкой температурой стеклования, которая снижается от 26.3 до –0.9°С с возрастанием относительного мольного содержания звеньев –(СО2–НО)– в терполимере от 0.16 до 0.59.
Список литературы
Luinstra G.A. // Polym. Rev. 2008. V. 48. № 1. P. 192.
Taherimehr M., Pescarmona P.P. // J. Appl. Polym. Sci. 2014. V. 131. № 21. App. 41141.
Kember M.R., Buchard A., Williams C.K. // Chem. Commun. 2011. V. 47. P. 141.
Chukanova O.M., Korenkov K.O., Perepelitsina E.O., Garifullin N.O., Sedov I.V. // Polym. Sci. B. 2019. V. 61. № 4. P. 395.
Zhang X.-H., Wei R.-J., Zhang Y.-Y., Du B.-Y. Fan Z.-Q. // Macromol. 2015. V. 48. P. 536.
Seong J.E., Na S.J., Cyriac A., Kim B.-W., Lee B.Y. // Macromol. 2010. V. 43. P. 903.
Lu X.-B., Shi L., Wang Y.-M., Zhang R., Zhang Y.-J., Peng X.-J., Zhang Z.-C., Li B. // J. Am. Chem. Soc. 2006. V. 128. № 5. P. 1664.
Chukanova O.M., Perepelitsina E.O., Belov G.P. // Polym. Sci. B. 2014. V. 56. № 5. P. 547.
Martin C., Kleij A.W. // Macromol. 2016. V. 49. P. 6285.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ