Кинетика и катализ, 2020, T. 61, № 4, стр. 469-481
Диеновый синтез и one-pot процессы в растворах Мо–V–P-гетерополикислот
Л. Л. Гогин a, *, Е. Г. Жижина a
a ФГБУН ФИЦ Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, просп. Акад. Лаврентьева, 5, Россия
* E-mail: gogin@catalysis.ru
Поступила в редакцию 18.12.2019
После доработки 25.12.2019
Принята к публикации 25.12.2019
Аннотация
Основанный на работах авторов обзор посвящен использованию водных растворов Mo–V–P-гетерополикислот (ГПК-х, х – число атомов ванадия) в качестве бифункциональных (кислотных и окислительных) катализаторов. Основное внимание сосредоточено на разработке one-pot процессов, в которых кислотно-каталитическая реакция диенового синтеза объединена с окислением образующихся аддуктов. Показаны перспективы создания ряда промышленных процессов получения замещенных 1,4-нафто- и 9,10-антрахинонов в присутствии модифицированных растворов ГПК-х некеггиновских составов.
ВВЕДЕНИЕ
Катализ гетерополисоединениями (ГПС), называемыми также полиоксометаллатами, – интенсивно развивающееся направление в современной науке о катализе. Об этом свидетельствует большое число научных работ, рассмотренных в многочисленных обзорах [1–15]. Исследования в области катализа ГПС интенсивно ведутся уже около 50 лет. Они позволили существенно продвинуться в понимании механизма каталитического действия ГПС на молекулярном уровне и приступить к реализации новых промышленных процессов с их участием.
Впервые применять ГПС – гетерополикислоты (ГПК) и их соли – в составе двухкомпонентных катализаторов в качестве обратимо действующих окислителей в 1971 г. предложил проф. Матвеев К.И. (Институт катализа СО РАН (ИК СО РАН), Новосибирск), разработавший с сотрудниками гомогенный катализатор (Pd + ГПК) для двухстадийного окисления кислородом этилена в ацетальдегид [16]. Отсутствие Cl–-ионов было главным преимуществом нового катализатора по сравнению с “хлоридным” катализатором PdCl2 + CuCl2, используемым в промышленном Вакер-процессе [17]. Именно работы К.И. Матвеева [2, 3, 16] положили начало развитию нового направления катализа – катализа гетерополисоединениями. Всесторонние исследования ГПС с целью их применения в катализе, начатые в ИК СО РАН, вызвали большой интерес и очень быстро распространились по всему миру.
Большое число опубликованных научных работ и внедренных каталитических технологий показывают, что в первую очередь ГПС используются как кислотные катализаторы (гомогенные или гетерогенные). Из промышленных процессов окисления важными являются парофазное окисление метакролеина в метакриловую кислоту на гетерогенном катализаторе Мо–V–Р-ГПК (1982) [8] и этилена в уксусную кислоту на гетерогенном катализаторе Рd + SiW12 (1997) [18]. Надо отметить, что промышленные гомогенно-каталитические способы окисления с участием ГПС пока не реализованы. В связи с этим в настоящем обзоре мы сконцентрировались на гомогенном окислительном катализе с участием растворов Мо–V–P-ГПК-х (х – число атомов ванадия в составе ГПК). Существенной особенностью этих растворов является то, что они не только довольно сильные окислители (Е ~ 1 В) за счет наличия VV в их составе, но и очень сильные бренстедовские кислоты (рН < 0). К тому же ГПК-х обладают обратимой окисляемостью – исключительно важным для катализа свойством. Оно заключается в том, что восстановленные формы ГПК-х способны окисляться молекулярным кислородом, поэтому в их присутствии можно в 2 стадии осуществить каталитическое окисление кислородом различных органических субстратов. Например, окисление (III) субстратов (Su) кислородом можно представить реакциями (I) + (II):
(I)
$\begin{gathered} {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{\text{Su}} + {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{ГПК - }}x \to \\ \to {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{\text{SuO}} + {{{\text{Н}}}_{m}}{\text{ГПК - }}x. \\ \end{gathered} $(II)
${{{\text{Н}}}_{m}}{\text{ГПК - }}x + {m \mathord{\left/ {\vphantom {m 4}} \right. \kern-0em} 4}{{{\text{O}}}_{2}} \to {\text{ГПК - }}x + {m \mathord{\left/ {\vphantom {m 2}} \right. \kern-0em} 2}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{\text{.}}$———————————————————————
(III)
${\text{Su}} + {1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}{{{\text{O}}}_{2}} \rightleftarrows {\text{SuO}},$В этом случае ГПК-х, являясь обратимо действующим окислителем, играет роль катализатора суммарной реакции (III). Важно отметить, что редокс-превращения в растворах ГПК-х претерпевают только атомы ванадия: VV$ \rightleftarrows $ VIV. Стадии (I) и (II) каталитической реакции (III) часто проводят раздельно в разных условиях. При этом удается предотвратить взаимодействие субстрата с кислородом в тех случаях, когда возможно образование взрывоопасных смесей, и получить максимальную селективность в реакции (I). Стадия (II) регенерации катализатора кислородом – общая стадия всех окислительных процессов с участием растворов ГПК-х. Именно она чаще всего является ключевой, поскольку возможность быстрой и эффективной регенерации ГПК-х определяет технологичность разрабатываемых процессов и перспективы их промышленной реализации.
Уникальные свойства растворов ГПК-х позволяют реализовывать в их присутствии довольно сложные каталитические one-pot процессы, в которых используется их бифункциональность. Очень перспективно применение ГПК и их солей в качестве катализаторов процессов тонкого органического синтеза, включая асимметрический синтез. Благодаря высокой цене продуктов выигрыш в селективности за счет введения более эффективного катализатора часто многократно перекрывает затраты на катализатор. В последнее время выполнено много работ по применению ГПС в синтезе антиоксидантов, лекарственных препаратов, витаминов, биологически активных веществ [5, 7, 14, 15, 19, 20].
В настоящем обзоре рассмотрены one-pot процессы получения 1,4-нафтохинона (НХ), 9,10-антрахинона (АХ) и их производных на основе реакции Дильса–Альдера в присутствии растворов ГПК-х. Ранее в работах Кожевникова И.В. [12, 15, 21] было показано, что фосфорновольфрамовая ГПК (H3PW12O40) катализирует реакцию диенового синтеза между хинонами (1,4-нафто-, толу- и бензохинонами) и 2,3-диметил-1,3-бутадиеном. Если же использовать в качестве катализаторов Мо–V–P-ГПК-х (довольно сильные окислители), образующиеся в ходе реакции аддукты могут быть сразу же окислены в соответствующие хиноны непосредственно в том же реакционном сосуде, то есть в one-pot процессе можно совместить стадии диенового синтеза и окисления аддуктов. В обзоре также проанализированы проблемы, возникающие при реализации этих процессов, и возможные пути их устранения.
1. ПОЛУЧЕНИЕ 9,10-АНТРАХИНОНОВ РЕАКЦИЕЙ ДИЕНОВОГО СИНТЕЗА В ПРИСУТСТВИИ РАСТВОРОВ ГПК-x
1.1. Получение незамещенного антрахинона из 1,4-нафтохинона и 1,3-бутадиена
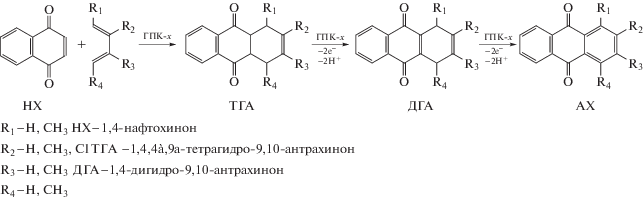
В наших работах [22–28] были исследованы one-pot процессы синтеза АХ и его замещенных аналогов в присутствии растворов ГПК-x, протекающие в соответствии со следующей схемой (схема 1 ):
Схема 1 . Получение АХ из НХ и замещенных 1,3-бутадиенов.
В ранней работе [22] нами была исследована реакция НХ с 1,3-бутадиеном в присутствии водных растворов ГПК-4 (брутто-состава Н7РМо8V4O40), протекающая в отсутствие органического растворителя. При температуре не выше 40°С и времени реакции 5–7 ч конверсия НХ была низкой, в реакционной смеси обнаруживались только ТГА и ДГА, АХ не образовывался. Продукт такой реакции в воде нерастворим и легко отделялся от раствора ГПК-4 простым фильтрованием.
При повышении температуры степень превращения НХ быстро росла, содержание АХ в реакционной смеси также возрастало (рис. 1) [22, 23]. При температуре 80°С достигалась полная конверсия НХ, однако в смеси оставались значительные количества ТГА и ДГА. Дальнейшее повышение температуры (до 135°С) потребовало увеличения давления выше атмосферного, однако не привело к существенному росту содержания АХ в смеси. Поэтому дальнейшие исследования по оптимизации one-pot процесса синтеза АХ в отсутствие органического растворителя мы вели при температурах ниже 100°С.
Рис. 1.
Зависимость конверсии НХ (γ) (1, 2) и выхода АХ (α) (3) от температуры: 1 – конверсия НХ за 7 ч (анализ методом ЯМР 1Н); 2 – конверсия НХ за 5 ч (анализ методом ГЖХ); 3 – выход АХ за 7 ч (анализ методом ЯМР 1Н). Условия реакции: 25 мл 0.2 М ГПК-4, 0.79 г НХ; атм. 1,3-бутадиена.
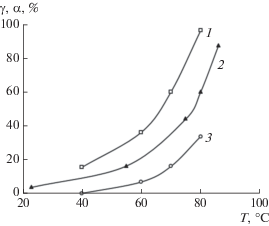
При Т = 80°С практически полная конверсия НХ достигалась за 2 ч. В то же время при этой температуре даже за 9 ч реакции содержание АХ в продуктах реакции не превышало 51% (остальное – ДГА и ТГА) [23]. Таким образом, стадией, определяющей скорость всего one-pot процесса синтеза АХ из НХ и 1,3-бутадиена в присутствии растворов ГПК-x, является не реакция диенового синтеза, а окисление аддукта этой реакции.
В работе [23] мы продемонстировали, что использование вместо ГПК-4 некеггиновского высокованадиевого раствора ГПК-7 (H15P4Mo18V7O89) как более сильного окислителя позволило в тех же условиях увеличить содержание АХ в продуктах реакции в отсутствие органического растворителя только до 55%.
Применение же в реакции гидрофобных органических растворителей (бензол, хлороформ, октанол-1) не улучшало показатели процесса синтеза АХ из НХ и 1,3-бутадиена в присутствии растворов ГПК-х.
Таким образом, в работах [22, 23] нами было показано, что при осуществлении one-pot процесса получения АХ при температурах 80−135°С в отсутствие органического растворителя или в присутствии несмешивающегося с водой растворителя получаются смеси (ТГА + ДГА + АХ), содержащие не более 50−55% АХ. Мы предположили, что неполнота окисления аддукта диенового синтеза в присутствии водных растворов ГПК-х связана с тем, что реакционная смесь является гетерогенной (НХ в холодном растворе ГПК-х растворим мало, а ТГА и ДГА плохо растворимы даже при нагревании; использованные ранее неполярные органические растворители не смешиваются с водным раствором ГПК-х). Поэтому реакция окисления аддуктов на границе раздела фаз протекала довольно медленно. Мы решили, что одним из вариантов оптимизации условий one-pot процесса получения чистого АХ может быть применение органических растворителей, растворяющих НХ, ТГА, ДГА и смешивающихся с водой. Обязательным требованием к таким растворителям является также их устойчивость к действию ГПК-х (довольно сильных окислителей).
В табл. 1 приведены результаты экспериментов в присутствии ГПК-4 с несколькими гидрофильными растворителями [24, 25]. Можно видеть, что использование ацетона и 1,4-диоксана позволяет получить продукт, в состав которого входят в основном АХ и ДГА, а содержание же ТГА и исходного НХ очень мало. В случае диметилсульфоксида (ДМСО) и особенно изопропанола конверсия НХ были заметно ниже. Наблюдаемые изменения в составе продуктов реакции, вероятно, обусловлены неполной растворимостью субстрата в органическом растворителе.
Таблица 1.
Зависимость показателей процесса получения АХ от природы растворителя*
| Растворитель, мл | T, °С | Продукты реакции (мол. %) | Конверсия НХ, % | Выход АХ***, % | |||
|---|---|---|---|---|---|---|---|
| АХ | ТГА | ДГА | НХ | ||||
| Вода** | 80 | 51.7 | 22.9 | 16 | 4.1 | 97.1 | 27.9 |
| Ацетон (8) | 60 | 83.4 | 1.8 | 12.6 | 0.4 | 99.5 | 73.4 |
| Изопропанол (8) | 80 | 58 | 16.5 | 17 | 3.4 | 97.3 | 35.7 |
| ДМСО (8) | 80 | 72.3 | 9.9 | 13.3 | 0.8 | 99.7 | 22.8 |
| 1,4-Диоксан (8) | 80 | 84.5 | 0 | 14.7 | 0.2 | 99.8 | 69.7 |
* Условия реакции: 15.6 мл 0.2 М водного раствора ГПК-4; мольное отношение ГПК-4/НХ = 2; давление бутадиена ${{P}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{6}}}}}}}$ = = 200 кПа – ${{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}};$ время реакции 7 ч. ** Время реакции 9 ч. *** Здесь и далее выход АХ рассчитан как отношение массы полученного АХ к теоретически возможному его количеству. Продукт реакции в реакционной смеси практически нерастворим и отделялся простым фильтрованием. Состав продукта реакции определялся методом ВЭЖХ.
Поскольку в присутствии названных выше растворителей в смеси все еще остается некоторое количество ДГА, вместо кеггиновского раствора ГПК-4 в процессе синтеза АХ были опробованы также растворы ГПК-х с бóльшим содержанием ванадия, такие как ГПК-7 и ГПК-10 (H17P3Mo16V10O89), сохраняющие высокие значения окислительного потенциала в ходе всего процесса [29].
Результаты опытов приведены в табл. 2. При использовании ГПК-7 и ацетона в качестве органического растворителя в ходе one-pot процесса образовалась смесь продуктов, содержащая 91.6% АХ и 8.4% ДГА. Применение раствора ГПК-10 и 1,4-диоксана в качестве растворителя при температуре 90°С и времени реакции 7 ч позволило получить продукт, содержащий 97% АХ и 3% ДГА. Конверсия НХ в этом случае была 99.7%, выход АХ около 70%.
Таблица 2.
Зависимость показателей процесса получения АХ от состава ГПК-х*
| ГПК-х | Е раствора ГПК-х, В | Растворитель | Время реакции, ч |
Т, °С | Содержание АХ в продукте, % | Конверсия НХ, % | Выход АХ, % |
|---|---|---|---|---|---|---|---|
| ГПК-4 | 0.995 | Вода | 5 | 80 | 46.5** | 97.2 | 17.7 |
| ГПК-7 | 1.09 | Вода | 5 | 80 | 74.6** | 99.5 | 17.9 |
| ГПК-10 | 1.16 | Вода | 5 | 80 | 75.5** | 98.9 | 23.0 |
| ГПК-7 | 1.09 | Ацетон | 7 | 60 | 91.6*** | 99.6 | 65.0 |
| ГПК-4 | 0.995 | 1,4-Диоксан | 7 | 80 | 84.5 | 99.8 | 69.7 |
| ГПК-10 | 1.16 | 1,4-Диоксан | 7 | 90 | 96.9*** | 99.7 | 67.0 |
* Условия реакции: 15.6 мл 0.2 М водного раствора ГПК-x; мольное соотношение ГПК-x/НХ = 2; давление бутадиена ${{P}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{6}}}}}}}$ = = 200 кПа – ${{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}};$ объем органического растворителя 8 мл. ** Продукт содержит также ТГА и ДГА. *** Продукт содержит только АХ и ДГА.
Таким образом, совместное применение смешивающегося с водой органического растворителя и более сильного, чем кеггиновский раствор ГПК-4, окислителя (раствор ГПК-10) позволило получить практически чистый АХ, который отделяется от восстановленного раствора катализатора простым фильтрованием.
Перед регенерацией катализатора по реакции (II) кислородом [30] растворители можно отделить отгонкой из реакционной смеси: ацетон – в чистом виде, 1,4-диоксан – в виде водного азеотропа (Ткип = 88°С), содержащего 82% диоксана. Регенерированные растворители могут быть использованы многократно на следующих циклах процесса синтеза АХ.
1.2. Получение замещенных антрахинонов из 1,4-нафтохинона и замещенных 1,3-бутадиенов
По аналогичной методике в работах [26–28] нами осуществлен также синтез ряда замещенных антрахинонов в присутствии раствора ГПК-10 из НХ и соответствующих замещенных бутадиенов. Для синтеза были выбраны промышленно важные замещенные АХ. Условия и результаты экспериментов приведены в табл. 3.
Таблица 3.
Результаты экспериментов по диеновому синтезу замещенных антрахинонов в присутствии раствора ГПК-10*
| № п/п | Заместители | Выход замещенного АХ, % | Содержание основного вещества, % |
|---|---|---|---|
| 1 | R1= R3=H R2=СH3 |
50 | 98 |
| 2 | R2= R3 =H R1=СH3 |
84 | 99 |
| 3 | R1 =H R2= R3= CH3 |
78 | 98 |
| 4 | R1= R3 =H R2=Сl |
30 | 95 |
Из табл. 3 видно, что все полученные замещенные АХ являются чистыми продуктами (95–99% основного вещества по данным ВЭЖХ), однако выход 2-метил- и 2-хлор-АХ невысок. Путем модификации условий реакции (изменение мольных отношений ГПК-10 : НХ и ГПК : диоксан) удалось повысить выход метилзамещенных АХ до 72–91% (табл. 4). Данные, представленные в табл. 4, свидетельствуют, что при получении замещенных АХ можно использовать существенно меньшие загрузки катализатора (мольное отношение ГПК-10 : НХ), чем 2 : 1 [27]. Тот факт, что выход замещенных метил-АХ в наших экспериментах все же не превышал 70–90%, объясняется протеканием в присутствии Мо–V–Р-ГПК-х побочных процессов, природа которых требует проведения дополнительных экспериментов.
Таблица 4.
Влияние параметров реакции на выход и чистоту монозамещенных антрахинонов*
| Заместитель и его положение | Растворитель (объем, мл) | Объем раствора ГПК-10, мл |
Мольное отношение ГПК-10/НХ | Выход продукта, % |
Содержание основного вещества, % |
|---|---|---|---|---|---|
| 2-CH3 | 1,4-Диоксан (8) | 15.6 | 2 | 50 | 98 |
| 2-CH3 | 1,4-Диоксан (8) | 7.8 | 1 | 71 | 97 |
| 2-CH3 | 1,4-Диоксан (6) | 5.9 | 0.75 | 70 | 96 |
| 2-CH3 | 1,4-Диоксан (4) | 3.9 | 0.5 | 72 | 96 |
| 1-CH3 | 1,4-Диоксан(8) | 15.6 | 2 | 84 | 99 |
| 1-CH3 | 1,4-Диоксан (8) | 7.8 | 1 | 91 | 99 |
Добиться увеличения выхода 2-хлор-АХ путем изменения мольных соотношений ГПК-10: НХ и ГПК: диоксан нам не удалось. Поскольку побочного образования смол в ходе процесса не наблюдалось, то для окончательного вывода о причинах полученного в работах [26, 27] низкого выхода 2-хлор-АХ необходимы дальнейшие исследования.
Заметим также, что разработанный нами способ получения антрахинонов применим только для диенов, устойчивых в сильнокислой среде. Так, 1,3-циклогексадиен при температуре реакции 80°С в присутствии ГПК-х полимеризуется, поэтому в реакции с НХ наблюдалось только образование смолы. По аналогичной причине в реакции 2,4-гексадиена (90% транс-транс-изомера) с НХ выход соответствующего 1,4-диметил-АХ не превышал 29% при конверсии НХ равной 85% [28].
Таким образом, в работах [22–28] нами были осуществлены one-pot синтезы АХ и его замещенных производных по реакциям 1,4-нафтохинона с 1,3-бутадиенами в присутствии водных растворов Мо–V–P-ГПК и смешивающихся с водой органических растворителей и показана принципиальная возможность получения таким способом антрахинонов с выходами до 90% и чистотой продукта 95–99%.
1.3. Получение антрахинонов из гидрохинона и 1,3-бутадиенов
В качестве исходного субстрата для получения АХ диеновым синтезом может быть использован не только НХ, но и 1,4-бензохинон (БХ) [31]. По нашим данным БХ количественно образуется при окислении гидрохинона (ГХ) в растворах ГПК-х, поэтому вполне логично ожидать получения производных АХ при проведении реакции между ГХ и замещенными диенами в присутствии раствора ГПК-x.
В работах [23, 32] была исследована реакция ГХ или БХ с 1,3-бутадиеном в присутствии водного раствора ГПК-6 (H9PMo6V6O40), протекающая без органического растворителя либо в присутствии гидрофобных органических растворителей (хлороформ, трихлорэтилен). Установлено, что реакция ГХ с 2 молями 1,3-бутадиена может протекать при комнатной температуре, давая смесь АХ, ТГА и ДГА при полной конверсии ГХ. Использование гидрофобного растворителя в этой реакции не улучшает, а ухудшает показатели процесса (табл. 5). Это можно объяснить тем, что катализатор и реагенты находятся в разных фазах. Повышение температуры до 45°С, а также увеличение мольного отношения ГПК: ГХ позволяют добиться большей конверсии НХ и роста содержания АХ в продуктах реакции.
Таблица 5.
Реакция ГХ с 1,3-бутадиеном*
| Объем ГПК-6, мл (ммоль) |
Мольное соотношение ГПК-6/ГХ | Растворитель, мл |
Т, °С | Продукты реакции | |||
|---|---|---|---|---|---|---|---|
| АХ | ДГА | ТГА | НХ | ||||
| 25 (6.25) | 1.25 | CHCl3 (5) | 23 | 1 | 1 | 23 | 70 |
| 25 (6.25) | 1.25 | C2HCl3 (5) | 23 | 1 | 2 | 46 | 46 |
| 25 (6.25) | 1.25 | – | 23 | 9 | 3 | 67 | 15 |
| 25 (6.25)** | 1.25 | – | 23 | 10 | 4 | 65 | 17 |
| 50 (12.5) | 2.5 | – | 23 | 19 | 9 | 45 | 21 |
| 50 (12.5) | 2.5 | – | 40 | 23 | 19 | 46 | 12 |
| 50 (12.5) | 2.5 | – | 45 | 31 | 29 | 35 | 5 |
* Условия реакции: 0.25 М раствор H9PMo6V6O40 (ГПК-6); 5 ммоль ГХ (0.550 г); атмосфера C4H6 (${{P}_{{{{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{6}}}}}}}$ = 1 – ${{P}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}}$), t = 8 ч, конверсия ГХ – 100%. ** Использован 0.25 М раствор кислой соли ГПК-6 (NaH8PMo6V6O40).
Отметим, что реакция БХ с 1,3-бутадиеном в этих условиях протекает так же легко, как и в случае ГХ, поскольку последний окисляется в БХ раствором ГПК-х очень быстро.
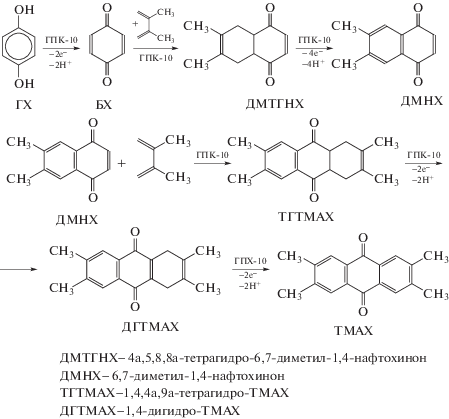
Для повышения выхода АХ и поиска оптимальных условий реакции в работе [33] была изучена возможность осуществления one-pot процесса получения алкилзамещенного производного АХ – 2,3,6,7-тетраметилантрахинона (ТМАХ) – из ГХ и 2,3-диметилбутадиена (ДМБ) в присутствии модифицированного раствора ГПК-10 и гидрофильного органического растворителя (1,4-диоксана) (схема 2 ):
Схема 2 . One-pot процесс получения 2,3,6,7-тетраметил-9,10-антрахинона (ТМАХ) при взаимодействии гидрохинона с 2,3-диметилбутадиеном (ДМБ) в присутствии раствора ГПК-10.
В ходе исследования было установлено, что наибольшее влияние на показатели one-pot процесса оказывают следующие параметры: время реакции, регенерация катализатора (ГПК-10) in situ в ходе процесса и мольное отношение ДМБ : ГХ. Условия осуществления one-pot процесса и полученные результаты представлены в табл. 6–8.
Таблица 6.
Влияние времени реакции на показатели one-pot процесса синтеза ТМАХ*
| Время реакции, ч | Выход твердого продукта** в расчете на ТМАХ, % | Содержание ТМАХ в твердом продукте, % | Выход ТМАХ, % |
|---|---|---|---|
| 14 | 32 | 61 | 19.5 |
| 18 | 37 | 70 | 26 |
| 24 | 45 | 76 | 34 |
* Условия реакции: ГХ – 1.3 × 10–3 моль (0.143 г), ДМБ – 4.29 × 10–3 моль, ГПК-10 – 3.5 × 10–3 моль (14 мл 0.25 М раствора); мольные отношения: ДМБ : ГХ = 3.3, ГПК : ГХ = 2.7; объемное отношение раствор ГПК-10 : 1,4-диоксан 1 : 1; температура 90°С. ** Многокомпонентная смесь производных НХ и АХ (по данным ВЭЖХ).
Таблица 7.
Влияние промежуточной регенерации катализатора на показатели one-pot процесса синтеза ТМАХ*
| Мольное отношение ДМБ : ГХ |
Выход твердого продукта в пересчете на ТМАХ, % | Содержание ТМАХ в твердом продукте, % | Выход ТМАХ, % |
|---|---|---|---|
| 3.3 | 45 | 76 | 34 |
| 5 | 82 | 72 | 59 |
| 5 | 95** | 76 | 72 |
| 8.2 | 100*** | 76 | 76 |
* Условия реакции: ГХ – 1.3 × 10–3 моль (0.143 г), ГПК-10 – 3.5 × 10–3 моль (14 мл 0.25 М раствора); мольное отношение ГПК : ГХ = 2.7; объемное отношение диоксан : водный раствор ГПК = 1 : 1; температура 90°С, время реакции 24 ч. В опытах с регенерацией получена твердая смесь ТМАХ + ДГТМАХ (данные ВЭЖХ и ЯМР). ** Регенерация пероксидом водорода (2 × 0.5 мл) через 6.5 и 14 ч. *** Регенерация добавкой 0.15 мл конц. HNO3 через 16 ч.
Таблица 8.
Влияние мольного отношения ДМБ : ГХ на показатели one-pot процесса синтеза ТМАХ*
| Мольное отношение ДМБ : ГХ |
Количество диена по отношению к стехиометрическому количеству | Выход твердого продукта в расчете на ТМАХ, % | Содержание ТМАХ в твердом продукте, % | Выход ТМАХ, % |
|---|---|---|---|---|
| 3.3 | 1.65 | 45** | 76 | 34 |
| 5 | 2.50 | 82*** | 72 | 59 |
| 6.6 | 3.30 | 93*** | 79 | 74 |
В табл. 6 приведены данные о влияние времени реакции на показатели процесса. При его проведении в течение 14 ч (условия см. в табл. 6) была получена трехкомпонентная смесь (ТГТМАХ + + ДГТМАХ + ТМАХ) с преобладанием ТМАХ (61%). При увеличении длительности процесса содержание ТМАХ в продукте реакции постепенно повышалось до 70 и 76% за 18 и 24 ч соответственно. Симбатно с этим возрастал и выход ТМАХ. Ясно, что в заданных условиях one-pot процесс по схеме 2 не протекает до конца. Бóльшая длительность процесса, вероятно, позволила бы несколько повысить содержание ТМАХ, однако в своих экспериментах мы, тем не менее, решили ограничить время реакции 24 ч. Именно столько длились процессы, результаты которых представлены в табл. 7–8.
Надо отметить, что суммарный выход твердого продукта в приведенных в табл. 6 условиях был не более 45%, т.е. значительная часть продуктов реакции оставалась в реакционном растворе.
В отдельных опытах для повышения значения Е раствора ГПК-10 прямо в ходе one-pot процесса проводили in situ частичную регенерацию катализатора добавками концентрированной азотной кислоты или Н2О2. С помощью этих процедур мы рассчитывали на улучшение показателей суммарного процесса.
Как следует из данных табл. 7, существенно увеличить содержание ТМАХ (выше 76%) в продуктах реакции за счет частичной регенерации ГПК-10 прямо в реакционной смеси не удалось как при использовании для этой цели концентрированной HNO3, так и Н2О2. Тем не менее, промежуточная регенерация катализатора дала положительный эффект: она позволила повысить суммарный выход твердого продукта реакции, содержащего 2 компонента – ТМАХ и ДГТМАХ.
Результаты табл. 7 показывают, что частичная регенерация (доокисление) бифункционального катализатора (ГПК-10) позволяет обеспечить практически 100%-й выход антрахиноновых производных. Следовательно, в указанных условиях реакция диенового синтеза полностью смещена вправо, в сторону образования АХ-аддуктов.
Возрастания выхода ТМАХ и уменьшения количества веществ в продукте реакции до двух удалось добиться увеличением соотношения ДМБ : ГХ. Вероятно, здесь сказывается тот факт, что реакция диенового синтеза является обратимой [34]. Повышая количество диена и смещая вправо равновесие реакции циклоприсоединения, мы ускоряем протекание последующих стадий one-pot процесса, приведенного на схеме 2 . Так, из данных табл. 8 следует, что при увеличении избытка диена в 2 раза также в 2 раза повышается суммарный выход твердого вещества (с 45 до 93%) и, соответственно, выход целевого продукта – ТМАХ.
Влияние мольного отношения ДМБ: ГХ подтверждают и данные табл. 7, где показано, что увеличение этого параметра до значения 8.2 позволяет обеспечить 100% выход твердого продукта в расчете на ТМАХ.
Таким образом, во всех экспериментах, проведенных в оптимальных условиях, в смеси продуктов реакции кроме ТМАХ оставалось около 20% ДГТМАХ – недоокисленного дигидропроизводного ТМАХ. Для достижения полного превращения всех промежуточных соединенийв в ТМАХ по схеме 2 необходимы дополнительные исследования по оптимизации этого процесса. Однако продукт, полученный в новом one-pot процессе и представляющий собой смесь 79% ТМАХ и 21% его дигидропроизводного, может с успехом использоваться в качестве эффективного катализатора делигнификации древесины [31].
2. ПОЛУЧЕНИЕ 1,4-НАФТОХИНОНОВ РЕАКЦИЕЙ ДИЕНОВОГО СИНТЕЗА В ПРИСУТСТВИИ РАСТВОРОВ ГПК-х
2.1. Получение 1,4-нафтохинонов из ГХ и 1,3-бутадиенов
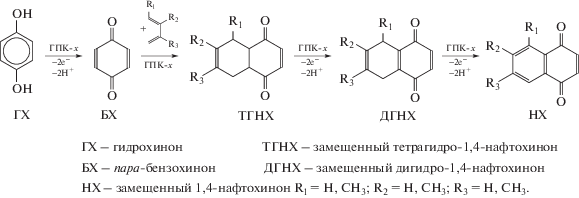
В упомянутых выше работах [23, 32] было показано, что в присутствии растворов ГПК-х реакция между ГХ и избытком бутадиена в отсутствие органического растворителя в зависимости от температуры приводит к образованию смесей, содержащих НХ, АХ, а также гидрированных производных АХ в различных соотношениях. Если при проведении процесса при комнатной температуре в смеси преобладает НХ (до 70%), то при повышенных температурах – АХ и его гидрированные производные. Поэтому вполне логично ожидать образование именно НХ при взаимодействии ГХ и 1,3-диенов в мольном соотношении, близком к 1 : 1, в присутствии растворов ГПК-х при комнатной температуре.
В работе [35] изучены реакции между ГХ и различными 1,3-диенами, протекающие согласно следующей схеме (схема 3 ):
Схема 3 . Получение НХ из ГХ и 1,3-бутадиенов.
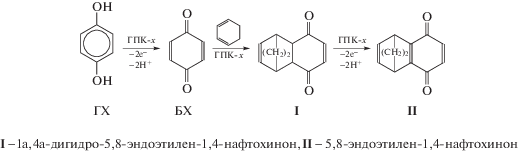
Кроме того, была изучена реакция ГХ с 1,3-циклогексадиеном, предположительно протекающая по схеме 4 :
Схема 4 . Реакция диенового синтеза между ГХ и 1,3-циклогексадиеном в присутствии раствора ГПК-х.
Для определения оптимальных условий реализации one-pot процессов было выбрано взаимодействие ГХ с изопреном (R1 = CH3; R2 = H), а не с газообразным 1,3-бутадиеном ввиду бóльшей простоты контроля дозировки реагентов.
В первой серии экспериментов варьировали количество атомов ванадия в составе ГПК-х (х = 4, 7, 10), т.е. меняли концентрация ${\text{VO}}_{2}^{ + }$ − главной окисляющей частицы в растворах ГПК-х. При этом изменялось и значение редокс-потенциала раствора Е. Полученные результаты представлены в табл. 9.
Таблица 9.
Зависимость показателей one-pot процесса синтеза 6-метил-НХ от состава ГПК-х*
| ГПК-x | Е раствора ГПК-х, В | Мольное отношение V : ГХ |
Содержание НХ (CНХ), % | Выход НХ (YНХ), % |
|---|---|---|---|---|
| H17P3Mo16V10O89 (х = 10) | 1.16 | 12.5 : 1 | 83 | 67 |
| H15P4Mo18V7O89 (х = 7) | 1.09 | 10.5 : 1 | 84 | 65 |
| H7PMo8V4O40 (х = 4) | 0.995 | 6 : 1 | 98 | 62.5 |
* Условия реакции: 10 мл 0.25 М водного раствора ГПК-х; объемное отношение диоксан : ГПК-х = 1 : 1; мольное отношение изопрен : ГХ = 1.25 : 1; время реакции 30 ч, комнатная температура; полная конверсия ГХ и БХ. Бóльшая часть продукта отделялась простым фильтрованием, добавочное количество – экстракцией диэтиловым эфиром.
Из данных табл. 9 видно, что выход целевого 6-метил-НХ при использовании высокованадиевых ГПК-7 и ГПК-10 несколько выше, чем в случае ГПК-4, однако наиболее чистым продукт получается именно в присутствии последней. По данным ВЭЖХ и ГХ-МС для высокованадиевых ГПК-х в продуктах имелась заметная примесь производных антрахинона. То есть в присутствии растворов ГПК-7 и ГПК-10, обладающих бóльшими значениями Е, one-pot процесс протекал глубже, при этом окислению подвергались уже аддукты диенового синтеза НХ и изопрена. Поскольку для получения замещенных НХ оказалось вполне достаточно ГПК-4, то дальнейшее исследование процесса синтеза 6-метил-НХ было проведено именно с ним, а не с высокованадиевыми растворами.
Для выбора оптимального времени one-pot процесса была изучена зависимость его показателей от времени. Оказалось, что через 6 ч ведения реакции основным продуктом взаимодействия ГХ с изопреном является 6-метил-ДГНХ. Через 24 ч в продукте остается еще заметная примесь гидрированных производных НХ (табл. 10), а через 30 ч процесс синтеза 6-метил-НХ практически завершается. Поэтому в дальнейшем one-pot процесс при комнатной температуре проводили в течение 30 ч.
Таблица 10.
Зависимость показателей процесса синтеза 6-метил-НХ от времени*
| Время, ч | Содержание НХ (CНХ), % | Выход НХ (YНХ), % |
|---|---|---|
| 6 | 5** | 3.5 |
| 24 | 84 | 58 |
| 30 | 98 | 62.5 |
Полученные данные показывают, что в присутствии раствора ГПК-х и гидрофильного органического растворителя возможно получение 6-метилнафтохинона из ГХ и изопрена в мягких условиях с достаточно хорошим выходом. Как и следовало ожидать, наиболее сильное влияние на показатели процесса при комнатной температуре оказывают длительность реакции, а также наличие гидрофильного органического растворителя. Заметим, что во всех проведенных экспериментах (кроме реакции в отсутствие растворителя) в продукте реакции не обнаруживались ни ГХ, ни БХ, то есть реакция диенового синтеза между БХ и диеном проходила полностью.
Было важно оценить возможность осуществления аналогичного процесса для других диенов. Процессы велись с использованием растворов ГПК-4 или ГПК-7. Данные представлены в табл. 11.
Таблица 11.
Реакция ГХ с различными диенами в присутствии 0.25 М ГПК-x [35]*
| Диен | ГПК-x | Содержание НХ (CНХ), % | Выход НХ (YНХ), % |
|---|---|---|---|
| ДМБ | ГПК-7 | 92** | 77 |
| Пиперилен | ГПК-4 | 97 | 62 |
| 1,3-Бутадиен | ГПК-4 | 99 | 51 |
| 1,3-Циклогексадиен | ГПК-4 | 87*** | 84*** |
* Условия реакции:10 мл 0.25 М водного раствора ГПК-4; объемное отношение ГПК-4 : диоксан = 1 : 1; мольное отношение диен : ГХ = 1 : 1; время реакции 30 ч, комнатная температура, полная конверсия ГХ и БХ. ** Также примесь двух производных АХ. В присутствии ГПК-4 содержание примесей увеличивается. *** Аддукт диенового синтеза I.
Хорошие результаты удалось получить для реакции ГХ с транс-пипериленом (транс-1-метилбутадиеном). В этом случае в присутствии ГПК-4 образуется чистый 5-метил-НХ с выходом 62%.
При реакции ГХ с 2,3-диметилбутадиеном (ДМБ) продукт содержит кроме соответствующего НХ (выход 77%) примесь производных антрахинона (8%).
В реакции ГХ со стехиометрическим количеством бутадиена (1 : 1) получается чистый НХ с выходом 51%.
Интересно было оценить возможность реализации one-pot процесса при взаимодействии ГХ с 1,3-циклогексадиеном. Оказалось, что в этом случае основными продуктами реакции (данные хромато-масс-спектрометрии) являются моноаддукт диенового синтеза I (М = 188) диена с БХ и неидентифицированный продукт с М = 238. Надо отметить, что М продукта II окисления аддукта диенового синтеза равна 186. Аддукт же с двумя молями диена (М = 268) обнаружен лишь в следовых количествах (менее 1%). Повышение температуры реакции выше комнатной ведет не к увеличению содержания аддукта с двумя молями 1,3-циклогексадиена, а к полимеризации последнего и осмолению реакционной смеси. Продукт II не образуется в ходе процесса ни при комнатной, ни при повышенной температуре, вероятно, потому что в данном случае при окислении аддукта реакции Дильса−Альдера I не происходит ароматизация кольца.
Таким образом, в работах [23, 32, 35] была показана возможность получения 1,4-нафтохинонов из ГХ и 1,3-бутадиенов в присутствии растворов ГПК-x в одну стадию с выходами 51−77% и чистотой 92−99%. До наших работ одностадийные способы получения нафтохинонов из ГХ в литературе описаны не были.
2.2. Получение менадиона (витамина К3) реакцией диенового синтеза
2-Метил-1,4-нафтохинон (витамин К3, менадион, МД) – жирорастворимый витамин группы К. Потребность в витаминах группы К постоянно растет, что заставляет искать эффективные способы их синтеза.
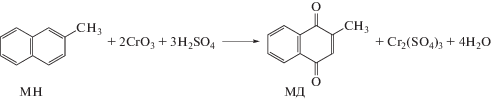
В промышленности МД в основном получают методом некаталитического окисления 2-метилнафталина (МН) хромовым ангидридом (схема 5 ) с использованием 5-кратного избытка CrO3 [36]:
Схема 5 . Получение менадиона окислением 2-метилнафталина.
Производство витамина К3 этим способом, с одной стороны, неэкологично вследствие обилия сточных вод, содержащих токсичные соединения хрома, смолы и кислоты. С другой стороны, оно также и неэкономично, поскольку селективность целевой реакции (схема 5 ) ниже 50%. Помимо окисления с помощью хромового ангидрида было предложено много других методов синтеза менадиона окислением МН, например [37–40]. Однако их эффективность не выше, чем у существующего промышленного способа. Известны и другие подходы к решению поставленной задачи. В частности, в патентах [41, 42] для получения витамина К3 предлагается использовать реакцию диенового синтеза с последующим окислением аддуктов в отдельной стадии. Однако предлагаемые в этих патентах методы имеют существенные недостатки: малую доступность исходного сырья (1-ацетокси-1,3-бутадиена), многостадийность и неэкологичность.
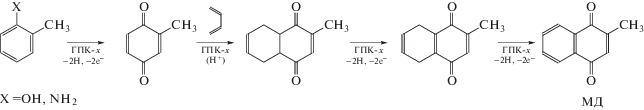
В нашей работе [43] мы показали, что с использованием растворов ГПК-х можно в одну технологическую стадию получить менадион из таких доступных субстратов, как 2-метилфенол (о-крезол) или 2-метиланилин (о-толуидин), в присутствии 1,3-бутадиена (схема 6 ):
Схема 6 . One-pot процессы получения МД из 2-метилфенола и 2-метиланилина в растворах ГПК-х в атмосфере 1,3-бутадиена.
В качестве катализатора таких процессов на первом этапе исследований был выбран традиционный раствор ГПК-4. Согласно схеме 6 вышеназванные субстраты в растворе ГПК-4 сначала достаточно быстро окисляются в толухинон (2-метил-1,4-бензохинон), который далее конденсируется с 1,3-бутадиеном по реакции диенового синтеза. Полученные при этом аддукты окисляются раствором ГПК-4, а сама гетерополикислота постепенно восстанавливается.
Результаты изучения синтеза витамина К3 в соответствии со схемой 6 [43] представлены в табл. 12. Температуру one-pot процессов с о-крезолом и о-толуидином в качестве субстратов варьировали в интервале 40−80°С. В случае обоих субстратов оптимально вести процесс при температуре 60°С. При получении МД из о-крезола в 0.2 М растворе ГПК-4 его выход не превышает 21%, а из о-толуидина – 29%. Побочно наблюдается образование большого количества полимерных продуктов окисления.
Таблица 12.
Получение витамина К3 из о-крезола и о-толуидина по реакции диенового синтеза в 0.25 М растворах ГПК-4, ГПК-7 и ГПК-10*
| Субстрат/г/ммоль | ГПК-х/мл | Мольное отношение ГПК-х : субстрат |
Т, °C | Выход МД, % |
|---|---|---|---|---|
| о-Крезол/0.27/2.5 | x = 4/18.8 | 1.5 | 80 | 18.9 |
| 60 | 20.9 | |||
| 40 | 16.7 | |||
| о-Толуидин/0.13/1.25 | x = 4/12.5 | 2.0 | 80 | 27.1 |
| 60 | 28.5 | |||
| 40 | 24.3 | |||
| о-Толуидин/0.107/1.0 | x = 7/12 | 3.0 | 60 | 32.4 |
| 80 | 30.0 | |||
| x = 10/12 | 60 | 32.8 | ||
| 80 | 29.9 |
Вариант с о-толуидином выглядит несколько более перспективным, поскольку выход МД в этом случае выше. Было установлено, что образующийся вначале черный осадок политолуидина по ходу реакции частично растворяется, окисляясь в толухинон, однако бóльшая его часть все-таки остается в неизменном виде, что приводит к фактическому снижению выхода МД. Мы рассчитывали, что путем оптимизации этого процесса (снижения интенсивности образования полимера) удастся увеличить выход МД.
Для этого мы изучили влияние различных условий проведения синтеза МД из о-толуидина на количество и чистоту получаемого витамина К3 [44]. В частности, было установлено, что способ введения о-толуидина в реакционную смесь (одной порцией или путем постепенного прикапывания его раствора в ДМСО), а также наличие гидрофильного органического растворителя (ДМСО или 1,4-диоксана) не оказывает практически никакого влияния на количество получаемого полимера и, соответственно, на итоговый выход МД [44].
Кроме того, в качестве бифункциональных катализаторов мы опробовали модифицированные растворы ГПК-х некеггиновских составов (x = 7, 10) [44]. За счет бóльшей (по сравнению с ГПК-4) концентрации VV растворы ГПК-7 и ГПК-10 обладают более высоким окислительным потенциалом Е (см., например, табл. 2), гарантируя полное окисление аддуктов диенового синтеза в витамин К3.
Результаты, полученные при исследовании one-pot процесса синтеза витамина К3 из о-толуидина в растворах ГПК-7 и ГПК-10, приведены в табл. 12.
Отметим, что для one-pot процесса синтеза МД из о-толуидина в растворах модифицированных высокованадиевых ГПК-7 и ГПК-10, как и в случае кеггиновской ГПК-4, оптимальной является температура 60°С.
Также из данных табл. 12 следует, что ни увеличение содержания VV в составе ГПК, ни рост избытка самой кислоты по отношению к субстрату (с 2 для ГПК-4 до 3 для ГПК-7 и ГПК-10) не приводят к заметному повышению выхода МД, который в случаях всех трех ГПК лежит в пределах 28–33%. При этом количество образующегося политолуидина также практически не изменяется.
С целью обнаружения возможных (кроме политолуидина) побочных продуктов реакции были проведены холостые опыты: в течение 5 ч в растворы ГПК-х подавали 1,3-бутадиен в отсутствие о-толуидина. При этом было установлено, что общее количество побочных продуктов, образующихся из 1,3-бутадиена в растворах ГПК-х не превышает 2%. Главными из них являются продукт гидратации бутадиена – 3-бутен-2-ол, а также получающийся из него при окислении метилвинилкетон [43].
Таким образом, в работах [43, 44] нами было показано, что МД может быть получен из о-толуидина в растворах ГПК-х (x = 4, 7, 10) по схеме 6 с выходом до 33%. Побочно образующийся в этом процессе политолуидин обладает достаточно высокой электропроводностью и поэтому может быть использован в электротехнике [45].
3. РЕГЕНЕРАЦИЯ РАСТВОРОВ ГПК-х
Как было отмечено выше, регенерация восстановленных растворов ГПК-х является важнейшей стадией их применения в качестве катализаторов. В работах [30, 46] мы показали, что регенерация растворов ГПК-х как кеггиновского, так и некеггиновского (модифицированного) составов может быть проведена с использованием кислорода под давлением (150−160°С, ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 0.3–0.4 МПа). В принципе, частично окислить сильно восстановленный раствор ГПК-х можно 30% раствором пероксида водорода. Такой способ мы использовали при разработке процесса получения витамина К3 [43]. Окислитель этот очень хорош, поскольку является экологически чистым, однако сам процесс окисления ГПК-х в его присутствии не идет глубоко, т. к. ионы ванадия катализируют разложение H2O2 на кислород и воду. Поэтому окислительная емкость раствора ГПК-х при регенерации его пероксидом водорода будет существенно сниженной, начиная со 2-го цикла. Кроме того, органические примеси, оставшиеся в растворе катализатора после целевой реакции, не окислятся полностью в ходе такой регенерации и будут постепенно (от цикла к циклу) накапливаться в растворе ГПК-х, снижая значение Е перед целевой реакцией, а, следовательно, и производительность катализатора.
В своих работах для регенерации растворов ГПК-х мы применяли также концентрированную азотную кислоту [47]. Хотя этот окислитель и не является экологичным, однако при определенных условиях он вполне может быть использован, например, в качестве небольшой добавки при окислении восстановленных растворов ГПК-х кислородом воздуха. Удобно, что при использовании HNO3 регенерацию катализатора можно вести при атмосферном давлении. В том случае, когда в растворе катализатора остались примеси органических соединений с предыдущего цикла, минимальная добавка азотной кислоты в конце регенерации позволяет окислить их полностью.
В работе [48] мы провели сравнительные испытания растворов катализаторов после их регенерации кислородом (под давлением) и концентрированной азотной кислотой (при атмосферном давлении) на примере многоцикловой реакции получения 2-метил- и 2,3-диметилантрахинона (2,3-ДМАХ). Контроль полноты регенерации производили путем измерения величины редокс-потенциала Е раствора ГПК-10. Результаты для 2,3-ДМАХ представлены в табл. 13. Видно, что оба метода позволяют успешно регенерировать катализатор и использовать его многократно в синтезе 2,3-ДМАХ с воспроизводимыми результатами. Результаты для 2-метил-АХ были аналогичными [48].
Таблица 13.
Результаты многоцикловых опытов получения 2,3-диметилантрахинона по реакции НХ с 2,3-диметил-1,3-бутадиеном в присутствии раствора ГПК-10*
| № цикла | Значение Е раствора ГПК-10 до реакции, В (НВЭ) | Выход 2,3-ДМАХ, % |
Чистота 2,3-ДМАХ, % |
Способ регенерации раствора катализатора |
|---|---|---|---|---|
| 1 | 1.098 | 81 | 98 | 150°С, ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 0.4 мПа, 20 мин |
| 2 | 1.063 | 77 | 98 | 160°С, ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 0.4 мПа, 15 мин |
| 3 | 1.066 | 77 | 97.5 | Кипячение на воздухе с добавкой 0.15 мл HNO3 конц., 30 мин |
| 4 | 1.101 | 80.5 | 98 | Кипячение на воздухе с добавкой 0.15 мл HNO3 конц., 30 мин |
| 5 | 1.097 | 80 | 98.5 | 160°С, ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 0.4 мПа, 15 мин |
| 6 | 1.063 | 77 | 98 | Кипячение на воздухе с добавкой 0.2 мл HNO3 конц., 30 мин |
| 7 | 1.104 | 81 | 98 | 160°С, ${{P}_{{{{{\text{O}}}_{2}}}}}$ = 0.4 мПа, 15 мин |
ЗАКЛЮЧЕНИЕ
Таким образом, в наших работах исследованы one-pot процессы получения ряда 1,4-нафтохинонов, 9,10-антрахинонов и витамина К3 на основе реакции диенового синтеза в присутствии водных растворов Mo–V–P-гетерополикислот ГПК-x (x = 4, 7, 10) в качестве бифункциональных катализаторов – кислотных катализаторов диенового синтеза и катализаторов окисления гидрохинона и образующихся аддуктов. Показано, что указанные процессы можно реализовать в мягких условиях (температура 20–80°С, атмосферное давление). Наиболее сильно на показатели процессов влияет их длительность, а также присутствие гидрофильного органического растворителя, такого как 1,4-диоксан.
Продемонстрирована возможность получения указанным одностадийным способом незамещенного антрахинона и его замещенных производных как из 1,4-нафтохинона, так и из гидрохинона, а также незамещенного и метилзамещенных (в том числе витамина К3) нафтохинонов из гидрохинона. Выходы и чистота получаемых продуктов, как правило, высокие. Кроме того, в ходе многоцикловых испытаний доказана стабильность работы растворов ГПК-х, используемых в качестве бифункциональных катализаторов этих процессов. Показано, что они сохраняют свою гомогенность и полностью восстанавливают активность (значение Е) после многократной регенерации.
Список литературы
Кожевников И.В., Матвеев К.И. // Успехи химии. 1982. Т. 51. № 11. С. 1875.
Kozhevnikov I.V., Matveev K.I. // Appl. Catal. 1983. V. 5. № 2. P. 135.
Pope M.T., Muller A. // Angew. Chem. Int. Ed. Eng. 1991. V. 30. P. 34.
Mizuno N., Misono M. // J. Molec. Catal. 1994. V. 86. № 1–3. P. 319.
Hill C.L., Prosser-McCartha C.M. // Coord. Chem. Rev. 1995. V. 143. № 1–2. P. 407.
Okuhara T., Mizuno N., Misono M. // Adv. Catal. 1996. V. 41. № 1–3. P. 113.
Kozhevnikov I.V. // Chem. Rev. 1998. V. 98. № 1–2. P. 171.
Misono M., Nojiri N. // Appl. Catal. 1990. V. 64. P. 1.
Okuhara T., Mizuno N., Misono M. // Appl. Catal. A: General. 2001. V. 222. № 1–2. P. 63.
Kozhevnikov I.V. Catalysis by Polyoxometalates. Chichester: John Wiley, 2002. 202 p.
López X., Carbó J.J., Bo C., Poblet J.M. // Chem. Soc. Rev. 2012. V. 41. P. 7537.
Zhou Yu., Guo Z., Hou W., Wang Q., Wang J. // Catal. Sci. Technol. 2015. V. 5. P. 4324.
Wang S.S., Yang G.Yu. // Chem. Rev. 2015. V. 115. P. 4893.
Rodikova Yu.A., Zhizhina E.G., Pai Z.P. // Chem. Select. 2016. V. 1. P. 2113.
Kale S.S., Armbruster U., Eckelt R., Bentrup U., Umbarkar S.B., Dongare M.K., Martin A. // Appl. Catal. A: General. 2016. V. 527. P. 9.
A.c. 421226 CCCP. Б.И. 1992. № 16. C. 34.
Pat. 1154798 DBR, 1963.
Sano K., Uchida H., Wakabayashi S. // Catal. Surv. Japan. 1999. V. 3. P. 55.
Пaтeнт 2165406 PФ. БИ, 2001. № 11. C. 286.
Пaтeнт 2162837 PФ. БИ, 2001. № 4. C. 257.
Meuzelaar G.J., Maat L., Sheldon R.A., Kozhevnikov I.V. // Catal. Lett. 1997. V. 45. P. 249.
Жижина E.Г., Симонова M.В., Русских В.В., Матвеев К.И. // Катализ в пром-ти. 2005. № 1. С. 12.
Zhizhina E. G., Odyakov V. F. // ChemCatChem. 2012. V. 4. P. 1405.
Gogin L., Zhizhina E. // Modern Res. Catal. 2013. V. 2. P. 90.
Гогин Л.Л., Жижина Е.Г., Пай З.П., Пармон В.Н. // Изв. РАН. Сер. хим. 2015. Т. 64. № 9. C. 2069.
Gogin L., Zhizhina E. // Modern Res. Catal. 2014. V. 3. № 2. P. 57.
Гогин Л.Л., Жижина Е.Г. // Катализ в пром-ти. 2014. Т. 4. С. 33.
Гогин Л.Л., Жижина Е.Г., Пай З.П. // Кинетика и катализ. 2019. Т. 60. № 1. С. 75.
Odyakov V.F., Zhizhina E.G., Maksimovskaya R.I. // Appl. Catal. A: General. 2008. V. 342. P. 126.
Жижина E.Г., Симонова M.В., Одяков В.Ф., Матвеев К.И. // Химия в интересах устойчивого развития. 2004. Т. 6. С. 683.
Anthraquinone, in Kirk-Othmer Encyclopedia of chemical technology, 5th Ed., V. 2. 2006.
Жижина Е.Г., Матвеев К.И., Русских В.В. // Химия в интересах устойчивого развития. 2004. Т. 1. С. 47.
Гогин Л.Л., Жижина Е.Г., Пай З.П. // Кинетика и катализ. 2018. Т. 59. № 5. С. 566.
Общая органическая химия. Т. 1. Под ред. акад. Кочеткова Н.К. М.: Химия, 1981.
Gogin L.L., Zhizhina E.G., Pai Z.P. // Modern Res. Catal. 2019. V. 8. P. 1.
Шнайдман Л.О. Производство витаминов, 2-е изд. М.: Пищепромиздат, 1973. 330 с.
A.c. 1121255 CCCP. Б.И. 1984. № 40. C. 63.
Pat. 6237700 JP, 1994.
Pat. 245797 PL, 1985.
Pat. 61221148 JP, 1985.
Pat. 4482492 USA, 1984.
Pat. 2002138063 JP, 2002.
Симонова М.В., Жижина Е.Г. // Химия в интересах устойчивого развития. 2005. Т. 13. № 3. С. 479.
Гогин Л.Л., Жижина Е.Г. // Кинетика и катализ. 2020. Т. 61. № 2. С. ?.
Genies E.M., Lapkowski M., Tsintavis C. // New J. Chem. 1988. V. 12. P. 181.
Одяков В.Ф., Жижина E.Г., Матвеев K.И. // Журн. неорган. химии. 2000. Т. 45. С. 1258.
Пaтeнт 2142935 PФ // Б.И., 1999. № 35. Ч. II. C. 228.
Гогин Л.Л., Жижина Е.Г., Пай З.П. // Катализ в пром-ти. 2016. Т. 16. № 3. С. 24.
Дополнительные материалы отсутствуют.
Инструменты
Кинетика и катализ